KDM2B调控FAK信号通路在卵巢癌细胞骨架排列中的作用*
张国平,顾秀玉,翟光华,闫美娜(南京医科大学姑苏学院&南京医科大学附属苏州医院&苏州市立医院北区检验科,江苏苏州215008)
卵巢癌是致死率最高的妇科恶性肿瘤,高转移率是卵巢癌致死的主要原因[1]。细胞骨架的破坏可以抑制卵巢癌细胞的迁移及侵袭,进而抑制转移[2]。组蛋白去甲基化酶[lysine(K)-specific demethylase 2B, KDM2B],又名 FBXL10、JHDM1B 或NDY1,是一类重要的组蛋白脱甲基酶,主要发挥组蛋白 H3上赖氨酸4的三甲基化(tri-methylation of lysine 4 on histone H3,H3K4me3)和组蛋白H3上赖氨酸36的二甲基化(dimethylation of histone H3 at K36,H3K36me2)的脱甲基酶活性。研究发现, KDM2B可以通过PI3K/AKT信号通路,调控结肠癌干细胞的干性[3];KDM2B还可以调控前列腺癌细胞的骨架排列,促进其迁移及侵袭[4]。然而,KDM2B在卵巢癌细胞骨架排列中的作用机制尚不明确。本课题组前期研究发现,KDM2B在卵巢癌组织中的表达水平升高,并可促进卵巢癌细胞迁移。本研究拟探讨KDM2B在卵巢癌细胞骨架排列中的调控作用,并进一步分析KDM2B的调控机制。
1 资料与方法
1.1细胞系、仪器及试剂 人胚肾细胞293T由江苏大学医学院临床血液学检验教研室许文荣教授惠赠,人卵巢癌细胞系 HO8910由江苏大学医学院组织胚胎学教研室卢小东教授惠赠。实时荧光定量PCR仪(Light Cycler480 Ⅱ,瑞士Roche公司),超微量核酸分析仪(杭州奥盛仪器公司),化学发光凝胶成像系统(上海天能科技公司),共聚焦显微镜(德国蔡司公司)。KDM2B过表达慢病毒质粒购自美国Addgene公司,DMEM培养基和胎牛血清(美国Gibco公司),胰蛋白酶(美国Sigma公司),RNA提取试剂、反转录试剂盒(PrimeScriptTMRT Master Mix)、实时荧光定量PCR试剂盒(SYBR Pre-mix Ex TaqⅡ)购自日本TaKaRa公司,鬼笔环肽染色试剂盒、嘌呤霉素和聚凝胺试剂(上海翊圣生物科技公司),RIPA裂解液及蛋白酶抑制剂以及青、链霉素(上海碧云天公司),兔抗人KDM2B多克隆抗体(美国Millipore公司),兔抗人FAK多克隆抗体(美国CST公司), 鼠抗人GAPDH单克隆抗体、羊抗兔IgG(H+L)抗体(武汉三鹰生物公司),HRP偶联的抗小鼠/兔IgG二抗(杭州联科生物公司)。
1.2细胞培养 HEK-293T细胞、人卵巢癌HO8910细胞用DMEM培养液(含10%胎牛血清+1%青、链霉素)培养,并置于5%CO2、37 ℃恒温培养箱中。每2~3 d换液1次,待细胞融合度达80%时,用2.5 g/L胰蛋白酶消化传代,取生长状态良好的细胞用于后续试验。
1.3稳定敲减和过表达KDM2B卵巢癌细胞系的建立 在美国Sigma Aldrich公司网站(https://www.sigmaaldrich.com)检索人KDM2B shRNA序列:CCGGCGGCCTTTACAAGAAGACATTCTCGAGA
ATGTCTTCTTGTAAAGGCCGTTTTTGAATT,送广州艾基生物公司构建KDM2B shRNA慢病毒载体。将KDM2B shRNA慢病毒质粒、KDM2B过表达的质粒分别与包装质粒psPAX2和pMD2.G共转染HEK-293T细胞。各质粒的比例为目的质粒∶psPAX2∶PMD2.0G=3∶2∶1。 按照Lipofectamine 3000转染试剂说明书进行转染,收集病毒,感染细胞。分别将3组慢病毒原液(空载慢病毒、KDM2B shRNA病毒和KDM2B过表达病组)加入HO8910细胞,聚凝胺浓度为 8 μg/mL,感染24 h后换液, 48 h 后进行二次感染。待细胞融合度达70%时,用嘌呤霉素(1 mg/mL)筛选2周,获得稳定敲减和过表达KDM2B的HO8910卵巢癌细胞系。
1.4F-actin荧光染色法 实验分为3组:HO8910对照组(慢病毒空载组)、HO8910-KDM2B敲减组和HO8910-KDM2B过表达组。将多聚赖氨酸处理的无菌细胞圆形爬片置于24孔细胞培养板内,2.5 g/L胰蛋白酶消化各组细胞成单个细胞悬液,铺板,待细胞融合度达50%时,按照F-actin染色说明书进行细胞骨架蛋白染色,步骤:4%多聚甲醛溶液固定细胞,PBS清洗3次;0.5% Triton-X 100溶液透化处理细胞,PBS清洗3次;每组加200 μL TRITC标记的鬼笔环肽工作液,浓度为5 μg/mL,PBS洗涤细胞3次;每孔加入200 μL DAPI溶液,对细胞核进行复染,PBS洗涤,封片。荧光共聚焦显微镜下观察3组细胞骨架蛋白F-actin的表达及排列的变化。实验重复3次。
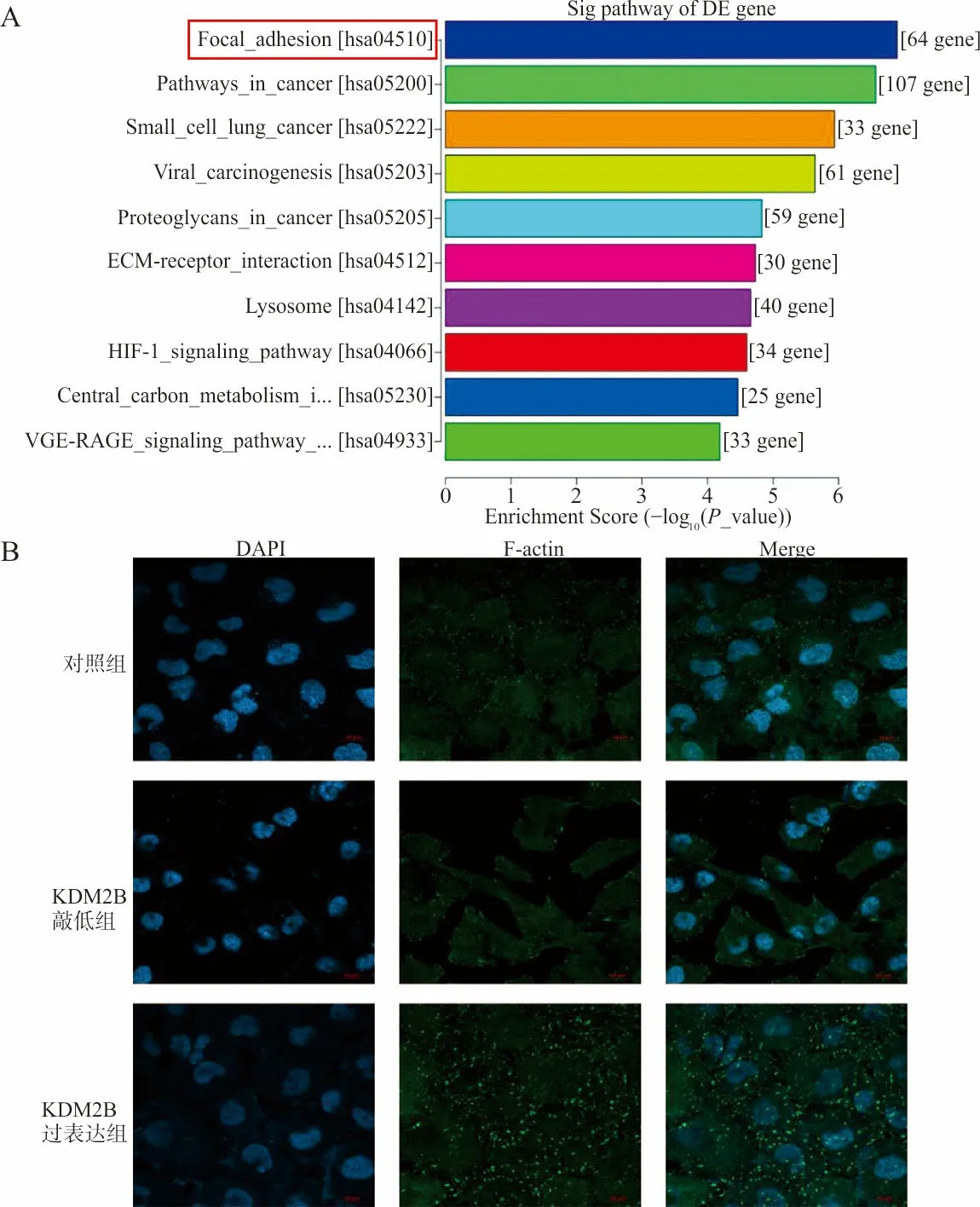
1.5KDM2B敲减组转录组学测序 采用10 cm细胞培养皿培养HO8910对照组及KDM2B敲减组细胞,待细胞融合度达80%时,加入TRizol试剂,由上海康成生物公司采用Illumina Hiseq 4000测序仪进行转录组测序,并对2组细胞差异表达基因进行Pathway富集分析。利用统计学算法(Fisher′s exact test)找出1组差异表达基因和KEGG数据库(http://www.genome.jp/kegg)中的哪些生物学通路功能条目联系最大,分析结果中每个Pathway条目对应1个统计值P-value(表示显著性),P-value越小表示该Pathway条目和输入的差异表达基因联系越大,即该组差异表达基因大部分具有该Pathway条目对应的描述功能。
1.6免疫荧光染色试验 试验分组同上,待细胞融合度达50%时,参照文献[5]进行免疫荧光染色,步骤:4%多聚甲醛固定细胞,PBS洗涤3次;加入Triton X-100C透化处理,PBS洗涤3次,每次5 min;3% BSA封闭1 h,加入兔抗人FAK多克隆抗体(1∶100稀释),4 ℃过夜;PBS洗涤3次,每次5 min,避光温育FITC标记的荧光二抗(1∶200稀释)1 h;加入抗荧光猝灭剂,封片,荧光共聚焦显微镜下观察3组细胞FAK蛋白荧光强度及细胞分布变化。实验重复3次。
1.7western blot 试验分组同1.4,各组细胞达80%融合度时,用预冷PBS缓冲液洗涤2次,每孔加入200 μL RIPA 裂解液,冰上裂解30 min,刮下细胞,4 ℃、12 000 r/min离心10 min,吸取蛋白质上清, BCA法测定蛋白质浓度,加入5×loading buffer煮沸,进行SDS-PAGE电泳,每组蛋白质样本40 μg,电泳条件60 V 40 min,110 V 80 min,使用转膜仪将蛋白质转移至PVDF膜上,用50 g/L脱脂奶粉室温封闭2 h,温育加入兔抗人KDM2B多克隆抗体(1∶1 000稀释),鼠抗人GAPDH单克隆抗体(1∶5 000稀释);使用HRP偶联的抗小鼠/兔IgG二抗(1∶5 000稀释)室温温育2 h,将 PVDF 膜与曝光液充分混匀后,进行曝光,以检测KDM2B蛋白的表达水平。采用ImageJ软件进行蛋白质条带灰度值分析,以目标蛋白灰度值/对应内参灰度值作为该组目标蛋白的相对表达量,再将对照组设置为1进行标准化,实验组蛋白质表达量=(实验组蛋白质相对表达量/对照组蛋白质相对表达量)。
1.8RNA提取、cDNA逆转录及RT-qPCR 按照RNA提取试剂盒说明书提取细胞总RNA,采用Nano-Drop分光光度仪检测核酸浓度,吸光度(A260 nm/A280 nm)在1.8~2.0的样本用于逆转录实验。根据逆转录试剂盒说明书将RNA逆转录为cDNA。根据NCBI数据库中GenBank提供的人KDM2B(Gene ID:84678)、ITGA6(Gene ID:3655)、ITGB1(Gene ID:3688)和β-actin(Gene ID:60)的基因序列,采用Primer Premier 5.0软件进行引物序列设计,并由上海生工生物公司合成,引物序列见表1。 qPCR反应体系为20 μL,包括SYBR Premix ExTaq Ⅱ(2×)10 μL,10 μmol/L上、下游引物各0.8 μL,cDNA模板2 μL,ddH2O 6.4 μL。每组设3个复孔。循环参数:95 ℃预变性5 min;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 30 s,共39个循环。采用荧光定量PCR仪配套的LC480软件采集65 ℃时的荧光信号并进行熔解曲线分析。实验重复3次。以β-actin为内参,采用2-ΔΔCt法计算基因相对定量的表达水平,公式:ΔCt=Ct目的基因-Ctβ-actin,ΔΔCt=ΔCt实验组-ΔCt对照组。

表1 RT-PCR引物序列
1.9统计学分析 采用GraphPad Prism5软件对数据分析和作图。两组间数据比较采用两样本的t检验,以P<0.05为差异有统计学意义。
2 结果
2.1KDM2B敲减及过表达组中KDM2BmRNA和蛋白质的水平 RT-qPCR结果显示,与对照组相比,KDM2B敲减组KDM2BmRNA水平下降(1.0±1.0 vs 0.48±0.05,t=20.10,P<0.01),KDM2B过表达组KDM2BmRNA水平升高(1.0±1.0 vs 2.33±0.23,t=9.89,P<0.05)。western blot结果显示,与对照组相比,感染shKDM2B慢病毒的HO8910细胞中KDM2B蛋白的表达水平下降(图1),蛋白质灰度扫描结果显示,两组间差异有统计学意义(1.0±1.0 vs 0.53±0.05,t=17.22,P<0.01);此外,KDM2B过表达组KDM2B蛋白的表达水平升高(图1),蛋白质灰度扫描结果显示两组间差异有统计学意义(1.0±1.0 vs 2.37±0.28,t=8.563,P<0.05)。

图1 western blot检测HO8910卵巢癌细胞中KDM2B敲低及过表达后的水平
2.2F-actin免疫荧光染色检测KDM2B敲减及过表达组中细胞骨架排列 F-actin免疫荧光染色结果显示,与对照组相比,过表达KDM2B后,F-actin表达明显增多,细胞骨架排列更规则有序;而敲低KDM2B后,F-actin表达减少,排列受到破坏(图2)。
2.3转录组测序法分析KDM2B敲减组基因富集的信号通路 Pathway分析结果显示,差异表达的基因主要集中在FAK(Focal-adhesion)信号通路(图3A)。采用RT-qPCR检测FAK信号通路上游分子ITGA6、ITGB1mRNA的表达,结果显示敲低KDM2B后,ITGA6(1.0±1.0 vs 0.51±0.03,t=28.29,P<0.05)及ITGB1(1.0±1.0 vs 0.53±0.10,t=8.266,P<0.05)mRNA水平降低,过表达KDM2B后,ITGA6(1.0±1.0 vs 1.9±0.36,t=5.129,P<0.05)及ITGB1(1.0±1.0 vs 2.39±0.48,t=4.958,P<0.05)mRNA水平升高。免疫荧光结果显示,KDM2B促进了FAK蛋白的表达(图 3B)。

注:F-actin荧光染色检测KDM2B对卵巢癌细胞骨架排列的调控作用,蓝色代表细胞核,红色代表细胞骨架F-acin(×40)。
注:A,干扰KDM2B后,转录组测序细胞信号通路分析图; B,免疫荧光试验检测KDM2B对FAK蛋白的分布及表达水平的调控作用,蓝色代表细胞核,绿色代表FAK蛋白,放大倍数×40,标尺20 μm。
2.4GEPIA肿瘤数据库分析FAK在卵巢癌组织中的表达及其与KDM2B的相关性 利用GEPIA肿瘤数据库分析卵巢癌组织中FAK的表达水平,结果显示相对于正常对照组织,卵巢癌组织中FAK的表达上调(图4);相关性分析显示,卵巢癌组织中,FAK与KDM2B存在正相关(r=0.37,P<0.01)。

图4 GEPIA肿瘤数据库卵巢癌大样本中FAK的表达水平
3 讨论
尽管分子靶向治疗、免疫疗法等技术快速发展,但是晚期卵巢癌患者的五年生存率仍低于30%[6]。肿瘤转移是影响卵巢癌患者预后的一个重要因素。研究证实,肿瘤转移早期需要依赖细胞骨架蛋白F-actin聚合形成特殊细胞突起来破坏基底膜,侵入组织、血管或淋巴管[7]。破坏细胞骨架排列已经成为一种具有临床应用前景的抗肿瘤策略[8]。本研究成功构建了稳定敲低和过表达KDM2B的卵巢癌细胞系,并且证实KDM2B调控细胞骨架蛋白F-actin排列。进一步的试验结果证实,高表达KDM2B后,F-actin表达增加,排列更加规则有序,成矛状伸展,提示细胞具有更高的动力;而敲低KDM2B后,F-actin表达减少,排列受到破坏,没有规则。已有的研究证实,KDM2B可以调控ERRα蛋白的稳定性,进而促进乳腺癌细胞的增殖[9];KDM2B还可以调控Hippo信号通路,促进胰腺导管腺癌(PDAC)进展[10]。另外,研究还发现KDM2B可以通过let-7b-EZH2轴促进卵巢癌的进展[11]。上述研究表明,KDM2B具有促进肿瘤进展的作用。本研究结果支持KDM2B可能通过调控细胞骨架排列来促进卵巢癌细胞迁移,侵袭,进而促进卵巢癌转移。但KDM2B如何调控F-actin排列尚需深入研究。
本研究采用转录组测序技术在KDM2B敲低细胞组中发现差异表达的基因主要集中于FAK相关的信号通路。FAK是一种非受体酪氨酸激酶,可通过整合素和其他细胞表面受体介导信号转导,从而调节细胞的黏附、迁移、存活、增殖和分化等[12]。研究表明,FAK可以调控细胞骨架排列,促进细胞迁移[13];抑制FAK信号通路,可以破坏F-actin的聚合,进而抑制肿瘤细胞迁移侵袭[14]。此外,FAK信号通路激活还可以导致卵巢癌细胞化疗耐药,细胞迁移、侵袭能力增强[15-16]。上述研究提示,KDM2B可能通过激活FAK信号通路来调控F-actin排列。笔者进一步的研究结果证实,KDM2B上调FAK通路上游分子ITGA6及ITGB1的表达,免疫荧光试验证实KDM2B能促进FAK的表达。因此,笔者推测KDM2B通过活化ITGA6-ITGB1/FAK信号通路,促进卵巢癌细胞骨架重塑。
综上所述,本研究初步探讨了KDM2B在卵巢癌细胞骨架排列中的调控作用,证实KDM2B促进F-actin表达及重塑,并进一步证实KDM2B活化了ITGA6-ITGB1/FAK信号通路,据此推测,KDM2B在卵巢癌转移过程中可能发挥重要角色。本研究亦存在一定局限性,首先,本研究仅在HO8910卵巢癌细胞系验证了KDM2B对细胞骨架的调控作用,后续需要在其他卵巢癌细胞系验证,以揭示KDM2B对卵巢癌细胞骨架调控作用的普遍性。其次,本研究并没有深入探讨KDM2B调控ITGA6-ITGB1/FAK/F-acin信号通路的具体分子机制。最后,本研究并未在动物实验中验证KDM2B对卵巢癌转移的调控作用。

