去泛素化酶OTUD3调控胆固醇酯化酶SOAT1蛋白稳定性的机制
盖文彬 毕明霞 姜宏


[摘要] 目的 鉴定胆固醇酯化酶甾醇O-酰基转移酶1(SOAT1)的去泛素化酶(DUB),探讨维持SOAT1蛋白稳定性的分子机制。
方法 采用Western blot方法检测多种肝癌细胞系中SOAT1的表达,在SOAT1表达较低的肝癌细胞系HCCLM3中加入蛋白酶体抑制剂MG132后检测SOAT1蛋白水平的变化,筛选人源卵巢肿瘤相关蛋白酶(OTU)家族中与SOAT1相互作用的DUB分子,通过泛素化实验检测其对SOAT1的去泛素化效应。
结果
SOAT1蛋白稳定性受到泛素-蛋白酶体系统的调控,对人源OTU家族进行无偏性筛选,显示OTUD3可以与SOAT1特异性结合,通过去除SOAT1的多聚泛素化,维持SOAT1的蛋白稳定性。
结论 在肝癌细胞中OTUD3是SOAT1的一个DUB,参与调控SOAT1蛋白稳定性。
[关键词] 去泛素酶类;甾醇O-酰基转移酶;蛋白质稳定性;细胞系,肿瘤
[中图分类号] R345
[文献标志码] A
[文章编号] 2096-5532(2021)05-0637-05
doi:10.11712/jms.2096-5532.2021.57.132
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20210628.1659.014.html;2021-06-29 11:01:49
MECHANISM OF DEUBIQUITYLASE OTUD3 IN REGULATING THE PROTEIN STABILITY OF STEROL O-ACYLTRANSFERASE-1
GAI Wenbin, BI Mingxia, JIANG Hong
(Stake Key Disciplines: Physioloy (in Incubtion), Department of Phy-
siology, Qingdao University, Qingdao 266071, China)
[ABSTRACT] Objective To identify the deubiquitinase (DUB) for sterol O-acyltransferase-1 (SOAT1), and to investigate the molecular mechanism for maintaining the protein stability of SOAT1.
Methods Western blot was used to measure the expression of SOAT1 in various hepatoma cell lines, and after the hepatoma cell line HCCLM3 with low expression of SOAT1 was added with the proteasome inhibitor MG132, the change in the protein expression level of SOAT1. Human ovarian tumor-related proteases (OTU) were screened to identify the DUB molecules interacting with SOAT1, and then ubiquitination assay was conducted to confirm their ubiquitination effect on SOAT1.
Results The protein stability of SOAT1 was regulated by the ubiquitin-proteasome system, and unbiased screening of the OUT family showed that OTUD3 could specifically bind to SOAT1 and promote the protein stability of SOAT1 by removing the poly-ubiquitination of SOAT1.
Conclusion OTUD3 is a DUB for SOAT1 and is involved in maintaining its protein stability in hepatoma cells.
[KEY WORDS] deubiquitinating enzymes; sterol O-acyltransferase; protein stability; cell line, tumor
胆固醇酯化酶甾醇O-酰基转移酶1(SOAT1)是胆固醇酯生物合成的关键酶[1],对维持细胞内脂代谢的稳态至关重要。SOAT1在多种肿瘤中异常高表达,与原发性肝癌、胰腺癌、肾癌和前列腺癌等的预后不良密切相关,提示SOAT1或可作为多种肿瘤的预后生物标志物和治疗靶点。在肝癌细胞中SOAT1通过促进胆固醇的合成,进而影响癌细胞的生长和迁移,促进肿瘤的发生发展[2-5]。因此,研究肝癌细胞中SOAT1蛋白稳定性的调控机制,可以为深入了解肝癌的发病机制及寻找新型药物治疗提供新的思路。
在肿瘤中SOAT1转录水平并没有明显变化,而蛋白表达上调却十分显著,提示肿瘤中异常高表达的SOAT1主要受到蛋白水平的调控[3]。泛素-蛋白酶体系统是生物体内维持蛋白质稳态的重要途径,蛋白发生泛素化修饰后会被蛋白酶体降解。泛素化修饰是一种依赖ATP的级联反应,需要泛素激活酶E1、泛素结合酶E2和泛素連接酶E3的参与[6-8]。泛素化修饰是一种可逆的动态过程,除了上述酶分子,去泛素化酶(DUB)也参与其中,它与泛素连接酶E3共同维持蛋白质的稳态[9]。已有研究证实,SOAT1的表达受到泛素-蛋白酶体系统的调
控[10],但维持其蛋白稳定性的DUB却未见报道。
本研究旨在鉴定SOAT1的DUB,揭示在肝癌细胞中SOAT1蛋白异常高表达的分子机制,为研发靶向SOAT1的肿瘤治疗药物提供理论依据。
1 材料与方法
1.1 实验材料
Protein A/G-agarose beads、GAPDH、SOAT1抗体、Normal IgG、相关二抗购自Santa Cruz公司;Flag抗体、蛋白酶体抑制剂MG132购自Sigma公司;HA-Ubiquitin抗体购自MBL公司;Lipofec-
tamine2000购自Invitrogen公司;OTUD3抗体购自abcam公司;RPMI-1640(1∶1)培养液、胎牛血清(FBS)、MEM和DMEM购自Gibco公司;SuperSignal west pico chemiluminescence substract购自Thermo公司;PBS粉末、抗原修复液购自北京中杉金桥公司。
1.2 细胞培养
人肾上皮细胞系HEK293T、人高转移性肝癌细胞HCCLM3、人肝星形细胞LX2、人肝癌细胞SK-HEP-1、人高转移性肝癌细胞97H培养于含有体积分数0.10 FBS、100 mg/L青链霉素混合液的DMEM细胞培养液中;正常人肝上皮细胞HL-7702、人肝癌细胞系SSMC7721、人肝癌细胞BEL-7402培养于含有体积分数0.10 FBS、100 mg/L青链霉素混合液的RPMI-1640细胞培养液中;肝癌亚力山大细胞PLC/PRF/5培养于含有体积分数0.10 FBS、100 mg/L青链霉素混合液的MEM细胞培养液中。上述细胞均应用细胞培养皿,置于37 ℃、体积分数0.05 CO2的细胞培养箱中进行培养。传代时用与细胞等渗的PBS洗去血清,加入2.5 g/L胰蛋白酶进行消化,并根据实验需要将细胞铺于不同规格的细胞培养板或培养皿中。
1.3 质粒及引物构建
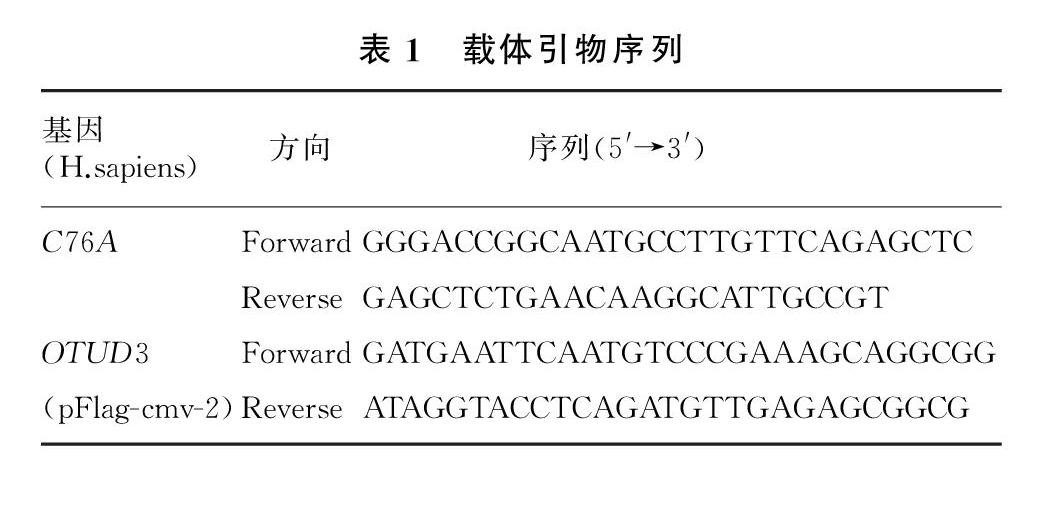
人源DUB文库(载体pCMV6-entry)购自OriGene公司。OTUD3及 OTUD3的酶活突变体C76A购自生物工程(上海)公司。引物序列见表1。
1.4 细胞转染
脂质体转染采用Lipofectamine2000转染试剂。在无血清的细胞培养液中分别加入需要转入细胞的质粒DNA和所需量的脂质体,单独混合室温放置,5 min后将含有质粒DNA和所需量脂质体的无血清培养液混合孵育,30 min后加入细胞培养液中,37 ℃培养4 h后弃去含DNA-脂质体复合物的培养液,换成含血清和抗生素的培养液继续培养24 h。
1.5 免疫共沉淀实验
用25 cm2的培养瓶培养细胞到70%融合,转染质粒48 h后收集细胞;用预冷的PBS洗涤3次,4 ℃下以3 000 r/min离心5 min;用HEPES裂解液裂解细胞,超声处理2 min;4 ℃下以12 000 r/min离心10 min,取上清,除少量作为lysate蛋白样品外,其余上清中加入相应抗体1 μg,4 ℃下在旋转混合器上混匀3 h;加入protein A/G-agarose,4 ℃混匀8 h以上;4 ℃下以3 000 r/min离心5 min,用裂解液洗涤3次,加入2×Sample buffer,100 ℃变性15 min,样品进行免疫印迹检测。
1.6 体内泛素化修饰实验
應用Lipofectamine2000转入各种目的质粒;收获细胞前8 h加入20 μmol/L MG132处理;36~48 h后用RIPA裂解液裂解细胞,并超声破碎;收集部分裂解液检测各种质粒的表达;加入相应抗体进行免疫沉淀,4 ℃混匀8 h以上;用RIPA裂解液洗涤,加入2×Sample buffer,100 ℃变性15 min,样品进行免疫印迹检测。
1.7 免疫印迹检测
收集细胞后,加入实验所需的细胞裂解液及等量的2×Sample buffer混合,100 ℃沸水煮15 min后进行SDS-PAGE电泳;分离实验所需目的条带的SDS变性胶,将蛋白转移到硝酸纤维素膜上,置含50 g/L脱脂牛奶的TBST缓冲液中封闭90 min;然后加一抗室温孵育3 h或4 ℃过夜,用TBST缓冲液洗膜3次,每次10 min;加耦联HRP的二抗孵育1 h,用TBST洗膜3次后,加入底物化学发光剂,于暗室中进行X线片曝光显影。
2 结 果
2.1 泛素-蛋白酶体系统对SOAT1蛋白表达影响
免疫印迹检测结果显示,SOAT1在不同肝癌细胞系中的表达水平不同(图1A),选择SOAT1表达较低的HCCLM3细胞系,加入蛋白酶体抑制剂MG132后,SOAT1的蛋白表达水平回升(图1B)。此外,SOAT1可以在肝癌细胞HCCLM3中发生多聚泛素化修饰(图1C)。该结果表明,泛素-蛋白酶体系统参与调控SOAT1的蛋白稳定性。
2.2 OTUD3与SOAT1的相互作用
选用人肾上皮细胞系HEK293T进行实验,在人源去泛素化酶OTU家族成员中进行无偏性相互作用筛选,结果显示,OTUD3可以特异地与内源SOAT1发生相互作用(图2)。
2.3 OTUD3对SOAT1多聚泛素化的影响
选用人肾上皮细胞系HEK293T进行泛素化实验,结果显示,过表达OTUD3能有效去除SOAT1蛋白的多聚泛素化(图3A)。并且,只有野生型的OTUD3可以去泛素化修饰SOAT1,而酶活突变体OTUD3-C76A无法去除SOAT1蛋白的多聚泛素化(图3B),说明OTUD3的去泛素化酶活性对稳定SOAT1至关重要。
2.4 OTUD3对SOAT1蛋白稳定性的影响
在HEK293T細胞中梯度过表达OTUD3,可特异性上调SOAT1的蛋白表达水平(图4),表明OTUD3通过去除SOAT1的多聚泛素化修饰维持SOAT1的蛋白稳定性。
3 讨 论
本研究鉴定出了调控SOAT1蛋白表达的DUB分子OTUD3,OTUD3依赖其去泛素化酶活性,通过特异性去除SOAT1的多聚泛素化修饰,维持SOAT1的蛋白稳定性。
SOAT1是一种定位于内质网的5次跨膜蛋白[1]。内质网是蛋白质合成和折叠的重要场所,内质网中的蛋白稳态由一套精细的质量控制系统调控。当新合成的蛋白质发生错误折叠时,它最终会从内质网中被逆向转运到细胞质,随后被泛素化降解,这一途径被称为内质网相关蛋白降解,简称为ERAD[7,11]。近年来的研究结果表明,ERAD减轻了蛋白质错误折叠引起的细胞毒性,其对突变蛋白的降解在多种疾病中发挥作用[12-14]。在ERAD过程中,已经鉴定出的泛素连接酶E3数量并不多[11],并且在底物的特异性识别过程中DUB承担关键的作用[15]。因此,鉴定出SOAT1的DUB对于阐明维持SOAT1蛋白稳态的分子机制尤为重要。
胆固醇是生物体内一种重要的分子,它既是细胞膜的重要组成部分,也是很多固醇类激素的前体[1,16]。但是,细胞内的游离胆固醇过多是有害的,其会在内质网被酰基化,以疏水的胆固醇酯的形式储存起来,这一过程由SOAT1催化[1,12,17-19]。有研究表明,癌细胞中高表达的SOAT1通过影响胆固醇酯的合成,促进癌症的发生与转移[3],敲除或者抑制SOAT1后,肝癌细胞的增殖和迁移能力降低[3]。SOAT1高表达与肝癌、甲状腺癌、头颈癌、胃癌、肾癌、前列腺癌、胰腺癌等不良预后均有关,有望被用作多种肿瘤的预后生物标志物和治疗靶点[17,20-22]。近年来,肿瘤免疫治疗备受关注,已有研究结果显示,联合应用SOAT1抑制剂Avasimibe和抗程序性死亡受体1抗体对小鼠黑色素瘤进展的控制效果优于单用Avasimibe[23]。因此,研究维持SOAT1蛋白稳定性的分子机制对于疾病的治疗及预后评估具有重要意义。
SOAT1的蛋白稳定性受到泛素-蛋白酶体系统的调控[10],泛素化与去泛素化作为一种重要的蛋白质翻译后修饰,在控制底物降解中起着至关重要的作用,参与了调控细胞内蛋白稳态和各项生命活动[2]。目前,调控SOAT1的泛素连接酶E3未见文献报道,本研究鉴定出的SOAT1的去泛素化酶OTUD3,可特异性去除SOAT1的多聚泛素化修饰,从而维持其蛋白稳定性。OTUD3是OTU家族的去泛素化酶。本实验室前期研究显示,在乳癌、结肠癌、肝癌和宫颈癌中,OTUD3通过稳定人第10号染色体缺失的磷酸酶以及张力蛋白同源物基因(PTEN)发挥抑癌作用[24];而在肺癌中,OTUD3通过稳定促癌蛋白GRP78发挥促癌作用[25]。
综上所述,本研究首次揭示OTUD3是SOAT1的去泛素化酶,该结果对于明确SOAT1蛋白稳定性的调控机制以及靶向SOAT1的肿瘤治疗具有重要意义。
[参考文献]
[1]VOLKMAR N, THEZENAS M L, LOUIE S M, et al. The ER membrane protein complex promotes biogenesis of sterol-related enzymes maintaining cholesterol homeostasis[J]. Journal of Cell Science, 2019,132(2):jcs223453.
[2]ONI T E, BIFFI G, BAKER L A, et al. SOAT1 promotes mevalonate pathway dependency in pancreatic cancer[J]. The Journal of Experimental Medicine, 2020,217(9):e20192389.
[3]JIANG Y, SUN A H, ZHAO Y, et al. Proteomics identifies new therapeutic targets of early-stage hepatocellular carcinoma[J]. Nature, 2019,567(7747):257-261.
[4]KHATIB S A, WANG X W. Proteomic heterogeneity reveals SOAT1 as a potential biomarker for hepatocellular carcinoma[J]. Translational Gastroenterology and Hepatology, 2019,4:37.
[5]SHIBUYA Y, CHANG C C, CHANG T Y. ACAT1/SOAT1 as a therapeutic target for Alzheimers disease[J]. Future Medicinal Chemistry, 2015,7(18):2451-2467.
[6]PARK J, CHO J, SONG E J. Ubiquitin-proteasome system (UPS) as a target for anticancer treatment[J]. Archives of Pharmacal Research, 2020,43(11):1144-1161.
[7]BERNER N, REUTTER K R, WOLF D H. Protein quality control of the endoplasmic Reticulum and ubiquitin-proteasome-triggered degradation of aberrant proteins: yeast pioneers the path[J]. Annual Review of Biochemistry, 2018,87:751-782.
[8]ZHANG X N, LINDER S, BAZZARO M. Drug development targeting the ubiquitin-proteasome system (UPS) for the treatment of human cancers[J]. Cancers, 2020,12(4):E902.
[9]KOMANDER D, CLAGUE M J, URB S. Breaking the chains: structure and function of the deubiquitinases[J]. Nature Reviews Molecular Cell Biology, 2009,10(8):550-563.
[10]DING L, BISWAS S, MORTON R E, et al. Akt3 deficiency in macrophages promotes foam cell formation and atherosclerosis in mice[J]. Cell Metabolism, 2012,15(6):861-872.
[11]LERNER M, CORCORAN M, CEPEDA D, et al. The RBCC gene RFP2 (Leu5) encodes a novel transmembrane E3 ubiqui-
tin ligase involved in ERAD[J]. Molecular Biology of the Cell, 2007,18(5):1670-1682.
[12]JENSEN T J, LOO M A, PIND S, et al. Multiple proteolytic systems, including the proteasome, contribute to CFTR processing[J]. Cell, 1995,83(1):129-135.
[13]VEIT G, AVRAMESCU R G, CHIANG A N, et al. From CFTR biology toward combinatorial pharmacotherapy: expanded classification of cystic fibrosis mutations[J]. Molecular Biology of the Cell, 2016,27(3):424-433.
[14]GUERRIERO C J, BRODSKY J L. The delicate balance between secreted protein folding and endoplasmic reticulum-associated degradation in human physiology[J]. Physiological Reviews, 2012,92(2):537-576.
[15]BRODSKY J L. Just a trim, please: refining ER degradation through deubiquitination[J]. Cell, 2013,154(3):479-481.
[16]CHEN X, LIANG H L, SONG Q B, et al. Insulin promotes progression of colon cancer by upregulation of ACAT1[J]. Lipids in Health and Disease, 2018,17(1):122.
[17]XU H J, ZHOU S, TANG Q L, et al. Cholesterol metabolism: New functions and therapeutic approaches in cancer[J]. Biochimica et Biophysica Acta (BBA)-Reviews on Cancer, 2020,1874(1):188394.
[18]CRONIN K A, LAKE A J, SCOTT S, et al. Annual Report to the Nation on the Status of Cancer, part Ⅰ: National can-
cer statistics[J]. Cancer, 2018,124(13):2785-2800.
[19]NEGOITA S, FEUER E J, MARIOTTO A, et al. Annual Report to the Nation on the Status of Cancer, part Ⅱ: Recent changes in prostate cancer trends and disease characteristics[J]. Cancer, 2018,124(13):2801-2814.
[20]GENG F, CHENG X, WU X N, et al. Inhibition of SOAT1 suppresses glioblastoma growth via blocking SREBP-1-mediated lipogenesis[J]. Clinical Cancer Research: an Official Journal of the American Association for Cancer Research, 2016,22(21):5337-5348.
[21]LIU Y, WANG Y Q, HAO S D, et al. Knockdown of sterol O-acyltransferase 1 (SOAT1) suppresses SCD1-mediated lipogenesis and cancer procession in prostate cancer[J]. Prostaglandins & Other Lipid Mediators, 2021,153:106537.
[22]WEIGAND I, ALTIERI B, LACOMBE A M F, et al. Expression of SOAT1 in adrenocortical carcinoma and response to mitotane monotherapy: an ENSAT multicenter study[J]. The Journal of Clinical Endocrinology & Metabolism, 2020,105(8):2642-2653.
[23]YANG W, BAI Y B, XIONG Y, et al. Potentiating the antitumour response of CD8(+) T cells by modulating cholesterol metabolism[J]. Nature, 2016,531(7596):651-655.
[24]YUAN L, LV Y, LI H C, et al. Deubiquitylase OTUD3 regulates PTEN stability and suppresses tumorigenesis[J]. Nature Cell Biology, 2015,17(9):1169-1181.
[25]DU T D, LI H C, FAN Y S, et al. The deubiquitylase OTUD3 stabilizes GRP78 and promotes lung tumorigenesis[J]. Nature Communications, 2019,10:2914.
(本文編辑 马伟平)

