HBV相关肝脏纤维化患者血清miRNA差异表达谱的建立及分析*
王卫敏,李长安,郑辉,狄贯腾(新乡医学院第三附属医院,.感染科,.检验科,.公共卫生科,河南新乡 453000)
慢性乙型肝炎病毒(HBV)感染是严重影响人类生命健康的疾病,而肝纤维化是乙肝最为显著的特征之一[1]。肝纤维化的早期诊断和持续随访对于预防肝硬化和终末期肝病至关重要。非创性血清学指标对于预测疾病进展具有重要的意义。研究表明,在HBV相关的肝纤维化过程中,多伴随着微小RNA(microRNA, miRNA)表达量的改变[2]。miRNA有望成为HBV相关肝纤维化的生物学标志物[3]。本研究旨在检测HBV相关肝纤维化患者血清中差异表达的miRNA,初步探讨该类差异表达的miRNA在HBV相关肝纤维化进展过程中的作用机制。
1 材料和方法
1.1研究对象 选择2019年3月至2020年3月于新乡医学院第三附属医院感染科经组织活检诊断为肝纤维化(S2~S3期)的患者70例作为研究对象,其中包括乙肝患者35例[男15例,女20例,年龄(46.27±18.62)岁],非乙肝患者(除乙肝外的慢性肝病所致的肝纤维化患者)35例[男18例,女17例,年龄(40.59±14.77)岁],纳入标准:6个月内未经核苷(酸)类抗病毒治疗且至少间隔3个月的2次丙氨酸氨基转移酶(ALT)检测超过参考值上限的2倍;组织活检诊断为纤维化S2~S3期。乙肝纳入:符合《慢性乙型肝炎防治指南2010年更新版》中的诊断标准[4]。排除标准:(1)感染人类免疫缺陷病毒的患者;(2)由其他病因(包括丙型肝炎病毒感染、丙型肝炎病毒感染、药物摄入、酒精摄入、自身免疫性肝炎等)造成肝损伤的患者;(3)有严重系统性疾病者;(4)怀孕和哺乳者。收集同期体检健康者35例作为健康人对照组,男21例,女14例,年龄(47.45±12.51)岁。本研究通过新乡医学院第三附属医院医学伦理委员会审核批准(批准文号:20190601),各研究对象均签署知情同意书。
1.2标本采集 取上述肝纤维化患者治疗前(健康者于体检时采集)的空腹外周血标本10 mL,经2 500 r/min离心10 min,分离血清,10 000 r/min离心10 min,完全清除细胞碎片。将血清收集于含EDTA-K2的抗凝管中,置于-80 ℃保存。
1.3主要仪器及试剂 TruSeq小RNA样品制备试剂盒(TruSeq Small RNA Sample Prep Kit,美国Illumina公司),TRIzol LS试剂(美国Invitrogen公司),RevertAid逆转录试剂盒(美国Thermo公司),miRNA qPCR master mix 试剂盒(上海生工公司),胶回收试剂盒(北京天根公司)。 NanoDrop ND-2000分光光度计(美国Thermo Scientific公司), Agilent 生物分析仪(美国Agilent公司),Illumina GA IIx测序仪(美国Illumina公司),Qubit 2.0荧光定量仪、E-Gel Imager凝胶成像系统(美国Invitrogen公司)。
1.4血清中总RNA提取 取上述各研究对象的血清标本6 mL,采用TRIzol LS试剂提取血清总RNA。采用NanoDrop ND-2000分光光度计检测并分析RNA的纯度及浓度,取吸光度A260 nm/A280 nm>2.0、A230 nm/A260 nm>1.8的样本,置于-80 ℃保存。
1.5文库构建、测序及分析 按照TruSeq小RNA样品制备试剂盒说明书进行文库构建。通过两步法将RNA 3′接头和5′接头连接至miRNA。通过RevertAid逆转录试剂盒合成单链cDNA,对样本进行PCR扩增,通过胶回收试剂盒回收目的片段,即得到miRNA文库。取1 μL产物上样至 Agilent 生物分析仪,采用Qubit 2.0荧光定量仪分析样本的大小、纯度和浓度。文库质量控制的标准:将质量值低的序列去掉;去除未知碱基含量超过10%的序列;去除无接头的序列;去除<18 bp或>30 bp的序列。以差异倍数(fold change,FC)表示两样本间表达量的比值。在差异表达miRNA检测过程中,使用∣log2(FC)∣≥1且FDR≤0.1作为筛选标准。
1.6qRT-PCR检测血清中miRNA的表达 参考 RevertAid逆转录试剂盒说明书将总RNA逆转录为cDNA,cDNA产物置于-80 ℃保存。按照miRNA qPCR说明书对miRNA进行相对定量,根据GenBank中U6(NR_004394.1)、miR-197-3p(NR_029583.1)、miR-500a-3p(NR_030224.1) 、miR-33a-5p(NR_029507.1) 基因的序列号,用Primer Premier 5.0软件设计引物,并送上海生工公司合成。U6上游引物序列:5′-CTCGCTTCGGCAGCACA-3′,下游引物序列:5′-AACGCTTCACGAATTTGCGT-3′,目的产物长度77 bp;miR-505-3p上游引物序列:5′-GCGAGCACCGTCAACACT-3′,下游引物序列:5′-TGGTGTCGTGGAGTCGGC-3′,目的产物长度67 bp;miR-197-3p上游引物序列:5′-GGGTGGCAGTGTCTTAGC-3′,下游引物序列:5′-GTGCAGGTCCGAGGT-3′,目的产物长度73 bp;miR-500a-3p上游引物序列:5′-GGGGGCAGATAGACGCT-3′,下游引物序列:5′-TGCACGAACTCTATCTC-3′,目的产物长度64 bp;miR-33a-5p上游引物序列:5′-GGGATTCTCCCCCTGCC-3′,下游引物序列:5′-AAGAGAGTACCGGC-3′,目的产物长度73 bp。PCR总反应体系为50 μL,包括10 μmol/L上、下游引物各0.5 μL,2×miRNA qPCR master mix 10 μL,1 μL cDNA,1 μL ROX Reference Dye (H),无菌ddH2O补足体积至50 μL。PCR反应参数:95 ℃预变性20 s;95 ℃ 变性5 s,60 ℃退火30 s,72 ℃延伸 30 s,共35个循环;72 ℃ 5 min。取扩增产物2 μL,经20 g/L琼脂糖凝胶电泳,并用E-Gel Imager凝胶成像系统扫描并拍照。结果以2-△△Ct法表示。
1.7miRNA靶基因生物信息学分析 通过数据库 TargetScan 和 miRanda 相结合预测miRNAs的靶基因。然后,基于数据库将所有的靶基因进行 GO(Gene ontology)注释,筛选出靶基因富集的显著性 GO。最后基于 KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对靶基因进行注释。

2 结果
2.1各组研究对象的临床病理参数 乙肝组与健康人对照组、乙肝组与非乙肝组临床病理参数(包括性别、年龄、血液生化指标等)的比较结果见表1。
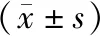
表1 乙肝组、健康人对照组和非乙肝组的临床病理参数比较
2.2差异表达miRNA的聚类分析 根据miRNA表达FC和P值分析结果表明,与健康人对照组相比,在乙肝组中有53个表达差异的miRNA,其中表达上调的miRNA有30个(FC>2,P<0.05),表达下调的miRNA有23个(FC>2,P<0.05)。与非乙肝组相比,在乙肝组中有23个显著性表达miRNA,其中表达上调的miRNA有14个(FC>2,P<0.05),表达下调的miRNA有9个(FC>2,P<0.05)。与健康人对照组和非乙肝组相比,miR-505-3p、miR-197-3p、miR-500a-3p、miR-33a-5p在乙肝组中的表达差异最为显著(表2)。

表2 乙肝组中表达显著性差异的miRNA
2.3差异表达miRNA的鉴定结果 qRT-PCR结果表明,miR-505-3p、miR-197-3p和miR-500a-3p的表达水平在乙肝组中显著上调(P<0.01),miR-33a-5p的表达水平在乙肝组中显著下调(P<0.01)。与健康人对照组和非乙肝组相比,乙肝组中miR-505-3p、miR-197-3p和miR-500a-3p显著下调,miR-33a-5p显著上调(表3)。
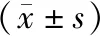
表3 差异表达miRNA在健康人对照组、非乙肝组和乙肝组中的表达
2.4miRNA靶基因和GO注释 肝纤维化组差异表达miRNA(miR-505-3p、miR-197-3p、miR-500a-3p、miR-139-5p、miR-1273g-5p、miR-33a-5p和miR-3960)的潜在靶基因共59个(表4)。上述差异表达的miRNA所对应的靶基因主要涉及的生物学过程包括细胞的生长、维持和信号转导等(表5)。

表4 肝纤维化组差异表达miRNA的潜在靶基因

表5 差异表达的miRNA靶基因的功能
3 讨论
肝纤维化的早期诊断和持续随访对于预防肝硬化和终末期肝病至关重要。临床上常用的诊断方法——肝活检是一种有创性的手术,具有很大的局限性,因此,迫切需要一种新的诊断方法。既往研究证实了循环miRNAs可作为肝纤维化疾病进展的生物学标志物[5]。另有学者在HBV感染患者S1~S4期组中检测到140个miRNA,其中有12个miRNA在各个阶段均有差异表达[6]。
在本研究中纳入了75例肝纤维素化患者,其中包括了35例非乙肝患者和35例乙肝患者,同时以35例健康者作为对照。采用高通量测序对HBV相关纤维化差异表达的miRNA进行了筛选。发现与健康人对照组相比,在乙肝组中有53个表达具有显著性差异的miRNA,其中表达上调的miRNA有30个,表达下调的有23个。与非乙肝组相比,在乙肝组中有23个显著性表达的miRNA,其中表达上调的miRNA有14个,表达下调的miRNA有9个。笔者选取乙肝组中表达差异最为显著的miR-505-3p、miR-197-3p、miR-500a-3p、miR-33a-5p进行进一步分析。通过GO分析发现,差异基因主要涉及生物学过程、细胞组分以及分子功能。但本研究报道的差异表达的miRNA通过转导通路参与肝纤维化的发生、发展,但具体机制仍需进一步验证。部分miRNA已有相关研究报道。例如,miR-505-3p可以通过上调趋化因子受体,在高胆固醇血症中发挥了重要作用[7]。miR-197-3p在肺癌患者血浆中表达异常,有望成为肺癌的标志物[8]。然而,这些miRNA是否与HBV相关肝纤维化有关,仍需要进一步的实验验证。
综上所述,本研究结果表明,表达差异显著的miRNA可能作为HBV相关肝纤维化的临床标志物。然而,本研究分析的样本量有限,结果还不足以确定miRNA的表达与HBV相关肝纤维化之间的关系存在一定的规律,但对于研究HBV相关肝纤维化的发生以及临床上早期诊断和预防研究具有重要的参考价值,血清中miRNA的含量或可作为肝纤维化的诊断和预后生物学标志物。

