MALDI-TOF质谱在乳腺癌诊断及分型中的应用
许小雨,宋御繁,孙克娜,陈英剑,胡成进(1.潍坊医学院医学检验学院,山东潍坊61053;.联勤保障部队第九六〇医院检验科,济南50031)
乳腺癌是导致世界女性癌症死亡最主要的原因,乳腺癌常用的检查方法有活检、乳房X线检查、CT检查、超声检查和磁共振成像(MRI)等,然而上述方法昂贵、耗时,不适合大规模患者的早期筛查[1]。由美国食品药品监督管理局(Food and Drug Administration,FDA)认证的生物学标志物——CA153已应用于临床,但其特异性和敏感性仅为65.7%和76.7%[2],且其仅可用于监测乳腺癌的疗效、预后评估以及复发判断。目前临床上主要通过免疫组化染色法检测肿瘤细胞雌激素受体(ER),孕酮受体(PR)和人类表皮生长因子受体(HER2)蛋白质的表达,并根据结果将乳腺癌区分为不同的乳腺癌亚型,但此种方法成本高、操作繁琐且需进行染色处理,实际操作中存在很多因素影响免疫组化染色结果的准确性和稳定性。因此,临床上需要寻找到新的方法以提高乳腺癌诊断阳性率,并为临床个体化治疗提供决策依据。
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)是一种蛋白质组学研究的有效工具,在肿瘤精准诊疗中具有重要作用。本研究旨在采用MALDI-TOF-MS技术建立一种具有高敏感性和高特异性,以及适用于临床乳腺癌诊断的预测模型,应用该技术将乳腺癌患者从体检健康者及良性疾病者中鉴别出,并进一步区分三阴性乳腺癌(TNBC)和非三阴性乳腺癌(NTNBC)患者。
1 材料及方法
1.1一般资料 收集2020年8月至2021年3月联勤保障部队某医院经病理组织学活检确诊的乳腺癌患者(61例)和纤维腺瘤患者(60例),病理分型为浸润性导管癌47例、浸润性小叶癌 1例、导管内原位癌8例及浸润性导管癌伴高级别导管内癌5例。乳腺癌分子分型分为TNBC 10例, NTNBC 51例。乳腺癌患者年龄32~77岁,中位年龄53岁;乳腺纤维腺瘤患者年龄33~74岁,中位年龄55岁。病例组纳入标准:(1)患者初次经病理组织学活检确诊为乳腺癌或纤维腺瘤;(2)既往未经其他手术、抗癌药物及放化疗治疗;(3)具有完整的临床病理学诊断资料;(4)无其他恶性肿瘤病史。排除标准:(1)非乳腺癌及纤维腺瘤患者;(2)接受过抗癌治疗者;(3)合并其他恶性肿瘤者;(4)感染性疾病患者。以同期44名体检健康者作为健康人对照组,年龄35~79岁,中位年龄55岁。本研究经解放军第九六〇医院医学伦理委员会审核批准[(2021)科研伦理审第(60)号],各研究对象均知情同意。
1.2仪器和试剂 基质辅助激光解吸电离飞行时间质谱系统(MALDI-TOF,德国Bruker公司),低温高速离心机(德国Eppendorf公司),电子天平(瑞士Mettler Toledo公司)。弱阳离子交换磁珠(WCX-MB)试剂盒、蛋白质/多肽校准品(德国Bruker公司),α-氰基-4羟基肉桂酸(HCCA)、三氟乙酸(TFA)、乙腈(ACN)、无水乙醇(美国Sigma公司)。
1.3方法
1.3.1标本采集及预处理 在各受试者治疗前采集清晨空腹静脉血5 mL贮于含有惰性分离胶的真空采血管中,于室温条件下静置30 min,置于离心机中以3 000 r/min离心5 min,取血清分装至0.5 mL的Ep管中,随后置于-80 ℃冻存备用。
1.3.2血清标本分组 将所有的样本按照3∶1的比例进行随机分组,训练组78例(乳腺癌患者45例,体检健康者33例),验证组27例(乳腺癌患者16例,体检健康者11例)。训练组用以建立诊断预测模型,验证组用以评估模型诊断效能。
1.3.3血清预处理 从-80 ℃冰箱取出血清标本,置于-20 ℃冻融8 h,再置于4 ℃冻融6 h,将复融的血清以10 000 r/min离心3 min。进行以下操作:每5 μL血清标本与10 μL弱阳离子交换磁珠(WCX-MB)和10 μL结合缓冲液(BB)混合于200 μL试管中。混合后,将样品管放入磁力分离器中,1 min后弃除试管中的上清液。样本与磁珠结合后,用100 μL的洗涤缓冲液(WB)洗涤3次,加入5 μL的磁珠洗脱缓冲液(EB)与磁珠结合。悬浮液样本从上清液中完全分离后转移至新的10 μL试管中。每个试管中加入5 μL稳定缓冲液(SB),用于质谱分析。
1.3.4仪器校准与质量控制 检测前使用蛋白质/多肽校准品混合液进行仪器校准,随机选取30例体检健康者血清标本,取5 μL混匀,用于评价质谱仪的稳定性。弱阳离子磁珠(WCX-MB)提取混合血清中的蛋白质/多肽,检测时每15个样本进行1次点靶,质谱上样检测获得质谱峰,计算每批质谱多肽峰的变异系数(CV)。
1.3.5血清处理标本质谱检测 取提取的蛋白质/多肽样本1 μL点样于AnchorChip 384靶板上,样本一式三份点靶,自然干燥后取1 μL新鲜配置的6 mg/mL基质(6 mg HCCA,50%ACN,2%TFA)覆盖于样本点上,自然晾干后置于质谱仪进行检测。在正离子线性模式下,1 ~10 kDa分子质量范围内采集峰的m/z值和强度。采用的离子源1为19.64 kV,离子源2为18.34 Kv,基质抑制为m/z 700 Da。在激光能量为75%下采集谱图,每个样本点累积轰击1 200次。
1.3.6峰谱图处理 使用ClinProTools软件及FlexAnalysis软件对采集的原始质谱图进行平滑、去噪、基线去除和归一化处理,并确定分子质量为1~10 kDa的峰,剔除信噪比(S/N)<5的峰。
1.3.7建立及验证乳腺癌诊断预测模型 采用ClinProTools软件中包含的3种模型算法:遗传(GA)算法、监督神经网络(SNN)算法及快速分类(QC)算法对乳腺癌建立诊断预测模型,并使用验证血清组血清标本对模型进行验证,得出模型的敏感性、特异性及准确性,从中选出最佳诊断预测模型。
2 结果
2.1质量控制结果分析 本次实验检测时每15个样本点1次靶,检测后得到9个质控样本质谱峰,计算1~10 kDa范围内9个峰的平均CV为19.56%(11.67%~29.78%)。表明此CV在正常范围内,此系统检测一致性较好,符合要求。
2.2乳腺癌诊断预测模型的建立与验证结果分析 应用ClinProTools软件对乳腺癌组与对照组进行分析,建立了诊断预测模型,并使用验证组进行验证(表1)。结果发现GA算法建立的模型诊断效能最佳。选取差异最显著的2个峰:m/z 5 920.36、m/z 4 220.9分别为X、Y轴进行聚类分析,结果显示乳腺癌组与对照组可明显区分(图1),在GA算法模型下使用验证组血清验证,16例乳腺癌患者中正确判断15例,误判1例;11例对照者中正确判断10例,误判1例。GA模型的预测诊断特异性为90.9%,敏感性为93.8%,准确性为92.6%。
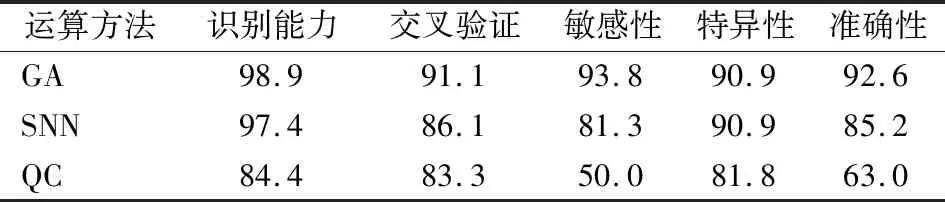
表1 3种诊断预测模型的效能(%)

注:红色叉号为训练组乳腺癌患者;绿色圆圈为训练组对照者,A中黑点为验证组乳腺癌患者;B中黑点为验证组对照者。
2.3血清蛋白质/肽指纹图谱分析
2.3.1乳腺癌组与对照组图谱分析 通过ClinProTools软件分析后,得到乳腺癌组与对照组的血清蛋白质/肽指纹图谱(图2),证实两组间图谱存在明显差异。在分析范围为1~10 kDa内发现差异峰 106个(P<0.05),筛选出差异有统计学意义(P<0.000 001)且AUCROC值>0.80的差异峰26个。峰m/z 4 220.9、5 920.36、2 960.40、2 110.95在乳腺癌组中表达下调,其余22个峰均表达上调。此外,m/z 4 220.9、5 920.36的2个峰差异最为显著,其AUCROC值分别为0.93和0.85,且乳腺癌组m/z 4 220.9、5 920.36的峰强度明显低于对照组(图3)。
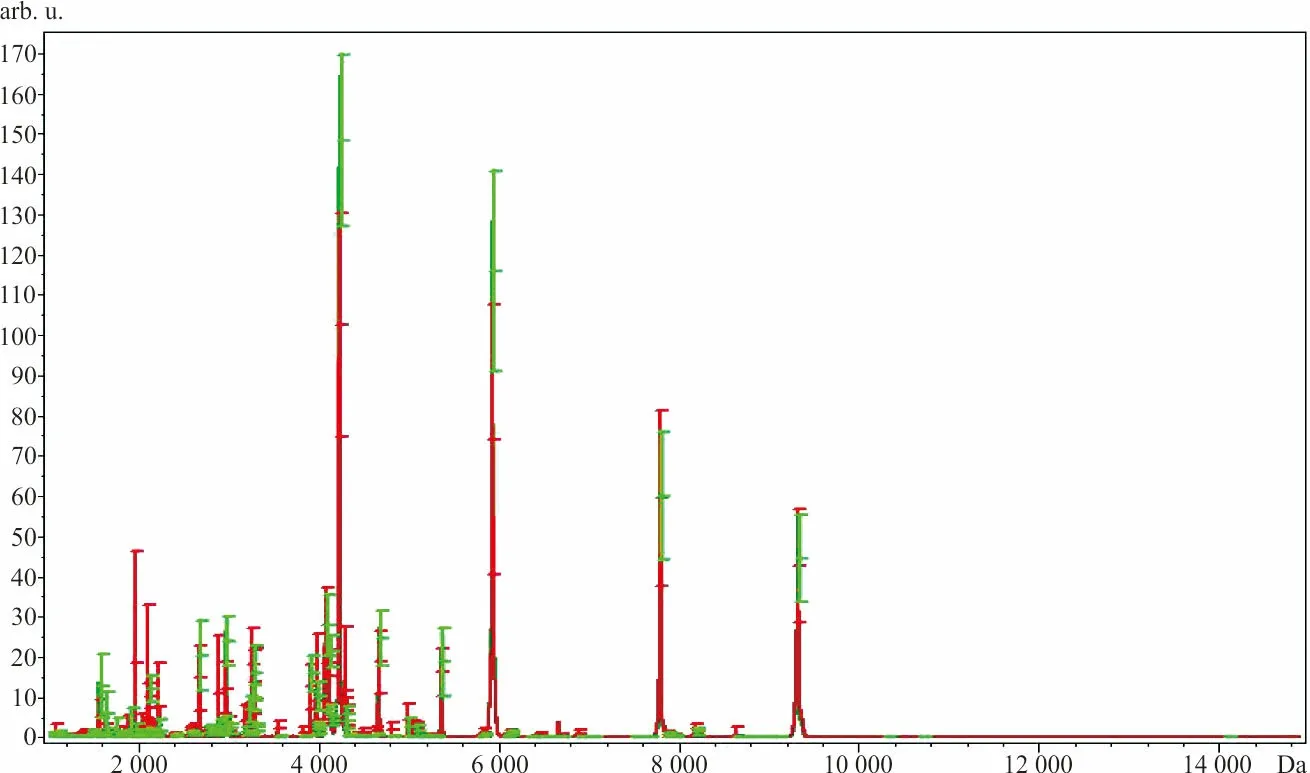
注:红色为乳腺癌组;绿色为对照组。

注:A、a分别为m/z 4 220.9的叠加峰谱图及ROC曲线;B、b分别为m/z 5 920.36的叠加峰谱图及ROC曲线。红色为乳腺癌组;绿色为对照组。
2.3.2乳腺纤维腺瘤组与对照组图谱分析 经ClinProTools软件分析,纤维腺瘤组和对照组两谱图在质量范围1~10 kDa之间,存在明显差异,其中具有统计学意义(P<0.05)的差异峰有40个。包括10个峰表达上调,30个峰表达下调。此外,m/z 4 220.9、5 920.36的2个峰差异最为显著,其AUCROC值分别为0.85和0.96,且纤维腺瘤组m/z 4 220.9、5 920.36的峰强度明显高于对照组。以m/z 5 920.36、4 220.9分别为X、Y轴进行聚类分析,纤维腺瘤组与对照组可以准确地区分,见图4。

注:红色叉号为纤维腺瘤组;绿色圆圈为对照组。
2.3.3乳腺癌组与纤维腺瘤组图谱分析 经ClinProTools软件分析,乳腺癌组与纤维腺瘤组图谱存在明显差异,在1~10 kDa范围内发现有统计学意义(P<0.05)的差异峰78个,其中5个峰表达下调,其余73个峰表达上调。此外,m/z 4 220.9、5 920.36的2个峰差异最为显著,其AUCROC值分别为0.90和0.99,且乳腺癌组m/z 4 220.9、5 920.36的峰强度明显低于纤维腺瘤组。以m/z 5 920.36、4 220.9分别为X、Y轴进行聚类分析,可准确区分乳腺癌组与纤维腺瘤组(图5)。

注:红色叉号为乳腺癌组;绿色圆圈为纤维腺瘤组。
2.3.4TNBC组与NTNBC组图谱分析 经ClinProTools软件分析,TNBC组与NTNBC组图谱存在显著差异,在1~10 kDa范围内筛选出有统计学意义(P<0.05)的差异峰40 个,其中6个峰表达上调,34个峰表达下调。此外,m/z 4 220.9、5 920.36的2个峰差异最为显著,其AUCROC值分别为0.66和1,且TNBC组m/z 4 220.9、5 920.36的峰强度明显高于NTNBC组。以m/z 5 920.36、4 220.9分别为X、Y轴进行聚类分析,可以准确区分TNBC和NTNBC患者(图6)。

注:红色叉号为TNBC组;绿色圆圈为NTNBC组。
3 讨论
质谱技术作为一种新型蛋白质组学技术,具有高灵敏度、高分辨率、高准确性、高通量等优势,能为疾病的临床诊疗提供快速、精准的分子生物学信息,在医学检验领域受到越来越多的关注。既往大量学者使用MALDI-TOF-MS技术对胃癌、肺腺癌、甲状腺乳头状癌、食管鳞癌进行多肽峰的鉴定[3-4]。本研究基于WCX-MB纯化技术,应用MALDI-TOF-MS对乳腺癌组与对照组血清样本进行分析,采用3种算法(GA、SNN、QC)分别建立乳腺癌诊断预测模型并进行验证,结果发现GA算法建立的模型诊断效能最佳。GA算法是一种优化算法,它通过遗传和进化机理,从给出的原始解群中,不断进化产生新的解,直至产生最优解。本研究应用此理论进行取舍,直至得到最佳峰群建立模型。经验证组验证其特异性、敏感性和准确性分别为90.9%、93.8%和92.6%,可有效区分乳腺癌患者与体检健康者。对纤维腺瘤组和对照组、乳腺癌组和纤维腺瘤组以及TNBC组和NTNBC组分别进行聚类分析结果表明,差异最显著的2个质谱峰m/z 4 220.9、5 920.36在纤维腺瘤组中的峰强度显著高于对照组;在乳腺癌组中的峰强度显著低于纤维腺瘤组;在TNBC组中的峰强度显著高于NTNBC组。
综上所述,应用MALDI-TOF-MS技术建立的乳腺癌诊断预测模型具有高敏感性、高特异性、高准确性的特点。该技术能够准确区分良恶性乳腺癌和体检健康者,可用于乳腺癌的早期诊断和高危人群筛查,同时可以更直观地区分TNBC和NTNBC,为临床精准治疗提供更为可靠的依据。在乳腺癌分型上,与传统免疫组化染色法相比,MALDI-TOF-MS技术具有高通量、操作简单以及可排除人为主观因素影响的优点。本次研究筛选出的2个差异峰m/z 4 220.9、5 920.36有望成为乳腺癌潜在的肿瘤标志物。由于本次实验所收集的样本量较少,研究结果存在偏倚的可能性,因此,后续研究中我们将进一步扩大样本量,纳入更多早期乳腺癌患者,细化分组,丰富实验内容。对于此次获得的差异蛋白质/多肽,后续将使用高效液相色谱-电喷雾串联质谱法进行蛋白质分子鉴定,研究其功能并阐明其在乳腺癌发生发病机制中的作用。

