TNF-α对大鼠肺泡 Ⅱ 型上皮细胞增殖及凋亡的影响*
石国翠, 马希刚
1河北沧州市人民医院呼吸内科,沧州 0610002宁夏医科大学总医院重症医学科,银川 750001
急性肺损伤(acute lung injury,ALI)是以中性粒细胞聚集和肺屏障通透性增加为病理特征的临床综合征。全球每年急性肺损伤的患病率为1.5/10万~6.5/10万,病死率约为32%~55%[1]。目前急性肺损伤的发病机制尚未明确,肺泡Ⅱ型上皮细胞(alveolar typeⅡepithelial cells,AEC-Ⅱ)是其重要病理部位。大量研究发现急性肺损伤时伴有AEC-Ⅱ的凋亡[2],上皮细胞的凋亡破坏肺屏障的完整性,导致肺上皮屏障功能损伤。肿瘤坏死因子-α(TNF-α)是急性肺损伤早期的重要炎症因子,参与其发生发展[3]。本研究主要观察TNF-α对正常大鼠AEC-Ⅱ细胞增殖及凋亡的影响,探讨TNF-α在急性肺损伤中的作用机制。
1 材料与方法
1.1 主要实验材料
大鼠AEC-Ⅱ购自上海拜力生物技术有限公司,重组大鼠TNF-α购自PEPROTECH公司,DME/F-12细胞培养液购自美国Hyclone公司,胎牛血清(FBS)购自美国Gibco公司,MTT细胞增殖及细胞毒性检测试剂盒购自南京凯基生物科技发展有限公司,DMSO购自美国Sigma公司,Annexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒购自上海贝博生物公司,大鼠IL-6 ELISA试剂盒购自武汉博士德生物技术有限公司。
1.2 实验方法
1.2.1 AEC-Ⅱ的复苏与传代培养 从液氮罐中取出冻存管(含AEC-Ⅱ)立即放入37℃水浴锅中,迅速摇晃解冻。1000 r/min离心5 min,用含10%FBS的DME/F-12培养液重悬,并以1×106/mL的密度接种于培养瓶中,置于37℃、5%CO2培养箱中培养,隔天换液。光镜下观察AEC-Ⅱ生长状态及形态。当细胞单层融合至90%时用含0.25%的胰蛋白酶消化传代,取第3~6代细胞进行实验。
1.2.2 实验分组与处理 将细胞分为:对照组,用含10%FBS DME/F-12培养液与AEC-Ⅱ共培养;TNF-α不同浓度及不同时间干预组,分别用等体积的5、10、20、40 ng/mL TNF-α溶液与AEC-Ⅱ共培养24、48、72 h。均置于37℃、5%CO2培养箱中培养。
1.2.3 透射电镜鉴定及观察细胞超微结构 收集生长状况良好的AEC-Ⅱ,1000 r/min离心5 min,弃上清,用预冷的缓冲液重悬细胞,2%戊二醛4℃固定1 h,预冷缓冲液漂洗2次,乙醇逐步脱水,1%四氧锇酸后固定,环氧树脂包埋,超薄切片,枸橼酸铅染色,透射电镜下观察。
1.2.4 MTT法测定细胞增殖情况 取对数生长期的AEC-Ⅱ,细胞计数调整细胞密度为0.5×105个/mL,以5000个/孔接种于96孔培养板中,置于37℃、5%CO2饱和湿度培养箱中培养24 h。弃培养液,TNF-α各组每孔分别加入不同浓度TNF-α溶液200 μL,对照组加入等体积的完全培养液,每组设3个复孔,在37℃、5%CO2饱和湿度条件下培养24、48、72 h。培养结束后,更换为无血清培养液,每孔加入1×MTT溶液20 μL及不含FBS的DME/F-12培养液90 μL,37℃避光温育4 h,使MTT还原为甲瓒。弃上清,每孔加二甲基亚砜(DMSO)150 μL,平板摇床摇荡10 min,于490 nm处测定吸光度值(A),按公式计算细胞的增殖抑制率。细胞增殖抑制率(%)=(对照组A值-实验组的A值)/对照组A值×100%。
1.2.5 流式细胞仪测定细胞凋亡率 将AEC-Ⅱ细胞接种于6孔板上,接种密度为2×105个/mL,贴壁24 h后按照上述分组进行处理,处理结束后用不含EDTA的胰酶消化后离心,冷PBS洗涤细胞,用1×Annexin Ⅴ结合液400 μL悬浮细胞,加入Annexin Ⅴ-FITC染色液5 μL,轻轻混匀后于2~8℃避光孵育15 min。加入10 μL PI染色液后轻轻混匀于2~8℃避光孵育5 min。1 h内送流式细胞仪检测。
1.2.6 夹心ELISA法测定细胞上清液中IL-6的含量 收集上述各组细胞上清液,3000 r/min离心10 min,取上清。采用酶联免疫法检测,严格按照试剂盒操作说明进行,最后置于酶标仪450 nm波长处测定各孔A值,用标准品浓度及对应的A值(复孔均值)绘制标准曲线,计算IL-6的含量。
1.3 统计学方法
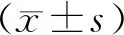
2 结果
2.1 电子显微镜下大鼠AEC-Ⅱ的超微结构
透射电镜下可见细胞表面有长短不一的微绒毛,细胞核较大,胞质内含有大小不一的特征性板层小体,沿细胞核分布,数量不等,可看到不同的成熟阶段(图1)。
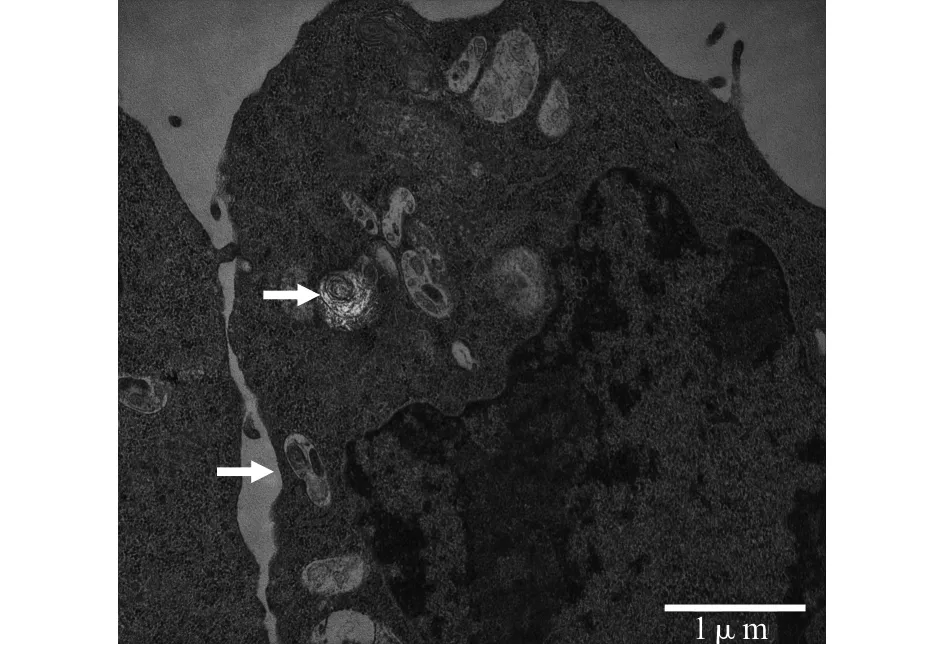
图1 AEC-Ⅱ透射电镜下的超微结构(箭头所示为板层小体)Fig.1 Ultrastructure of AEC-Ⅱ under transmission electron microscope(lamellar bodies are indicated by arrows)
2.2 TNF-α对AEC-Ⅱ增殖的影响
不同浓度TNF-α相同作用时间下细胞增殖抑制率的比较:当作用时间为24 h时,TNF-α 40 ng/mL组细胞的增殖抑制率明显高于其它浓度组(均P<0.05);48 h、72 h时TNF-α各浓度组细胞的增殖抑制率与对照组比较均明显升高(均P<0.05),且随着浓度的增加,对细胞增殖的抑制率也随之上升,各浓度组之间差异有统计学意义(均P<0.05)。相同作用浓度不同作用时间下细胞增殖抑制率的比较:与24 h时比较,作用48、72 h时各浓度组细胞抑制率均明显增加(均P<0.05);TNF-α作用72 h后细胞的抑制率均较48 h明显增加(均P<0.05)。见表1。
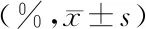
表1 TNF-α对AEC-Ⅱ增殖的影响Table 1 The effect of TNF-α on AEC-Ⅱ proliferation
同一作用时间不同TNF-α浓度组间比较:与对照组(TNF-α 0 ng/mL)比较,aP<0.05;与TNF-α 5 ng/mL组比较,bP<0.05;与TNF-α 10 ng/mL组比较,cP<0.05;与TNF-α 20 ng/mL组比较,dP<0.05。同一TNF-α浓度不同作用时间组间比较:与24 h组比较,*P<0.05;与48 h组比较,#P<0.05
2.3 TNF-α对AEC-Ⅱ凋亡的影响
作用时间24 h时,TNF-α 20 ng/mL组和TNF-α 40 ng/mL组的凋亡率与对照组比较明显增加(均P<0.05);在作用时间为48、72 h时,TNF-α的各浓度组AEC-Ⅱ细胞的凋亡率与对照组比较均明显增加,且随着浓度增加,细胞凋亡率逐渐增加,各浓度组之间差异均有统计学意义(均P<0.05)。TNF-α各浓度组细胞的凋亡率随作用时间的延长而增加,各组间差异均有统计学意义(均P<0.05)。见图2。
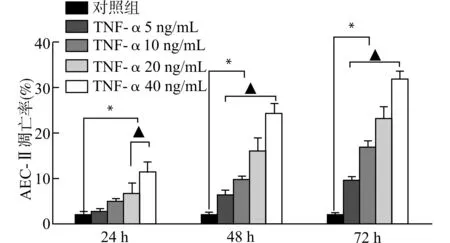
与对照组比较,*P<0.05;相同作用时间下各浓度组间两两比较,▲P<0.05图2 TNF-α对AEC-Ⅱ凋亡的影响Fig.2 Effect of TNF-α on AEC-Ⅱ apoptosis
2.4 TNF-α对AEC-Ⅱ细胞上清液中IL-6含量的影响
在TNF-α同一作用时间下,各浓度组间两两比较,TNF-α 40 ng/mL组IL-6水平较对照组及TNF-α 5 ng/mL组明显升高(均P<0.05),其余各浓度组间两两比较差异无统计学意义(均P>0.05)。在同一作用浓度下,各时间点组间两两比较,细胞上清液中IL-6的水平差异均无统计学意义(均P>0.05)。见表2。
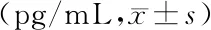
表2 TNF-α对体外培养的AEC-Ⅱ上清液中IL-6水平的影响Table 2 The effect of TNF-α on the level of IL-6 in the supernatant of AEC-Ⅱin vitro
3 讨论
肺屏障主要由肺泡表面液体层、肺泡上皮细胞层、上皮基底膜层、肺泡上皮和毛细血管之间的间隙(基质层)、毛细血管基底膜、肺微血管内皮细胞层共同组成,维持肺内外气体交换及液体平衡。肺泡上皮细胞是肺与外界环境进行气体交换的物理屏障,主要由AEC-Ⅰ(占肺泡表面积的95%以上)和AEC-Ⅱ(合成和分泌表面活性物质)组成[4]。AEC-Ⅱ是肺泡上皮的祖细胞,可以自我增殖并分化为AEC-Ⅰ,促进肺泡的组织修复[5]。因此,AEC-Ⅱ对维持肺泡张力,防止肺泡萎陷及修复损伤的肺组织尤为重要。且研究发现,在AEC-Ⅱ受损时,即可导致肺水肿的形成,造成肺损伤[6]。故本研究选用AEC-Ⅱ作为研究对象,用透射电镜鉴定,可见其胞浆丰富,含有不同成熟阶段的板层小体,分布于细胞核的周围。
TNF-α是肺损伤时介导炎症反应的重要因子,主要由单核细胞、巨噬细胞等免疫细胞产生。在炎症反应时,TNF-α过表达可以上调肺上皮及内皮细胞的炎症介质及细胞凋亡相关基因表达,并促进免疫细胞的活化与凋亡[7]。本研究结果显示:TNF-α与体外培养的大鼠AEC-Ⅱ共培养时,细胞的凋亡率明显增加,且呈现时间-剂量依赖关系。说明急性肺损伤时,TNF-α诱导AEC-Ⅱ的凋亡,损伤肺泡组织。有研究显示,AEC-Ⅱ的凋亡参与肺上皮屏障功能的破坏,导致细胞旁通透性增加,增加水分子及其他溶质分子通过细胞旁途径进入肺泡内,引起肺水肿[8]。因此,ACE-Ⅱ细胞凋亡导致结构细胞数量减少,肺表面活性物质释放减少,肺泡塌陷,肺组织病理变化加重,这可能与破坏了肺屏障的连续性及完整性,增加肺屏障的通透性有关。
在各种原因导致的急性肺损伤模型中,TNF-α参与调节细胞的增殖与分化、炎症级联反应,调节免疫功能[9-11]。研究证实,急性肺损伤时,TNF-α大量释放,肺泡灌洗液中及血清中TNF-α的水平明显升高[12-13]。过量的TNF-α可诱导炎性介质及细胞因子瀑布式释放,加重肺部炎症反应,导致肺损伤。因此,TNF-α在肺损伤的发生及发展过程中发挥关键性作用。本研究将TNF-α与AEC-Ⅱ共培养后测定细胞的增殖抑制率,结果显示TNF-α作用24 h时,只有TNF-α 40 ng/mL组细胞的增殖抑制率高于对照组,当TNF-α作用时间延长至48 h、72 h时,TNF-α各组细胞的增殖均明显受到抑制,说明TNF-α对细胞增殖的抑制作用与TNF-α的浓度及作用时间相关,浓度越高,作用时间越长,其对细胞的增殖抑制越明显,这可能与TNF-α对细胞造成炎性损伤,并抑制细胞的有丝分裂有关。说明在急性肺损伤时,释放入血的TNF-α刺激AEC-Ⅱ,诱导其凋亡,破坏肺屏障,导致肺损伤,进而使更多的炎性介质、液体、蛋白等渗透入肺泡,形成肺水肿,影响肺通气及换气功能,加重组织缺氧。同时过量释放的TNF-α抑制AEC-Ⅱ的自我增殖,影响损伤肺组织的自我修复,从而进一步加重肺损伤。
此外,TNF-α是损伤时介导炎症反应的重要因子,始动炎症级联反应和细胞因子瀑布效应。研究证实,在急性肺损伤时,大鼠肺泡灌洗液及血清中的IL-6的水平明显升高[14]。研究认为这可能与TNF-α激活了NF-κB,促进炎症因子的产生及释放有关[15]。在本研究中,高浓度TNF-α组细胞上清液中IL-6的含量高于对照组及低浓度TNF-α组,说明TNF-α诱导IL-6水平的增加与TNF-α的作用浓度明显相关,具有一定的剂量依赖效应。而在同一浓度条件下,作用时间的长短并不影响IL-6水平的改变。说明TNF-α单独作用于AEC-Ⅱ时,IL-6升高与TNF-α的浓度相关,而与作用时间无明显关系。
综上,TNF-α通过诱导AEC-Ⅱ的凋亡,导致肺损伤,并通过抑制其增殖,阻碍损伤肺组织的自我修复;同时,高浓度TNF-α诱导IL-6水平的上调,加重肺部的炎症反应,加重肺损伤。

