JAK2/STAT3信号通路在右美托咪定抗小鼠脑缺血/再灌注损伤中的作用*
门运政, 童旭辉, 胡 淼, 王雪如, 刘 刚, 董淑英△
1蚌埠医学院药学院药理学教研室,蚌埠 2330302蚌埠医学院第一附属医院麻醉科,蚌埠 233004
随着世界人口老龄化的加速,脑卒中成为危害中老年人生命健康的主要疾病,且该病具有发病率高、致残率高以及死亡率高的特点[1]。脑卒中以缺血性脑卒中居多,其占比可达80%以上。目前临床上治疗缺血性脑卒中以溶栓为主,但溶栓治疗会带来脑缺血再灌注(ischemia/reperfusion,I/R)损伤的不利影响。脑I/R损伤是缺血区脑组织恢复血液再灌注所造成的二次损伤,同时脑I/R损伤也是临床围术期常见的并发症。右美托咪定(dexmedetomidine,DEX)作为临床常用麻醉辅助用药已被证实可减轻心脏、肾脏等器官I/R损伤[2-3]。近年来研究表明,DEX可通过抗炎和抗氧化应激发挥神经保护作用,减轻脑I/R损伤,但其具体的作用机制尚不明确[4-5]。JAK2/STAT3信号通路是细胞中不可缺少的信号转导通路,对细胞增殖、凋亡、炎症反应等生理过程具有重要的调控作用。有研究表明,JAK2/STAT3信号通路的激活可以减轻脑I/R损伤[6-7]。但DEX抗脑I/R损伤的作用是否与JAK2/STAT3信号通路有关尚未见文献报道。本研究通过建立小鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型,观察DEX给药对脑I/R损伤JAK2/STAT3信号通路及细胞凋亡的影响,探讨JAK2/STAT3信号通路在DEX抗脑I/R损伤中的作用。
1 材料与方法
1.1 实验动物
所有实验采用雄性ICR小鼠,鼠龄9~12周,体重25~35 g,共60只,购自山东朋悦实验动物公司。小鼠统一饲养在动物房中,保持室温(22±2)℃,相对湿度55%~65%,明暗循环12 h,食物和饮水可自由获取。
1.2 药物与试剂
盐酸右美托咪定注射液(江苏恩华),水合氯醛、多聚甲醛(上海Macklin公司),2,3,5-氯化三苯基四氮唑(TTC)染色液(美国Sigma公司),JAK2/STAT3抑制剂AG490(Selleck公司),p-STAT3、STAT3单克隆抗体(美国CST公司),Bax、Bcl-2、GAPDH单克隆抗体(Proteintech公司)。
1.3 分组及给药处理
将60只ICR小鼠随机分为4组:假手术(sham)组、I/R组、I/R+DEX组、I/R+DEX+AG490组。DEX(50 μg/kg)在MCAO前30 min经腹腔注射给药,AG490(5 mg/kg)经腹腔注射给药。
1.4 小鼠MCAO模型的制备
采用改良线栓法制备小鼠MCAO模型。小鼠腹腔注射10%水合氯醛(4 μL/g)进行麻醉,仰卧位固定于操作台。剃去颈部毛发,用碘伏和乙醇消毒后,沿颈部正中切开,暴露出右侧颈总动脉后,继续分离出颈外动脉和颈内动脉。在颈外动脉远心端用手术缝合线结扎,并用小动脉夹将颈内动脉夹闭,然后在颈外动脉上剪一小口,将线栓从颈外动脉插入颈内动脉,略感阻力后停止进线,线栓经颈内动脉到达大脑中动脉。sham组除线栓只插入颈内动脉外,其他操作与模型组一致。缺血1 h后拔出线栓,缝合皮肤,恢复血液再灌注,正常饲养24 h后进行后续实验。
1.5 神经功能障碍评分
参照Longa五分法对脑缺血1 h,再灌注24 h的小鼠进行神经功能障碍评分。活动正常无神经功能障碍小鼠评为0分;不能充分伸展手术对侧前爪者评为1分;行走时向手术对侧转圈者评为2分;行走不便,向手术对侧倾倒者评为3分;行走严重障碍或无自发运动,意识水平下降者评为4分。神经行为学评分为1~4分者视为造模成功。
1.6 小鼠脑梗死体积测定
对脑缺血1 h,再灌注24 h的小鼠进行评分后,立即取出脑组织,在-20℃冰箱冷冻10~12 min取出,随后将脑组织做成等距的4片冠状切片(厚度约2 mm)。将脑片置于1%的TTC染色液中,在37℃恒温水浴锅中避光孵育20 min,每5 min翻一次面。染色结束后,弃TTC染液,将脑片固定在4%的多聚甲醛中。用数码相机拍照,使用Image J软件扫描图片,并计算各组小鼠脑梗死体积占对侧大脑体积的百分比。
1.7 TUNEL染色法检测脑组织细胞凋亡
于脑缺血1 h,再灌注24 h后,取出小鼠大脑并在4%的多聚甲醛中固定。24 h后对脑组织进行常规石蜡包埋、切片,然后用二甲苯浸洗脱蜡,梯度乙醇浸洗2~3 min,滴加蛋白酶K在37℃条件下孵育15~30 min。滴加50 μL的TUNEL检测液,37℃避光孵育1 h。接着,滴加50 μL工作液并在37℃条件下孵育30 min,最后,加DAB染色,苏木精复染,梯度乙醇脱水、透明、封片。正常细胞核被染成蓝色,凋亡细胞的细胞核被染成深棕色。在显微镜下观察小鼠大脑皮层区细胞凋亡情况,随机选取3个视野计数TUNEL染色阳性细胞数和细胞总数,计算TUNEL染色阳性率。TUNEL染色阳性率(%)=阳性细胞数/细胞总数×100%。
1.8 免疫印迹法检测脑组织中p-STAT3、Bax、Bcl-2的表达
于脑缺血1 h,再灌注24 h后,立即处死小鼠并夹取缺血区脑组织,将脑组织置于玻璃研磨器中加入裂解液匀浆,收集蛋白匀浆到1.5 mL EP管中,冰上静置裂解30 min。然后在4℃、12000 r/min的条件下离心30 min,取上清液进行标准蛋白定量。制备SDS-PAGE凝胶,将蛋白样品上样后进行电泳,转膜,封闭。封闭结束后用TPBS将膜洗3遍,每次4 min。随后将PVDF膜分别与p-STAT3(1∶1000)、Bax(1∶1000)、Bcl-2(1∶1000)、GAPDH(1∶2000)一抗在4℃孵育过夜,第2天,用TPBS洗膜,加二抗孵育2 h。使用ECL显影液使膜发光、显影,用Bio-Rad凝胶成像系统采集图像,用Bio Imaging System(Gene Genius)对图像进行灰度扫描分析。
1.9 统计学分析
2 结果
2.1 DEX可减轻脑I/R损伤所致小鼠神经功能障碍
小鼠脑缺血1 h,再灌注24 h后进行神经行为学评分。结果表明,sham组小鼠行动正常,无神经功能缺失现象;I/R组小鼠出现严重的神经功能障碍,神经行为学评分(3.10±0.74)较sham组小鼠显著升高(P<0.01);DEX治疗后,小鼠神经功能有所改善,神经行为学评分(1.50±0.71)较I/R组降低(P<0.01);在使用DEX的基础上使用JAK2/STAT3抑制剂,DEX的保护作用减弱,神经行为学评分(2.80±0.79)较I/R+DEX组升高(P<0.01)。以上结果提示,DEX可减轻脑I/R损伤导致的小鼠神经功能障碍,其作用机制可能与JAK2/STAT3信号通路有关。
2.2 DEX可减小脑I/R损伤小鼠脑梗死体积
采用TTC染色法检测不同组小鼠的脑梗死体积,结果显示(图1),sham组脑组织染色后呈红色,无梗死区;I/R组染色后出现梗死区,梗死区染色呈白色。DEX治疗后,小鼠脑梗死体积较I/R组明显缩小(P<0.01);而在使用DEX的基础上加用JAK2/STAT3抑制剂,小鼠脑梗死体积较I/R+DEX组增加(P<0.01)。以上结果提示,DEX可以改善I/R造成的脑组织损伤,减小脑梗死体积。
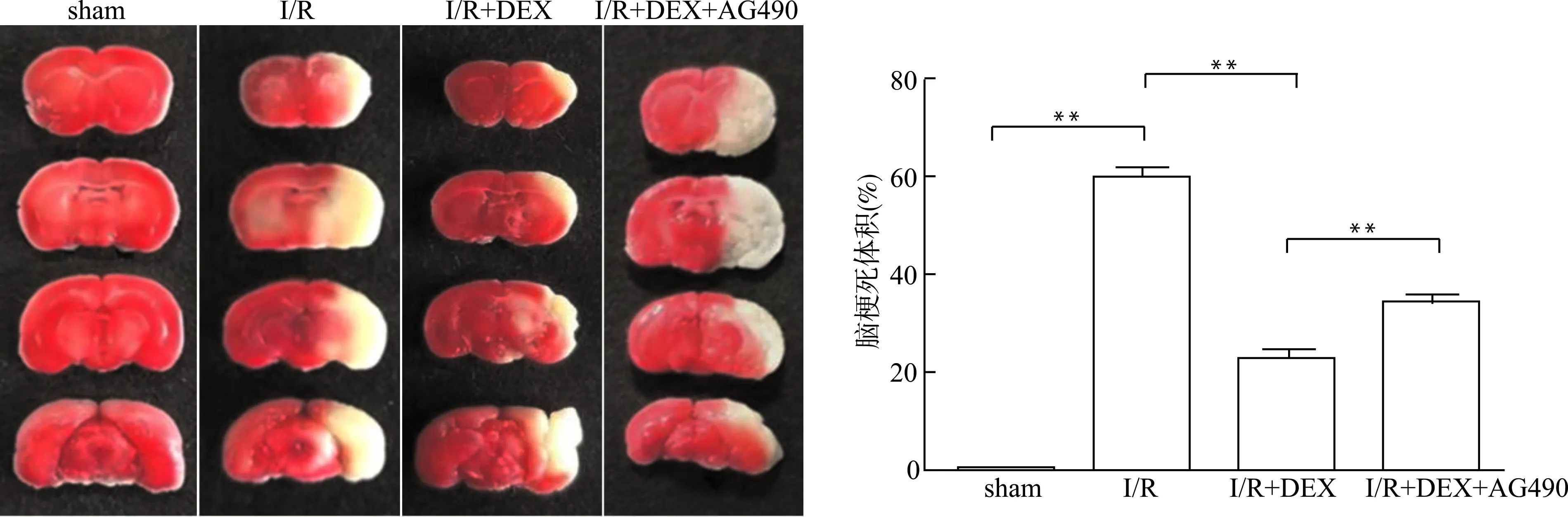
**P<0.01图1 DEX对脑I/R损伤小鼠脑梗死体积的影响Fig.1 Effects of dexmedetomidine on brain infarct volume of mice after cerebral I/R injury
2.3 DEX可减少小鼠脑组织细胞凋亡
用TUNEL染色法检测不同组小鼠大脑皮层组织中细胞的凋亡情况。正常细胞染色呈蓝紫色,凋亡细胞呈深棕色。结果显示(图2),sham组存在少量凋亡细胞,当发生脑I/R损伤后,I/R组凋亡细胞显著增多(P<0.01);DEX治疗后,与I/R组相比,凋亡细胞率显著降低(P<0.01);在使用DEX的基础上加用JAK2/STAT3抑制剂,与I/R+DEX组相比,小鼠脑组织细胞凋亡显著增多(P<0.01)。上述结果表明,DEX可以降低I/R损伤小鼠脑组织细胞的凋亡,其作用可能与JAK2/STAT3信号通路的激活有关。
2.4 DEX可激活JAK2/STAT3信号通路
为探究DEX对JAK2/STAT3信号通路的影响,用免疫印迹法检测JAK2/STAT3信号通路的活性成分p-STAT3和STAT3的表达。结果显示(图3),与sham组相比,I/R组p-STAT3/STAT3增加(P<0.01);DEX治疗后,与I/R组相比,p-STAT3/STAT3进一步增加(P<0.01);在使用DEX的基础上加用JAK2/STAT3抑制剂后,与I/R+DEX组相比,p-STAT3/STAT3降低(P<0.05)。上述结果表明,在抗小鼠脑I/R损伤时,DEX可激活JAK2/STAT3信号通路。
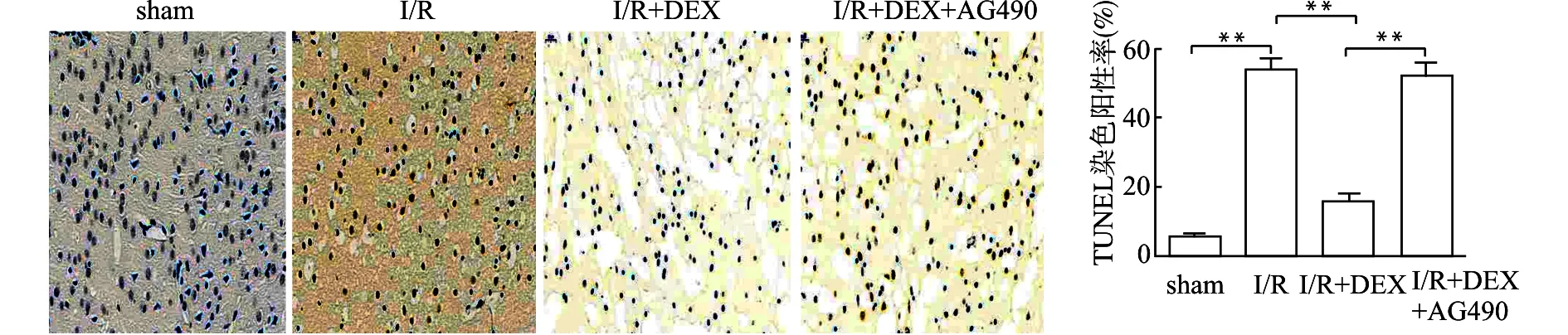
**P<0.01图2 DEX对脑I/R损伤小鼠细胞凋亡的影响(×400)Fig.2 Effects of dexmedetomidine on cell apoptosis in mice with cerebral I/R injury(×400)

*P<0.05,**P<0.01图3 DEX对脑I/R损伤小鼠p-STAT3/STAT3的影响Fig.3 Effects of dexmedetomidine on the ratio of p-STAT3/STAT3 in mice with cerebral I/R injury
2.5 DEX可影响脑I/R损伤后Bax、Bcl-2蛋白的表达
为进一步探究JAK2/STAT3信号通路在DEX抗脑I/R损伤中的作用机制,我们检测了凋亡相关蛋白Bax和Bcl-2的表达。结果显示(图4),与sham组相比,I/R组Bax/Bcl-2的比值显著升高(P<0.01);DEX治疗后,与I/R组相比,Bax/Bcl-2的比值显著降低(P<0.01);在使用DEX的基础上加用JAK2/STAT3抑制剂后,与I/R+DEX组相比,Bax/Bcl-2的比值升高(P<0.01)。以上结果表明,DEX抗脑I/R损伤的作用可能与激活JAK2/STAT3信号通路后降低Bax/Bcl-2比值有关。
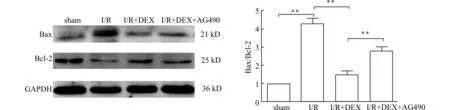
**P<0.01图4 DEX对脑I/R损伤小鼠Bax/Bcl-2比值的影响Fig.4 Effects of dexmedetomidine on the ratio of Bax/Bcl-2 in mice with cerebral I/R injury
3 讨论
缺血性脑损伤是多种机制共同参与的一种复杂的病理生理过程,其机制涉及到能量代谢障碍、兴奋性氨基酸毒性、炎症反应、神经细胞凋亡等[8-9]。目前临床上治疗缺血性脑损伤主要采用静脉溶栓药以及血管内介入疗法等措施恢复血液再灌注,但由再灌注造成的二次损伤是临床面临的又一项挑战[10]。因此,探索治疗脑I/R损伤的潜在治疗药物具有十分重要的临床意义。DEX是临床上广泛使用的麻醉辅助用药,具有镇静、镇痛、稳定围术期血流动力学等作用[11]。既往研究报道,DEX可通过抗炎、抗氧化应激等途径发挥器官保护作用,改善多种组织器官I/R损伤[4,12]。有临床研究证实,DEX可通过PI3K/AKT/GSK-3β信号通路减轻大鼠心肌的I/R损伤[13]。在对糖尿病大鼠模型的研究中发现DEX预处理通过上调HIF-1α减轻肾脏I/R损伤[14]。为了探究DEX对脑I/R损伤的作用机制,本研究通过线栓法构建脑I/R损伤模型,I/R组小鼠神经行为学评分和脑梗死体积百分比明显增加,表明模型构建成功。DEX进行干预后发现,小鼠神经行为学评分和脑梗死体积百分比均显著低于I/R组,提示DEX对小鼠脑I/R损伤有保护作用。
脑I/R损伤的发生机制复杂,其中神经细胞凋亡是导致脑I/R损伤的重要因素。本实验通过TUNEL染色检测发现,I/R组小鼠脑细胞TUNEL染色阳性率显著升高,证明小鼠脑I/R损伤过程中存在细胞凋亡;而在使用DEX处理后,TUNEL染色阳性率明显降低,再次表明DEX对脑I/R损伤小鼠的保护作用,且其保护作用可能是通过抑制脑I/R损伤过程中神经细胞的凋亡实现的。
JAK2/STAT3信号通路是一条高度进化保守的信号通路,主要参与细胞对不同的细胞因子和生长因子的反应,是细胞内调控凋亡和氧化应激等反应的重要途径。STATs蛋白家族在JAK2/STAT3信号通路中发挥主要作用,其中STAT3比其他STAT蛋白具有更高的保守性,STAT3的激活可以指导下游基因的转录和表达发挥抗凋亡和促增殖的作用[15]。在Zhao等[16]的研究中发现,激活STAT3抑制了缺氧/复氧诱导的大鼠心肌微血管内皮细胞的凋亡。在脑I/R损伤的动物模型中发现,JAK2/STAT3信号通路的激活可以减轻脑损伤[17-18]。在我们的实验中发现,I/R组小鼠脑组织中p-STAT3/STAT3增加,我们分析这可能是由于机体自身的保护机制部分激活了JAK2/STAT3信号通路。而在使用DEX进行治疗后,p-STAT3/STAT3表达明显增加,表明DEX可以促进JAK2/STAT3信号通路活化,提示DEX可能通过JAK2/STAT3信号通路发挥脑保护作用。为了进一步验证此结论,我们在使用DEX治疗的基础上进一步使用JAK2/STAT3信号通路抑制剂AG490进行处理,在抑制JAK2/STAT3信号通路后发现,与I/R+DEX组相比,小鼠神经行为学评分、脑梗死体积百分比、TUNEL阳性率均明显增加,脑组织中p-STAT3/STAT3明显降低。上述结果表明,JAK2/STAT3信号通路抑制剂显著减弱了DEX的脑保护作用,提示DEX通过JAK2/STAT3信号通路抑制神经细胞的凋亡,发挥对小鼠脑I/R的保护作用。
多项研究表明,脑I/R损伤过程中的神经细胞凋亡受到B细胞淋巴瘤(Bcl-2)蛋白家族的调控,这些蛋白在凋亡级联反应中起重要作用[19-21]。Bcl-2家族中抗凋亡蛋白Bcl-2以及促凋亡蛋白Bax是参与线粒体介导凋亡的关键分子,两者维持动态平衡。越来越多的证据表明,在多种病理生理条件的刺激下Bax表达上调,Bcl-2表达下调,引起线粒体膜通透性改变,触发细胞色素C的释放并促进凋亡小体的形成最终导致细胞凋亡[22-23]。因此,Bax/Bcl-2的比值也被用来衡量细胞凋亡的严重程度。研究表明,JAK2/STAT3信号通路的激活可以通过降低Bax表达及增加Bcl-2的表达抑制细胞的凋亡[24-25]。我们猜测DEX通过JAK2/STAT3信号通路抑制细胞凋亡的作用也可能与Bax、Bcl-2有关,为了进行验证,我们用免疫印迹法检测了Bax、Bcl-2蛋白的表达。结果发现,I/R组小鼠脑组织中Bax/Bcl-2的比值显著升高,在使用DEX处理后,Bax/Bcl-2的比值降低,在使用JAK2/STAT3信号通路抑制剂AG490后DEX对凋亡基因的调节作用被减弱,Bax/Bcl-2的比值有所升高。
综上所述,本研究发现DEX抗小鼠脑I/R损伤作用与激活JAK2/STAT3信号通路,减少Bax/Bcl-2的比值,进而减少神经细胞凋亡有关。本研究为缺血性脑卒中患者围手术期合理使用DEX提供了理论依据。

