保健食品中微量酚酞ELISA的快速检测方法
杨文斌,李晓娜,管淑玉, *
1. 广东药科大学中药学院(广州 511400);2. 国家中医药管理局中药数字化质量评价技术重点研究室(广州 511400)
近年来,在保健食品中非法添加化学药物及化学成分越来越复杂与隐蔽,这给消费者带来极大的安全隐患和危害,也给监管部门带来监管困难与挑战。2018年国家食品药品监督管理总局(CFDA)公布的10起保健食品欺诈和虚假宣传典型案例中,就有2起案件是关于减肥类保健食品非法添加酚酞与盐酸西布曲明[1]。酚酞是化学品和临床处方药,主要用于治疗习惯性、顽固性便秘。过量或长期滥用,可造成人体电解质代谢紊乱,严重时甚至可诱发心律失常,是国家明令禁止非法添加的非食用物质[2]。一些不法商贩为达到快速减肥的效果,在保健食品中非法添加酚酞。因此,针对减肥类保健食品中非法添加酚酞的情况,建立一种快速、稳定、灵敏的检测方法,具有重要意义。
目前,用于检出非法添加酚酞的方法主要有拉曼光谱法、HPLC-DAD法、HPLC-MS/MS法等[3]。这些方法检测仪器昂贵、操作繁琐、专属性低。而免疫分析方法,尤其是ELISA,技术操作简单快速、灵敏度高、不需要昂贵的仪器设备等优点。逐渐成为市场上检测化合物有效手段之一。
传统间接竞争ELISA检测方法中,小分子半抗原与蛋白偶联后通过疏水作用吸附在酶标板上,而这种吸附作用会影响抗原与抗体的结合反应[4-5]。小分子半抗原与蛋白偶联的过程繁琐,重复性较差,不利于检测方法的标准化。该方法将酚酞氨基化后通过戊二醛直接交联于酶标板微孔上,避免传统ELISA检测的缺点。对其主要影响因素如包被浓度、封闭条件、抗体稀释度等进行优化,建立一种新型的检测酚酞ELISA方法。
1 材料
1.1 仪器与试剂
酶标仪(ELX800,BioTek Instruments);低温高速离心机(北京博劢行公司);恒温磁力搅拌器(JB-3,常州澳华公司);AVANCE 500 MHz核磁共振仪(瑞士布鲁克拜厄斯宾有限公司)。
脱脂奶粉(北京Solarbio公司,批号232100);卵清蛋白(OVA,合肥博美生物科技公司,批号AL7514);辣根过氧化物酶(HRP,标记的羊抗鼠IgG,北京Solarbio公司,批号20180607);96孔可拆卸酶标板(上海斯信生物科技有限公司,批号171224-079);酚酞(天津大茂,批号20160917);浓硝酸(广州化学试剂厂,20080601-1);氨基乙酸(天津福晨化学试剂,20150205)免疫抗原(广东工业大学制备,批号PHCB170302);酚酞多克隆抗体血清(自制);50%戊二醛(麦克林公司,批号M00318013);连二亚硫酸钠(天津永大化学试剂,20170804);3, 3’, 5, 5’-四甲基联苯胺(北京Solarbio公司,批号0759)。
1.2 溶液的配置
pH 7.4磷酸盐缓冲液(PBS):0.60 g NaH2PO4·2H2O和5.816 g Na2HPO4·12H2O,用蒸馏水定容至1 L;pH 9.6碳酸盐缓冲液:1.59 g Na2CO3和2.93 g NaHCO3,蒸馏水定容至1 L;酶标二抗稀释液及洗涤液(PBST):含0.05%吐温-20的磷酸盐缓冲液;TMB显色液:10 mg TMB+1 mL H2O+10 μL 30% H2O2配成显色剂,取100 μL显色剂加入至9.9 mL底物缓冲液(蒸馏水溶解0.51 g柠檬酸和1.84 g Na2HPO4·12H2O并定容至100 mL)中混匀即为TMB显色液;终止液为2 mol/L浓硫酸。
2 方法与结果
2.1 氨基化酚酞的制备
称取1 g酚酞溶解于20 mL丙酮并置于100 mL单口瓶中,加入1 mL浓硝酸,不停搅拌,将体系升温至60℃,搅拌反应12 h。反应结束后,将20 mL水滴入到反应液中,析出大量黄色晶体,经过滤、用少许冷乙醇洗涤,烘干,过滤得到黄色固体a[6]。向100 mL三口瓶中加入0.5 g 3, 3’-二硝基酚酞、0.25 g无水碳酸钠,向瓶中加入20 mL DMF、10 mL去离子水,快速搅拌溶解。在60~70 ℃温度下,分批量加入1.5 g连二亚硫酸钠。溶液由红色逐渐变淡。加完料后升温回流1 h。冷却,过滤,用少量水冲洗残留的盐分,抽真空干燥得到灰白色固体b,合成路线见图1。

图1 氨基化酚酞的合成路线图
化合物b1H-NMR谱峰由AVANCE 500 MHz核磁共振仪测得,如图2所示。产物在δ=4.60时有一单峰,即为苯环氨基上的氢。δ=9.17时的峰为苯环上羟基氢。说明应用连二亚硫酸钠已经将苯环上硝基还原成氨基。

图2 化合物b 1H-NMR图谱
2.2 氨基化酚酞包被ELISA微孔板的制备
用pH 9.6碳酸盐缓冲液(CBS)将50%戊二醛稀释成6.5%,加入到酶标板中,每孔200 μL,37 ℃孵育2 h。PBST洗涤3次。用DMF溶解氨基化酚酞并用PBS稀释至4 μg/mL,加入酶标板中,每孔100 μL,37 ℃孵育2 h。PBST洗涤后,用适当浓度的氨基乙酸结合剩余的醛基部分,37 ℃孵育2 h。PBST洗涤3次后,加入5%脱脂奶粉,每孔200 μ L,进行封闭,37 ℃孵育2 h,用PBST洗涤5次后,冰箱4 ℃保存[3-4]。包被原理见图3。
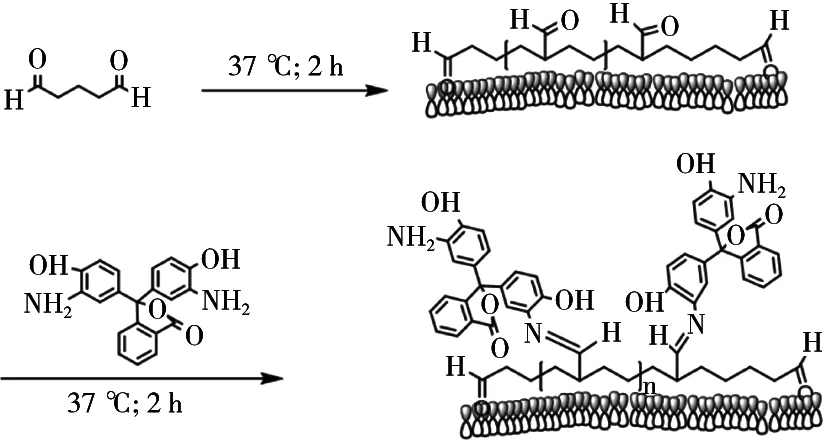
图3 氨基化酚酞包被微孔板的过程
2.3 酚酞间接竞争ELISA(ic-ELISA)检测方法的研究
2.3.1 ic-ELISA检测的一般步骤
在制备好的微孔板中加入一定浓度样品及抗体,37 ℃孵育1 h。PBST洗涤5次,加入PBST稀释1 000倍后的酶标二抗,37 ℃孵育1 h,用PBST洗涤5次后,向酶标板中加入每孔100 μ L的TMB显色液,37 ℃孵育15 min后加入每孔50 μL 2 mol/L浓硫酸终止反应。用酶标仪450 nm波长测定OD值[7-8]。
2.3.2 封闭条件的优化
在包被氨基酚酞的酶标板上加入浓度分别为0.1,0.2,0.3,0.4和0.5 mol/L氨基乙酸,每孔200 μL。37 ℃孵育2 h后,5%脱脂奶粉37 ℃封闭2 h。PBST洗涤3次,加入PBS缓冲液,37 ℃孵育1 h,后续步骤同2.3.1。由图4可知,氨基乙酸浓度0.1 mol/L时,酶标二抗与酶标板微孔的非特异性结合最低,确定0.1 mol/L的氨基乙酸为最佳封闭浓度。

图4 封闭液的优化
2.3.3 抗体稀释液的筛选
为减少血清的非特异性结合,按上述最佳封闭条件,对戊二醛处理后的酶标板进行封闭。分别用1%卵清蛋白(OVA)、2.5%脱脂奶粉、PBST稀释抗体血清,按2.3.1的步骤测定OD450nm值。结果见图5,向抗体血清中加入一定量的脱脂奶粉可减少血清的非特异性结合,因此对脱脂奶粉浓度做进一步考察。用PBS配置含0,1%,2%,3%,4%和5%脱脂奶粉作为抗体的稀释液,在未包被氨基酚酞的酶标板中进行间接ELISA检测,结果见图6。3%脱脂奶粉抗体稀释液,有利于避免抗体血清的非特异性结合。
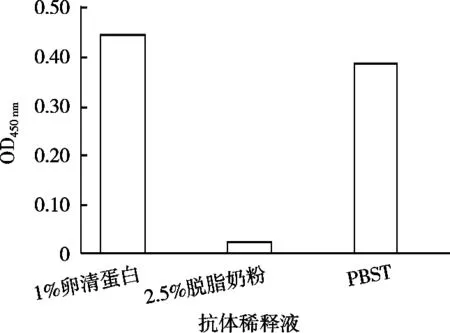
图5 抗体稀释液的选择

图6 脱脂奶粉浓度的筛选
2.3.4 最佳包被抗原及抗体稀释度的确定
采用方阵滴定法确定包被抗原浓度、抗体稀释倍数。包被原氨基化酚酞质量浓度为2,3,4,5和6 μ g/mL。抗体血清由1︰50倍比稀释至1︰1 600。采用间接非竞争ELISA测定OD450nm值。通过间接非竞争ELISA确定最佳包被浓度及抗体的稀释倍数,检测结果见表1。为确保检测结果的准确性及方便分析,一般选取OD450nm值1左右。ic-ELISA检测时血清的量为50 μL,因此选OD450nm值2.0左右。由表1可知,氨基酚酞质量浓度4 μ g/mL、抗体血清稀释倍数1︰100时,OD450nm=2.017,即包被抗原的最佳质量浓度4 μg/mL,抗体的最佳稀释倍数1︰100。

表1 方阵滴定法确定工作浓度
2.3.5 样品溶剂筛选及TMB显色时间的优化
将酚酞分别溶解于二甲基亚砜(DMSO)、二甲基甲酰胺(DMF)、甲醇、乙醇试剂中,配置成50 ng/mL的溶液。在未包被氨基酚酞的酶标板中加入样品与多克隆抗体,同2.3.1的步骤测定OD450nm值。发现DMSO、DMF可破坏封闭液,导致抗体的非特异性结合增加,而甲醇与乙醇影响较小,因此首选乙醇作为样品的溶剂。
2.3.6 ic-ELISA标准曲线的绘制
配置0.1,1,10,100,1 000和10 000 ng/mL酚酞标准品溶液,由确定的各因素最佳值进行间接竞争ELISA检测,按2.3.1的步骤测定OD450nm值。以酚酞标准品的浓度作为横坐标,B/B0值作为纵坐标构建ic-ELISA曲线。如图7所示。酚酞质量浓度在10~1 000 ng/mL区间线性较好。分别测定质量浓度为10,50,100,200,400,800和1 000 ng/mL酚酞标准品的吸光度,以酚酞浓度的对数值作为横坐标,以抑制率作为横坐标得到标准曲线(图8)。拟合标准曲线得到方程为y=38.795x-22.554,R2=0.980 2,检测范围IC20~IC80为(12.50~439.93 ng/mL)酚酞的IC50=74.15 ng/mL。说明酚酞多克隆抗体灵敏度较高。
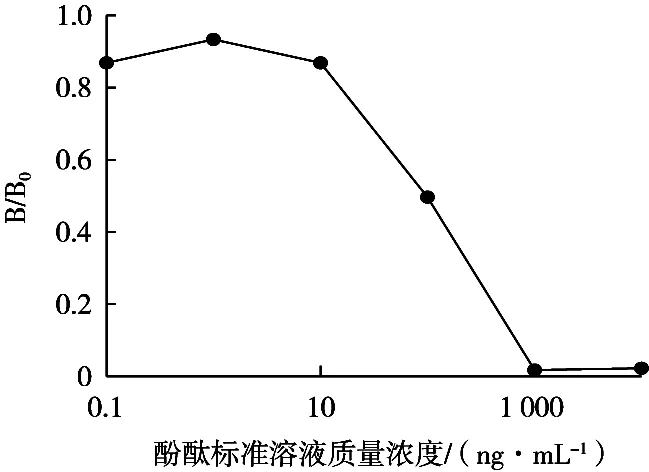
图7 ic-ELISA标准曲线点的确定

图8 酚酞抗体血清抑制率标准曲线
2.3.7 精密度试验
酚酞标准品溶液质量浓度为30,150和300 ng/mL。按照2.3.6建立的ic-ELISA方法进行检测,每个浓度设4个平行孔进行精密度检测。得到该方法的精密度RSD,为4.5%~9.3%。结果见表2。
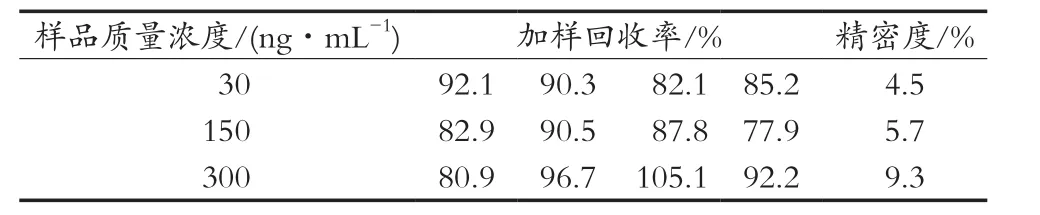
表2 不同质量浓度酚酞溶液的检测精密度(n=4)
2.3.8 加标回收率
配制质量浓度为30,150和300 ng/mL酚酞标准品溶液。按照2.3.6建立的ic-ELISA方法进行检测。计算酚酞的加标回收率及变异系数RSD。由表3可知,在标准曲线范围内,加入30,150和300 ng/mL的酚酞标准液,每个浓度测定3次。测定的平均回收率为89.76%,变异系数RSD=7.96%。说明在标准曲线范围内,该方法用于检测酚酞的含量具有准确性与重复性。

表3 不同质量浓度酚酞溶液的回收率测定结果(n=3)
3 讨论与结论
通过氨基化酚酞直接包被酶标板,建立酚酞含量检测标准曲线。该方法消除包被过程中,载体蛋白构象改变导致小分子半抗原与抗体结合力下降的因素,且不需要制备包被抗原。因此直接偶联ELISA更利于检测方法的标准化及检测的稳定性。为减少抗体血清的非特异性结合,用0.1 mol/L氨基乙酸结合微孔板上多余的醛基。对抗体稀释液进行优化,3%脱脂奶粉可有效避免抗体血清的非特异性结合。试验建立的酶联免疫方法与仪器检测方法相比操作更简便、费用更低,可快速测定大批量样品。在市场监督酚酞的非法添加中具有应用价值。

