红曲米醋制曲过程中微生物群落演替及其对生化指标的影响
张娇娇,李 婧,范冰倩,杜 鹏,郑 宇,朱立磊,宋 佳*
(1.天津科技大学 生物工程学院工业发酵微生物教育部重点实验室 天津市微生物代谢与发酵过程控制技术工程中心,天津 300457;2.山东玉兔食品股份有限公司 山东调味品发酵工程技术研究中心,山东 淄博 255300)
食醋,也称为醯、苦酒,通常是以高粱、大米、小麦、豌豆、水果等作为原料,酵母菌、霉菌、醋酸菌、乳酸菌等多菌种参与,固态、半固态或液态发酵工艺,经糖化、酒精发酵、醋酸发酵、陈酿而成的色香味俱全的调味品[1-2]。因为红曲具有良好的糖化力、酯化力和发酵力[3],可作为糖化发酵剂酿造红曲米醋。其酸中微甘,醋味醇厚,色泽棕红,澄清透亮,深受人们喜爱[4]。红曲米醋是通过加入乌衣红曲进行糖化及酒精发酵,乌衣红曲中的多种微生物、发酵产生的代谢产物及其在制备过程中的变化等对红曲米醋的风味、品质具有重要作用[5]。目前国外对于红曲米醋的研究较少,而国内也多集中于红曲米醋酿造工艺、红曲米醋功效成分之一——洛伐他汀含量测定方法和提高洛伐他汀含量工艺优化以及通过动物实验研究其降低血脂、降血压、抗氧化等功能[6-8],但是有关红曲米醋中红曲的过程以及过程中微生物变化研究较少,因此了解红曲米醋制曲过程中微生物群落变化,对科学地研究红曲米醋制曲过程微生物菌群代谢和红曲米醋品质提升具有重要意义。
曲微生物分析传统采用平板分离培养的方法,但是实验室条件下能够培养分离出的微生物仅占样品的1%~10%[9],因此免培养分离方法,如实时荧光定量聚合酶链式反应(real time-fluorescent quantitative-polymerase chain reaction,RT-FQ-PCR)、反转录酶-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)、聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gel gradient electrophoresis,PCR-DGGE)、16S/18Sr核糖核酸(ribonucleic acid,RNA)基因克隆文库、限制性片段长度多态性(restriction fragment length polymorphism,RFLP)等在近年来被广泛地应用于传统食醋酿造过程中微生物群落的分析[10],但是存在成本高、检测不到丰度小于1%的种群、操作繁琐等问题[11-13]。而高通量测序技术能从微生物基因水平获取群落资源,具有通量高、效率高、测序快、覆盖率高等优点[14-18],可较为全面的分析微生物群落信息。
本研究通过高通量测序方法研究红曲米醋制曲过程微生物群落演替,同时分析测定了制曲过程曲的糖化力、液化力、酯化力、淀粉酶活力、蛋白酶活力等生化指标,采用典范对应分析(canonical correspondence analysis,CCA)深度解析制曲过程微生物群落变化对曲生化指标的影响,找出主要功能微生物,为进一步筛选功能微生物提供理论支撑,同时为曲质量优劣的评判、曲的强化、制曲工艺的优化提供依据,以提升红曲米醋的品质。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
红曲米醋酿造用红曲:山东玉兔食品有限责任公司;黑曲霉(Aspergillus niger)、红曲霉(Monascus purpureus)、酵母(Saccharomyces)、巴氏醋杆菌(Acetobacter pasteurianus):天津科技大学微生物制药研究室保藏菌种;大米(有机糙米):市售。
1.1.2 化学试剂
乙酸钾、乙酸铵、碳酸钠、氯化钠、氢氧化钠、三氯乙酸、乙二胺四乙酸(ethylenediaminetetraacetic aid,EDTA)、氯仿、异丙醇、乙醇(均为分析纯):天津市福晨化学试剂厂;柠檬酸、柠檬酸钠、乙酸、可溶性淀粉(均为分析纯):天津市北方天医化学试剂厂;福林试剂、酪蛋白、Tris-HCl、十六烷基三甲基溴化铵(cetyltrimethylammonium ammonium bromide,CATB)(均为分析纯):北京索莱宝科技有限公司;引物:苏州金唯智生物科技有限公司。
1.2 仪器与设备
CP1502电子分析天平:上海奥豪斯仪器有限公司;TGL-16G高速台式电动离心机:上海安亭仪器厂;DK-8D电热恒温水浴箱:巩义予华仪器有限公司;nexus GX2 聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;ChemiDocTMXRS+凝胶分析仪:美国Bio Rad公司;WS2-134-75恒温培养箱:天津市实验仪器厂;HYG-W1回旋式恒温调速摇瓶柜:上海欣蕊自动化设备有限公司;1500全波长酶标仪:美国THERMO公司。
1.3 实验方法
1.3.1 红曲米醋制备工艺流程及操作要点

操作要点:
大米选择:选择颗粒饱满、色泽清白透明、无灰尘杂质的大米。
浸泡:按1∶2~1∶4(g∶mL)料液比加水浸泡10~15 h,温度控制在25~30 ℃。
蒸煮液化:将上述浸泡大米煮沸20~30 min后,降至50~60 ℃后加入0.02%~0.04%(V/V)的耐高温淀粉酶,在70~90 ℃温度下液化20~30 min。
红曲制备:
前泡曲:将红曲种、黑曲种、蒸熟已冷却大米、水按(0.5~1.0)∶(0.01~0.03)∶(1~2)∶(3~4)混合后于28~30 ℃泡曲4~6 d,制得红曲醪;制曲:将红曲醪以3%~5%的接种量接种于蒸熟已冷却大米,于30~40 ℃、60%~70%湿度条件下培养4~6 d,当感官上呈现红与黑所占比例分别为60%~80%、20%~40%时,即可制成乌衣红曲;后泡曲:将制备的乌衣红曲放入罐中,加入4~6倍水于28~30 ℃浸泡2~3 d,备用。
酒精发酵:将液化后的浆液冷却至28~30 ℃,补充糖度达到15~18°Bé后无菌条件下接入8%~12%的乌衣红曲醪液,温度控制在28~30 ℃条件下发酵至酒精度为8%vol~10%vol,制得小米红曲酒醪。
醋酸发酵:取过滤后的酒液,以4%~8%的接种量接入醋酸菌进行醋酸发酵,温度控制在35~37 ℃,通风量为0.05~0.10 m3/min,发酵至酸度达到6~8 g/100 mL时终止发酵,制得原醋。
陈酿熟化:将制得原醋室温陈酿1~3年,陈酿熟化的醋液加入新鲜果汁和蜂蜜调配,得到优质红曲米醋。
1.3.2 曲生化指标分析
红曲米醋制曲过程中糖化力、液化力的测定依据文献[19-20]中的淀粉水解法;酯化力采用轻工行业标准QB/T 4257—2011《酿酒大曲通用分析方法》;蛋白酶活依据商业行业标准SB/T 10317—1999《蛋白酶活力测定法》;淀粉酶活按照国标GB/T 5521—2008《粮油检验谷物及其制品中α-淀粉酶活性的测定》中的比色法测定。其中,在40 ℃下每分钟水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位(U/g);在40 ℃下,以每克样品每5 min生成1 mg麦芽糖定义为1个淀粉酶活力单位(U/g)。
1.3.3 宏基因组总DNA提取
按文献[21]的方法进行适当修改,即取制曲过程24 h、48 h、72 h、96 h时样品(制曲总时间为96 h),五点法取曲样混合后,从中取1 g样品放入4 ℃预冷的无菌研钵中,加入液氮快速研磨至粉末状,然后加入脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提液和5%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液,放入65 ℃恒温水浴锅温浴2 h,然后加入乙酸钾,放于4 ℃冰箱1 h,1000 r/min离心5 min取上清,加入苯酚-氯仿-异丙醇(25∶24∶1,V/V)混合液,1 000 r/min离心5 min取上清,加入乙酸铵-异丙醇(24∶1,V/V)混合液1 000 r/min离心5 min取沉淀,用4 ℃预冷乙醇漂洗3次后,室温放置1 h至乙醇挥发,加入ddH2O 50 μL溶解沉淀,得到基因组。
1.3.4 红曲高通量测序的方法
以红曲总DNA为模板,进行细菌16S rRNA V3-V4区域扩增,真菌内部转录间隔区(internal transcribed spacer,ITS)区段克隆测序和序列特征比较分析。细菌16S rRNA基因通用引物[22]:27F(5'-AGA GTT TGA T(C/T)(A/C)TGG CTC AG-3'),1492R(5'-TAC CTT GTT A(C/T)G ACT T-3');真菌ITS序列通用引物:NSA3(5'-AAA CTC TGT CGT GCT GGG GAT A-3'),NLC2(5'-GAG CTG CAT TCC CAA ACA ACT C-3'。
细菌16S rRNA基因PCR扩增体系:10×PCR缓冲液5 μL;三磷酸脱氧核糖核苷(deoxyribonucleoside triphosphate,dNTP)mix 4 μL;引物1:2 μL;引物2:2 μL;MgCl2:3 μL;模板:2 μL;Taq酶1 μL,加ddH2O至50 μL。PCR扩增条件为:94 ℃5 min,94 ℃1 min,56 ℃1 min,72 ℃1 min 30s,72 ℃15 min,2~4步30个循环。
真菌ITS测序及PCR扩增体系:10×PCR缓冲液:5 μL;dNTP mix 4 μL;引物1:2 μL;引物2:2 μL;MgCl2:3 μL;模板:2 μL;Taq酶1 μL,加ddH2O至50 μL。PCR扩增条件为:94 ℃2 min,94 ℃30 s,58 ℃30 s,72 ℃1 min,72 ℃15 min,2~4步30个循环。
各取PCR产物5 μL,用1%琼脂糖凝胶电泳进行检测,将检测合格样品进行送至苏州金唯智生物科技有限公司进行高通量测序。
1.3.5 数据分析
Illumina MiSeq测序得到的原始数据通过Fastqc 进行质量检测去除低质量Reads,然后通过COPE软件,进行序列拼接及过滤处理,去除嵌合体序列,得到有效序列后进行聚类分析,每一个聚类称为一个物种操作单元(operational taxonomic units,OTU),对于相似性≥97%(RDP classifier贝叶斯算法)的序列划分为同一个OTU,进行生物信息统计,其中每个OTU代表一个物种[23]。利用Qiime2软件和核糖体数据库项目(ribosomal database project,RDP)中的Classifier算法,择置信度阈值≥0.9,对OTU序列进行物种注释和丰度分析[19]。基于OTU进行物种的Alpha多样性分析、样本间的Beta多样性比较分析等,基于分类学信息,进行群落结构分析。
3.运用科学决策新技术,推动大数据治理创新。大数据是信息文明的产物和必然结果。当前,随着大数据国家战略的稳步推进,政府治理迫切需要直接面对大数据、全面基于大数据和创新应用大数据,以提升决策科学化、智能化水平。要运用大数据技术揭示传统技术方式难以展现的关联关系,提升政府整体理性认知水平,从而促使治理目标定位更准确,治理政策、治理方式和手段更加符合客观事实,治理进程和治理成效更加满足社会期待。要推动政府数据开放共享,促进社会事业数据融合和资源整合,并应用大数据技术开发这些数据资源,为有效处理复杂社会问题提供新的手段,推动政府治理模式进步。
1.3.6 数据处理
每个样品至少3次重复数据,采用SPSS20.0软件进行方差分析和Tukey's 相关性分析,采用Origin85软件作图,实验数据以平均数±标准差(mean±SD)表示,显著性差异以P<0.05为标准。CCA分析采用CAVOCOV45软件。
2 结果与分析
2.1 红曲的生化指标分析[25]
红曲米醋制曲过程曲生化指标分析结果见表1。由表1可知,随着制曲时间的延长,蛋白酶活力、酯化力呈现先升高后降低的趋势,并均于72 h达到最高,分别为(21.70±0.07)U/g和(109.58±4.02)U/g;曲的糖化力、液化力、淀粉酶活力均呈逐渐增高趋势,可能与曲中微生物生长变化有关,如已有研究表明黑曲霉、米曲霉、红曲霉等霉菌属可产生丰富蛋白酶、淀粉酶、酯化酶,促进原料中淀粉、蛋白、脂肪等营养物质水解,以及一些有机酸和乙醇的合成[26],而酵母菌可利用糖类物质发酵产生乙醇,水解及发酵过程温度及小分子营养物质含量的提升,一方面促进微生物生长,提供更丰富的糖化及发酵所需酶类的同时,进一步促进发酵过程,对红曲米醋产品的风味和品质有重要作用,这与李光永等[27-29]研究结果一致。
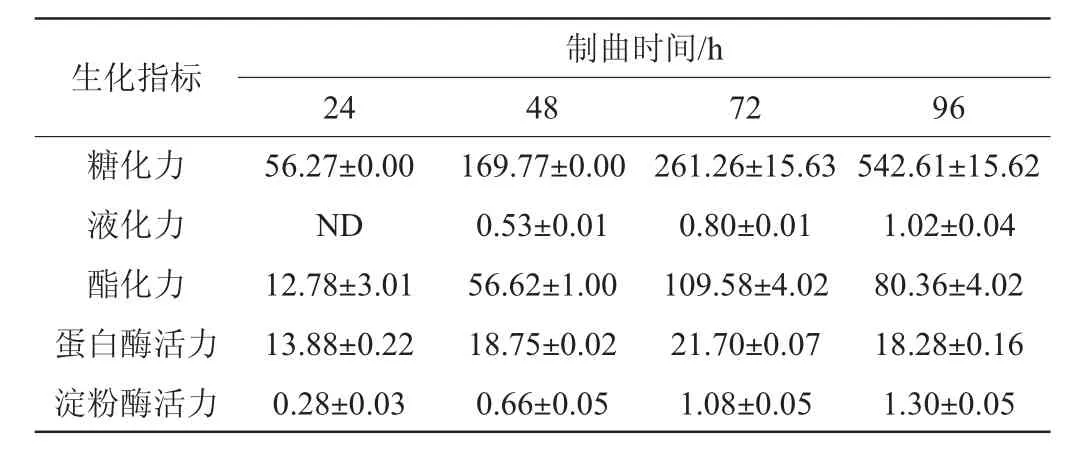
表1 红曲米醋制曲过程生化指标分析结果Table 1 Analysis results of biochemical indexes during koji making process of red roji rice vinegar U/g
2.2 制红曲过程中真菌测序数据统计及多样性分析
2.2.1 制红曲过程中真菌的Alpha多样性分析[30-32]
对制曲过程的4个时间段样品真菌进行测序分析,共得到192 505条有效序列,聚类分析结果显示共有28个QTU数,各组分别有14、25、20、16个QTU数。
制曲过程中4个时间段样品真菌Alpha多样性的分析结果见表2。由表2可知,Coverage指数均>99.9%,表明测序深度已覆盖大部分物种,可以真实展示样品中的绝大多数真菌;随着制曲时间的增加,ACE指数和Chao1指数均呈先上升后下降的趋势,在72 h时达到最高分别为42.167和38.667,表明制曲过程真菌总数随制曲时间增加而增加,72 h时曲中真菌总数最多,随后真菌总数减少,可能是随着制曲时间延长,微生物不断生长,消耗较多的营养物质,从而导致真菌总数降低;随着制曲时间的增加,Shannon指数呈先降后增趋势,而Simpson指数呈先上升后下降的趋势,转折点均在48 h,为0.703,体现制曲过程48 h时,样品真菌的多样性最高,表明可能由于随着制曲时间的增长,曲中营养物质减少、环境pH变化、优势菌的生长以及微生物代谢物质对其本身生长产生不利影响[33-35],造成真菌数量和多样性下降。

表2 真菌多样性指数分析结果Table 2 Results of fungal diversity index analysis
2.2.2 制红曲过程中真菌菌群结构演替分析
由图1B可知,在属水平上共有16种,其中曲霉属(Aspergillus)、酵母属(Saccharomyces)和红曲霉属(Monascus)可占80%以上,而毕赤酵母属(Pichia)和未分类(Unclassified)也占较大相对丰度,分别为0.03%~17.34%、0.25%~18.35%;此外青霉属(Penicillium)、季也蒙酵母属(Meyerozyma)、拟盘多毛孢菌属(Clavispora)、根霉属(Rhizopus)、毛孢子菌属(Trichosporon)、赤霉菌属(Gibberella)等菌属也参与制曲过程,占比为12.5%以下。制曲前期(24 h、48 h)Saccharomyces、Monascus为优势菌,总占分别为比为80.13%和75.29%,后期(72h和96h)优势菌变为Aspergillus,占比为66.79%、61.35%,即随着制曲时间的增加,Monascus、Rhi zopus、镰胞菌(Eurotium)、Gibberella等属相对丰度逐渐降低,Aspergillus、Penicillium、Trichosporon等相对丰度逐步增加,而Saccharomyces呈现先增后减趋势,在48 h达到最高。可能是由于营养物质的消耗,使得对营养要求严格菌的降低,同时酵母菌会利用糖类产酒精,从而导致部分菌的死亡。酵母属利用糖类物质发酵产酒,红曲霉属和曲霉属可产生丰富的淀粉酶、蛋白酶、酯化酶,尤其是曲霉属有较一定的耐醇能力[27],影响用于酿造红曲米醋的红曲糖化力、发酵产酒能力以及红曲米醋的产量、色泽和风味。

图1 门(A)和属(B)水平真菌的相对丰度分析Fig.1 Relative abundance analysis of fungal at the phylum (A) and genus (B) level
2.2.3 制红曲过程中真菌的Beta多样性分析[36]
Beta多样性主成分分析(principal component analysis,PCA)通过分析不同样本OTU(97%相似性)组成可以反映样品的差异和距离,样品间距离越近,表示相似度越高,反之,差异度越大[37]。制曲过程的4个时间段样品中真菌Beta多样性分析结果见图2。
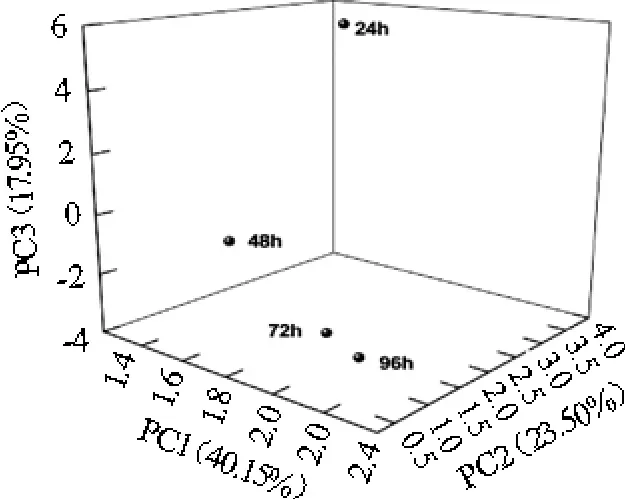
图2 属水平真菌的主成分分析Fig.2 Principal component analysis of fungus at the genus level
由图2可知,用PCA分析直观呈现红曲米醋制曲过程不同时间点曲样本的相似及差异性。制曲时间24 h和48 h样品距离较远,表明二者组成差异性较大,而制曲时间72 h和96 h的样品距离较近,表明这两个样品组成相似度较高。随着制曲时间的延长,样本的相似性逐渐增加,曲中真菌组成逐渐趋于稳定,稳定于以曲霉属、酵母属、红曲霉属为主要真菌属,可能与制曲后期酒精浓度有关,而而这三种真菌均有一定耐酒精特性。
2.3 制红曲过程中细菌测序数据统计及多样性分析
2.3.1 制红曲过程中细菌的Alpha多样性分析
对制曲过程的4个时间段样品细菌进行测序分析,共得到153 918条有效序列,聚类分析结果显示共有41个OTU数,各组分别为27,40,33,34个OTU数,样品的细菌多样性如表3所示。

表3 细菌多样性指数分析结果Table 3 Results of bacterial diversity index analysis
由表3可知,Coverage指数均大于99.9%,表明测序深度已覆盖大部分物种,可以真实展示样品中的绝大多数细菌;随着制曲时间的增加,Chao1指数逐渐降低、Ace指数先减后增再降低现象,整体呈现降低趋势,表明样品细菌总数呈逐渐降低趋势,最低分别22.398和17.0;Shannon指数呈先增后降趋势,于48 h达到最高为1.745,而Simpson指数处于先降后增趋势,在48 h达到最低点为0.459,表明在制曲过程中,制曲48 h时细菌多样性达到最高,随后降低,可能与真菌生长有一定抑制作用关系,如红曲霉菌、酿酒酵母对芽孢杆菌的生长会抑制作用[38],从而造成细菌总数及多样性的下降。
2.3.2 制红曲过程中细菌菌群结构演替分析
由图3A可知,基于门水平细菌菌群结构分为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Acti nobacteria)、蓝藻菌门(Cyanobacteria)及其他门细菌,其中厚壁菌门和变形菌门相对丰度分别为64.79%~96.98%,0.87%~35.00%,二者相对丰度和占总相对丰度的97.5%以上,随着制曲时间的延长,厚壁菌门呈先增后减的趋势,48 h达到最高相对丰度为96.98%,而变形菌门与之相反,先减后增,48 h相对丰度最低,为0.87%,可能与营养物质消耗、环境pH变化以及微生物相互作用有关系[39-40]。
由图3B可知,基于属水平的细菌菌群结构包括乳酸杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、醋酸菌属(Acetobacter)、小球菌属(Pediococcus)、葡糖杆菌属(Gluconobacter)、泛菌属(Pantoea)、假单胞菌属(Pseudomonas)以及普雷沃菌属(Prevotella)等,其中乳酸杆菌属(厚壁菌门)所占比例最高,为63.54%~94.98%,且随着制曲时间的增加,呈先增后降趋势,在48 h达到最高,可达94.98%。可能与乳酸菌一致处于优势菌,且可利用糖类生长并生产乳酸,且由于其细胞壁特殊结构可耐受较高的乙醇浓度[41],对红曲、红曲酒以及红曲醋质量起到关键作用;杆菌属与乳酸杆菌属趋势一致,且杆菌属可产生较高的淀粉酶、蛋白酶促进营养成分的水解及利用,但是酵母属以及红曲霉菌属对其有抑制作用,从而造成其先增后降趋势,而醋酸菌属、泛菌属、小球菌属、魏氏菌属(Weissella)呈逐渐下降趋势,其他菌属[1]均有不同程度变化,可能与其他微生物相互作用结果,具体相互作用有待进一步研究。

图3 门(A)和属(B)水平细菌的相对丰度分析Fig.3 Relative abundance analysis of bacteria at the phylum (A) and genus (B) level
2.3.3 制红曲过程中细菌的Beta多样性分析
由图4可知,制曲24 h和48 h样品距离较远,表明二者组成差异较大,而72 h与96 h样品距离较近,表明二者组成相似度较高。与真菌PCA分析结果相似,随着制曲时间的延长,样本的相似性逐渐增加,曲中微生物以乳酸菌为主,组成逐渐趋于稳定,乳酸菌具有较高的耐醇能力以及产生乳酸与发酵过程种酯类物质结合,提升红曲酒及红曲醋的品质。

图4 属水平细菌的主成分分析Fig.4 Principal component analysis of bacteria at the genus level
2.4 典范对应分析
采用典范对应分析解析红曲米醋制曲过程中微生物群落对曲生化指标的影响,以期找出曲的主要功能微生物与生化指标之间的内在联系,结果如图5所示,菌属与生化指标垂直距离远近代表影响作用的小大,真菌对红曲生化影响效果为:Penicillium、Meyerozyma、Aspergillus>Clavispor、Trichosporon>Saccharomyces、Monascus。这与文献报道的Aspergillus、Monascus等曲霉,可产丰富的蛋白酶、肽酶、糖化酶和酯酶,Penicillium也产生丰富的酶系相一致[42-43],同时Saccharomyces和Meyerozyma等酵母属在酒精发酵中有重要作用[44];同时,Aspergillus和Penicillium作为红曲中主要真菌属相对丰度可达71.36%,对红曲生化指标影响最为显著(P<0.05)。此外,Aspergillus、Monascus、Penicillium等属分解产生氨基酸、酯类物质以及有机酸、Monascus产的红曲色素、Pichia、假丝酵母属(Candida)等生香酵母对曲的色泽风味乃至红曲米醋的品质有很大关系[45]。
细菌属水平菌落组成对生化指标影响看出,对曲蛋白酶活影响菌属为:Saccharopolyspora>Enterococcus>Acinetobacter、嗜糖假单胞菌属(Pelomona)、Streptomyces>其他;对曲酯化力、液化力影响菌属为:Saccharopolyspora>Enterococcus>Acinetobacter、Pelomonas、Streptomyces>其他;对曲淀粉酶活、液化力影响菌属为:Saccharopolyspora>Enterococcus>Acinetobacter、Pelomonas、Streptomyces>其他。主要细菌属(相对丰度>1%)有:Lactobacillus、Bacillus、Acetobacter、Gluconobacter,其中Lactobacillus所占比例最高,可达94.98%,但从CCA分析结果看,其与生化指标相关性弱于Saccharopolyspora、Enterococcus、Acinetobacter、Pelomonas、Streptomyces等相对丰度<1%的细菌属,表明细菌对红曲生化指标影响甚微,但是Lactobacillus、Bacillus等属可产生丰富的乳酸、柠檬酸等有机酸,可缓和红曲米醋酿造过程中产生的醋酸等刺激性物质[46],使得食醋酸味绵长、柔和可口,红曲米醋制曲过程中微生物群落组成对红曲及红曲米醋风味物质影响有待进一步研究。
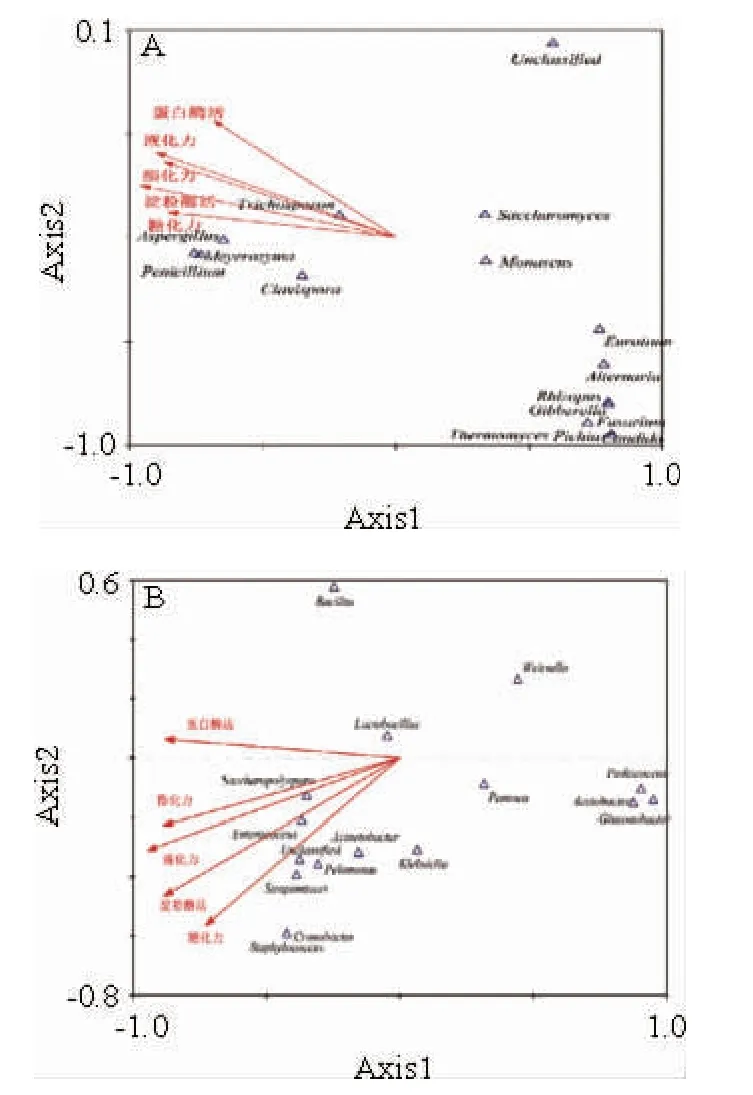
图5 属水平微生物群落结构与曲生化特性的典范对应分析Fig.5 Canonical correspondence analysis of microbial community structure and biochemical indicators of koji at the genus level
3 结论
对红曲米醋制曲过程中曲的生化性质进行研究,发现除蛋白酶活力、酯化力于72 h达到最高外,曲的糖化力、液化力、淀粉酶活力等均呈逐渐增高趋势,在96 h时候达到最高,分别为(542.61±15.62)U/g、(1.02±0.04)U/g和(1.30±0.05)U/g;同时通过高通量测序对红曲米醋制曲过程微生物群落多样性的分析,共获得16个真菌属和16个细菌菌属,其中Aspergillus、Saccharomyces、Monascus为主要真菌,且制曲24 h、48 h时Saccharomyces、Monascus为优势菌,总占比为80.13%和75.29%,而72 h及96 h时优势菌变为Aspergillus,占比可达66.79%、61.35%;细菌中乳酸杆菌属所占比例最高为94.98%,且随着制曲时间的增加,呈先增后降趋势,在48 h达到最高。采用CCA分析方法研究曲中微生物群落演替与曲生化指标的内在关系,研究发现真菌中Aspergillus和Penicillium作为红曲中主要真菌(相对丰度>1%)比例可达71.36%,对红曲生化指标影响最为显著(P<0.05);而细菌中Lactobacillus所占比例最高,但是CCA分析结果显示其与生化指标的相关性较弱,而其他细菌,如Saccharopolyspora、Enterococcus、Acinetobacter、Pelomonas、Streptomyces虽然与酶活有一定相关性,但是其丰度较小,表明细菌对红曲生化指标影响甚微。

