制曲方式对豉香型白酒酒曲理化因子及细菌群落的影响
王宇良,李志溥,苏泽佳,梁景龙,2,白卫东,2,费永涛,2,赵文红,2,*,方毅斐
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.农业农村部岭南特色食品绿色加工与智能制造重点实验室,广东 广州 510225;3.广东省九江酒厂,广东 佛山 528203)
中国白酒类型繁多,可根据地域、发酵材料、酿造工艺、所用酒曲及酒体风味进行区分[1]。白酒香型概念在中国第三届品酒大会上被首次提出,而豉香型白酒在1984年被确立,是继浓、酱、清、米4 个标准之后第1个出现的独立香型[2],也是珠三角地区所特有的传统白酒,因其具有独特的豉香味而得名,其复杂的酿造过程可大致分为制曲、投罐发酵、蒸馏、陈肉酝浸等,其中制曲是酿造过程中最关键的环节之一,酒曲的质量直接决定了豉香型白酒的产量和品质。
豉香型白酒酒曲属于小曲[3],以大米、黄豆为主要原料,加入饼丸(母曲)、酒饼叶及各种中草药等辅料所制成,是豉香型白酒酿造过程中的唯一糖化发酵剂[4-5]。传统酒曲的制作存在劳动强度大、生产效率低和高生产成本等缺点,同时以人工操作为主的生产操作,使得制曲过程易受环境因素影响,导致酒曲质量难以稳定,因此近年来豉香型白酒酒曲的制作开始引进机械化制曲技术,机械制曲工艺如图1所示。机械制曲与传统制曲有明显不同,首先在原料上,机械制曲在与传统制曲所用原料相同的基础上额外添加了麦麸,使得酒曲质地松散,区别于传统制曲大酒饼的紧密质地,其次机械制曲的发酵过程在集进料,控温调湿、控风和翻曲、培养、出料及清洗等于一体的全封闭机械化自动化圆盘制曲机中进行[6],代替了传统人工操作,大大降低了生产成本和劳动强度,提高了酒曲的生产效率及质量的稳定性。虽然机械化制曲能够有效解决传统制曲存在的问题,但由于机械制曲和传统制曲存在较大差异,在酒曲发酵过程是否会导致微生物的生长演替情况、菌群结构产生差异,以及酒曲发酵力、糖化力等理化因子有无差异,均成为机械化制曲能否代替传统制曲关键问题。目前已对豉香型白酒传统制曲过程中的细菌群落进行研究,但机械制曲和传统制曲过程细菌群落结构的差异尚不清晰,因此,本研究通过分析表征酒曲品质的理化因子,同时采用高通量对机械制曲和传统制曲过程中细菌群落结构进行解析,并结合相关性分析菌群和理化因子间的作用关系,对推动豉香型白酒机械化制曲的创新和应用具有重要意义。

图1 机械制曲工艺流程Fig.1 Flow chart of mechanized Qu making
1 材料与方法
1.1 材料与试剂
广东某酒厂机械制曲不同时间段样品:由制曲开始0 h至制曲结束120 h,隔6 h取样一次,其中0~96 h为发酵期,96~120 h为干燥期;传统制曲不同时间段样品:由制曲开始0 h至制曲结束144 h,隔6 h取样一次,其中0~120 h为发酵期,120~144 h为干燥期。两种制曲方式过程中,发酵期温度均保持在32~45 ℃,干燥期保持在45~55 ℃。
氢氧化钠标准溶液 广东铭固化学科技有限公司;酚酞 广州化学试剂厂;3,5-二硝基水杨酸溶液、福林-酚试剂、L-干酪素、糖化酶、α-淀粉酶、磷酸氢二钠-柠檬酸缓冲液 上海源叶生物科技有限公司;无水乙醇、无水碳酸钠、碘化钾、碘、五水硫酸铜、氢氧化钠、酒石酸钾钠、三氯己酸 天津永大有限公司;乳酸、葡萄糖 麦克林试剂有限公司;可溶性淀粉 国药集团化学试剂有限公司。
1.2 仪器与设备
PHS-3C pH计 艾力特国际贸易有限公司;TU-1901紫外-可见分光光度计 北京普析通用仪器有限责任公司;HC130水分测定仪 上海梅特勒-托利多仪器有限公司;SPX智能生化培养箱 宁波江南仪器厂;Illumina MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 理化因子的测定
水分、发酵力、酯化力、糖化力测定根据QB/T 4257—2011《酿酒大曲通用分析方法》,酸度、氨基酸态氮测定参考杜亚飞等[7]采用连续滴定法,液化力测定参考沙均响等[8]采用分光光度法,酸性蛋白酶活力测定参考郑东影等[9]采用福林-酚法。
1.3.2 微生物多样性解析
1.3.2.1 样品总DNA提取
DNA提取按照DNA提取试剂盒E.Z.N.A.®Soil DNA Kit的说明书进行。提取后对DNA进行检测。
1.3.2.2 聚合酶链式反应(polymerase chain reaction,PCR)提取及MiSeq Illumina测序
PCR扩增引物对应区域16S V3~V4区,细菌16S引物338F(ACTCCTACGGGAGGCAGCAG),真菌引物806R(GGACTACHVGGGTWTCTAAT),对PCR产物进行鉴定、纯化以及定量后构建PE文库,进行Illumina测序,由上海美吉生物医药科技有限公司完成。
1.4 数据统计分析
采用Excel、Origin 2020、Qiime1.9.1、Mothur等结合R语言软件对数据进行统计分析。
2 结果与分析
2.1 制曲方式对酒曲理化因子的影响
2.1.1 制曲过程中水分的变化
水分是衡量曲是否达到储藏标准的一个主要指标,一般来说水分质量分数小于13%为宜[3]。如图2所示,在整个制曲过程中,传统制曲和机械制曲中水分含量均随时间延长缓慢降低,其中传统制曲最高水分质量分数由初始的(40.78±1.82)%降低至干燥结束时的(10.32±0.10)%,而机械制曲则由初始最高水分质量分数(33.65±1.74)%降低至干燥结束时的(7.35±0.17)%。两者制曲过程的不同导致两者水分含量的变化趋势有所不同,传统制曲过程除混料压饼成型前阶段均晾挂在饼房中进行自然发酵,因此其水分含量变化趋势呈随时间持续降低,而机械制曲全程均在封闭的圆盘制曲仪中,在制曲过程的前4 d为机械控水,使得其水分含量呈阶梯式下降趋势。而两者就质地而言,传统制曲为整块状,机械制曲为松散状,因此传统制曲中水分含量会略高于机械制曲,两者最终水分含量存在显著差异(P<0.05)。
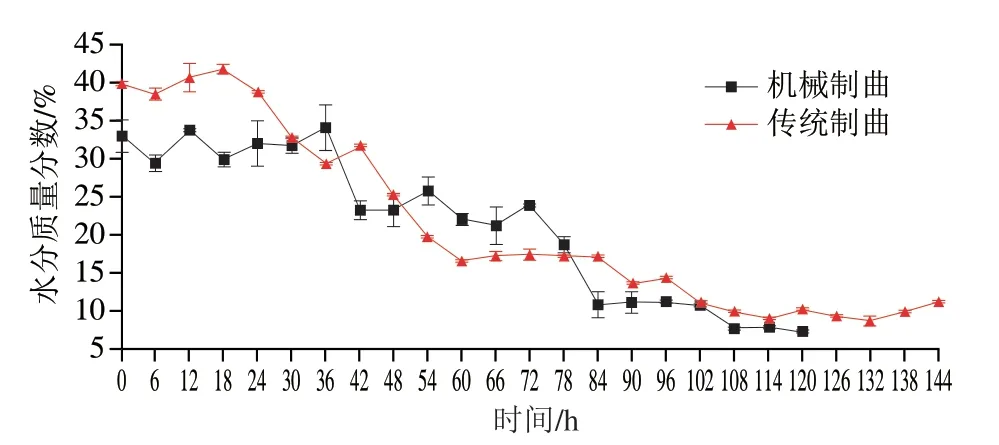
图2 制曲过程中水分变化Fig.2 Change of moisture during Qu making
2.1.2 制曲过程中酸度的变化
曲中酸度是评定大曲质量的重要指标,酸度主要是由产酸微生物如乳杆菌等在曲中进行有机酸代谢而形成,还有一部分来源于有机物的降解。它是大曲中微生物综合作用的结果,适当的酸度能够抑制大曲中有害杂菌的代谢,也为有益微生物提供了某些生化反应的前体物质[10]。如图3所示,在制曲过程中,传统制曲的酸度在发酵初期迅速升高,由(0.22±0.01 )mmol/10 g 上升至(0.88±0.03)mmol/10 g,在36 h后开始降低至干燥完成后酸度仅有(0.30±0.01)mmol/10 g。而机械制曲的酸度变化则呈缓慢积累过程,初始酸度为(0.38±0.01)mmol/10 g,在90 h到达峰值(0.63±0.02)mmol/10 g,而后迅速降低至(0.40±0.01)mmol/10 g,到最后干燥完成时酸度为(0.463±0.01)mmol/10 g,比传统制曲高0.16 mmol/10 g,存在显著差异(P<0.01)。荣瑞金等[11]在对酱香型白酒的研究中发现,水分含量高的酒曲酸度显著高于水分含量低的酒曲,所以两者酸度迅速下降的原因可能是水分含量变化所引起,在传统制曲中,24 h后培养房湿度缓慢下降,而机械制曲中90 h后也进入鼓风干燥的过程,水分含量的减少进而影响了产酸微生物的生命代谢活动,酸性物质也可能会在该阶段有所挥发。

图3 制曲过程中酸度变化Fig.3 Change of acidity during Qu making
2.1.3 制曲过程中氨基酸态氮的变化
氨基酸态氮是衡量曲优劣的一项重要指标,利用氨基酸态氮的指标反映制曲过程中自身微生物以及酶降解蛋白质的能力,含量越高表明曲中所积累的复合香气物质越多、微生物活力越强[12]。由图4可知,传统制曲和机械制曲的初始氨基酸态氮含量分别为(125.59±11.71)mg/g和(104.65±4.81)mg/g,均在制曲42 h到达峰值,分别为(384.29±27.76)mg/g和(312.27±3.58)mg/g,制曲结束时传统制曲中氨基酸态氮显著高于机械制曲(P<0.01),含量分别为(311.31±10.25)mg/g和(233.00±10.12)mg/g。

图4 制曲过程中氨基酸态氮变化Fig.4 Change of amino nitrogen content during Qu making
2.1.4 制曲过程中发酵力的变化
影响发酵力的主要微生物是酿酒酵母,酿酒酵母在无氧条件将原料中的糖类物质分解产生醇类物质以及二氧化碳[13]。同时,不同酵母之间也存在着相互作用关系,有研究结果显示,在酿造过程中,异常汉逊酵母的生长受酿酒酵母的抑制,并且酿酒酵母对发酵力的影响高于异常汉逊酵母[14]。由图5可知,传统制曲和机械制曲的初始发酵力分别为(1.328±0.09)U和(1.348±0.14)U,传统制曲在78 h达到峰值(5.067±0.341)U,机械制曲则在36 h达到峰值(4.605±0.145)U,制曲结束时传统制曲发酵力显著高于机械制曲(P<0.01),分别为(4.532±0.039)U和(3.220±0.094)U。
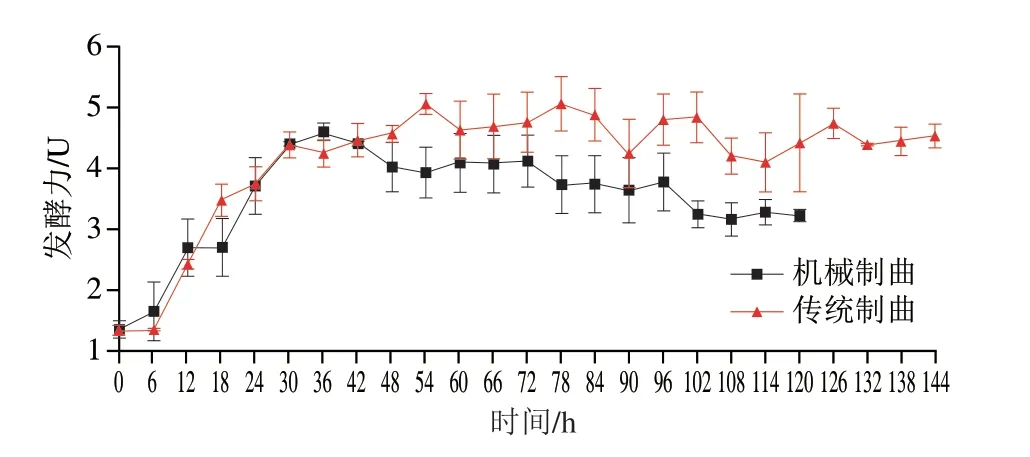
图5 制曲过程中发酵力变化Fig.5 Change of fermentation power during Qu making
2.1.5 制曲过程中酯化力的变化
酯化力是酯化酶活性的表现,酯化酶是脂肪酶和酯酶的统称,酯化酶可以由酵母菌、细菌、霉菌等微生物生成。其中最主要的产酯微生物是酵母菌,酵母菌通过脂肪酸与辅酶A的结合活化,形成酰基辅酶A与醇类物质合成相应酯类,醇和酰基CoA再在醇酰基转移酶的作用下生物催化生成相应的酯类物质,这就是酵母中酯类合成的主要途径[15]。由图6可知,传统制曲和机械制曲的初始酯化力分别为(211±26.98)mg/(g·100 h)和(184.66±6.66)mg/(g·100 h),传制曲在30 h达到峰值(547.66±12.76)mg/(g·100 h),机械制曲则在36 h达到峰值(511.66±23.01)mg/(g·100 h),制曲结束时传统制曲发酵力显著高于机械制曲(P<0.05),分别为(498±26.28)mg/(g·100 h)和(433.65±34.25)mg/(g·100 h)。

图6 制曲过程中酯化力变化Fig.6 Change of esterification power during Qu making
2.1.6 制曲过程中液化力的变化
液化力主要是受曲中微生物体内的淀粉酶活性影响,淀粉酶可由多种微生物所代谢出,主要由细菌和真菌产生,如枯草芽孢杆菌、地衣芽孢杆菌、根霉、黑曲霉等[16]。由图7可知,传统制曲的液化力由培养初始的(0.276±0.02)g/(g·h)至72 h达到峰值(3.521±0.12)g/(g·h),随后呈波动变化趋势,制曲结束时其液化力为(1.95±0.08)g/(g·h);机械制曲则由发酵初始(0.60±0.04)g/(g·h)至30 h达到峰值(4.04±0.135)g/(g·h),制曲结束时其液化力为(1.88±0.095)g/(g·h)。两者液化力动态变化趋势相似,干燥期结束后液化力无显著差异(P>0.05)。

图7 制曲过程中液化力变化Fig.7 Change of liquefaction power during Qu making
2.1.7 制曲过程中糖化力的变化
糖化力是衡量酒曲是否合格的一项重要指标。糖化力是影响出酒率的重要因素之一,糖化力高低主要与细菌群落的代谢过程有关[17]。相关研究表明,糖化力还与发酵原料有关,原料中的淀粉含量能够影响曲中霉菌代谢糖化酶的能力[18]。由图8可知,传统制曲和机械制曲的初始酯化力分别为(139.92±12.06)mg/(g·h)和(168.33±9.03)mg/(g·h),传统制曲在72 h达到峰值(565.66±15.10)mg/(g·h),机械制曲则在84 h达到峰值(353.78±4.14)mg/(g·h),制曲结束时传统制曲的糖化力显著高于机械制曲(P<0.01),分别为(455.96±23.16)mg/(g·h)和(233.36±19.17)mg/(g·h)。
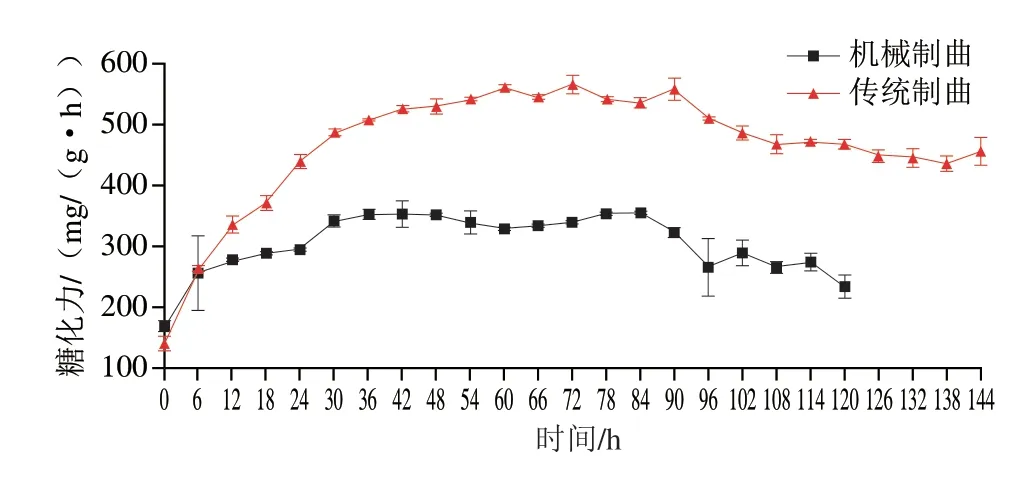
图8 制曲过程中糖化力变化Fig.8 Change of saccharifying power during Qu making
2.1.8 制曲过程中酸性蛋白酶活力的变化
蛋白酶能够分解蛋白质生成氨基酸,而氨基酸可以作为风味物质。酒中许多风味物质来源于蛋白质和蛋白酶,高活性的酸性蛋白酶能够加强酒质[19-20];在不同大曲样品的水解酶活性研究中发现,蛋白酶对酱香型大曲的质量有重要作用[21]。因此,酸性蛋白酶与曲中的风味和后续发酵酒体具有密切联系。由图9可知,传统制曲和机械制曲的初始酸性蛋白酶活力分别为(33.08±2.58)U/g和(21.68±1.23)U/g,传统制曲在60 h达到峰值(66.91±1.67)U/g,机械制曲则在39~51 U/g之间浮动,制曲结束时传统制曲与机械制曲之间无显著差异(P>0.05),分别为(51.85±4.95)U/g和(40.71±4.03)U/g。

图9 制曲过程中酸性蛋白酶活变化Fig.9 Change of acid protease activity during Qu making
2.2 传统制曲与机械制曲过程中细菌群落结构分析
传统和机械制曲过程中共鉴定出18 种(相对丰度大于1%)属水平微生物群落(图10),包括乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、片球菌属(Pediococcus)、魏氏菌属(Weissella)、青枯菌属(Ralstonia)、明串珠菌属(Leuconostoc)、醋酸杆菌属(Acetobacter)、微小杆菌属(Exiguobacterium)、葡萄球菌属(Staphylococcus)、库特氏菌属(Kurthia)、不动杆菌属(Acinetobacter)、肠球菌属(Enterococcus)、葡萄糖酸杆菌属(Glutamicibacter)、裂孢菌属(Thermobifida)、链霉菌属(Streptomyces)、肠杆菌属(Enterobacter)、芽殖杆菌属(Gemmobacter)、海洋芽孢杆菌属(Oceanobacillus),其中传统和机械制曲中的核心细菌属均为Lactobacillus、Bacillus、Pediococcus和Weissella,分别占两组总菌落数的80%以上,这4 种菌属为药曲中的常见菌属,它们的代谢产物可对酒的风味起促进作用[22],同时还是酱香型等白酒发酵过程中的重要功能微生物[23-25]。通过对比发现,两组中Lactobacillus、Bacillus、Pediococcus和Weissella有明显差异,机械制曲结束时的优势细菌属为Bacillus(71.20%),传统制曲中Bacillus的相对含量仅为0.38%;传统制曲结束时的主要优势细菌属为Lactobacillus(68.30%),而机械制曲中Lactobacillus的相对含量仅为9.71%,同时Pediococcus和Weissella在机械制曲中的含量明显低于传统制曲,其中在制曲结束时,Pediococcus在传统制曲和机械制曲中的含量分别为17.10%和2.20%,Weissella为7.70%和0.28%。Lactobacillus和Bacillus等主要功能性菌属在两组间存在差异,可能与机械制曲的环境及散曲的质地相关,机械制曲过程采用大型鼓风机控湿,该阶段鼓风机将大量空气吹入环境中,同时散曲的质地松散,在制曲过程中定时搅拌,使得散曲能够充分与环境中的氧气接触,为Bacillus等好氧菌[26]提供充足氧气,且机械制曲额外添加的麸皮具有良好的保湿效果,这就为Bacillus等菌属提供了舒适的生长条件,但这同时也抑制了Lactobacillus、Weissella等兼性厌氧和厌氧菌的生长。相关研究表明,Lactobacillus、Weissella可代谢产生多种有机酸,不仅能够提高酒曲酸度抑制不耐酸杂菌的生长,还能为酒体中的风味物质提供前体物[27-29]。Bacillus除了与挥发性酸的产生有关,同时还是蛋白酶和淀粉酶的重要来源,还可代谢4-甲基吡嗪、乙偶姻等风味物质[30-31],高活力的Bacillus对酒体风味品质有重要贡献作用[32-33]。在茅台酒曲的研究中发现,人工制曲和机械制曲的优势菌属和动态变化虽没有显著差异,但机械制作的大曲比手工制作的大曲含有更多的Bacillus,而Bacillus是酱香型白酒发酵过程中最主要的功能菌,有利于酱香型白酒的制曲发酵[34]。

图10 细菌属水平物种丰度图Fig.10 Relative abundance of bacterial genera in Qu samples at different fermentation times
2.3 机械制曲主要优势细菌间及理化因子的相关性分析
为揭示细菌群落间的竞争关系以及对理化因子的影响,选取机械制曲过程中的核心且与传统制曲存在显著差异的细菌属与理化因子进行相关性分析,如图11所示,发现Bacillus与Lactobacillus、Pediococcus和Weissella间存在竞争关系,由于机械制曲和传统制曲的质地及生产环境不同,使得两者虽主要核心菌属相同,但核心菌种间的组成比例不同,机械制曲过程中的环境适宜Bacillus的生长,其大量繁殖从而导致Lactobacillus、Pediococcus和Weissella的生长受到抑制[29],同时在传统制曲中,较高丰富度的Lactobacillus可能会合成抗生素和细菌素,导致传统制曲中Bacillus的生长受到抑制,这与唐鳗秋等[35]对四川黄酒麦曲的研究结果一致,该结果表明机械制曲过程要合理科学控制干燥时进风量及散曲搅拌频率,将制曲过程中的氧气含量控制在合理范围内,使得优势菌群结构处于相对平衡状态。此外Lactobacillus与氨基酸态氮、发酵力、酯化力、糖化力和酸性蛋白酶呈正相关;Bacillus与酸度、氨基酸态氮和液化力呈正相关;Pediococcus、Weissella与氨基酸态氮、发酵力、酯化力、液化力和酸性蛋白酶呈负相关与酸度呈正相关。以上结果表明,机械制曲过程保持一个相对合适的氧气含量环境和相对稳定环境变化,既有利于Lactobacillus、Bacillus、Weissella等核心功能微生物的平衡生长,又有利于提高酒曲品质。

图11 机械制曲过程细菌群落与理化因子相关性分析Fig.11 Correlation between bacterial community and physicochemical properties of Qu during mechanized making
3 结论
通过测定豉香型白酒传统和机械制曲过程中水分、酸度、氨基酸态氮、发酵力、酯化力、液化力、糖化力、酸性蛋白酶发现,在制曲结束时,传统制曲的水分、氨基酸态氮、发酵力、酯化力和糖化力显著高于(P<0.05)机械制曲,机械制曲的酸度高于传统制曲;两者液化力、酸性蛋白酶活力分别稳定在40~50 U/g和1.8 g/(g·h)左右,无显著差异(P>0.05)。采用高通量测序技术对豉香型白酒传统和机械制曲过程中的细菌群落进行鉴定发现,两者制曲过程中的主要核心细菌属虽相似,均为Lactobacillus、Bacillus、Pediococcus和Weissella,占两组总菌落数的80%以上,但核心细菌属间的占比存在显著差异(P<0.05),传统制曲中Lactobacillus(传统制曲:68.30%;机械制曲:9.71%)、Pediococcus(传统制曲:17.10%;机械制曲:2.20%)和Weissella(传统制曲:7.70%;机械制曲:0.28%)显著高于机械制曲,机械制曲中Bacillus(传统制曲:0.38%;机械制曲:71.20%)显著高于传统制曲。通过核心菌属与理化因子相关性分析发现,Lactobacillus、Bacillus、Pediococcus和Weissella均与表征酒曲品质的理化因子间存在明显相关性,其中Lactobacillus与氨基酸态氮、发酵力、酯化力、糖化力和酸性蛋白酶呈正相关;Bacillus与酸度、氨基酸态氮和液化力呈正相关,Lactobacillus和Bacillus同时为两种制曲方式中差异最显著的细菌属,由于机械制曲过程中添加了麦麸及制曲环境的不同,使得其与传统制曲的质地及制曲过程中与氧气的接触量有所差异,如若能在机械制曲过程中合理科学地控制制曲环境中氧气含量以及保持环境变化的相对稳定,这样既有利于好氧及厌氧核心功能微生物的平衡生长,又有利于提高酒曲品质。机械制曲相较于传统制曲,不仅有较高的生产效率和较低生产成本,还能够有效提高制曲环境的质量,此外,豉香型白酒酒曲中除细菌微生物群落外,还含有丰富的真菌微生物群落,真菌同样对发酵力、酯化力和液化力等表征指标有着重要影响作用,细菌和真菌间的协同发酵作用最终决定了酒曲品质,同时,机械制曲在原料中添加的麸皮可能更有利于好氧真菌的生长,在后续研究中可探究其中真菌微生物群落的演替情况,同时结合细菌群落结构,以此更加全面地分析两种制曲方式之间产生差异的原因。本研究通过分析对比两种制曲方式的理化因子及细菌微生物等指标间的差异,为豉香型白酒机械化制曲的发展及后续应用提供一定参考意义。

