应用Illumina高通量测序技术分析3 种酒曲中微生物多样性
母应春,姜 丽,苏 伟
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
酒曲是在蒸煮的谷物及其辅料上接种或天然定型发酵而成。我国用曲酿酒已有几千年的历史,历代劳动人民传承下来的民间酒曲是我国宝贵的微生物资源,随着科学技术与酿酒业的发展,对酒曲的研究也日益增多[1-2],酒曲是中国酒酿造的糖化、发酵和生香剂,含多种微生物及其产生的酶,酒曲品质对酒的产率和品质影响极大,故有“曲是酒之骨”之称[3]。
贵州省位置独特,少数民族众多,酒文化深厚。很多地区至今保持着传统的酿酒工艺以及传统的酒曲制作技术。传统曲一般是自然接种微生物,因此微生物种类繁多。贵州省花溪、盘州、安顺酒曲是采用传统工艺制成,糖化力、液化力都相对较强,且出酒率高,品质香醇。近年来,国内外有许多的酒曲微生物多样性的研究。Hui Wenyan等[4]使用单分子实时测序技术发现3 个日本酒曲中存在大量隶属于Ochrobactrum的细菌。沈馨等[5]采用高通量测序技术对3 个孝感凤窝酒曲的细菌多样性分析发现,凤窝酒曲中存在大量的核心细菌菌群。相飞[6]采用变性梯度凝胶电泳技术发现Weissella kimchi、Enterococcus faecium、Herbaspirilum sp.为辣蓼甜酒曲中的优势菌。刘孟华等[7]利用宏基因组学的方法对剑南春中细菌群落多样性的研究得出,剑南春酒曲微生物主要分布在Proteobacteria、Firmicutes、Actinobacteria三大门中,占总量的95%以上。然而有关贵州酒曲的微生物多样性的研究报道尚少。
高通量测序技术具有通量高、成本低、准确率高、可进行双向测序等优点[8-10],可以方便快捷地分析样品中复杂的微生物菌群结构,是分析复杂多样微生物样品的首选[11-12]。本研究利用高通量测序技术及相关性分析方法对贵州3 个地区生产的酒曲中微生物组成差异及多样性进行比较,以期为不同酒曲中微生物资源开发利用提供参考。
1 材料与方法
1.1 材料与试剂
花溪酒曲,编号酒曲A;盘州酒曲,编号酒曲B;安顺酒曲,编号酒曲C。
DNA试剂提取盒 德国Qiagen公司;2%琼脂糖凝胶 西班牙Biowest公司;E.Z.N.A.®Soil试剂盒上海玉博生物科技有限公司;AxyPrep DNA凝胶提取试剂盒 AxyPrep DNA Gel Extraction Kit 美国Axygen Biosciences公司;QuantiFluor™-ST微型荧光剂 美国Promega公司;相关生理生化实验所用试剂均为进口或国产分析纯。
1.2 仪器与设备
Fresco21型高速冷冻离心机 美国Thermo公司;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;Gel DOC XR凝胶成像系统 美国Bio-Rad公司。
1.3 方法
1.3.1 样品采集及前处理
采集来自贵州省3 个地区(花溪、盘州、安顺)不同酒厂生产的酒曲,采集时间2017年9月,所有样品经无菌密封好后放入-80 ℃超低温冰箱保存备用。
1.3.2 酒曲的理化指标检测
水分测定:直接干燥法;酸度测定:酸碱中和法(以乳酸计);糖化酶活力测定:婓林快速法;液化酶活力测定:分光光度法。以上方法参考文献[13]。
1.3.3 DNA抽提和PCR扩增
根据E.Z.N.A.®Soil试剂盒说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;细菌用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3-V4可变区进行PCR扩增;真菌用ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’)引物对ITS1可变区进行PCR扩增;扩增程序为:95 ℃预变性3 min,27 个循环(95 ℃ 变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。扩增体系为20 μL,4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶;10 ng DNA模板。
1.3.4 Illumina MiSeq测序
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA凝胶提取试剂盒进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluor™-ST微型荧光剂进行检测定量。根据 Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库。
构建文库步骤:1)连接“Y”字形接头;2)使用磁珠筛选去除接头自连片段;3)利用PCR扩增进行文库模板的富集;4)氢氧化钠变性,产生单链DNA片段。利用Illumina公司的MiSeq PE300平台进行测序(上海美吉生物医药科技有限公司)。原始数据上传至NCBI数据库中。
1.3.5 数据处理
原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接:1)设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,去除质控后长度低于50 bp的序列;2)barcode需精确匹配,引物允许2 个碱基的错配,去除模糊碱基;3)根据重叠碱基overlap将两端序列进行拼接,overlap需大于10 bp。去除无法拼接的序列。使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行操作分类单元(operational taxonomic unit,OTU)聚类;使用UCHIME 软件剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。
1.4 数据分析
利用Excel 2010、Origin 9、SPSS Statistics 20.0等统计软件进行数据分析。
2 结果与分析
2.1 酒曲中基本理化性质分析

表1 酒曲基本理化性质分析Table 1 Basic physicochemical properties of rice wine kojis
由表1可知,3 种酒曲的水分质量分数在10.04%~13.273%之间,酒曲A和酒曲C不显著(P>0.05),酒曲B和酒曲C之间差异不显著(P>0.05);酸度在0.421%~1.501%之间,酒曲A、B、C之间差异显著(P<0.05);液化酶活力在77.420~91.880 U/g之间,酒曲A、B、C之间差异显著(P<0.05);糖化酶活力在346.282~673.540 U/g之间,其中酒曲A和酒曲B 之间差异不显著(P>0.05),酒曲B和酒曲C之间差异不显著(P>0.05)。3 个地区的酒曲在酸度和液化酶活力上差异显著。
2.2 酒曲中DNA提取与定量
提取3 个地方酒曲的DNA,测定其质量与纯度,并观察OD260nm/OD280nm和OD260nm/OD230nm值(表2)可知,酒曲样品的DNA的OD260nm/OD280nm值在1.8~2.3之间,OD260nm/OD230nm值在0.04~0.17之间,其质量浓度在8.5~42.8 ng/μL之间,说明提取的DNA浓度较纯,以便用于酒曲的细菌和真菌多样性分析。

表2 酒曲中DNA质量浓度分析Table 2 Microbial DNA concentrations from rice wine koji
2.3 样品中细菌的分析
2.3.1 细菌丰度和多样性分析

表3 酒曲样品细菌测序数据统计分析Table 3 Statistical analysis of bacterial sequencing data of koji samples
除去不合格序列后,3 种酒曲样品中共获得129 510 条高质量细菌序列(表3),其中从酒曲A、B、C中分别获得45 308、40 940、43 262 条有效序列,基于97%相似度其OTU数量分别为474、89和476。ACE指数在246.09~476.27之间,Shannon指数在1.64~4.42之间,Chao 1指数在139.65~477.67之间,覆盖率范围99.87%~99.97%。说明所测得的OTU基本能反映所研究的酒曲样品细菌群落组成。每个样品的Chao 1指数和Shannon指数用于评估物种丰度和多样性[14]。通过计算样品的多样性指数发现,酒曲A和酒曲C的Chao 1指数和Shannon指数明显高于酒曲B,这说明酒曲A和酒曲C中的物种丰度明显高于酒曲B,且酒曲A和酒曲C的细菌群落结构比较复杂。由图1可知,随着测序深度的增加物种的数量也随之增加,但与此同时每个样品的Shannon曲线已进入平台期[15]。由此可知,虽然随着测序量的增加有可能会发现新的细菌种系型,但样品细菌多样性已经不再随测序量的增加而发生变化,说明测序数量足够充分合理[16]。因此,本研究细菌的测序量满足后续的生物信息学分析要求。
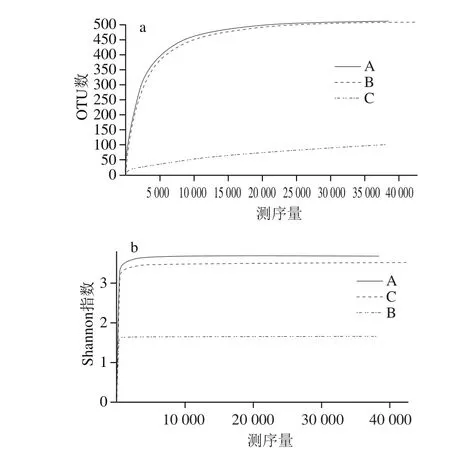
图1 3 种酒曲中细菌的稀释性曲线(a)和Shannon指数(b)图Fig. 1 Rarefaction curve (a) and Shannon index (b) of bacteria in three rice wine kojis
2.3.2 细菌中微生物群落组成分析
在门水平上,3 个样品中共检测出8 个细菌门,分别为厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌(Bacteroides)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、异常球菌-栖热菌门(Deinococcus-Thermus)、未分类菌群(others)。如图2a所示,相对丰度高且3 个样品均有分布的厚壁菌门、变形菌门、放线菌门。不同地区的酒曲样品之间微生物菌群明显不同,其中酒曲A和酒曲C中优势的细菌门为变形菌门,比例高达31.86%,39.98%;放线菌门为酒曲A中第2大优势菌群,占样品序列的29.31%;酒曲B中厚壁菌门为优势细菌门,占样品序列的98.08%,而酒曲C中厚壁菌门的相对丰度仅次于变形菌门,占样品序列的29.28%,居第2位。不同的酒曲样品之间微生物菌群不同,3 个样品中酒曲A和酒曲C的细菌微生物群落组成相似,但相对丰度存在差异。
在属水平上,3 个样本中共检测到19 个细菌属,分别为芽孢杆菌属(Bacillus)、片球菌属(Pediococcus)、红球菌属(Rhodococcus)、罗尔斯顿菌属(Ralstonia)、不动细菌属(Acinetobacter)、肠球菌属(Enterococcus)、乳酸杆菌属(Lactobacillus)、Burkholderia-Paraburkholderia、双歧杆菌属(Bifidobacterium)、norank-f-Mitochondria、鞘氨醇单胞菌属(sphingomonas)、Hydrogenispora、norankc-Gemmatimonadetes、Faecalibaculum、unclassified-f-Micromonospraceae、栖热菌属(Thermus)、norank-f-OM1-clade、Alistipesothers、未分类菌群(others)。如图2b所示,相对丰度较高且3 个样品中均分布的主要细菌属有芽孢杆菌属、片球菌属、红球菌属、罗尔斯顿菌属和不动细菌属。其中酒曲A和酒曲C中细菌微生物组成较为复杂,且相似。但所占比例不同,主要以红球菌属、青枯菌属、芽孢杆菌属、不动细菌属等为主。酒曲B中微生物多样性最低,主要有芽孢杆菌属、不动细菌属和红球菌属等为主。红球菌属为酒曲A的优势菌属,占样本序列比例为18.50%;其次是罗尔斯顿菌属,占样本序列比例为8.46%;芽孢杆菌属为酒曲B的优势菌属,占样本序列比例为13.09%;其次是片球菌属和肠球菌属,分别占样本序列比例为11.15%,11.34%。而酒曲C中的优势菌属也是芽孢杆菌属,占样本序列比例61.49%,其次是不动细菌属,占样本序列比例的23.74%。
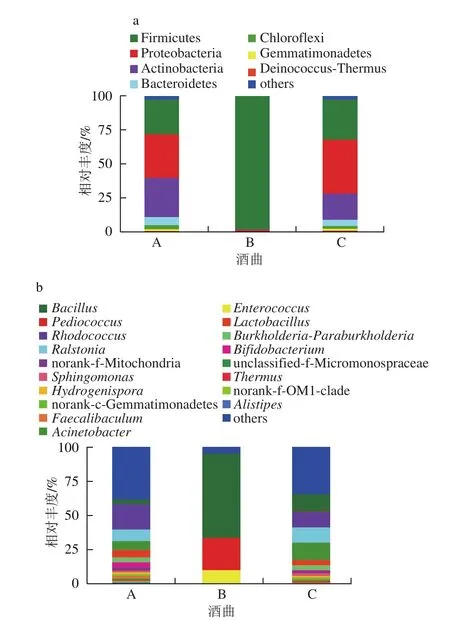
图2 3 种酒曲在门水平(a)和属水平(b)的细菌组成Fig. 2 Bacterial community composition of three rice wine kojis at the phylum level (a) and genus level (b)
2.3.3 细菌微生物群落相似性分析
通过非度量多维尺度(nonmetric multidimensional scaling,NMDS)分析细菌群落间存在的关系,根据样品中包含的物种信息,以点的形式反映在多维空间上,而对不同样品间的差异程度,则是最终通过点与点的距离表现在图中,其距离远近代表样品中菌体群落的差异程度[17]。由图3a可知,酒曲A和酒曲C距离较近,聚集在图的左侧,群落差异较小;而酒曲B的细菌微生物聚集在右侧部分,距酒曲A和酒曲C较远,差异较大,构成一个独立的组群。通过对样品细菌Beta多样性距离矩阵进行层级聚类分析,构建样品层级聚类树研究不同样品的相似性和差异性[18]。如图3b所示,Beta分析结果与NMDS相似,3 种酒曲共聚为两大支,酒曲A和酒曲C的细菌属聚为一类,差异较小,酒曲B的细菌属另聚为一类。
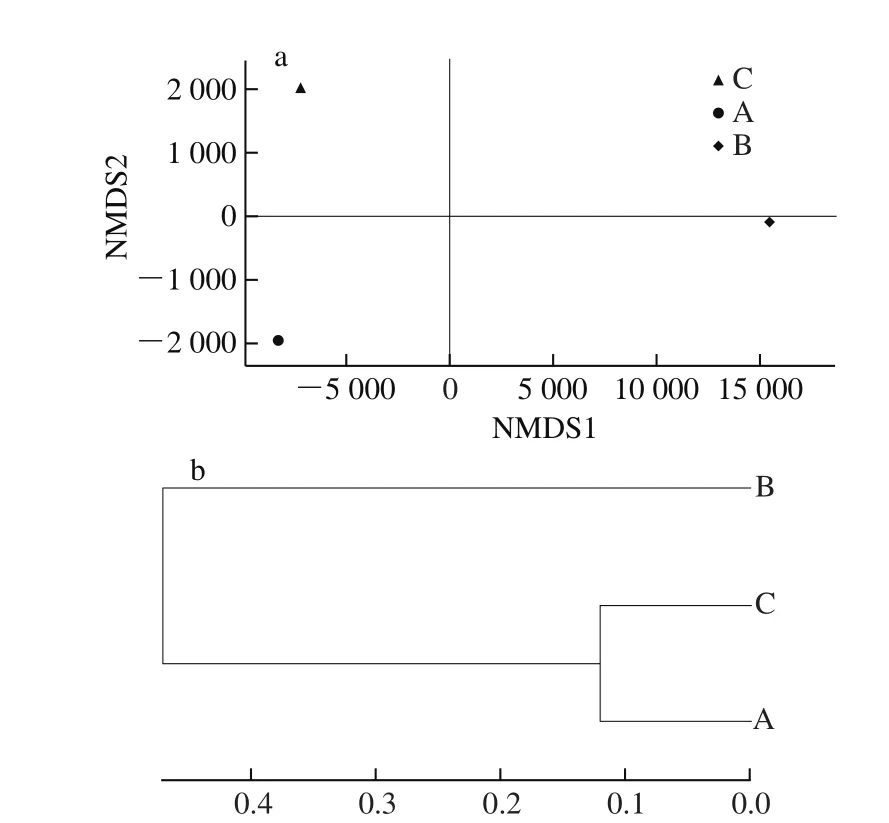
图3 细菌非度量多维尺度分析图(a)和基于Beta多样性距离的样品层级聚类树(b)Fig. 3 Bacterial non-metric multi-dimensional analysis (a) and hierarchical dendrogram based on Beta diversity distance (b)
2.4 样品中真菌的分析
2.4.1 真菌的丰度和多样性分析
酒曲A、B、C经过测序后得出3 种酒曲样品中共获得60 945 条高质量真菌序列(表4),3 种酒曲中获得有效序列相同,均为20 315 条,基于97%相似度,其OTU数量分别为2.4、1和15.8。ACE指数在0~16.09之间,Shannon指数在0.06~1.06之间,Chao 1指数在5.5~25之间,覆盖率均为99.99%。说明所测得的OTU基本能反映所研究酒曲样品真菌群落组成。通过计算样品的多样性指数发现,酒曲A的Chao 1指数25最大,说明酒曲A的真菌微生物丰度高于酒曲B和酒曲C。在多样性方面,酒曲C的Shannon指数1.06最大,说明酒曲C的真菌群落结构较为复杂。由图4可知,随着测序深度的增加,发现物种的数量也随之增加,与此同时,每个样品的Shannon曲线己进入平台期。由此可知,虽然随着测序量的增加有可能会发现新的真菌种系型,但样品真菌的多样性己经不再随测序量的增加而发生变化。因此,本研究真菌的测序量满足后续的生物信息学分析要求。
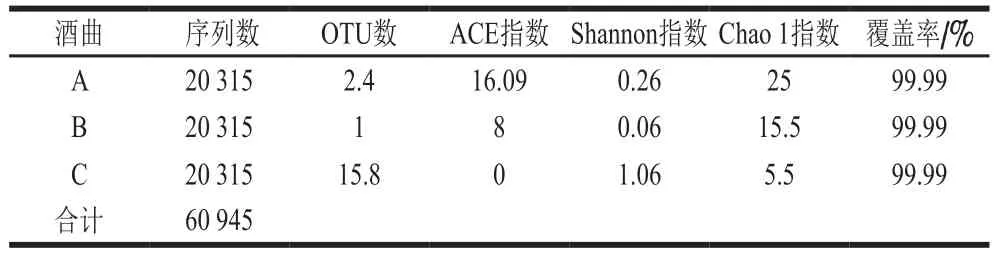
表4 酒曲样品真菌测序数据统计分析Table 4 Statistical analysis of fungal sequencing data of koji samples

图4 3 种酒曲中真菌的稀释性曲线(a)和Shannon指数(b)图Fig. 4 Dilution curve (a) and Shannon index (b) of fungi in three kinds of koji
2.4.2 真菌中微生物群落组成分析

图5 3 种酒曲在门水平(a)和属水平(b)上的真菌组成Fig. 5 Fungal community composition of three kojis at the phylum level (a) and genus level (b)
如图5a所示,在门水平上,检测出3 个真菌门为接合菌门(Zygomycota)、子囊菌门(Ascomycota)和担子菌门(Basidiomycota)。在门水平上相对丰度高且3个样品均有分布的主要真菌门为子囊菌门。不同的酒曲样品之间微生物菌群明显不同。酒曲A和酒曲B中接合菌门为优势真菌门,比例达64.57%、98.91%。酒曲C中子囊门为优势真菌门,占样品序列比例95.26%。
如图5b所示,在属水平上,3 个样本中共检测到4 个真菌属,分别为米根霉属(Rhizopus)、酵母菌属(Saccharomyce)、曲霉菌属(Aspergillus)和嗜热菌属(Thermomyces)。酒曲A和酒曲B中米根霉属为优势真菌属,占样本序列比例的66.58%和95.25%。酒曲C中优势真菌属为酵母属,占样本序列比例的95.25%。3 种酒曲样品中尽管微生物群落组成相似,但相对丰度仍存在显著性差异。
2.4.3 真菌微生物群落相似性分析

图6 真菌非度量多维尺度分析图(a)和基于Beta多样性距离的样品层级聚类树(b)Fig. 6 Fungal non-metric multidimensional scaling analysis (a) and hierarchical clustering dendrogram based on beta diversity distance (b)
如图6a可知,真菌NMDS聚类与细菌结果不同,酒曲A和酒曲B距离较近,聚集在图的右侧,群落差异较小。而酒曲C的细菌微生物聚集在左侧部分,距酒曲A和酒曲B较远,差异较大,构成一个独立的组群。如图6b所示,真菌Beta多样性距离矩阵层级聚类结果与NMDS结果一样,3 种酒曲同样共聚为两大支,酒曲A和酒曲B聚为一类,酒曲C另聚为一类。
2.5 典型关联分析(canonical correlation analysis,CCA)
CCA揭示不同地区酒曲样品微生物群落组成与不同环境因子之间的相关性[19]。选择3 个地方酒曲理化指标作为环境因子与酒曲中属水平上细菌丰度前10的微生物进行典范对应分析。如图7所示,酸度与液化酶活力之间夹角为钝角,表明两个理化指标之间不具有协同效应;水分质量分数与糖化酶活力之间夹角为锐角,表明两个指标之间具有协同效应。酒曲A和酒曲C与酸度相关性最高,酒曲B与液化酶活力、水分质量分数、糖化酶活力相关性最高,Acinetobacter、Ralstonia、Rhodococcus、norank-f-Mitochondria、Bifidobacterium、Lactobacillus与酸度变化呈正相关;Bacillus、Enterococcus、Pediococcus与液化酶活力、糖化酶活力变化呈正相关,与水分质量分数变化也呈正相关但影响不显著。由此说明,酒曲中微生物的种群结构对酒曲理化指标具有显著影响。

图7 细菌群落与环境因子典范对应分析Fig. 7 Canonical correspondence analysis between bacterial community and environmental factors
3 讨 论
通过高通量测序分析3 种不同酒曲的群落结构及物种多样性之间的差异,从3 种酒曲中共检出8 个细菌门和3 个真菌门;19 个细菌属和4 个真菌属。细菌门主要有厚壁菌门、变形菌门、放线菌门、拟杆菌门、绿弯菌门、芽单胞菌门等。细菌属主要有红球菌属、罗尔斯顿菌属、不动细菌属、乳酸杆菌属、双歧杆菌属、芽孢杆菌属、伯克尔德属、片球菌属、肠球菌属等。真菌门有接合菌门、子囊菌门、担子菌门。真菌属有米根霉属、酵母菌属、曲霉菌属、嗜热菌属。据报道,酒曲中的细菌属有芽孢杆菌属、乳酸杆菌属、乳球菌属、链球菌属、芽孢梭菌属、葡萄球菌属、微细菌属、节细菌属、欧文氏菌属、醋杆菌属、柯匝克氏菌属、颗粒链菌属和希瓦氏菌属13 个菌属[20-22],由此可知,酒曲样品中微生物群落组成丰富,不同地区酒曲微生物群落组成虽然相似,但是丰度仍存在差异。3 个地区中,酒曲A和酒曲C的细菌种群相似,酒曲A和酒曲B的真菌种群相似,这应该与环境因素有所关系,并且揭示了酒曲中微生物组成种类的复杂程度。
张双燕等[23]研究发现,大曲中优势细菌属有乳酸杆菌属,片球菌属,也检测出醋酸杆菌属和芽孢杆菌属等。其中乳杆菌属,片球菌属和芽孢杆菌属在本实验3 种酒曲中均被检测出,芽孢杆菌属为酒曲B和酒曲C的第一优势菌属。芽孢杆菌属在白酒酿造过程中发挥着重要的作用,能产生淀粉酶和蛋白酶,分解淀粉和蛋白质等大分子物质。此外,芽孢杆菌能影响白酒的风味物质如酯、醇的形成[24-25]。李艳等[26]研究发现,羊羔美酒大曲中优势菌属有片球菌属和乳酸杆菌属,甜酒中酸味较重可归功于含量较高的片球菌属和乳酸杆菌属,表明了甜酒最终质量和风味与发酵微生物分类组成息息相关。本研究也发现,在酒曲B中片球菌属的丰度较高,但乳酸杆菌属丰度略低。Bora等[27]采用基于Illumina平台的全基因组鸟枪测序法对印度的米酒曲xaj-pitha进行研究发现,米酒曲含有大量以乳酸菌为其主要细菌类群的细菌属。3 种酒曲检测的结果均有乳酸杆菌属,但相对丰度各有不同,乳酸杆菌属与乳酸乙醋的形成具有密切关系[28],其对于有机酸具有一定的耐受能力[29],能减弱酵母菌的好氧代谢速度,延长前发酵期,有利于发酵有益菌的生长,对于白酒香味物质增加有利[30-31]。另外3 种酒曲中也检测到双歧杆菌属,双歧杆菌是有益菌的代表,对于维持肠道微生态平衡有重要作用,具有调整肠道功能、净化肠道环境、促进机体健康的效果,提高抗病能力等[32]。陈玲等[33]采用16S rDNA克隆文库法和高通量测序法分析大曲中细菌微生物组成,检测出在门水平上的细菌门有厚壁菌门、变形菌门、放线菌门、拟杆菌门等。王丹丹等[34]采用高通量测序技术对孝感凤窝酒曲的真菌微生物多样性进行评价,得出在门水平上真菌主要有子囊菌门。本研究也在3 种酒曲样品中检测到了厚壁菌门、变形菌门、放线菌门、拟杆菌门、子囊菌门的存在,其在酒曲A和酒曲C中子囊菌门的丰度最高,而在酒曲C中相对丰度较低。接合菌门为酒曲C中的优势菌门。乔晓梅等[35]研究发现,清香大曲真菌菌群有米根霉和酵母菌。罗惠波等[36]采用ITS基因文库法研究清香型大曲真菌群落结构,得出清茬曲的优势真菌属为毕赤酵母属和米根霉属。而本研究也检测到酒曲A和酒曲B中的优势真菌属为米根霉属,酒曲C中的优势真菌属为酵母属。
本实验对3 种酒曲微生物群落结构与组成及多样性进行研究,采用CCA酒曲的基本理化指标与酒曲细菌种群结构关系,发现不同地区的酒曲微生物群落构成及多样性存在明显差异,且酒曲的基本理化指标与微生物菌群结构有一定的相关性,这可能与环境、气候等因素有关[37],通过本研究对贵州不同地区酒曲微生物种群结构有了初步的了解,也为酒曲微生物多样性探究进一步提供参考。

