风干武昌鱼中鲜味肽的分离纯化及二级结构分析
莫加利,陈季旺,2,3,*,刘静泊,舒 静,2,廖 鄂,2,3,夏文水,3,程水源,4
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.农产品加工与转化湖北省重点实验室(武汉轻工大学),湖北 武汉 430023;3.江南大学食品学院,江苏 无锡 214122;4.国家富硒农产品加工技术研发专业中心,湖北 武汉 430023)
风干武昌鱼是通过自然风干腌制武昌鱼制作的一种发酵鱼,是长江中下游地区的一种传统风味鱼制品[1]。通过酶和微生物的作用,鱼肉中的蛋白质、脂肪和碳水化合物在腌制和风干过程发生降解,形成风干武昌鱼特有的风味。此外,风干武昌鱼中游离氨基酸种类齐全,富含二十碳五烯酸和二十二碳六烯酸,深受消费者喜爱[2]。
鲜味肽是指从食物中提取或者由氨基酸合成的低分子质量的肽,不仅能赋予食品特殊的滋味,而且能改善风味,提升味感[3-6]。科研人员从各种食品及动植物蛋白酶解物中已分离和鉴定了大量的鲜味肽,并研究了这些鲜味肽的结构与鲜味的关系[7-15]。超滤、凝胶过滤色谱、反相高效液相色谱(reversed phase high performance liquid chromatography,RP-HPLC)常用于分离和纯化鲜味肽,基质辅助激光解析电离-飞行时间质谱(matrix assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF-MS)和傅里叶变换红外光谱(Fourier translation infrared spectroscopy,FTIR)等可用于测定鲜味肽的分子质量和结构[4-5,9-14]。电子舌是基于非选择性电化学传感器阵列结合化学计量学的方法建立起来的检测体系。作为一种分析、识别和检测复杂呈味物质的仪器,电子舌具有快速、简便、安全、无疲劳等特点,广泛应用于食品领域[16-17]。
本课题组分析了风干武昌鱼的灰分、脂肪、蛋白质和多肽含量、氨基酸和脂肪酸组成及挥发性成分[18]。有关风干武昌鱼中鲜味肽的分离纯化和结构分析的研究鲜见报道。因此,本实验采用电子舌测定鲜味,以及超纳滤、RP-HPLC从风干武昌鱼中分离纯化出纯度均一的鲜味肽,MALDI-TOF-MS、氨基酸自动分析仪、FTIR测定鲜味肽的分子质量、氨基酸组成和二级结构,探讨鲜味肽结构与风味的关系,以为风干武昌鱼的标准化生产提供科学指导。
1 材料与方法
1.1 材料与试剂
风干武昌鱼(每条鱼质量约为258 g,水分40.64%、蛋白质32.72%、脂肪9.40%、灰分9.38%、多肽4.26%)湖北兴兴食品有限公司;三氟乙酸(色谱纯) 美国Sigma公司;乙腈(色谱纯)、甲醇(色谱纯)、溴化钾(分析纯)、正己烷(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
LG-3型冷冻干燥机 宁波市生化仪器厂;TS-5000Z电子舌 日本Insent公司;1500 HPLC仪 美国SSI公司;1525-2489 HPLC仪 美国Waters公司;HPS-3超滤膜、卷式芳香聚酰胺纳滤膜 上海摩速有限公司;MALDI-TOF-MS仪 日本岛津公司;NEXUS 670型FTIR仪 美国尼高力仪器公司;L-8900氨基酸自动分析仪 日本日立公司。
1.3 方法
1.3.1 风干武昌鱼水溶性蛋白的提取
将风干武昌鱼去骨后用刀切成块状,加入去离子水,于匀浆机中12 000 r/min匀浆5 min,打碎混匀冷冻干燥后粉碎。取粉碎的鱼肉100 g,正己烷脱脂后加入去离子水,在鱼肉与水的比例1∶10(g/mL),温度40 ℃,时间120 min条件下提取,4 000 r/min离心15 min,取上清液,真空浓缩、冷冻干燥,制得风干武昌鱼水溶性蛋白,-18 ℃冷冻贮藏,备用。
1.3.2 超滤预分离、纳滤脱盐
室温下使操作压力为0.1 MPa,将风干武昌鱼水溶性蛋白用超纯水配成1 mg/mL的溶液100 mL,通过截留分子质量3 kDa的超滤膜进行超滤分离,收集滤过液和截留液,真空浓缩、冷冻干燥,-18 ℃冷冻贮藏,备用;室温下使操作压力为0.5 MPa,将电子舌测得超滤后鲜味较佳的组分用超纯水配成1 mg/mL的溶液100 mL,通过截留分子质量约200 Da的纳滤膜进行纳滤脱盐,收集截留液,真空浓缩、冷冻干燥,制得纳滤脱盐组分,-18 ℃冷冻贮藏,备用。
1.3.3 鲜味肽的理化成分测定
水分含量测定:参照GB 5009.3—2016《食品中水分的测定》105 ℃恒重法[19];灰分含量测定:参照GB 5009.4—2016《食品中灰分的测定》550~600 ℃灰化法[20];蛋白质含量测定:参照GB 5009.5—2016《食品中蛋白质的测定》凯氏定氮法,转换系数采用6.25[21]。
肽含量测定:采用双缩脲法[22]。分别取4 mg超滤前水溶性蛋白、4 mg超滤后鲜味较强(未纳滤)水溶性蛋白、4 mg纳滤脱盐水溶性蛋白置于试管中,加入2.5 mL 10%的三氯乙酸溶液,于旋涡混合仪上混合均匀,静置10 min,然后4 000 r/min离心15 min。将上清液全部转移到50 mL容量瓶中并用5%的三氯乙酸溶液定容,摇匀。取6 mL上述溶液置于另一试管中,加入双缩脲试剂4 mL(样液∶双缩脲试剂=3∶2,V/V),于旋涡混合仪上混合均匀,静置10 min后2 000 r/min离心10 min。取上清液于波长540 nm处测定吸光度,参照标准曲线,计算超滤前组分、超滤后鲜味较强(未纳滤)组分、纳滤脱盐组分中的多肽含量。
标准曲线的绘制参照双缩脲法-常量法[22]。准确称取10 mg酪蛋白,以0.05 mol/L氢氧化钠溶液配制成质量浓度约为5 mg/mL的蛋白质标准溶液,分别取出0、1、2、3、4、5 mL转入6 支比色管,各加入4 mL双缩脲试剂,并分别加入超纯水补足到20 mL,于波长550 nm处比色,绘制标准曲线。
理化成分含量均按超滤前组分、超滤后鲜味较强(未纳滤)组分、纳滤脱盐组分质量计。结果以干基计。
1.3.4 RP-HPLC纯化鲜味肽
选用超纳滤分离得到的鲜味较强的肽组分,采用RP-HPLC进一步纯化,收集各组分,经真空浓缩、冷冻干燥,-18 ℃冷冻贮藏,备用。
RP-HPLC纯化条件:SSI 1500 HPLC系统;Jupiter C18色谱柱(250 mm×10 mm);SSI 1500紫外检测器,波长220 nm;流动相A:0.1%三氟乙酸溶液;流动相B:0.1%三氟乙酸-乙腈溶液;流速2 mL/min;样品质量浓度10 mg/mL;进样体积1 mL;线性洗脱梯度:0~5 min,5% A;5~18 min,5%~15% A;18~20 min,15%~5% A。
1.3.5 电子舌分析
参照Zhang Meixiu等[14]的方法稍作改进。分别将RP-HPLC纯化的肽组分和超滤分离、纳滤脱盐的肽组分用超纯水配成1 mg/mL的溶液80 mL,电子舌分析其滋味,选取鲜味较强的组分。
1.3.6 鲜味肽的纯度鉴定
采用RP-HPLC鉴定鲜味较强的肽组分的纯度,色谱条件如下:1525 HPLC系统;Jupiter C18色谱柱(250 mm×4.6 mm);Waters 1489紫外检测器,波长220 nm;流动相A:0.1%三氟乙酸溶液;流动相B:0.1%三氟乙酸-乙腈溶液;流速1 mL/min;样品质量浓度10 mg/mL;进样体积20 μL;线性洗脱梯度:0~2 min,5% A;2~10 min,5%~15% A;10~12 min,15%~5% A。
1.3.7 MALDI-TOF-MS测定分子质量
样品制备:称取约20 mg纯化的肽组分,溶于100 μL水中。用20%乙腈溶液稀释50 倍后,取0.5 μL点样,进行MALDI-TOF测试。
点样:取1 µL供试品点至样品靶上,自然干燥后,再取0.6 µL α-氰基-4-羟基肉桂酸(α-cyano-4-hydroxycinnamic acid,CHCA)基质溶液点至对应靶位上并自然干燥,用相同方法在样品靶位相邻位置点标准品。
校准:在正离子模式下选择反射方法对样品测试范围进行校准测试。标准物质校准范围为:1 046.542±0.5、1 533.858±0.5、2 465.199±0.5、3 494.651±0.5。
测试样品:在正离子模式下选择线性方法测试样品分子质量。
质谱数据及图谱处理:5800 MALDI-TOF/TOF产生的原始数据及图谱由4000 Series Explorer V3.5软件导出。
1.3.8 氨基酸组成分析
采用氨基酸自动分析仪测定纯化肽组分的氨基酸组成。取一定量的纯化肽组分于玻璃试管中,加入15 mL 6 mol/L HCl溶液,试管抽真空,充氮气封管,置于108 ℃恒温干燥箱内水解24 h,待冷却后,过滤,定容至100 mL,吸取滤液20 μL于40 ℃真空干燥器中进行干燥,用0.2 mol/L HCl溶液定容至1 mL,用氨基酸自动分析仪测定。结果以湿基计。
1.3.9 FTIR分析
参照Hasni等[23]的方法稍作改进。采用FTIR分析纯化肽组分的二级结构。用蘸取无水乙醇的脱脂棉将镊子、研钵、压片等用具擦试干净,放在红外灯下照射使无水乙醇快速挥发。在研钵中加入适量溴化钾,按照质量比约1∶100加入纯化的肽组分,充分研磨至粉末状混匀,压片(压片尽量薄而透明,以保证较高的透光率)。用FTIR测定红外吸收光谱图,以溴化钾粉末作为空白背景,设定分辨率4 cm-1,扫描次数16 次,做全波长(500~4 000 cm-1)扫描。
1.4 数据处理
采用Microsoft Office Excel 2010软件和SPSS 19.0进行数据处理,结果以 ±s表示。实验至少重复3 次,取其平均值。
2 结果与分析
2.1 超滤分离组分的电子舌分析
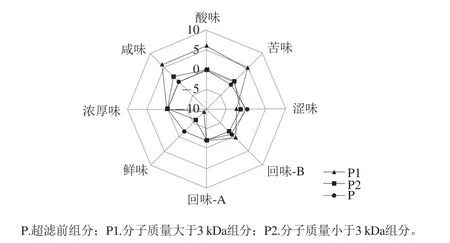
图1 超滤组分的电子舌雷达图Fig. 1 Electronic tongue radar chart for the taste of ultrafiltration fractions
采用截留分子质量为3 kDa的超滤膜对风干武昌鱼水溶性蛋白进行分离,得到分子质量大于3 kDa、小于3 kDa 2 种组分,分别命名为P1、P2。电子舌分析超滤前组分、P1、P2的滋味,结果见图1。从图1可以看出,超滤前组分鲜味比P1强,因为超滤前水溶性成分中有机酸、核酸及其他代谢产物,例如核苷酸、核糖等,对鲜味也有贡献[24-27]。分子质量小于3 kDa的组分(P2)鲜味较大于3 kDa的组分(P1)强,这与Lioea[28]、Claeys[29]等报道的风味肽主要是分子质量小于3 kDa的肽一致。因此,选取P2进行纳滤脱盐及进一步纯化。
2.2 超滤、纳滤组分的成分
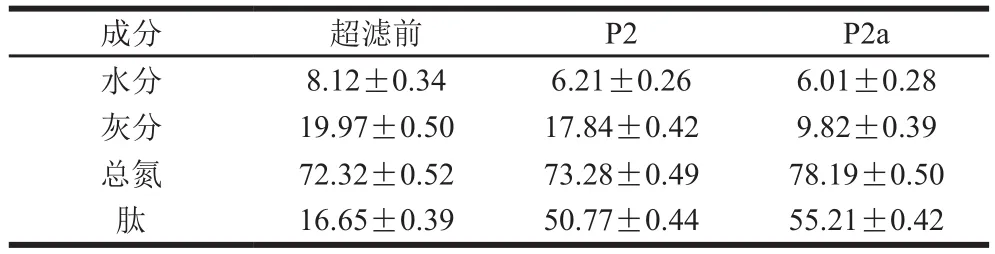
表1 超滤、纳滤肽组分的主要成分Table 1 Components of ultrafiltration and nano-filtration fractions%
将P2纳滤脱盐后得到组分P2a。由表1可知,超滤后组分(P2)中肽质量分数由16.65%增加至50.77%,高分子质量的蛋白质、多肽等被截留,低分子质量的肽被富集。从风干武昌鱼中提取的水溶性蛋白中灰分质量分数非常高,达到了19.97%,超滤虽然去除了少量的灰分,但是P2中灰分质量分数仍较高(17.84%),纳滤后组分(P2a)中灰分质量分数由17.84%降低至9.82%,纳滤脱盐去除了组分P2中50%的灰分,达到了较好的脱盐效果。
2.3 RP-HPLC纯化鲜味肽
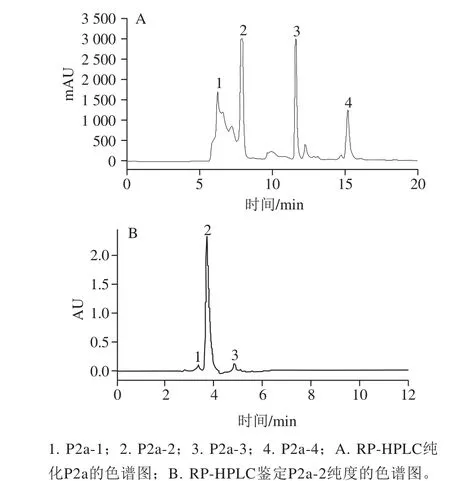
图2 RP-HPLC纯化鲜味肽的色谱图Fig. 2 Chromatogram of umami peptide purified by using RP-HPLC
由图2A可知,P2a在保留时间20 min内,线性梯度洗脱得到4 个在波长220 nm有吸收峰的组分,分别标注为P2a-1、P2a-2、P2a-3和P2a-4。由于RP-HPLC分离使疏水性弱(极性强)的物质先被洗脱下来,初步判断P2a-1、P2a-2的极性较强。分别收集4 个组分,经真空浓缩、冷冻干燥后进行电子舌分析。
从图2B可以看出,P2a-2在波长220 nm的洗脱图谱中呈单一峰,纯度高达95.20%,可用于进一步的结构分析。
2.4 RP-HPLC纯化肽组分的电子舌分析
RP-HPLC纯化的4 个组分(P2a-1、P2a-2、P2a-3、P2a-4)和P2a的电子舌分析结果见图3。从图3可知,5 个组分鲜味差别较大,P2a-3的鲜味最弱,其次是P2a-4、P2a-1和P2a,RP-HPLC纯化的4 个组分中P2a-2鲜味强度最高。因此,选用P2a-2进一步分析。
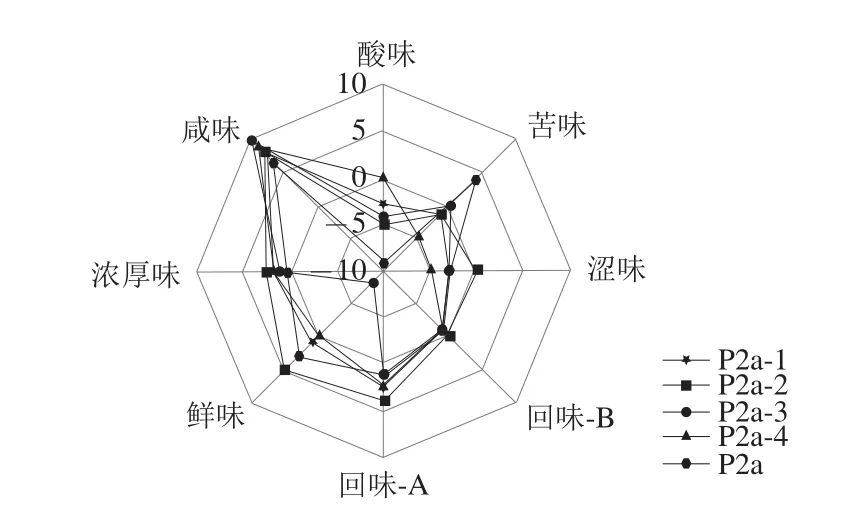
图3 RP-HPLC纯化鲜味肽的电子舌雷达图Fig. 3 Electronic tongue radar chart of umami peptide purified by using RP-HPLC
2.5 P2a-2纯度鉴定
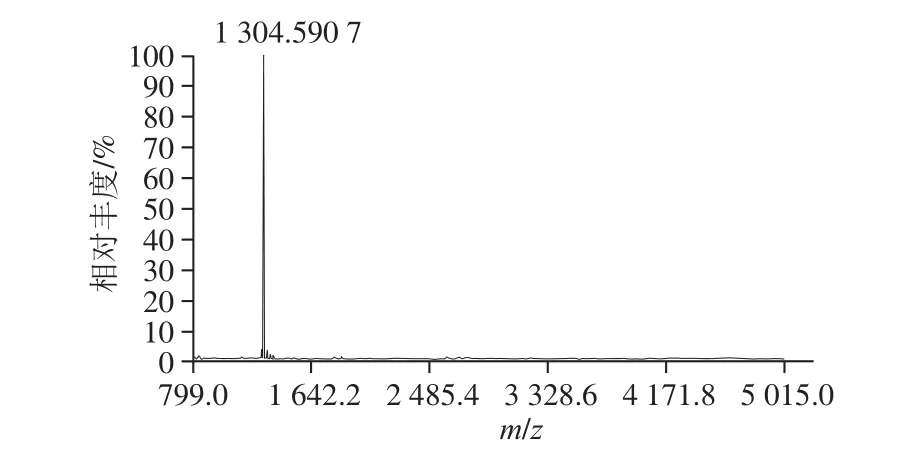
图4 P2a-2的MALDI-TOF-MS一级质谱图Fig. 4 MALDI-TOF-MS spectrum of P2a-2
采用MALDI-TOF-MS测定鲜味肽P2a-2的质量指纹图谱,结果见图4。由图4可知,P2a-2经过激光辐照解离并扣除基质的噪音干扰,在m/z 1 304.590 7出现明显的峰,杂峰较少,说明P2a-2纯度较高,是分子质量1 304.59 Da的肽,与RP-HPLC纯度鉴定的结果一致(图2B)。
2.6 氨基酸组成分析
构成天然蛋白质的氨基酸都属L型,大部分L型氨基酸及其盐具有酸味、甜味、苦味及鲜味,对食品风味的形成有重要作用[24,30-32]。如表2所示,P2a、P2a-2的呈味氨基酸比例均较高,分别为71.79%、57.28%。P2a、P2a-2的呈味氨基酸中鲜味氨基酸谷氨酸、甘氨酸、丙氨酸含量均较高,但是天冬氨酸含量较低。谷氨酸是呈现鲜味的特征酸性氨基酸,可以提供作为鲜味肽助味基的氨基或羟基,是呈现风干武昌鱼鲜美口感的重要氨基酸[24,30-32]。P2a-2中谷氨酸含量为21.97%,比P2a低1.3%,然而P2a-2的组氨酸含量(27.54%)比P2a高9.91%。Fuke等[33]研究表明组氨酸能够增强风味效果,促进水产品鲜香味的形成,初步推断P2a-2的鲜味比P2a强与组氨酸含量相差较大相关。另外,P2a-2中极性氨基酸组氨酸含量最高,与2.3节纯化过程中显示先被洗脱分离的组分P2a-2极性较强的结果一致。
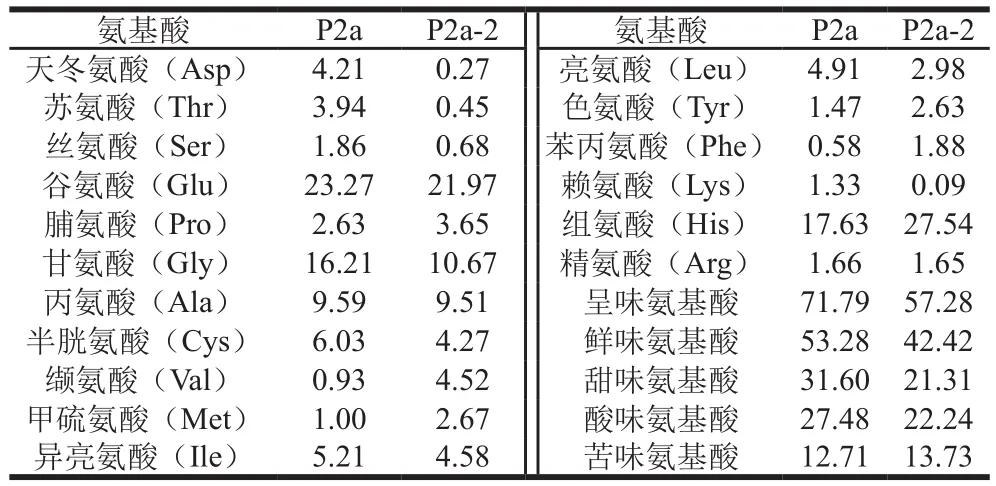
表2 P2a、P2a-2的氨基酸组成Table 2 Amino acid composition of P2a and P2a-2%
2.7 FTIR分析
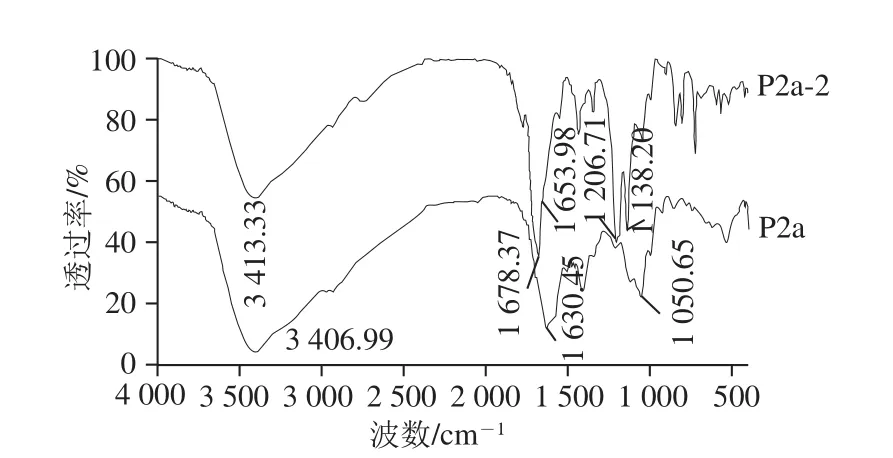
图5 P2a、P2a-2的FTIR分析Fig. 5 FTIR spectra of P2a and P2a-2
如图5所示,蛋白质和多肽在红外区域表现为9 个特征振动模式或基团频率,但只有酰胺I带(1 700~1 600 cm-1)是对蛋白质结构变化高度敏锐的一个谱带,常用于二级结构的分析,因此选用酰胺I带分析P2a、P2a-2二级结构的差异[12,23,34]。酰胺I带的振动频率取决于C=O和H—N之间的氢键性质,酰胺I带的波数在1 610~1 640 cm-1范围内为β-折叠,1 640~1 650 cm-1范围内为无规卷曲,1 650~1 658 cm-1范围内为α-螺旋,1 660~1 695 cm-1范围内为β-转角[12,23,34]。P2a、P2a-2各子峰的面积百分比及归属见表3。
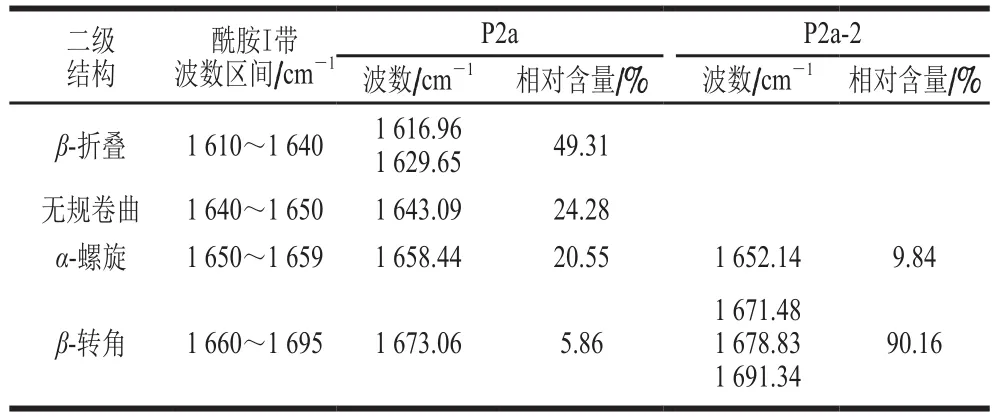
表3 P2a、P2a-2的二级结构分析Table 3 Analysis of the secondary structures of P2a and P2a-2
由表3可知,P2a二级结构相对含量依次为:β-折叠49.31%、无规卷曲24.28%、α-螺旋20.55%、β-转角5.86%;P2a-2二级结构相对含量依次为:β-转角90.16%、α-螺旋9.84%。P2a的二级结构以β-折叠为主,P2a-2的二级结构以β-转角为主。在蛋白质的二级结构中α-螺旋、β-折叠是常见的规则的二级结构,β-转角是部分规则的二级结构[24,30]。经常出现在β-转角中的氨基酸有天冬氨酸、天冬酰胺、丝氨酸、组氨酸和谷氨酸等,以及影响规则二级结构形成的脯氨酸和甘氨酸[24,30]。脯氨酸的α-碳原子参与R基吡咯的形成,环内的Cα—N键和C—N肽键都不能旋转,而且脯氨酸形成的肽键不具酰胺氢,不能形成链内氢键,多肽链中只要存在脯氨酸,α-螺旋、β-折叠结构即被中断。然而,脯氨酸具有的环状结构和固定的φ角,在一定程度上能促使β-转角的形成,因此,蛋白质中脯氨酸含量高且分布均匀时,该蛋白的α-螺旋、β-折叠结构缺乏,而β-转角结构含量较高[24,30]。P2a-2的脯氨酸相对含量是P2a的1.4 倍,明显高于P2a(表2),且组氨酸、谷氨酸含量均较高,利于β-转角的形成。经常出现在β-转角中的谷氨酸、天冬氨酸、天冬酰胺、甘氨酸均属于鲜味氨基酸,组氨酸属于鲜味增强氨基酸,有利于P2a-2鲜味的形成,推断P2a-2呈现鲜味与其二级结构以β-转角为主相关。
3 结 论
采用超滤分离、纳滤脱盐和RP-HPLC纯化从武昌鱼肉中纯化得鲜味较佳单一肽组分P2a-2,MALDI-TOF-MS测定P2a-2的分子质量为1 304.59 Da。P2a-2的鲜味氨基酸比例较高,二级结构分别以β-转角为主。经常出现在β-转角中的谷氨酸、天冬氨酸、天冬酰胺、甘氨酸均属于鲜味氨基酸,组氨酸属于鲜味增强氨基酸,有利于P2a-2鲜味的形成,推断P2a-2呈现较佳鲜味与其鲜味氨基酸含量较高及二级结构以β-转角为主相关。该研究结果可用于指导风干武昌鱼的标准化生产。

