钙离子交联对β-胡萝卜素乳液水凝胶微粒的影响
吴晓琳,王 健,邹立强*,严 持,刘 伟
(南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330047)
β-胡萝卜素是最主要的类胡萝卜素之一,属于四萜类碳氢化合物,分子式为C40H56,相对分子质量为536.88,是自然界最为普遍存在的天然色素。β-胡萝卜素是VA的前体,是人体VA的主要来源,一个β-胡萝卜素分子结构相当于两个分子的VA[1-2]。β-胡萝卜素具有抗氧化作用[3],可加强生物机体的特异性及非特异性免疫功能[4]以及加强细胞间的信号传递[5]。然而β-胡萝卜素对光、热、氧极为敏感,易发生降解、氧化、异构化、光敏化反应,应用效益下降,因此β-胡萝卜素应避光、低温、密封保存。再者,β-胡萝卜素的弱极性分子结构使得其溶解性较差,几乎不溶于水,在室温下只能微溶于油,这使得β-胡萝卜素在运输、储存、应用等方面受到了极大的限制。
为提高β-胡萝卜素的稳定性,扩大其应用范围,运用食品级运载体系对其进行包埋成为了近年来食品研究领域的一个热点[6]。可用于包埋β-胡萝卜素的运载体系有很多,如乳液[7]、脂质体[8]、环糊精[9]、微胶囊[10]、分子复合物[11]等。乳液因其在制备工艺上较简单、在经济上原料成本较合理,成为了研究最广泛、应用最多的β-胡萝卜素运载体系。将β-胡萝卜素包埋在乳液里,能提高β-胡萝卜素的溶解度,还能保护其免受外界环境中不稳定因素的影响,并提高其生物利用率[12]。但由于乳液是热力学不稳定体系,油水界面存在较大的表面张力。随着存放时间的推移,由于重力作用、两相密度差、表面净电荷不足等而发生分离、絮凝、聚结和奥氏熟化等作用,最终导致乳液破乳[13]。
水凝胶微粒是由三维网状结构的生物高分子构成的亲水胶体微粒,其中三维网状结构内可以填充大量的水相成分,因此可以包埋一些小的水溶性的运载体系[14]。近年来研究最多且比较典型的是用水凝胶微粒包埋乳液油滴,因此水凝胶微粒被定义为一种以乳液为基础的运载体系。水凝胶微粒包埋乳液油滴后相当于形成了O/W1/W2结构的乳液体系,其中O指乳液油滴,W1和W2指两种不同的生物高分子形成的水相,通常体积比例较小的一相为内水相(W1),体积比例较大的一相为外水相(W2)[15]。在相同油浓度的条件下,水凝胶微粒的物化特性与传统乳液相比大不相同,如光学性质、流变学性质、稳定性和释放特性。而微粒的大小、分布情况、乳液油滴在水凝胶内的空间位置以及水凝胶微粒的特性都依赖于所选择的生物高分子材料及制备方法。
本研究以酪蛋白为乳化剂制备β-胡萝卜素乳液,再通过凝聚法以酪蛋白和海藻酸钠为原料制备β-胡萝卜素乳液水凝胶微粒,并加入不同浓度的Ca2+进行交联,分析对比Ca2+交联后的β-胡萝卜素乳液水凝胶微粒的理化性质的变化,考察Ca2+交联对β-胡萝卜素乳液水凝胶微粒离心稳定性、pH值稳定性、离子稳定性、贮藏稳定性的影响,为提高β-胡萝卜素的稳定性提供一定的依据,并对构建高品质的乳液型运载体系和制备高品质乳液基食品具有一定的指导意义。
1 材料与方法
1.1 材料与试剂
β-胡萝卜素(C110501) 阿拉丁试剂(上海)有限公司;玉米油 益海嘉里南昌粮油食品有限公司;酪蛋白酸钠(C8654)、海藻酸钠(180947)、尼罗红、尼罗蓝A均 Sigma-Aldrich(上海)贸易有限公司;氯化钠、乙醇、正己烷、叠氮化钠等试剂均为国产分析纯。
1.2 仪器与设备
IKA T18分散机 德国艾卡仪器设备有限公司;M-110动态高压微射流 美国Microfluidic公司;Delta320 pH计 梅特勒-托利多仪器(上海)有限公司;Mastersizer 3000粒度仪、zs90电位分析仪 英国马尔文仪器有限公司;LSM710共聚焦显微镜 德国卡尔·蔡司股份公司;T6紫外-可见分光光度计 北京普析通用仪器有限公司;XW-80A旋涡混匀器 上海精科实业有限公司;HH-S26恒温水浴锅 金坛市梅香仪器有限公司;MCR302流变仪 奥地利安东帕有限公司;EX1103ZH电子分析天平 西杰天平(北京)仪器有限公司;TDL-5-A台式离心机 上海安亭科技仪器厂;LRHS-250B恒温培养箱 上海左乐仪器有限公司。
1.3 方法
1.3.1 Ca2+交联β-胡萝卜素乳液水凝胶微粒的制备
溶液的配制:配备0.01 mol/L pH 7.0的磷酸缓冲盐溶液(phosphate buffer saline,PBS):2.184 6 g/L Na2HPO4·12H2O,0.608 4 g/L NaH2PO4·2H2O;2 g/100 mL的酪蛋白溶液:称取一定量的酪蛋白溶解于PBS中,并加入0.01%的叠氮化钠抑菌,不断搅拌直至完全溶解,并置于冰箱中过夜使其充分水合;2 g/100 mL的海藻酸钠溶液:称取一定量的海藻酸钠溶解于PBS中,并加入0.01%的叠氮化钠抑菌,不断搅拌直至完全溶解,并置于冰箱中过夜使其充分水合。
β-胡萝卜素乳液的制备参考Yi Jiang等[16]方法:将一定量的β-胡萝卜素(0.5 g/100 mL)溶于玉米油中,超声并不断搅拌使其完全溶解。将油相与蛋白相(酪蛋白溶液)按照1∶9的质量比混合,并用高速分散机在22 000 r/min分散2 min,然后立刻用高压微射流(压力为120 MPa)均质3 次。最终得到β-胡萝卜素乳液。
β-胡萝卜素乳液水凝胶微粒的制备参考Zhang Zipei等[15]的方法:将所制备好的β-胡萝卜素乳液与2 g/100 mL的酪蛋白溶液以体积比1∶1的比例混合,并用磁力搅拌器充分搅拌(500 r/min)。再将所得到的体系与2 g/100 mL海藻酸钠溶液以体积比1∶2的比例混合,并用磁力搅拌器充分搅拌(500 r/min)。最后,用1 mol/L的柠檬酸溶液将混合体系的pH值调至4.5,磁力搅拌(500 r/min)30 min。最终形成β-胡萝卜素乳液水凝胶微粒。
Ca2+交联β-胡萝卜素乳液水凝胶微粒的制备:配备0.01 mol/L的CaCl2溶液,并用其作为母液,用于交联水凝胶微粒。最终使得水凝胶微粒中Ca2+浓度分别达到1、2、4 mmol/L,即得到不同交联度的β-胡萝卜素水凝胶微粒,并进行相应的考察。
1.3.2 Ca2+交联β-胡萝卜素乳液水凝胶微粒的Zeta电位、平均粒径以及包埋率的测定
β-胡萝卜素乳液及不同交联度的水凝胶微粒分别用相应pH值的缓冲溶液稀释100 倍后,用马尔文动态光散射仪测定Zeta电位。测试参数为:温度25 ℃,折光率1.333,外部光纤角度18.9°,散射角度14.0636°。
β-胡萝卜素乳液及不同交联度的水凝胶微粒的粒径使用马尔文激光粒度仪测定。用蒸馏水作为分散介质,设置分析条件为:颗粒(玉米油)折射率1.472,颗粒吸收率0.100,分散剂(水)折射率1.33,激光遮光度10%左右。粒径的大小用加权平均体积直径(d32)表示:

式中:ni为粒径为di的颗粒数目。
β-胡萝卜素乳液及不同交联度的水凝胶微粒中β-胡萝卜素的包埋率的测定参考Surh等[17]的方法并调整。取样品1 mL,加入正己烷3 mL,在旋涡混匀仪上充分振荡混合均匀后,于10 000×g离心5 min。取上清液于容量瓶中定容,并用紫外-可见分光光度计在波长450 nm处测定吸光度。根据标准曲线计算出β-胡萝卜素的含量,包埋率用公式(2)计算:

1.3.3 Ca2+交联β-胡萝卜素乳液水凝胶微粒的微观结构
β-胡萝卜素乳液及不同交联度的水凝胶微粒的微观结构采用激光共聚焦显微镜进行考察,参照Chung等[18]的方法并进行调整。分别称取一定量的尼罗红和尼罗蓝溶于酒精,形成质量浓度为1 mg/mL的染料。取2 mL样品分别加入0.1 mL的尼罗红染料和尼罗蓝染料,混合均匀。其中,样品中的蛋白相被尼罗蓝染色,油相被尼罗红染色。样品染色以后,加入到表面皿上,放置在激光共聚焦显微镜后,采用10 倍目镜和60 倍物镜,并设置显微镜的激发波长和吸收波长与相应的染料对应,并进行观察拍照。
1.3.4 Ca2+交联β-胡萝卜素乳液水凝胶微粒的流变性质
β-胡萝卜素乳液及不同交联度的水凝胶微粒的流变学性质分析参考Soukoulis等[19]的方法,利用DHR-2Discovery流变仪对样品进行流变学性质的研究。测试前将乳液及水凝胶微粒分别于1 000 r/min搅拌30 min,以保证没有气泡,并于4 ℃放置18 h以达到平衡。测试使用剪切扫描,使用40 mm夹具,夹具与载物台之间间距1 mm,在室温25 ℃,以剪切应力从0.1~500 s-1记录每个样品的流动曲线。
1.3.5 Ca2+交联β-胡萝卜素乳液水凝胶微粒的离心稳定性
将β-胡萝卜素乳液及不同交联度的水凝胶微粒分别稀释100 倍后,在2 500 r/min离心5 min,用注射器吸取离心后的底层部分,用紫外-可见分光光度计在600 nm波长处测其吸光度;同时,对经稀释未离心的乳液及水凝胶微粒取样,同样在600 nm波长处测定吸光度。离心稳定性用离心稳定性常数[20]表示,计算公式如下:

式中:K为离心稳定性常数/%;A1为样品离心前的吸光度;A2为样品离心后底层溶液的吸光度。
1.3.6 Ca2+交联β-胡萝卜素乳液水凝胶微粒的pH值稳定性
β-胡萝卜素乳液及不同交联度的水凝胶微粒的pH稳定性的测定参照Zhang Zipei等[21]的方法。将每组样品稀释至含等量的β-胡萝卜素,用1 mol/L氢氧化钠溶液或柠檬酸溶液将样品溶液的pH值分别调至3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0,分别取溶液约5 mL,分装于试管中。静置24 h,用1.3.2节法测其粒径变化,并进行拍照。
1.3.7 Ca2+交联β-胡萝卜素乳液水凝胶微粒的离子稳定性
β-胡萝卜素乳液及不同交联度的水凝胶微粒的离子稳定性的测定参照文献[21]的方法。将每组样品稀释到含等量的β-胡萝卜素,用6 mol/L氯化钠溶液将样品溶液的离子浓度分别调到0.5、1、2、3、4 mol/L,于各离子浓度下分别取溶液约5 mL,分装于试管中。静置24 h,用1.3.2节方法测其粒径变化,并进行拍照。
1.3.8 Ca2+交联β-胡萝卜素乳液水凝胶微粒的贮藏稳定性
将β-胡萝卜素乳液及不同交联度的水凝胶微粒稀释到含等量的β-胡萝卜素,分装在离心管中,密封避光保存在25 ℃和37 ℃,间隔取样,测定样品中β-胡萝卜素含量。β-胡萝卜素含量的测定参照Liu Fu等[22]的方法:每个样品取0.5 mL,分别加入2 mL的乙醇和3 mL的正己烷,于旋涡混匀器上振荡,使样品充分破乳溶解,再静置数分钟使正己烷相和乙醇相充分分离,吸取并收集萃取液(正己烷相)。继续添加3 mL正己烷进行振荡萃取两次,合并萃取液。定容后,吸取萃取液,用紫外-可见分光光度计在波长450 nm处测定其吸光度。并结合β-胡萝卜素标准曲线,得到样品中β-胡萝卜素的浓度,计算β-胡萝卜素的保留率:

式中:Ct为贮藏相应温度下第t天的浓度;C0为最初样品中β-胡萝卜素的浓度。
1.4 数据分析
所有实验数据都进行3 次平行,数据分析和图表分析采用Origin 8.0软件,结果表示为 ±s。实验数据之间的显著性差异借助SPSS 18.0进行Duncan检测,P<0.05,差异显著。
2 结果与分析
2.1 Ca2+交联β-胡萝卜素乳液水凝胶微粒的制备
参考Yi Jiang[16]和Zhang Zipei[15]等的方法制备得到β-胡萝卜素乳液水凝胶微粒,向其中滴加Ca2+使得水凝胶微粒中的Ca2+浓度分别为0、1、2、4 mmol/L,并分别记为FHP-0、FHP-1、FHP-2、FHP-4。海藻酸钠分子由α-L-古洛糖醛酸(G)和β-D-甘露糖醛酸(M)通过(1→4)糖苷键聚合而成,其中的G片段会通过协同作用结合形成钻石形的亲水空间,而Ca2+会占据这些亲水空间,并与G片段上的O原子发生螯合作用形成配位键[23]。如图1所示,本研究利用Ca2+和海藻酸钠的相互作用,在溶液中加入少量Ca2+交联水凝胶微粒,以期能获得更为稳定的体系。
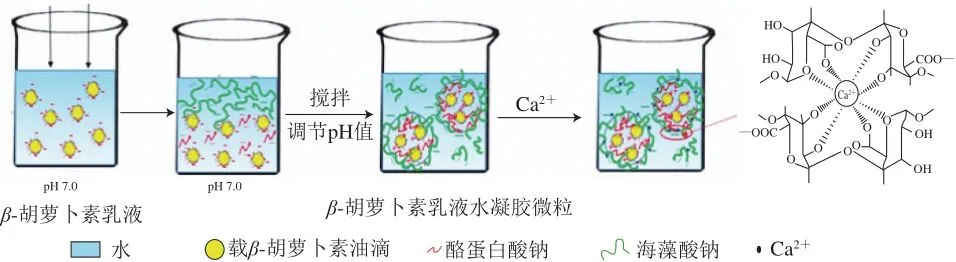
图1 钙交联β-胡萝卜素乳液水凝胶微粒制备示意图Fig. 1 Schematic diagram of the preparation process of Ca2+ crosslinked β-carotene-loaded emulsion hydrogel microparticles
2.2 Ca2+交联β-胡萝卜素乳液水凝胶微粒的Zeta电位、平均粒径与包埋率测定
如表1所示,随着Ca2+浓度的增加,水凝胶微粒的粒径有变小的趋势,而电位有所增大,但是这种趋势不明显,显著性分析表明FHP-0、FHP-1、FHP-2、FHP-4之间的粒径大小和电位均无显著性差异。这种不明显的趋势是由于所使用的Ca2+浓度较小,同时也证明所使用的Ca2+浓度范围不会破坏水凝胶微粒的结构。而海藻酸钠和Ca2+结合后,分子链蜷缩形成“蛋盒”结构,导致水凝胶微粒的粒径减小,并且随着Ca2+浓度的增加,海藻酸钠分子链和Ca2+交联程度越大,形成的水凝胶微粒的结构越紧密,因此粒径也会随之减少。水凝胶微粒与乳液对β-胡萝卜素的包埋率都比较高(97.39%以上),且没有显著性差异。这是由于β-胡萝卜素负载在乳液液滴中,水凝胶微粒对乳液油滴的虽然包裹更加紧凑,但并不会影响β-胡萝卜素的包埋率。此外Ca2+交联也不会显著影响β-胡萝卜素包埋率。

表1 不同钙离子浓度交联水凝胶微粒的平均粒径与电位以及包埋率Table 1 Mean particle size, zeta-potential and entrapment efficiency of cross-linked hydrogel microparticles with different Ca2+ concentrations
2.3 Ca2+交联β-胡萝卜素乳液水凝胶微粒的微观结构
β-胡萝卜素乳液水凝胶微粒微观结构采用激光共聚焦显微镜观察。其中蛋白相(尼罗蓝A染色)呈现绿色,油相(尼罗红染色)呈现红色,两相重叠呈现黄色。图2显示,在β-胡萝卜素乳液共聚焦图中,油滴布满了整个图像,隐约可观察到一个个的小颗粒。这是由于乳液的粒径太小,已经接近激光共聚焦的最低的分辨率,其他研究者也遇到类似的问题[24]。而在β-胡萝卜素乳液水凝胶微粒的共聚焦图中,可清晰地看到比较大的颗粒,呈不规则球形状,并且油相(红色)和蛋白相(绿色)都出现在水凝胶微粒里面。这表明水凝胶微粒成功地包埋住了乳液油滴,这与其单峰粒径分布图符合。
从图2还可以发现,FHP-0、FHP-1、FHP-2及FHP-4的粒子大小和形状无明显不同,但是随着Ca2+浓度的增加,可明显看到图像中所能观察到的粒子数目越多。这些现象与表1的粒径分布相符合,进一步说明Ca2+的加入会促进水凝胶微粒的形成。
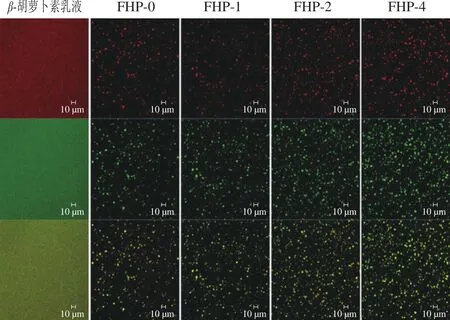
图2 β-胡萝卜素乳液及水凝胶微粒的共聚焦图Fig. 2 Confocal photomicrograph of β-carotene-loaded emulsion and hydrogel microparticles
2.4 Ca2+交联β-胡萝卜素乳液水凝胶微粒的流变性质
根据流变曲线形状,可以将流体分为牛顿流体和非牛顿流体两类[25]。非牛顿流体的黏度不仅受温度的影响,还受到剪切速率和剪切应力的影响,又可分为塑性流体、假塑性流体及膨胀型流体等主要类型。由图3可以看出,乳液的黏度随着剪切速度的增加呈现先下降后略微上升的趋势,总体呈现下降趋势,而水凝胶微粒的黏度随着剪切速率的增加而下降。乳液及水凝胶微粒均发生了剪切变稀现象,属于假塑性流体。水凝胶微粒的黏度高于乳液的黏度,且随着Ca2+浓度的增加而增加。随着Ca2+浓度的增加,Ca2+在海藻酸钠分子间建立的桥联越多,溶液的凝胶强度会增加,即黏度会增加。将β-胡萝卜素乳液及水凝胶微粒(FHP-0、FHP-1、FHP-2、FHP-4)样品瓶倒置(图4),可以看到溶液挂壁现象逐渐明显,FHP-4已经明显变成凝胶状态,倒置时不会下流。加入Ca2+交联水凝胶微粒不仅会促进水凝胶微粒的形成,同时也会导致水凝胶微粒形成凝胶。

图3 β-胡萝卜素乳液及水凝胶微粒的剪切速率-黏度曲线Fig. 3 Shear rate viscosity curves of β-carotene-loaded emulsion and hydrogel microparticles

图4 β-胡萝卜素乳液及水凝胶微粒的外观图Fig. 4 Appearance of β-carotene-loaded emulsion and hydrogel microparticles
2.5 Ca2+交联β-胡萝卜素乳液水凝胶微粒的离心稳定性
将乳液及水凝胶微粒在一定转速下离心一段时间可以加速乳液的分层,故离心稳定性可以用来判定样品自然静置长时间后的状态变化。乳液型运载体系维持其物理稳定的能力不仅取决于油相和水相的密度差,同时取决于油水相之间界面膜的稳定性[26]。由图5可以看出,β-胡萝卜素乳液的离心稳定性常数较β-胡萝卜素乳液水凝胶微粒(FHP-0)低,说明乳液具有更佳的离心稳定性。在β-胡萝卜素乳液水凝胶微粒(FHP-0)中,油相和水相的密度差更大,在外界离心力的作用下更易分层。但是随着Ca2+浓度的增加,水凝胶微粒的离心稳定性常数变小,趋向稳定。其中,FHP-1的离心稳定性和乳液不相上下,而FHP-2及FHP-4的离心稳定性均优于乳液。这表明,Ca2+交联β-胡萝卜素乳液水凝胶微粒,能够降低油水相间的界面张力,提高界面膜稳定性。
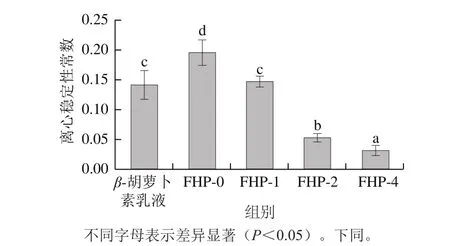
图5 β-胡萝卜素乳液及水凝胶微粒的离心稳定性Fig. 5 Centrifugal stability of β-carotene-loaded emulsion and hydrogel microparticles
2.6 Ca2+交联β-胡萝卜素乳液水凝胶微粒的pH值稳定性

图6 β-胡萝卜素乳液及水凝胶微粒在不同pH值的外观图Fig. 6 Appearance of β-carotene-loaded emulsion and hydrogel microparticles at different pH values
由图6可以看出,β-胡萝卜素乳液在pH 5.5~7时外观均一稳定,而在pH 3~5时发生了严重的分层现象,说明pH值对β-胡萝卜素乳液的稳定性有较大影响,β-胡萝卜素乳液在酸性pH值下极其不稳定。同时,结合β-胡萝卜素乳液在不同pH值下的粒径(图7)可以看出,乳液在pH 5.5~7时粒径都较小,集中在0.476 μm左右,而在pH 3~5时显著增大(大于20 μm),进一步说明了β-胡萝卜素乳液的稳定性对pH值的依赖性。这主要是因为乳液油滴在酪蛋白等电点附近时带的电荷量较少,难以形成静电排斥力导致乳液油滴发生聚集现象[27]。
水凝胶微粒在pH 3~7时外观都均一稳定,只有FHP-2和FHP-4在pH 3时发生了略微的分层现象(图6),说明pH值对β-胡萝卜素乳液水凝胶微粒的稳定性影响很小,β-胡萝卜素乳液水凝胶微粒在pH 3~7的范围内都较稳定。从图7可以发现,β-胡萝卜素乳液水凝胶微粒的粒径在pH 4~5.5的范围内不变,而在pH 3~3.5时略微的增大,在pH 6~7时有变小的趋势。其中,水凝胶微粒的粒径的增大(pH 3~3.5),这是因为在该pH值范围内,海藻酸钠带微弱负电而乳液油滴带正电,由于弱静电吸引作用导致水凝胶微粒发生溶胀现象,并且Ca2+的加入会促进水凝胶微粒的溶胀。pH 6~7时,水凝胶微粒的粒径减小,这是因为在此pH值范围内,海藻酸钠和乳液油滴同时带负电荷,由于静电排斥力导致出现水凝胶微粒分解释放出乳液油滴的现象,且Ca2+的加入会延缓水凝胶微粒的分解。由此可见,水凝胶微粒能够适应的pH值范围更宽泛,较乳液而言,水凝胶微粒能在pH 3~7能够保持相对稳定的状态。

图7 β-胡萝卜素乳液及水凝胶微粒在不同pH值条件下的粒径Fig. 7 Mean particle diameters (d32) of β-carotene-loaded emulsion and hydrogel microparticles at different pH values
2.7 Ca2+交联β-胡萝卜素乳液水凝胶微粒的离子稳定性
如图8所示,β-胡萝卜素乳液在NaCl浓度0~4 mol/L时,外观都均一稳定。结合图9,随着盐浓度的增加,β-胡萝卜素乳液的粒径无较大变化,可见β-胡萝卜素乳液的稳定性不依赖于离子浓度。然而有不少研究发现其所制备酪蛋白乳液的离子稳定性较差,在高盐浓度下会出现失稳分层现象[28-29]。这种现象差异主要是由于酪蛋白是一种全价含磷蛋白质,主要由αS1-、αS2-、β-、κ-酪蛋白这4 种类型蛋白组成,且其盐的稳定性主要受到αS1-酪蛋白及β-酪蛋白比例的影响,此外还会受到酪蛋白浓度的影响[30-32]。
由图8可以看出,FHP-0和FHP-1在NaCl浓度为3 mol/L和4 mol/L时均发生分层现象,其余浓度下都均一稳定。结合粒径图(图9),可发现FHP-0和FHP-1的粒径在NaCl浓度增加到2 mol/L时会有所增大,并随着NaCl浓度的增加而增大,而FHP-2和FHP-4的粒径一直维持不变。不同浓度的NaCl会产生不同的静电屏蔽效应,影响蛋白和多糖之间的静电相互作用[33]。Ca2+交联浓度为0~2 mmol/L时,水凝胶微粒在NaCl浓度高于2 mol/L时,受到静电屏蔽的作用而发生解离,因此发生分层现象。而当Ca2+交联浓度为2~4 mmol/L,水凝胶微粒可以在不同的NaCl浓度下一直保持稳定,并没有在高离子强度时发生解离,表明Ca2+的增加会加强蛋白和多糖之间的作用力,能提高水凝胶微粒的离子稳定性。

图8 β-胡萝卜素乳液及水凝胶微粒在不同盐浓度的外观图Fig. 8 Appearance of β-carotene-loaded emulsion and hydrogel microparticles at different salt concentrations
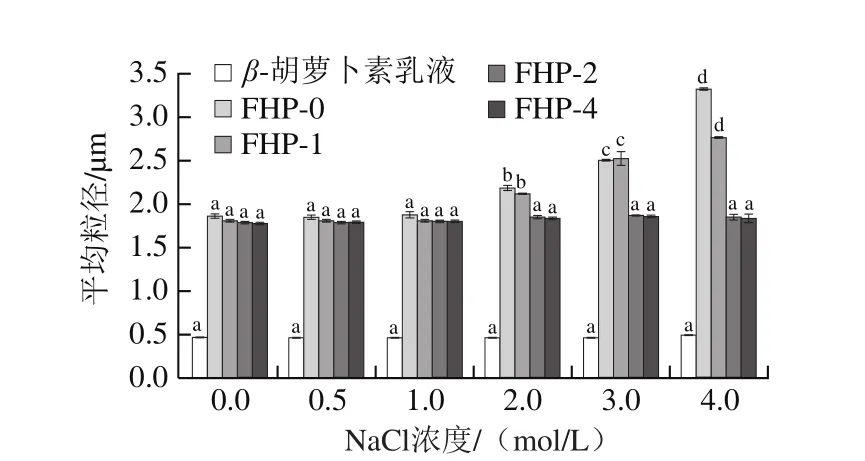
图9 β-胡萝卜素乳液及水凝胶微粒在不同盐浓度下的粒径Fig. 9 Mean particle diameters (d32) of β-carotene-loaded emulsion and hydrogel microparticles at different salt concentrations
2.8 Ca2+交联β-胡萝卜素乳液水凝胶微粒的贮藏稳定性
本研究测定在两个不同的贮藏温度(25 ℃和37 ℃)下β-胡萝卜素的保留率,结果如图10所示。由图10可知,于25 ℃贮藏第42天时,乳液中β-胡萝卜素的保留率约为2%,而水凝胶微粒中β-胡萝卜素的保留率达30%以上;于37 ℃贮藏第24天时,乳液中β-胡萝卜素基本全部被降解,而水凝胶微粒中β-胡萝卜素仍达25%以上。且水凝胶微粒经Ca2+交联后,对水凝胶微粒中β-胡萝卜素的保护效果有略微的提高作用。
据报道,β-胡萝卜素在酸性环境中更易降解[34-35]。因此,水凝胶微粒(pH 4.5)中的β-胡萝卜素比乳液(pH 7.0)有更高的保留率,可认为并非因环境pH值差异而导致的。在水凝胶微粒中,β-胡萝卜素乳液油滴是被由酪蛋白和海藻酸钠组成的三维网状结构给包围着,可阻碍氧、氧化剂、自由基的渗入,从而降低了β-胡萝卜素的降解率[30]。酪蛋白是一种具有抗氧化作用的蛋白,它能够清除自由基和螯合重金属[36]。而在水凝胶微粒结构中,β-胡萝卜素乳液油滴是被酪蛋白酸钠分子簇拥着,也就是β-胡萝卜素处在更高抗氧化剂浓度的环境中。研究表明,胡萝卜素的氧化降解反应是一个界面反应,界面面积越小,则反应速率越慢[37]。相对于乳液而言,拥有较大粒径的水凝胶微粒,其界面表面积更小,因而在相同的贮藏过程下,水凝胶微粒有较高的β-胡萝卜素保留率。综上所述,水凝胶微粒对β-胡萝卜素的保护效果更好。而用Ca2+交联水凝胶微粒,不仅可以促进水凝胶微粒的形成,还可以提高溶液的黏度,随着溶液黏度的增加,可以进一步减少氧化剂的摄入,从而进一步提高对β-胡萝卜素的保护。

图10 25 ℃(A)和37 ℃(B)贮藏过程中乳液及水凝胶微粒中β-胡萝卜素的保留率Fig. 10 Retention of β-carotene in emulsion and hydrogel microparticles during storage at 25 ℃ (A) and 37 ℃ (B)
3 结 论
本研究通过乳化法得到了以酪蛋白为原料、粒径约为0.476 μm的β-胡萝卜素乳液,并加入一定比例的海藻酸钠,再调节溶液的pH值,采用静电凝聚法成功构建了粒径约为1.87 μm的β-胡萝卜素乳液水凝胶微粒,最后加入浓度分别为0、1、2、4 mmol/L的Ca2+交联水凝胶微粒。并考察了钙交联对β-胡萝卜素乳液及水凝胶微粒基本性质及稳定性(离心稳定性、pH值稳定性、离子稳定性、贮藏稳定性)的影响。经Ca2+交联后的水凝胶微粒粒径有略微变小的趋势,电位有略微变大的趋势,对β-胡萝卜素的包埋率较乳液大;从微观结构分析表明,加入Ca2+后的水凝胶微粒的大小无明显变化,但是随着Ca2+的增加,水凝胶微粒离子的数目增加,说明Ca2+的加入有促进水凝胶形成的作用;β-胡萝卜素乳液及β-胡萝卜素乳液水凝胶微粒均属于剪切变稀的假塑性流体,随着Ca2+的增加,水凝胶微粒的黏度增加,凝胶强度增加;未经Ca2+交联的β-胡萝卜素乳液水凝胶微粒的离心稳定性比乳液差,但是Ca2+交联后,水凝胶微粒的离心稳定性得到提高,甚至优于乳液;β-胡萝卜素乳液会在pH 3~5发生分层现象,而β-胡萝卜素乳液水凝胶微粒在pH 3~7之间都相对较稳定,Ca2+的加入会促进水凝胶微粒的溶胀,且延缓水凝胶微粒的分解;β-胡萝卜素乳液可以在高NaCl浓度下一直保持稳定,Ca2+交联浓度为0~2 mmol/L的β-胡萝卜素乳液水凝胶微粒在高NaCl浓度(2 mol/L以上)时会分层现象,但是Ca2+交联浓度为2~4 mmol/L的β-胡萝卜素乳液水凝胶微粒可以在不同NaCl浓度下一直保持稳定;在贮藏稳定性实验中,测得水凝胶微粒中β-胡萝卜素的保留率更高,而经Ca2+交联后,可以进一步提高对β-胡萝卜素的保护。

