不同来源红曲米多酚类化合物和抗氧化活性的聚类分析
胡均亮,陆方菊,陈功,田霄飞,吴振强*
(华南理工大学生物科学与工程学院,广东广州510006)
不同来源红曲米多酚类化合物和抗氧化活性的聚类分析
胡均亮,陆方菊,陈功,田霄飞,吴振强*
(华南理工大学生物科学与工程学院,广东广州510006)
为了研究不同红曲米样品抗氧化性差异,考察了10种红曲米样品中总多酚和总黄酮含量与DPPH、ABTS自由基清除力,并进一步分析了多酚类化合物的种类和含量。结果表明,红曲米总多酚和总黄酮含量与其DPPH和ABTS自由基清除力呈显著的正相关性(P<0.01);其中广东红曲的总多酚、总黄酮含量和抗氧化性的指标最高,其次为福建红曲,浙江红曲最低。同时多酚类化合物的种类及含量在不同的红曲米样品间差异较大,以多酚类化合物种类和含量作为区分依据,10种红曲米样品被分为4组,呈现产地聚集。表明红曲米样品中多酚类化合物的种类和含量受产地来源的影响较大。
红曲米;多酚类化合物;抗氧化活性;相关性分析;聚类分析
红曲米是以大米作为主要原料,由红曲霉菌发酵而成的紫红色米曲,也称丹曲。红曲米作为一种传统发酵食品,在福建、浙江一带深受当地人民欢迎。红曲米应用广泛,不仅可以酿造红曲酒、烹饪饮食、发酵食品[1-2],同时具有降低胆固醇和防止心血管疾病的活性物质。目前研究表明,红曲菌的次级代谢产物,包括莫纳克林K、色素、γ-氨基丁酸和二聚酸等,具有降血脂、治疗阿兹海默症、防止肥胖、调节血压、防止氧化损伤和抗癌等功效[3]。
研究发现,通过红曲菌(安卡红曲霉(Monascus anka)和紫红曲霉(Monascus purpureus)等)固态发酵谷物、高粱和玉米等农副产品,可以促进酚类物质释放与转化,明显提高农副产品的抗氧化性等功能性价值。ANIYA Y等[4-5]研究发现,红曲提取液中的二聚酸(dimeric acid)是1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基抗氧化活性和红曲保肝作用的主要物质。YANG J H等[6]比较了经过红曲发酵的精米和除壳大米产品与未发酵原料的抗氧化特性,发现红曲发酵大米的还原能力、金属螯合能力、铁离子清除能力和酚类物质含量均高于未发酵大米;PYO Y H等[7]研究发现,红曲谷物发酵提取液不仅能够降低血脂浓度和脂质过氧化作用,还可以提高抗氧化物α-生育酚(α-tocopherol)和辅酶Q(coenzyme Q,CoQ)的水平;HUANG C S等[8]通过紫红曲霉发酵金门高粱酒糟,发现使用100 μg/mL的发酵液处理M.purpureusCWT715可以减少61%的脱氧核糖核酸(deoxyribonucleic acid,DNA)损伤和51%的脂质过氧化作用,表现出抗氧化功能性产品的开发潜力;KONGBANGKERD T等[9]开发了两步法红曲发酵糯玉米的方法,相比于传统工艺,新方法的DPPH、亚铁还原能力(ferric reducing antioxidant power,FRAP)和Fe2+清除能力的半抑制浓度(halfmaximalinhibitoryconcentration,IC50)下降了50%;ABD R D L等[10]利用紫红曲霉和少孢根霉发酵米糠,发现生物发酵能够明显提高米糠的抗氧化性和多酚类物质的含量。
本研究对不同地区和种类红曲米多酚类化合物的种类和含量、抗氧化活性的差异进行了相关性分析和聚类分析。旨在探索不同地区在菌种、原料和制作工艺等差异对红曲米品质的影响,以期为探讨建立高抗氧化活性的红曲米样品的标准生产工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
市售红曲米样品:当地农副产品市场,室温条件下保存于干燥处。红曲米样品信息详见表1。

表1 红曲米样品的产地、种类及干物质含量Table 1 Origins,varieties and dry matter contents of red kojic rice samples
福林酚(分析纯):广州市齐云生物技术有限公司;DPPH、维生素C(vitaminC,VC)(分析纯):上海阿拉丁生化科技股份有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS)(色谱纯):西格玛奥德里奇(上海)贸易有限公司;没食子酸、绿原酸、对羟基苯甲酸、香草酸、香豆酸、芦丁、芥子酸、反式肉桂酸、阿魏酸、山奈酚和槲皮素(均为色谱纯):上海阿拉丁生化科技股份有限公司;咖啡酸(分析纯):上海麦克林生化科技有限公司。
1.2 仪器与设备
SpectraMax M5多功能酶标仪:美国Thermo Fisher Scientific公司;UV-2802S型紫外可见分光光度计:上海尤尼柯仪器有限公司;e2695HPLC-2998PDA高效液相色谱(highperformanceliquidchromatography,HPLC)仪、SunFire C18色谱柱(250 mm×4.6 mm,5 μm):美国Waters公司;DHG-9070B恒温鼓风干燥箱:上海申贤恒温设备厂;BJ-400A多功能粉碎机:德清拜杰电器有限公司。
1.3 方法
1.3.1 红曲米样品干物质含量测定
红曲米样品经多功能粉碎机粉碎后过40目筛网。称取0.5~0.6 g红曲米粉于称量瓶中,置于105℃恒温鼓风干燥箱中8~12 h并在干燥皿中冷却。红曲米样品干物质含量计算公式为:

式中:W为红曲米样品的干物质含量,%;m1是称量瓶的质量,g;m2是称量瓶的质量和未干燥样品的质量之和,g;m3是称量瓶的质量与干燥后样品的质量之和,g。
1.3.2 红曲米样品提取物制备
精确称取1.00 g干燥的红曲米粉于100 mL具塞试管中,加入25 mL体积分数为80%的甲醇溶液混匀,在25℃条件下超声(40W)提取30min。每个样品提取两次,合并提取液后使用定性滤纸(直径12.5 cm)过滤。滤液储藏于4℃冰箱备用。
1.3.3 红曲米样品提取液中总多酚和总黄酮含量测定
提取液中总多酚含量的测定采用福林酚法[11]:取0.1mL提取液或没食子酸标准液(质量浓度梯度为0、0.01mg/mL、0.02 mg/mL、0.04 mg/mL、0.06 mg/mL和0.08 mg/mL),加入0.05 mL福林酚试剂混匀,室温条件下反应3~8 min,加入0.15mL质量分数为20%的Na2CO3溶液,再加入0.7 mL蒸馏水定容至1 mL,反应60 min,在波长765 nm处测定吸光度值(OD765nm)。总多酚的含量以没食子酸(mg/mL)表示,以总多酚含量(x)为横坐标,吸光度值OD765nm(y)为纵坐标,绘制总多酚溶液标准曲线为y=5.707 4x+0.009 9(相关系数R2=0.999)。样品中总多酚含量计算公式为:

式中:A1为反应液的总多酚含量,mg/mL;N为红曲米样品提取液的稀释倍数;25是提取溶剂体积,mL;m为红曲米样品的质量,g;W为红曲米样品的干物质含量,%。
总黄酮含量的测定参照DEWANTO V等[12]方法,取0.1mL提取液(或芦丁标准液)(质量浓度梯度0、0.04mg/mL、0.08 mg/mL、0.12 mg/mL、0.16 mg/mL、0.20 mg/mL),加入0.5 mL蒸馏水和0.03 mL NaNO2(5%,W/W)溶液混匀,反应6 min,加入0.06 mL 10%AlCl3溶液,室温反应5 min,加入0.2 mL 1 mol/L的NaOH溶液,再加入0.11 mL蒸馏水定容至1 mL,于波长510 nm处测定吸光度值。总黄酮的含量以芦丁(mg/mL)表示,以总黄酮含量(x)为横坐标,吸光度值OD510nm(y)为纵坐标,绘制总黄酮溶液标准曲线为y=0.5829x+ 0.002 4(相关系数R2=0.996 5)。样品中总黄酮含量计算公式为:

式中:A1为反应液的总黄酮含量,mg/mL;N为红曲米样品提取液的稀释倍数;25为提取溶剂的体积,mL;m为红曲米样品的质量,g;W为红曲米样品的干物质含量,%。
1.3.4 红曲米样品提取液DPPH和ABTS自由基清除力的测定
DPPH自由基清除力的测定按照LI H等[13]报道的方法:取0.1 mL提取液(或VC标准液)(质量浓度梯度为0、0.01mg/mL、0.02mg/mL、0.03mg/mL、0.04mg/mL、0.05mg/mL和0.06 mg/mL)加入3.9 mL DPPH甲醇溶液(6×10-5mol/L),混匀后在暗光下反应30 min,于波长515 nm处测定吸光度值。DPPH自由基清除力以VC当量(mg/mL)表示。DPPH自由基清除率的计算公式如下:

式中:A0为0.1 mL提取液(或VC标准液)+3.9 mL DPPH溶液的吸光度值;A1为0.1 mL提取液(或VC标准液)+3.9 mL甲醇溶液的吸光度值;A2为0.1 mL体积分数80%甲醇溶液+3.9 mL DPPH溶液的吸光度值。
ABTS自由基清除力的测定按照LI H等[13]报道的方法:将10mLABTS溶液(7mmol/L)和过硫酸钾溶液(2.45mmol/L)按等体积1∶1混合,室温暗光下静置12~16h。用乙醇稀释至OD732nm=0.700±0.020备用。取0.1 mL提取液(或VC标准液)(质量浓度梯度为0、0.005mg/mL、0.01mg/mL、0.02mg/mL、0.03 mg/mL、0.04 mg/mL和0.05 mg/mL)加入3.9 mL ABTS稀释液,混匀后室温反应6 min,于波长732 nm处测定吸光度值。ABTS自由基清除力以VC当量(mg/mL)表示。ABTS自由基清除率的计算公式如下:

式中:A0是0.1 mL提取液(或VC标准液)+3.9 mLABTS稀释液的吸光度值,A1是0.1 mL 80%甲醇溶液+3.9 mL ABTS稀释液的吸光度值。
1.3.5 红曲米样品各种多酚类化合物的测定
多酚类化合物含量的测定在ROGGERO J P等[14]方法的基础上进行了优化。HPLC检测条件为:柱温箱温度为30℃;流动相A为0.005 mol/L磷酸缓冲液(pH 2.5),流动相B为纯乙腈;梯度洗脱程序为:0~35 min(85%A+15%B),35~36 min(50%A+50%B),36~40 min(20%A+80%B),40~41 min(20%A+80%B),41~46 min(85%A+15%B),流速为0.8 mL/min。紫外检测器扫描波长为210~400 nm,提取波长280 nm。
1.3.6 相关性分析和聚类分析
使用IBM SPSS V22.0软件对实验数据进行相关性分析和聚类分析[15]。
2 结果与分析
2.1 红曲米样品的总多酚和总黄酮含量与抗氧化性分析
10种不同红曲米样品的总多酚和总黄酮含量检测结果见图1。
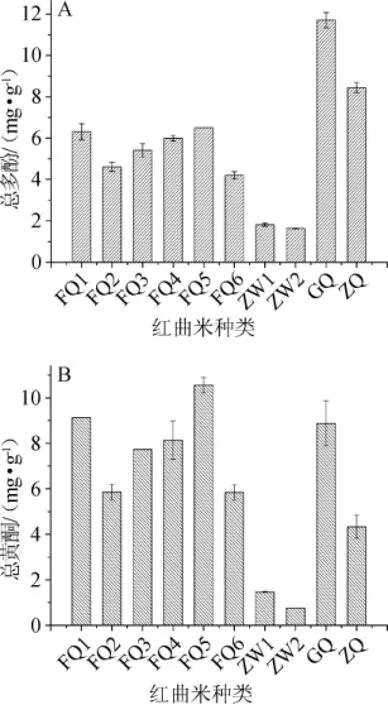
图1 10种红曲米样品的总多酚(A)和总黄酮含量(B)Fig.1 Contents of total polyphenols(A)and flavonoids(B)in 10 red kojic rice samples
由图1可知,福建地区的6种红曲米样品总多酚含量基本接近,在4.2~6.5 mg/g之间,而浙江地区的2种乌衣红曲米样品总多酚含量相对较低。红曲米样品GQ、ZQ的总多酚含量最高,分别为11.713 mg/g和8.439 mg/g。在总黄酮含量上,红曲米样品FQ5、FQ1总黄酮含量最高,分别为10.563 mg/g和9.120 mg/g。红曲米样品ZW1、ZW2总黄酮含量最低。说明相同地区相同种类红曲米样品的总多酚含量相近,不同地区间的红曲米和同地区不同种类的红曲米在总多酚、总黄酮含量上明显不同(P<0.05)。
考察10种不同红曲米样品的DPPH和ABTS自由基清除力,结果见图2。
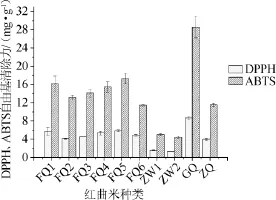
图2 10种红曲米样品的DPPH和ABTS自由基清除力Fig.2 DPPH and ABTS free radical scavenging ability of 10 red kojic rice samples
由图2可知,不同地区和种类的红曲米样品具有不同的DPPH和ABTS自由基清除力。福建地区的6种红曲米样品DPPH自由基清除力相近,在4.1~5.8 mg/g之间;来自浙江地区乌衣红曲米样品ZW1、ZW2的DPPH自由基清除力相对较低,分别为1.547 mg/g和1.338 mg/g,而浙江地区红曲米样品ZQ的DPPH自由基清除力为3.997 mg/g。红曲米样品GQ的DPPH自由基清除力最高,为8.711 mg/g。ABTS自由基清除力的结果表明,福建地区的5种红曲米样品FQ1~FQ5的清除能力相差不大,在13.1~17.3 mg/g的范围内。红曲米样品FQ6和ZQ的ABTS自由基清除力差不多,分别为11.452 mg/g和11.531 mg/g。浙江乌衣红曲米样品ZW1/ZW2的清除能力相对较弱,为5.004mg/g和4.474mg/g。红曲米样品GQ的ABTS自由基清除力最大,为28.607mg/g。
2.2 总多酚和总黄酮含量与DPPH、ABTS自由基清除力的相关性分析
总多酚含量、总黄酮含量以及DPPH、ABTS自由基清除力的相关性分析结果见表2。

表2 总多酚和总黄酮含量与DPPH和ABTS自由基清除力的相关性分析Table2Correlationanalysisoftotalpolyphenolsandflavonoidscontents and DPPH and ABTS free radical scavenging ability
由表2可知,红曲米的DPPH和ABTS自由基清除力与总多酚含量相关系数分别为0.918和0.943,与总黄酮含量的相关系数分别为0.957、0.944。说明红曲米样品的抗氧化能力与总多酚和总黄酮含量呈极显著正相关(P<0.01)。
2.3 红曲米样品多酚类化合物的种类和含量
采用HPLC法对10种红曲米样品提取物和多酚类化合物标准品(12种常见的化合物)进行分析,结果见图3。通过与标准品的对照,本研究对红曲米样品中主要的多酚类化合物进行了定性和定量的研究,结果如表3所示。

图3 红曲米样品中多酚类化合物及多酚类化合物标准品的HPLC色谱图Fig.3 HPLC chromatograms of polyphenol compounds of red kojic rice samples and the polyphenol compounds standards

表3 10种红曲米样品中多酚类化合物的含量Table 3 Contents of polyphenol compounds in 10 red kojic rice samples mg/kg
由图3和表3可知,10种红曲米提取液中多酚类化合物均得到了较好地分离。红曲米样品FQ1~FQ5中均含有12种多酚类化合物,样品FQ6含有10种多酚类化合物;样品ZQ和GQ中含有11种多酚类化合物,样品ZW1和ZW2中分别含有10和8种多酚类化合物。说明不同地区和种类的红曲米样品含有不同种类的多酚类化合物。
由检测结果可知,不同地区的红曲米样品在主要多酚类化合物的种类和含量上不同,福建红曲米样品FQ1~FQ5主要多酚类化合物为没食子酸、绿原酸,含量分别为208.31~327.20 mg/kg、145.52~241.57 mg/kg。浙江乌衣红曲米样品ZW1和ZW2主要多酚类化合物为没食子酸、芦丁和香草酸,和福建地区红曲米样品主要多酚类化合物明显不同,含量上也不一样。而广东红曲米样品GQ的主要多酚类化合物为没食子酸、芥子酸,含量分别为128.86mg/kg、109.12 mg/kg,相对于福建地区和浙江地区红曲米样品,在主要多酚类化合物的种类和含量上也表现出差异性。同时相对于浙江乌衣红曲米样品ZW1和ZW2,浙江红曲米样品ZQ的主要多酚类化合物为没食子酸,含量为361.69 mg/kg。说明相同地区不同种类红曲米样品在主要多酚类物质的种类和含量上也存在明显差异。
2.4 红曲米样品的聚类分析
在红曲米样品多酚类化合物的种类和含量研究结果的基础上,对10种不同来源的红曲米样品分别进行了聚类分析,结果如图4所示。
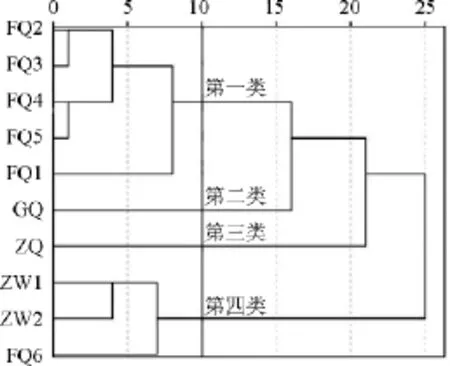
图4 10种红曲米样品的聚类分析结果Fig.4 Results of cluster analysis in 10 red kojic rice samples
由图4可知,红曲米样品被大致归为4类,分别为:第一类FQ1~FQ5,第二类GQ,第三类ZQ,第四类ZW1、ZW2和FQ6。由聚类结果分析可知,福建红曲、广东红曲、浙江红曲被分为三类,浙江红曲和浙江乌衣红曲被分为两类,说明不同的产地和种类是影响红曲米多酚类化合物种类和含量不同的因素。
3 结论
本研究通过对不同地区来源的红曲米样品的总多酚、总黄酮含量和体外抗氧化能力进行测定和比较。结果表明,广东红曲米样品中总多酚、总黄酮含量及抗氧化能力均较高,其次为福建红曲。不同地区和种类的红曲米样品具有不同的DPPH和ABTS自由基清除力,红曲米样品中总多酚和总黄酮含量与抗氧化性指标DPPH和ABTS自由基清除力表现出显著的相关性。不同地区和种类的红曲米样品含有不同种类的多酚类化合物,而且不同地区和相同地区不同种类红曲米样品在主要多酚类化合物的种类和含量上也有一定的差异。福建红曲米样品多酚类化合物的种类最多,广东红曲米样品的总多酚含量相对最高。而浙江两种乌衣红曲米样品多酚类化合物含量最少,仅为广东红曲米样品的13.92%和15.54%。同时聚类分析发现,红曲米样品按照不同地区和不同种类可以被分为4类,说明红曲米样品中多酚类化合物的种类和含量受产地来源影响较大。
[1]王荣荣,王家东,方玲.新型红曲米南瓜发酵酸奶的研制[J].中国酿造,2009,28(10):168-170.
[2]肖昌贵,刘志彬,张雯,等.响应面法优化红曲酸奶的发酵工艺[J].中国酿造,2014,33(4):145-149.
[3]BATT C A,ROBINSON R K.Encyclopedia of food microbiology(second edition)[M].Oxford:Academic Press,2014:815-825.
[4]ANIYA Y,YOKOMAKURA T,YONAMINE M,et al.Screening of antioxidant action of various molds and protection ofMonascus anka against experimentally induced liver injuries of rats[J].Gen Pharmacol, 1999,32(2):225-231.
[5]TAIRA J,MIYAGI C,ANIYA Y.Dimerumic acid as an antioxidant from the mold,Monascus anka:the inhibition mechanisms against lipid peroxidation and hemeprotein-mediated oxidation[J].Biochem Pharmacol, 2002,63(5):1019-1026.
[6]YANG J H,TSENG Y H,LEE Y L,et al.Antioxidant properties of methanolic extracts from monascal rice[J].LWT-Food Sci Tech,2006, 39(7):740-747.
[7]PYO Y H,SEONG K S.Effects of Monascus-fermented grain extracts on plasma antioxidant status and tissue levels of ubiquinones and alpha-tocopherol in hyperlipidemic rats[J].Food Chem,2013,141(1):428-435.
[8]HUANG C S,HU H H,TSAI Y M,et al.In vitroeffects of Monascus purpureus on antioxidation activity during fermentation of Kinmen sorghum liquor waste[J].J Biosci Bioeng,2013,115(4):418-423.
[9]KONGBANGKERD T,TOCHAMPA W,CHATDAMRONG W,et al. Enhancement of antioxidant activity of monascal waxy corn by a 2-step fermentation[J].Int J Food Sci Tech,2014,49(7):1707-1714.
[10]ABD R D L,ABD RASHID NY,JAMALUDDIN A,et al.Enhancement of phenolic acid content and antioxidant activity of rice bran fermented withRhizopus oligosporusandMonascus purpureus[J].Biocatal Agr Biotechnol,2015,4(1):33-38.
[11]WANG X,XIE K,ZHUANG H,et al.Volatile flavor compounds,total polyphenolic contents and antioxidant activities of a China gingko wine [J].Food Chem,2015,182:41-46.
[12]DEWANTO V,WU X,ADOM K K,et al.Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity [J].J Agr Food Chem,2002,50(10):3010-3014.
[13]LI H,WANG X,LI Y,et al.Polyphenolic compounds and antioxidant properties of selected China wines[J].Food Chem,2009,112(2):454-460.
[14]ROGGERO J P,COEN S,ARCHIER P.Wine phenolics:Optimization of HPLC analysis[J].J Liq Chromatogr,1990,13(13):2593-2603.
[15]MORENO-ARRIBAS M V,POLO M C.Wine chemistry and biochemistry[M].New York:Springer Press,2009:688-706.
Cluster analysis of polyphenol compounds and antioxidant activity of red kojic rice from different producing areas
HU Junliang,LU Fangju,CHEN Gong,TIAN Xiaofei,WU Zhenqiang*
(School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China)
In order to research the difference of antioxidant activity of red kojic rice simples from different producing areas,the contents of total polyphenols and flavonoids and the scavenging ability of DPPH and ABTS free radical in 10 red kojic rice simples were investigated,the varieties and contents of polyphenol compounds were further analyzed.The results showed that the total polyphenols and total flavonoids contents in red kojic rice had significant positive correlation with DPPH and ABTS free radical scavenging ability(P<0.01).Total polyphenols,total flavonoids content and antioxidant activity indexes in red kojic rice produced from Guangdong were the highest,followed by red kojic rice from Fujian and the lowest was the red kojic rice from Zhejiang.The differences of varieties and contents of polyphenol compounds between the different red kojic rice samples were greater.Using the varieties and contents of polyphenol compounds as distinguish basis,10 red kojic rice samples were divided into four groups and presented origin gather,which indicated that varieties and contents of polyphenol compounds in red kojic rice samples varied replying on their origin.
red kojic rice;polyphenolic compounds;antioxidant activity;correlation analysis;cluster analysis
TS202.1
0254-5071(2017)03-0039-05
10.11882/j.issn.0254-5071.2017.03.009
2016-11-27
国家自然科学基金(31271925);广东省教育部产学研结合项目(2013B090600015);广州市科技计划项目(2014J4100192)
胡均亮(1990-),男,硕士研究生,研究方向为红曲酒发酵和功能性物质分析。
*通讯作者:吴振强(1963-),男,教授,博士,研究方向为发酵工程、生物工程、生物化工、生态环境,大健康产业领域理论与应用。

