1株阿魏酸酯酶产生菌的筛选鉴定及发酵条件优化
曹 艳, 夏其乐, 陈剑兵, 陆胜民
(浙江省农业科学院食品科学研究所 农业农村部果品采后处理重点实验室浙江省果蔬保鲜与加工技术研究重点实验室, 浙江 杭州 310021)
阿魏酸是植物界普遍存在的一种酚酸,化学名称为4-羟基-3-甲氧基肉桂酸[1],具有清除自由基、抗血小板聚集的功效,常被用作治疗心脑血管疾病和保护神经等药品的原料[2-4]。此外,阿魏酸还可作为香兰素、愈创木酚等芳香物质的前体[4]。在自然界中只有很少一部分阿魏酸以游离态存在,通过酯键、醚键、缩醛键与纤维素、木质素、蛋白质等大分子物质相连[5-6]。在植物细胞壁结构中,木质素、半纤维素和纤维素之间通过阿魏酸酯键形成交联,从而构成一个坚实的网状结构[2,7]。自然界中,以禾本科植物中的阿魏酸含量最多,如小麦、大麦和玉米等,细胞壁中阿魏酸含量为0.6%~3%[7-8]。阿魏酸酯酶(EC3.1.1.73,ferulic acid esterase,FAE)是一种胞外酶,它能水解阿魏酸甲酯、低聚糖阿魏酸酯和多糖阿魏酸酯中的酯键,有效降解细胞壁致密网状交联结构,将阿魏酸分离出来,同时促进半纤维素、木质素与纤维素的降解[8-10]。能够产生FAE的微生物主要有黑曲霉、链霉菌、杆菌、乳酸菌、假单胞菌等,但绝大多数从真菌中分离得到,尤其是曲霉菌属[11-14]。植物中的酚类物质有游离型和结合型两种,至少有 50%以上为不溶性结合型多酚[15-17],水解阿魏酸的方法主要有化学法、物理法和酶解法,但这些方法存在成本高、会产生大量废水等问题,因此,利用能够产生FAE的菌株发酵植物原料释放阿魏酸成为目前使用最多的方法[16-17]。本研究从浙江绍兴黄酒厂附近的土样中分离到1株产FAE活性较高的菌株,对其进行形态观察,并对分子生物学鉴定、发酵条件优化等方面进行了研究。该菌株可用于提高植物纤维水解率或促进其中阿魏酸的释放,也可作为黄酒生产中的麦曲强化菌提高黄酒中阿魏酸或以阿魏酸为底物的芳香物质的含量,进而开发不同风味或特殊功效的黄酒。
1 材料与方法
1.1 材料
1.1.1 菌株 筛选自浙江绍兴鉴湖附近土样。
1.1.2 培养基[18](g/L) ①筛选培养基:硫酸铵1.3,KH2PO40.37,MgSO4·7H2O 0.25,CaCl2·2H2O 0.07,FeCl30.02,酵母提取物1.0,5 mL阿魏酸乙酯(10%质量与体积比,溶于二甲基甲酰胺),琼脂20,蒸馏水补齐1.0 L,pH 自然,115 ℃灭菌20 min;②种子培养基:马铃薯(PDA)培养基;③发酵培养基:以察氏培养基为基础,NaNO33.0,K2HPO41.0,MgSO4·7H2O 0.5,KCl 0.5,FeSO40.01,蔗糖30.0,琼脂20.0,蒸馏水补齐1.0 L,pH自然,121 ℃灭菌20 min。
1.1.3 主要试剂 葡萄糖、蔗糖、果糖、麦芽糖、甘露糖、尿素、硫酸铵、硝酸铵、硫酸镁、氯化钙、二甲基甲酰胺等均为国产分析纯试剂,国药集团化学试剂有限公司;阿魏酸乙酯(纯度97%),上海源叶生物科技有限公司;蛋白胨、酵母浸提物、马铃薯培养基,OXOID公司。
1.1.4 仪器与设备 立式压力蒸汽灭菌器(YXQ-50A,上海博迅医疗生物仪器股份有限公司),紫外/可见分光光度计(UV-1800,日本岛津公司),电子天平(AL104-IC,梅特勒-托利多(上海)仪器公司),恒温培养箱(DNP-9272,上海精宏实验设备有限公司),旋涡振荡器(HY-2,上海雷磁仪器厂)。
1.2 方法
1.2.1 培养方法[18]称取2.0 g土样,置于20 mL无菌水中,振荡混匀,静置沉降,取菌悬液用无菌水进行梯度稀释,适当稀释后涂布初筛平板,32 ℃培养48~72 h后观察透明圈大小。将透明圈较大的菌落继续分离纯化3次,选择单一菌落用甘油管保存于-80 ℃冰箱,备用。定期测量菌落直径,观察菌落形态、颜色、质地及菌株的孢子形态。
1.2.2 菌体生长量测定 在150 mL三角瓶中装50 mL培养基(含有不同碳源或氮源),用接种环接种1环菌丝体,在设定的温度、100 r/min培养一定时间后,于4 ℃、8 000 r/min离心20 min,去离子水清洗3次,80 ℃烘干至恒重,称重,菌体生长量以菌体干重计,单位为g/100 mL。每个条件设3个平行实验,取3组实验的平均值作为该条件下的菌体生长量。
1.2.3 培养条件优化 以察氏培养基为基础,从蔗糖、葡萄糖、果糖、麦芽糖和甘露糖中选择最适碳源;从蛋白胨、酵母浸提物、尿素、硫酸铵和硝酸铵中选择最适氮源;分别将培养基pH调至4.0、5.0、6.0、7.0和8.0选择菌体生长最适pH。向发酵培养基中添加不同量去淀粉麸皮(discarded starch wheat bran,DSWB)或在发酵的不同时刻添加DSWB,研究DSWB添加量及添加时间对阿魏酸酯酶的诱导作用。发酵条件为30 ℃、200 r/min振荡培养96~120 h,隔12 h取1次样测定菌体量和酶活。
1.2.4 阿魏酸酯酶活性测定[19]取0.5 mL稀释2倍的粗酶液加pH 6.8磷酸缓冲液于离心管中,50 ℃水浴保温10 min。加入DSWB 0.05 g,40 ℃反应60 min,每隔10 min摇匀。沸水浴10 min终止反应,8 000 r/min、4 ℃离心15 min。取0.2 mL离心过的上述反应液加入0.8 mL乙醇于离心管中,8 000 r/min、4 ℃离心15 min后取上清液在320 nm下测定阿魏酸含量。空白组为用沸水浴灭活了5 min的0.5 mL稀释2倍的粗酶液的上述反应体系。阿魏酸酶活性以比酶活计,定义为在测定条件下每分钟产生1 μmol阿魏酸所需要的粗酶量(总蛋白量)为1个酶活力单位(U)。计算公式:
比酶活(mU/mg)=
ε阿魏酸:14 700 L/(mol·cm);V反应体积:1 mL;C样品:样品中蛋白质量浓度,mg/mL;V样品:0.5 mL;反应时间:60 min;d:1 cm。 总蛋白含量采用考马斯亮蓝法测定。
1.2.5 菌种鉴定 ITS/18S rDNA序列测定及分析:委托浙江省微生物研究所进行DNA提取、PCR扩增及序列测定。登陆http://www.ncbi.nlm.nih.gov/使用Blast工具进行同源序列搜索后找到其对应的模式菌株,比较该菌株与模式菌株序列间的碱基同源率。将该菌株的18S rDNA序列与GenBank中微生物序列进行比较,利用MEGA 6.0采用相邻连接方法(Neighbor-Joining)进行分子系统学分析并构建系统发育树。
2 结果与分析
2.1 产阿魏酸酯酶菌株筛选与鉴定
将土样菌悬液稀释后涂布于含有阿魏酸乙酯的筛选培养基上,经过逐级分离纯化,得到12株可产生透明圈的菌株,其中FD-8透明圈最大,其菌落形态和分生孢子梗如图1所示。FD- 8菌落呈圆形,直径10~20 mm,质地疏松丝绒状,中央部分稍现絮状,初期呈白色,渐渐转为暗绿色,最后呈黄褐色,菌落背面灰白色、中间颜色较深。分生孢子梗大多生自基质,壁光滑,顶囊近球形或烧瓶形,分生孢子头呈球形至疏松辐射形,菌落和孢子形态与《真菌鉴定手册》中曲霉属相似[20]。
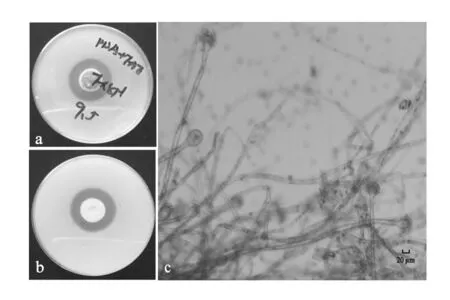
图1 菌株FD-8的菌落和分生孢子梗形态Fig.1 The colony and conidia morphology of strain FD-8a:FD-8菌落正面;b:FD-8菌落背面;c:FD-8分生孢子梗a:the front side of FD-8 colony;b:the back side of FD-8 colony;c:the conidia of FD-8
对菌株FD-8进行ITS/18S rDNA分析、GenBank序列比对,将相似度>80%的种及其DNA序列用MEGA 6.0软件中邻接法构建系统发育树(图2)。从图2中可以看出,菌株FD-8与溜曲霉Aspergillustamarii聚集在一起,结合菌落和孢子形态,鉴定该菌为溜曲霉,命名为AspergillustamariiFD-8。

图2 基于18S rDNA序列同源性构建FD-8的系统发育树Fig.2 Phylogenetic tree of FD-8 based on 18S rDNA sequence homology analysis
2.2 A. tamarii FD-8最适培养条件
2.2.1 温度对A.tamariiFD-8生长和产酶的影响 在察氏培养基中接种A.tamariiFD-8,分别于25、28、30、32、35和37 ℃下培养,最大菌体量和FAE活性如图3所示。从图3中可以看出,菌体量和FAE活性随着温度升高呈先增加后下降的趋势,FD-8最大菌体量在32~35 ℃时相差不大,FAE活性在32 ℃时最大,因此FD-8最适生长温度为32~35 ℃,而最适产酶温度为32 ℃。可能是因为在温度较高条件下,菌体虽然生长较快,但容易老化,菌体活力维持在较高水平的时间较短,因此,A.tamariiFD-8的最适生长和产酶温度为32 ℃。
2.2.2 接种量对A.tamariiFD-8生长及FAE活性的影响 将A.tamariiFD-8在液体察氏培养基中活化后,按体积分数0.5%、1.0%、1.5%、2.0%、2.5%和3.0%将种子培养液接种于发酵培养基中,32 ℃培养120 h,菌体生长曲线和FAE活性变化如图4所示。从图4可以看出,A.tamariiFD-8菌体量在48 h达到最大,之后到达平稳期,96 h开始缓慢下降。FAE活性在前48 h升高较缓慢,48 h后开始迅速升高,到96 h达到最大。由此可以看出,FAE合成属于非生长偶联型,菌体生长稳定后开始合成FAE。随着接种量的增加,最大菌体量和FAE活性持续增加,当接种量超过2.0%后,最大菌体量增加幅度逐渐减小,而当接种量超过2.5%以后,FAE的活性不再增加。因此,为保证菌体生长和FAE合成,A.tamariiFD-8的最适接种量为2.5%,发酵周期为120 h。
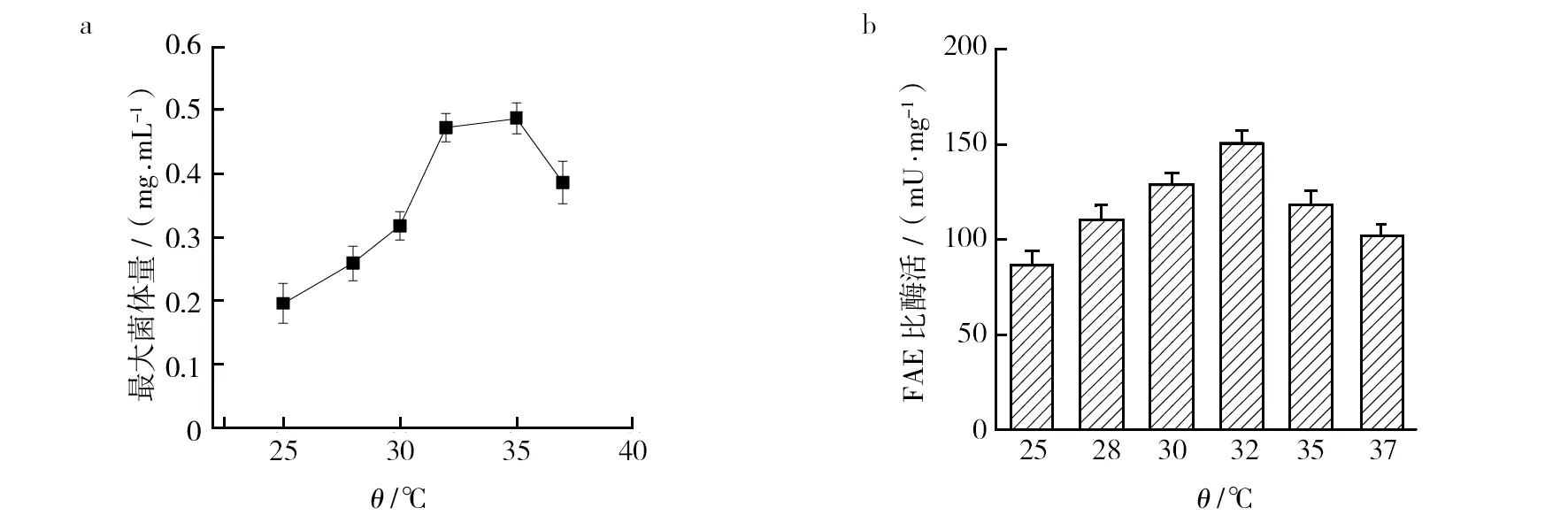
图3 温度对A. tamarii FD-8生长和FAE活性的影响Fig.3 Effect of temperature on growth of A. tamarii FD-8 and FAE activity
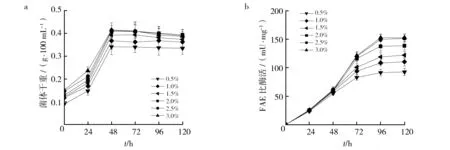
图4 接种量对A. tamarii FD-8生长和FAE活性的影响Fig.4 Effect of inoculation amount on the growth of A. tamarii FD-8 and FAE activity
2.2.3 碳源对A.tamariiFD-8生长和FAE活性的影响 分别以蔗糖、葡萄糖、果糖、麦芽糖、甘露糖为碳源,接种A.tamariiFD-8、于32 ℃培养120 h后,最大菌体量和FAE活性如图5所示。以蔗糖和葡萄糖为碳源时菌体量最多,且相差不大,但FAE活性并不是最高;以果糖为碳源时菌体量略低于以蔗糖或葡萄糖为碳源时的菌体量,但FAE酶活性最高;麦芽糖和甘露糖均不适合作菌体生长和FAE合成的碳源。因此,蔗糖和葡萄糖均可作为A.tamariiFD-8生长和合成FAE的最适碳源,以下研究均以蔗糖为碳源。
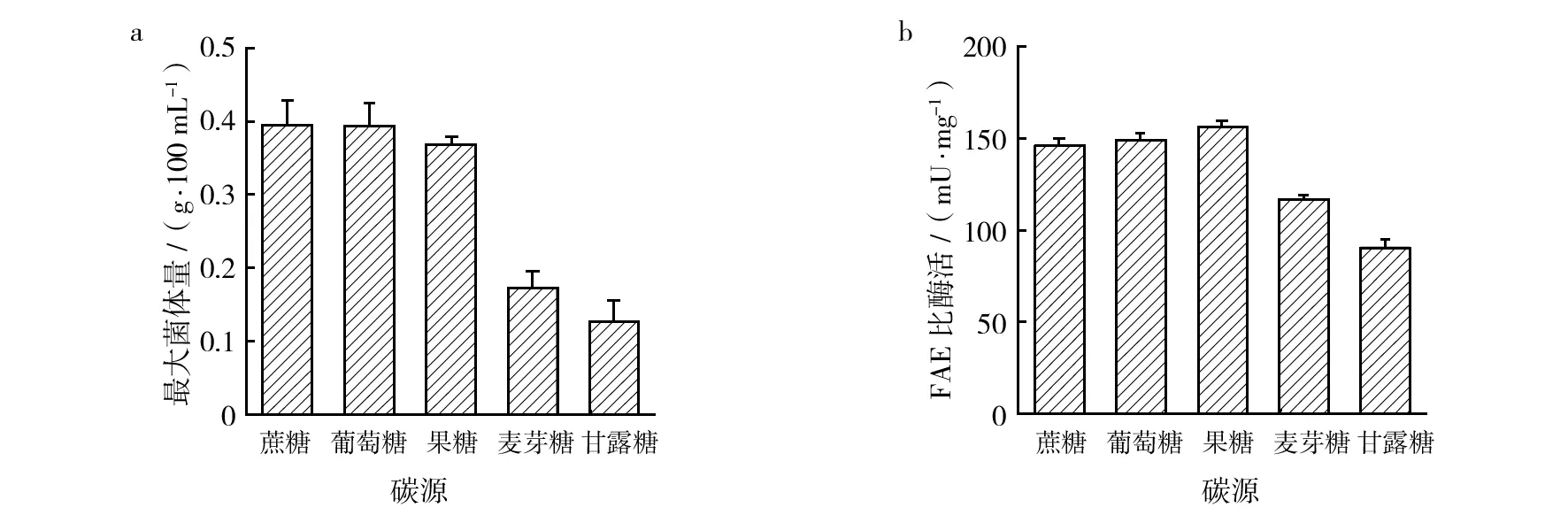
图5 碳源对A. tamarii FD-8生长和FAE活性的影响Fig.5 Effect of different carbon sources on growth of A. tamarii FD-8 and FAE activity
2.2.4 氮源对A.tamariiFD-8生长和FAE活性的影响 分别以蛋白胨、硫酸铵、尿素、酵母浸提物、硝酸钠为氮源,接种A.tamariiFD-8、于32 ℃培养120 h后,菌体生长量和FAE活性如图6所示。从图6可以看出,酵母粉和蛋白胨均可作为A.tamariiFD-8的最适生长和产酶氮源,但酵母浸提物作为氮源时,FAE活性略高于蛋白胨为氮源。蛋白胨和酵母浸提物均为蛋白质类原料的水解产物,含有氨基酸、多肽等容易被微生物利用的含氮有机化合物,酵母浸提物中还含有部分维生素、核苷酸及微量元素,可作为微生物生长的辅因子[21-22],而硫酸铵、尿素和硝酸铵成分单一。因此,选酵母浸提物作为A.tamariiFD-8的最适生长和产酶氮源。

图6 氮源对A. tamarii FD-8生长和FAE活性的影响Fig.6 Effect of different nitrogen sources on growth of A. tamarii FD-8 and FAE activity
2.2.5 pH对A.tamariiFD-8生长和产酶的影响 将发酵培养基pH分别调至4.0、5.0、6.0、7.0、8.0,接种A.tamariiFD-8、于32 ℃培养120 h后,最大菌体量和FAE活性如图7所示。从图7可以看出,A.tamariiFD-8最适生长pH为5.0,最适产酶pH为6.0。因此,在发酵过程中,将发酵培养基初始pH调至5.0、培养48 h时将pH调至6.0,可保证菌体生长量达到最大、合成更多的FAE,进而提高FAE活性。
2.3 DSWB对A. tamarii FD-8生长和产酶的影响
将A.tamariiFD-8接种于最适培养基中、于32 ℃培养120 h(发酵前48 h pH为5.0,48 h后 pH调至为6.0),FAE活性达到231.34 mU/mg(图8a所示)。在初始发酵培养基中添加不同量的DSWB条件下A.tamariiFD-8 FAE活性变化如图8b所示。从图8可以看出,随着DSWB添加量的增加,FAE活性呈先增加后平稳再下降的趋势,可能是因为大量DSWB对培养基中氧气传质过程产生不利影响,影响了菌体代谢活性,当DSWB超过20.0 g/L时,FAE活性不再继续升高。在不同发酵时刻添加DSWB条件下FAE活性如图8b所示,在发酵48 h添加20.0 g/L DSWB时,FAE活性最高,比酶活达到573.61 mU/mg,比对照提高1.48倍。
发酵48 h是菌体活力和代谢能力最高的时期,产酶速率最快,DSWB中的阿魏酸酯被前期合成的FAE水解,释放出游离阿魏酸诱导FAE大量合成,使得最终FAE活性提高。过早添加DSWB提前诱导FD-8进入产酶期,处于生长期的菌体胞内代谢受到干扰,导致FAE活性提高幅度较小。发酵72 h后菌体生长开始进入衰亡期,菌体代谢活力也开始下降,FAE合成能力也随之下降,此时添加DSWB已经错过FAE合成的最佳时间,对FAE的合成没有显著促进作用。
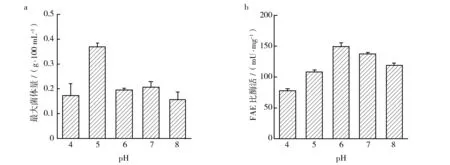
图7 pH对A.tamarii FD-8生长和FAE活性的影响Fig.7 Effect of pH on growth of A.tamarii FD-8 and FAE activity

图8 添加去淀粉麸皮(DSWB)对A. tamarii FD-8产FAE活性的影响Fig.8 Effect of DSW on FAE activity produced by A. tamarii FD-8a:初始培养基中添加不同量DSWB条件下FAE活性;b:不同时刻添加DSWB条件下FAE活性a:FAE activity under the condition of adding different amount of DSWB initially;b:FAE activity under the conditions of adding DSWB at different moment
3 讨 论
关于阿魏酸酯酶产生菌的筛选与鉴定的研究已有报道,菌种筛选来源大多是森林、菜地、果园或学校附近土样[11,14,18]。李夏兰等[11]筛选出1株桔青霉,最高酶活性可达到5 U/g麦糟,王洪川等[14]筛选出1株黑曲霉,最高FAE活性为445.41 mU/g,李干[18]筛选到的伯克氏菌最高FAE活性为56 mU/mL,Gottschalk等[24]从甘蔗渣中筛选出的泡盛曲霉所产FAE活性为160 mU/mL,可促进甘蔗渣水解,Mathew等[25]报道的1株黄曲霉产FAE活性可达到6.83 U/mL。利用基因工程手段构建的重组菌FAE活性可达到10.0 U/mL以上[26-27]。本研究从绍兴黄酒酿造水源鉴湖附近土样中筛选到产阿魏酸酯酶活性较高的菌株,鉴定为溜曲霉,命名为AspergillustamariiFD-8。经发酵条件优化后,FAE比酶活为231.34 mU/mg。研究表明培养基中添加谷物后,谷物中的阿魏酸酯被水解释放出游离阿魏酸,游离阿魏酸可以刺激与FAE过量表达相关的基因,进而合成较多的FAE,且FAE活性随着游离阿魏酸含量的增加而提高[18,23]。在发酵48 h向培养基中添加DSWB,FAE比酶活达到573.61 mU/mg(换算为酶活性为321.2 mU/mL),比对照提高1.48倍。与已报道的大部分菌株所产FAE的活性相比,本研究中溜曲霉所产FAE的活性处于中等水平,后期研究中可进一步优化发酵条件或通过基因重组方式提高酶活性。此外,菌株筛选土样来自黄酒厂附近,而张中华[28]通过对麦曲微生物群落的研究发现麦曲中含有溜曲霉。根据GB 4789.16-2016《食品微生物学检验-常见产毒霉菌的形态学鉴定》中描述,该菌株不属于产毒素的曲霉菌,而桔青霉、黑曲霉和黄曲霉均可能会产生毒素。因此,黄酒酿造麦曲中可能含有本研究筛选的溜曲霉,该菌株可用作麦曲强化菌,提高黄酒中阿魏酸或以阿魏酸为底物的香气成分(如香兰素)的含量[25]。同时,该菌株在促进植物纤维素水解和以麦麸等为原料制备高阿魏酸含量膳食纤维方面具有很好的应用前景。

