不同种植年限猕猴桃园土壤微生物功能多样性研究
朱海云, 马 瑜, 柯 杨, 李 勃
(陕西省微生物研究所,陕西 西安 710043)
微生物作为土壤生态系统中最活跃的部分,参与土壤有机质的分解、养分循环等过程,对植物生长发育和群落演替具有重要作用[1]。在植物-微生物-土壤系统中,土壤微生物扮演生产者与分解者的双重角色,维持了土壤生态系统的稳定性和可持续生产力[2-3]。研究表明,土壤微生物可以与作物的根系发生互作,其数量和种类的变化直接影响植物生长及土壤质量,而植物种类和种植方式也会对土壤微生物群落结构及功能产生稳定的影响[4-5]。同时,土壤微生物群落结构是反映土壤肥力和健康状况的重要指标[6]。因此,土壤微生物群落决定和推动着果园生态系统的物质循环和能量流动。而土壤微生物的功能多样性与土壤微生物群落所能执行的功能范围以及这些功能的执行过程,与土壤功能密切相关,对土壤生态功能及自然元素循环都具有重要意义[7-8]。 陕西秦岭北麓是我国猕猴桃资源最丰富的地区,也是世界上最大的猕猴桃生产基地,其产量占全国生产总量的60%以上。陕西自20世纪80年代开始大面积栽培猕猴桃,使得猕猴桃园面积逐年扩展。但是,猕猴桃树属多年生藤本植物,果树种植方式具有结构相对单一、长期定向施肥和“双高”(高投入及高产出)等特点,种植多年后可导致不同种植年限果园间土壤质量和生境差异性,根际微生物群落结构和功能多样性改变,有益微生物降低,真菌病害数量增加,导致作物减产[9]。 近年来,国内外对土壤微生物群落功能多样性的研究主要集中在环境变化及人为干扰对土壤微生物多样性的影响,而有关不同种植年限果园土壤微生物群落功能多样性的研究较少[10-11]。探讨不同种植年限果园土壤微生物群落特征能够较为简单、快速地反应果园土壤环境状况,对果园科学管理、有效施肥、生态环境改良及果品品质提升具有重要意义。本研究通过Biolog-Eco微平板法研究猕猴桃主产区不同种植年限猕猴桃园土壤微生物对不同碳源的利用情况,以期为该地区果园土壤质量诊断提供依据,为果园合理管理和生态修复提供参考。
1 材料与方法
1.1 材料
1.1.1 研究区概况 研究地区位于秦岭北麓周至县猕猴桃主产区(108°10′~108°29′ E,34°03′~34°14′ N),属温带大陆性季风气候,年平均气温12.0~13.6 ℃,年均降水量650~800 mm。沿秦岭北麓从西往东依次经过马召镇、楼观镇、集贤镇和九峰镇,选择同为砂质土壤且施肥管理状况较为接近的不同种植年限的海沃德猕猴桃园作为采样点(图1)。
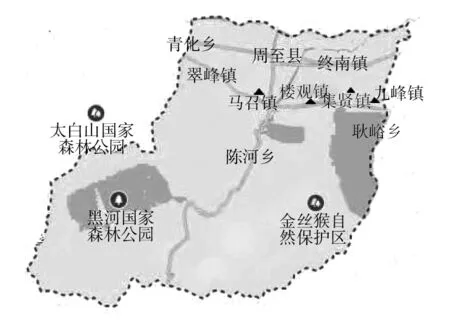
图1 周至县猕猴桃园土壤采样点分布Fig.1 The distribution map of the soil sampleing points in Zhouzhi county
1.1.2 样品采集及处理 2015年3月初猕猴桃萌芽期和10月末落叶期对研究区域20个猕猴桃园按照猕猴桃种植年限差异(0~5 a、5~10 a、10~20 a)进行分类采集样本。在距植株周围30 cm处,采用=9 cm土钻根据“S”采样法取0~40 cm土样。用手选法剔除样本中肉眼可见的石砾、植物根系杂质,将新鲜土样装入无菌袋中,4 ℃保存,用于微生物培养及微生物群落功能多样性分析。
1.1.3 主要仪器及设备 超净工作台(天津泰斯特,HS840),生化培养箱(山海一恒, LRH-70),恒温摇床(天津欧诺,HNY-100F),高压灭菌锅(上海申安,LDZX-50KBS), 微生物全自动鉴定分析系统(美国 Biolog),Biolog生态板(美国 Biolog)。
1.2 方法
1.2.1 可培养微生物数量测定 土壤可培养微生物数量测定采用稀释平板涂布培养计数法;细菌采用牛肉膏蛋白胨培养基,真菌采用马丁氏孟加拉红琼脂培养基,放线菌采用高氏Ⅰ号培养基。每个处理重复3次,以cfu/g计算结果。
1.2.2 土壤微生物群落功能多样性测定 采用Biolog-Eco微平板法测定不同种植年限猕猴桃园土壤微生物对31种碳源的利用情况,分析不同种植年限对猕猴桃园土壤微生物群落功能多样性的影响。称取相当于1 g烘干质量的新鲜土壤样品至99 mL无菌水中,4 ℃充分震荡30 min,静置30 min。取150 μL土壤上清液至Biolog-Eco板各孔中,25 ℃连续培养240 h,每24 h用微平板读数器分别读取590 nm和750 nm的吸光值。
1.2.3 数据的处理与分析 微生物代谢活性用590 nm吸光度值减去750 nm吸光度值表示。平均颜色变化率(average well color development,AWCD)用于表示土壤微生物对碳源的整体利用能力,计算公式:AWCD=∑(Ci-R)/31,式中Ci为第i个反应孔在590 nm下的光密度值减750 nm下的光密度值;R为对照孔A1的光密度值;Ci-R<0的孔,计算中将其记为零,即Ci-R的值均≥0[12]。功能多样性指数:Shannon-Wiener指数(H′)、Simpson指数(D)及McIntoshi指数(U)[13]。计算公式:
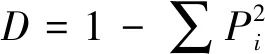
式中:Pi=(Ci-R)/Σ(Ci-R)表示第i孔的相对光密度值与整个微平板相对光密度值总和的比值;Ni表示第i孔的相对光密度值(Ci-R)。
采用Microsoft Excel 2007对数据分析处理,用SPASS 20.0软件进行统计学分析,用GraphPad Prism 5.0绘图。
2 结果与分析
2.1 种植年限对猕猴桃园土壤微生物数量的影响
从图2可知,不同种植年限猕猴桃园土壤中可培养微生物以细菌为主,其次是放线菌,真菌数量最少。随着种植年限的增加,细菌和放线菌数量显著降低,而真菌数量则显著升高,但是当种植年限超过10 a后,真菌数量升高不再显著。
2.2 不同种植年限对猕猴桃园土壤微生物群落总碳源利用变化特征
AWCD作为表征土壤微生物活性的重要指标,其值大小反映了土壤微生物利用碳源能力的强弱[14]。由图3可知,培养起始的48 h内AWCD值变化不明显,而在培养48~168 h内AWCD快速增长,说明此时微生物碳源代谢旺盛,168 h以后各样本的AWCD增长速率有所降低,最终进入平稳期。同时,随着种植年限的增加,AWCD值随着培养时间的升高逐渐降低,AWCD值之间的差异变大。从培养48 h开始,各种植年限间的AWCD值差别开始日渐增大,培养到96 h后,种植年限<5 a与种植年限>5 a的果园土壤AWCD值之间的差异开始呈现显著性,培养到144 h后,各种植年限间的AWCD值之间的差异均呈现显著性(P<0.05)。这说明随着种植年限的增加,猕猴桃园土壤微生物的碳源利用能力显著降低。

图2 不同种植年限猕猴桃园土壤微生物数量统计Fig.2 Variation of culturable microorganism numbers in soils with increased planting-years of kiwifruit orchards不同小写字母表示不同种植年限果园间差异显著(P<0.05),下同Different small letters meant significant difference among the kiwifruit orchards of different planting ages at 0.05 level, similarly hereinafter,sime follow
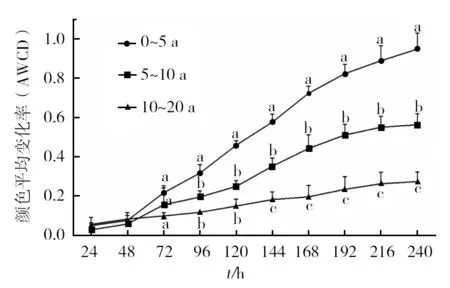
图3 不同种植年限猕猴桃园土壤微生物群落AWCD变化Fig.3 Changes of AWCD of soil microbe community with incubation time from different planting-years kiwifruit orchards
2.3 不同种植年限猕猴桃园土壤微生物群落多样性指数
不同多样性指数反应了土壤微生物群落功能多样性的不同侧面。其中,Shannon-Wiener指数(H′)用于评估物种的丰富度,Simpson指数(D)主要反映的是群落中最常出现的物种的多度,McIntoshi指数(U)用于评估群落一致度。由图4可知,0~5 a和5~10 a果园土壤的Shannon-Wiener指数较高且差异无显著性;而10~20 a果园土壤Shannon-Wiener指数较低,与0~5 a和5~10 a果园土壤的Shannon-Wiener指数差异具有显著性,说明当种植年限>10 a后,猕猴桃园中土壤微生物物种多样性显著降低。与AWCD相似,不同种植年限猕猴桃园土壤Simpson指数及McIntosh指数均随种植年限的延长而降低,表明0~5 a猕猴桃园土壤微生物分布较均匀且对碳源利用程度最高,而随种植年限的增加,土壤微生物物种优势度及均匀度均降低,系统稳定性降低,且不同种植年限之间的差异具有显著性。
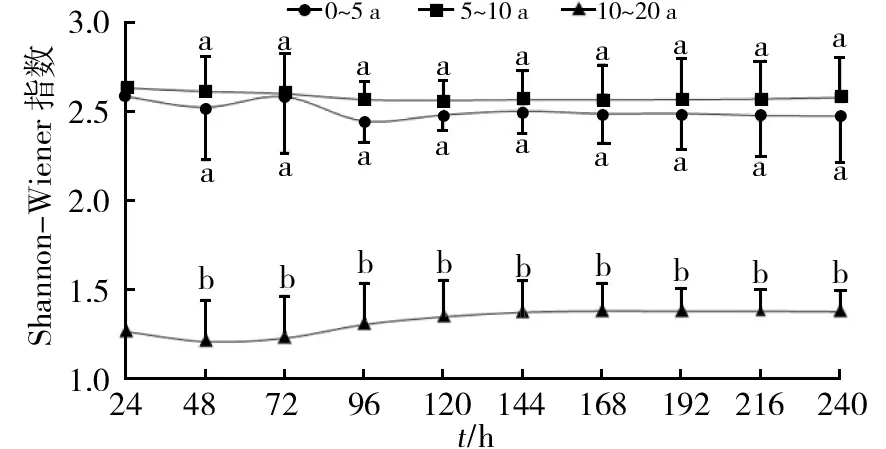

图4 不同种植年限猕猴桃园土壤微生物群落功能多样性指数Fig.4 Functional diversity indexes of soil microbial community from different planting-years kiwifruit orchards
2.4 不同种植年限猕猴桃园土壤微生物碳源利用特征
按照化学基团的性质将Eco板上的31种碳源分为六大类,即单糖/糖苷/聚合糖类、氨基酸类、酯类、醇类、胺类和酸类[15]。根据这六类碳源的平均AWCD值随培养时间的变化绘制动态变化图(图5)。从图5中可知,猕猴桃园土壤微生物对糖类、氨基酸类和酯类的利用率相对较高,而对醇类、胺类和酸类的利用率相对较低(以168 h为例)。猕猴桃园土壤微生物对六类碳源的利用程度随种植年限的增加而逐渐降低。其中对单糖/糖苷/聚合糖类、氨基酸类、酯类和酸类的利用程度在各种植年限间的差异均具有显著性;对醇类和胺类的利用则表现为10~20 a果园土壤与0~5 a和5~10 a果园土壤间的差异具有显著性,而0~5 a和5~10 a果园土壤之间的差异无显著性。
2.5 不同种植年限猕猴桃园土壤微生物群落功能主成分分析
对不同种植年限果园土壤样品培养96 h的平板微孔吸光度值进行主成分分析,选取方差贡献率最大的前两个主成分PC1和PC2来进行微生物群落功能多样性分析,并做载荷图(图6)。两个主成分因子累计方差贡献率达到79.38%,其中第一主成分(PC1)的方差贡献率为60.91%,第二主成分(PC2)的方差贡献率为18.47%。这说明前两个主成分可以很好地解释不同种植年限猕猴桃园土壤微生物对碳源利用的差异。从图6可以看出,不同种植年限猕猴桃园土壤微生物群落在碳源利用上差异较大。种植年限为0~5 a和5~10 a的猕猴桃园土壤与种植年限为10~20 a的猕猴桃园土壤在PC1上差异显著,种植年限<10 a的猕猴桃园土壤分布在正方向,得分系数为0.491~1.244;种植年限>10 a的猕猴桃园分布在负方向,得分系数为-1.285~-0.507。种植年限为0~5 a的猕猴桃园土壤与种植年限为5~10 a和10~20 a的猕猴桃园土壤在PC2上差异显著,种植年限<5 a的猕猴桃园土壤分布在正方向,得分系数为1.593~2.059。种植年限>5 a的猕猴桃园土壤主要分布在负方向,得分系数为0.364~-0.731。因此,利用主成分分析可以很好地将各种植年限猕猴桃园土壤微生物群落分别划分在载荷图第一、第四和第三象限,这进一步表明土壤微生物群落结构随着种植年限增加出现了明显变化,碳源的利用能力差异显著。
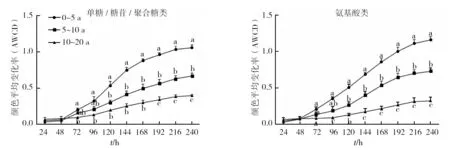

图5 不同种植年限猕猴桃园土壤微生物对不同碳源的利用Fig.5 Utilization of different carbon sources by soil microorganisms from different planting-years kiwifruit orchards

图6 不同种植年限猕猴桃园土壤微生物群落的主成分分析Fig.6 Principal components analysis (PCA) of soil microbial communities from different planting-years kiwifuit orchards
对PC1和PC2的得分系数与单一碳源AWCD进行相关性分析,得出不同碳源在PC1和PC2上的载荷值(表1)。主成分分析中的载荷因子表示原始变量线性组合的系数,绝对值越大表示该碳源对主成分的贡献越大[16]。分析结果表明在PC1上具有较高载荷值(|r|>0.5)的碳源共有11种,其中糖类占36.36%,氨基酸类及酯类均占18.18%,醇类、胺类及酸类各占9.09%。因此,对PC1贡献大的碳源为糖类和氨基酸类。在PC2上具有较高载荷值(|r|>0.5)的碳源有3种,包括甲基-D-葡萄糖苷、纤维二糖和吐温-80,对PC2贡献大的碳源是糖类,占66.67%。该结果与前述土壤微生物群落对六类碳源的利用特征一致,进一步表明猕猴桃园土壤微生物对糖类和氨基酸类的利用率较高。

表1 Biolog-Eco板碳源在PC1和PC2上的载荷值(|r|>0.5)Table 1 Carbon substrates loaded on the first and second principal components in analysis of ECO microplate data(|r|>0.5)
2.6 不同种植年限猕猴桃园土壤微生物多样性与养分的相关性
土壤养分作为土壤微生物重要的碳源和氮源,与土壤微生物的数量和多样性息息相关。结合已测定的土壤养分数据[17],分析两者之间的相关性。结果表明(表2),微生物总量及AWCD值与土壤有机质含量正相关,与有效磷和速效钾的含量负相关;Shannon-Wiener指数与有机质和速效钾的含量正相关,而与有效磷的含量负相关;Simpson指数与速效氮和有效磷的含量负相关;McIntosh指数与有效磷和速效钾的含量负相关。由此可见,土壤养分与微生物的功能多样性密切相关,有机质对土壤微生物功能多样性的贡献为正,速效氮对土壤微生物功能多样性的贡献不明显,有效磷及速效钾对土壤微生物功能多样性贡献基本为负。
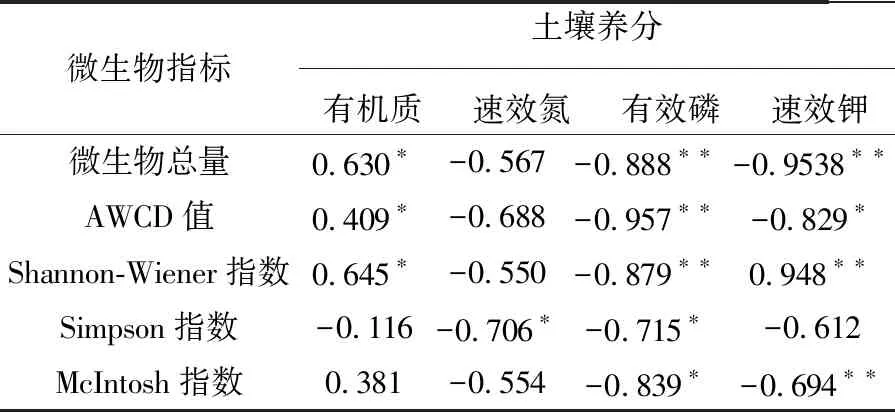
表2 不同种植年限猕猴桃园土壤微生物指标与土壤养分相关性分析Table 2 Correlation analysis between the microbiological indicators and the soil nutrients
注:*表示P<0.05;**表示P<0.01
3 讨 论
本研究结果表明,猕猴桃园土壤中的微生物主要以细菌为主,其次是放线菌和真菌,该结果与邵阳等[18]对猕猴桃园土壤微生物数量研究结果一致。随着种植年限的增加,猕猴桃园土壤中的细菌和放线菌数量显著降低,而真菌数量有所升高,但微生物总量显著降低。与此同时,随着种植年限的增加,猕猴桃园土壤微生物AWCD值和功能多样性指数均呈现显著性降低,且不同种植年限猕猴桃园土壤微生物对碳源的利用特征不同,说明土壤微生物功能多样性与微生物群落的变化密切相关。土壤微生物功能多样性与土壤养分变化密切相关,与土壤有机质含量正相关,与有效磷和速效钾的含量负相关。
猕猴桃园土壤微生物随种植年限的变化特征与苹果园、桃园以及葡萄园的微生物变化特征基本相似,均以细菌占数量优势,其次为放线菌;随着种植年限的增加,细菌/真菌的比例下降,放线菌的含量也随树龄增大而降低,同时幼龄和壮龄果园的土壤微生物在数量、活性以及多样性上都明显优于老龄果园[19-21]。土壤微生物的数量和类群随种植年限的增加而发生变化的原因可能有以下两点:①随着种植年限的增加,土壤养分出现亏缺,土壤微生态环境恶化,而真菌比细菌更能适应养分贫瘠的条件,并且随着土壤酸度的增加,细菌与放线菌的生长受到抑制,因此导致微生物数量和组成发生变化,进而导致微生物群落的生理活性降低和功能多样性降低[22-23];②随着种植年限的增加,根系分泌减弱,而根系分泌物中的自毒物质逐步累积,对微生物数量和种类的抑制作用日趋显著[24]。
平均颜色变化率(AWCD)作为表征土壤微生物活性的重要指标,其变化速率和最终所能达到的值反应了土壤微生物利用某一碳源物质的能力,因此,AWCD值在一定程度上反映了土壤微生物的数量和结构特征。AWCD值越大,表明土壤微生物群落代谢活性越高。本研究结果表明,AWCD值随着培养时间延长逐渐增加而后平稳,其值及增长幅度与种植年限负相关,该结果与顾美英等[25]对棉花根际土壤微生物的研究结果一致。
当种植年限超过10 a后,Shannon-Wiener指数显著降低,说明猕猴桃种植的前10 a根际土壤微生物物种丰富度变化不大,而此后其根际土壤微生物丰富度则显著降低。Simpson指数不仅受物种丰富度的影响,还会受到物种均匀性影响。本研究中种植年限为5~10 a的猕猴桃园Simpson指数不同于Shannon-Wiener指数而显著降低,可能是由于此时期某些优势菌群数量激增,物种间个体数量的不均匀而导致。McIntosh指数依赖于样方中的个体总数以及种间的分布。McIntosh指数随种植年限的增加而降低,说明在固定的微生物个体总数中,物种数越来越多。结合可培养微生物数量、AWCD值、Shannon-Wiener指数和Simpson指数分析可知,McIntosh指数随种植年限的增加而降低,说明随种植年限的增加,猕猴桃园土壤微生物有益菌、优势菌数量减少,杂菌有害菌滋生。
对31种碳源吸光值进行主成分分析,结果显示,不同种植年限猕猴桃园土壤微生物对碳源的利用能力差异显著,且在碳源利用中主要起分异作用的是微生物对糖类、氨基酸类和酯类的利用特征,说明猕猴桃园土壤微生物群落结构随种植年限的增加发生了显著变化。文献资料显示,在苹果园、胡椒园及蔬菜大棚中,均以土壤微生物对糖类和氨基酸类的利用特征起主要的分异作用[26-28],这与本研究结果基本一致。
不同种植年限猕猴桃园土壤微生物功能多样性与土壤有机质含量正相关,与有效磷和速效钾的含量负相关,而与速效氮的含量相关性不明显。土壤有机质是土壤肥力的基础,但是有机质在各类果园土壤中的含量普遍偏低,且随着种植年限的增加含量进一步降低。研究表明,有机肥的施用可以显著提高土壤微生物功能多样性[29],因此猕猴桃园应该合理加大有机肥的施用量,合理降低有效磷和速效钾的施用量。
综合本研究结果可知,随着种植年限的增加,猕猴桃园土壤微生物的数量、物种丰度及均匀性均呈现下降趋势,原因如下:①猕猴桃园长期一成不变的管理方式导致土壤理化性质发生改变,随着时间的积累,果园土壤养分日益失衡,导致微生物数量和种类的下降;②猕猴桃树根系的吸收和分泌作用导致土壤中有益物质的持续减少和有害物质的持续积累,同时病原微生物数量上升,有益微生物数量下降;③参与土壤物质转化的土壤酶活性随种植年限增加发生变化[17],进而影响土壤理化性质和植物根系的生长分泌,最终影响土壤微生物的生长和繁殖。因此,土壤理化性质、土壤酶和土壤微生物相互作用的微生态环境随种植年限的增加不断恶化,导致土壤微生物数量及功能多样性降低。
在本研究中,随猕猴桃种植年限的增加,土壤微生物群落组成及功能多样性下降,也与实际生产中老龄果园病害易发、产量下降、连作障碍等问题具有一致性。同时,将本研究与土壤养分研究结果相结合,将有助于解释不同种植年限猕猴桃园土壤生态系统中微生物群落变化与环境因子的相关性,为园区合理改造、施肥及大田管理提供参考。为能全面反映种植年限对猕猴桃园土壤微生物的影响,需要结合更多的研究方法,如PLFA法[30]和宏基因组法[7]等,以更好地指导果园土壤的科学管理,提高果品产量和质量。

