减毒单核细胞增生李斯特氏菌作为疫苗载体在肿瘤治疗中的应用
汪舒颖, 丁承超, 马俊飞, 李 杰, 董庆利, 许东坡, 王 翔, 邱景璇, 刘 箐
(上海理工大学 医疗器械与食品学院,上海 200093)
1796年人类开始利用减毒或灭活致病菌调动自身免疫系统治疗疾病。现代肿瘤免疫疗法起源于20世纪末期。1813年Vautier发现感染产气荚膜杆菌的患者有肿瘤退化的现象,这是有关利用致病菌治疗癌症的最早记录[1]。之后德国科学家Busch又发现化脓性链球菌可以有效地诱导肿瘤消退。随后卡介苗菌株也被证实可用于膀胱癌的免疫治疗。这种非特异性治疗曾在一段时间内起到一定的成效,但之后研究者更倾向于开发具有特异性的免疫疗法,即通过靶向肿瘤相关抗原(tumor-associated antigen,TAA),激活细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)来治疗肿瘤。目前,许多治疗性的疫苗均采用减毒病毒或细菌病原体作为载体,其自身能够加工递呈抗原,激活免疫系统,因此具有较大的发展潜力。鼠伤寒沙门氏菌(Salmonellatyphimurium)和单核细胞增生李斯特氏菌(Listeriamonocytogenes,Lm)是两种较为成熟的应用于肿瘤免疫治疗的细菌载体,以此为载体的部分肿瘤疫苗研究已进入临床试验。相较于沙门氏菌,Lm具有独特的胞内寄生加工、递呈抗原能力[2],因此被认为是一种良好的肿瘤疫苗载体。
1 Lm的生物学特性
Lm是一种革兰阳性、兼性厌氧菌,能在胞内寄生且具有广泛的宿主谱。Lm也是一种重要的食源性病原菌,感染后能穿过人体和动物的肠道、血脑和胎盘三大屏障,导致脑膜炎、胃肠炎等疾病,还会导致女性妊娠期流产。通常情况下,Lm经过消化道进入人体后,可在内化素A(inlA)和内化素B(inlB)的作用下穿过肠上皮细胞。在细菌进入吞噬体后,可借助LLO蛋白的裂解作用突破吞噬体的膜结构进入细胞质。在细胞质中,利用actA蛋白刺激细胞聚合宿主肌动蛋白,使自身得以在不离开细胞隔室的情况下在细胞之间活动[3]。新研究表明Lm可将李斯特黏附蛋白(Listeria adhesion protein,LAP)与表面受体Hsp60结合后,激活NF-kB信号传导,通过3个上皮链接蛋白的再分布,促进肌球轻链蛋白激酶介导的上皮屏障开放,从而入侵机体[4]。
1.1 Lm感染后诱导的免疫应答方式
1.1.1 固有免疫 在Lm激起的固有免疫应答中,中性粒细胞和巨噬细胞发挥了很大作用。中性粒细胞可通过吞噬细胞液泡上离子的运动,使得酶从细胞质颗粒释放到液泡,从而构建出有利于微生物杀灭和消化的环境[5]。中性粒细胞还能释放中性粒细胞胞外陷阱(neutrophil extracellular traps,NETs)降解毒力因子并杀死细菌[6],以及释放CSF-1和MCP-1等趋化因子促使巨噬细胞抵达感染部位。巨噬细胞,例如肝脏中的枯否细胞,是清除细菌的必须细胞亚群,能分泌TNF-α和IL-12细胞因子促使自然杀伤细胞(natural killer cell,NK)产生IFN-γ,同时也能反作用于巨噬细胞,增强它们的杀伤力[7]。
1.1.2 适应性免疫 Lm在体内感染后主要诱导的是细胞免疫,其产生的免疫应答方式主要有外源性途径和内源性途径两种(见图1)。外源性途径表现为细菌感染树突细胞(dendritic cell,DC)后,在溶酶体中被部分降解,产生的抗原短肽可通过MHCⅡ类分子递呈给CD4+T细胞。CD4+T细胞被诱导产生细胞免疫反应后,分泌IL-12刺激抗原已致敏的Th0细胞分化成Th1细胞,Th1细胞能分泌IL-2、IFN-γ、TNF-β等细胞因子引起自身增殖和分化,促进免疫反应进行。同时CD4+T细胞介导的免疫应答也会辅助内源性途径,即逃逸到胞浆的细菌所分泌的蛋白会被运输到内质网,经加工后通过MHC I类分子递呈给CD8+T细胞。CD8+T细胞主要通过两种协同机制介导针对Lm的免疫应答:①通过穿孔蛋白和颗粒酶裂解胞内细菌,使细菌暴露于激活的巨噬细胞,从而被杀死;②分泌INF-γ激活巨噬细胞杀死细菌[8]。后者的免疫应答途径作为清除胞内病原物质的关键,是Lm用于清除肿瘤细胞的重要因素。
1.2 Lm作为肿瘤疫苗载体的优势
1.2.1 Lm具有削弱与肿瘤相关免疫抑制的作用 肿瘤微环境中的免疫抑制作用是限制肿瘤免疫治疗的一个重要障碍,这些抑制作用是由一些抑制类型细胞如调节性T细胞(Regulatory cells,Tregs)介导的[9]。肿瘤微环境中的Tregs能产生IL-10和TGF-β等抗炎细胞因子,不但损害T细胞应答还能通过与抑制性受体CTLA-4的相互作用直接抑制抗原呈递细胞(antigen presenting cell,APC)的功能[10]。由于大部分肿瘤是免疫系统耐受的自体组织,肿瘤相关抗原与自身某些抗原的高度同源使得免疫系统的监视作用难以发挥,且很多情况下被递呈的抗原是引起免疫耐受的不良抗原,所以肿瘤难以被自身免疫系统发现并消灭。与此同时,肿瘤微环境还可以通过分泌某些细胞因子来抑制或沉默已产生的免疫反应,从而达到肿瘤逃逸的效果[11]。例如关注度很高的CD4+CD25+T细胞能够抑制效应T细胞的增殖,并能产生抑制性细胞因子如TGF-β和IL-10。
理想的肿瘤疫苗载体能够突破肿瘤设下的免疫逃逸保护屏障。研究表明,以Lm为载体的肿瘤疫苗,尤其是融合肿瘤相关抗原和溶血素LLO蛋白的疫苗,可以有效削弱这类免疫抑制以杀死肿瘤。其中研究人员还发现单独基于Lm的疫苗就可以达到减轻肿瘤相关免疫抑制的作用[12]。另外,Lm-LLO疫苗还可不通过免疫清除的途径杀死肿瘤细胞。Lm-LLO疫苗可在感染4T1癌细胞系后激活NADPH氧化酶,调高细胞内的Ca2+水平,导致肿瘤细胞在氧化酶和过高Ca2+水平下因线粒体衰竭而死[13]。
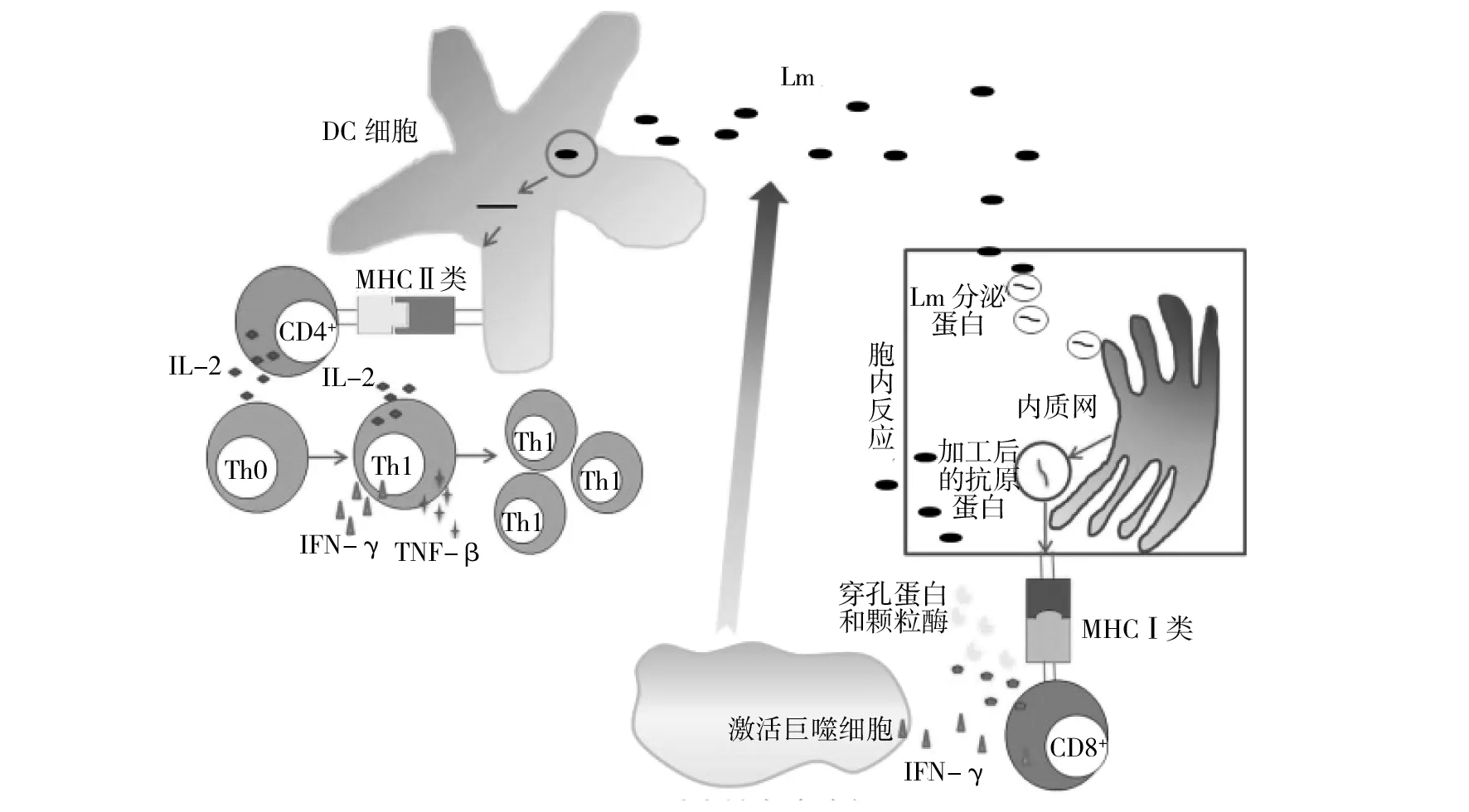
图1 Lm适应性免疫途径Fig.1 Lm adaptive immune pathway
1.2.2 Lm具有对原发性和转移性肿瘤的趋性 Lm作为肿瘤疫苗载体的另一优势就是能够靶向性地聚集到原发性和转移性肿瘤的位置,并在肿瘤发生器官内大量增殖,即Lm的归巢性质[14]。注射Lmdd-CD24疫苗后,在脾、肝、肾、肺和脑几种器官的菌落计数中发现大多数的Lm都聚集在脾和肝中,少部分出现在肾和肺,在脑部则未被发现,肝脏没有明显的被破坏或坏死现象。说明减毒Lm疫苗在对原发性肿瘤具有趋性的同时,不会对机体正常组织造成明显的伤害[15]。在一项针对晚期并已发生转移的乳腺癌研究中发现,减毒Lm-LLO疫苗会在注射早期存在于脾脏中,但在后期就会被自身的免疫系统清除。同时在对正常器官的检查中并没有发现Lm-LLO的存在。而在转移瘤和原发性肿瘤的位置均明显发现Lm-LLO的存在[16]。这两种疫苗中前者在肿瘤治疗和延长小鼠寿命方面有明显的效果,后者能够激起T细胞和NK细胞强烈的免疫反应。两者都体现了Lm对原发性肿瘤以及转移瘤的趋向性,说明Lm疫苗具有靶向病灶的潜质,是十分具有潜力的肿瘤疫苗。
1.2.3 Lm具有被肿瘤微环境保护的优势 肿瘤微环境使肿瘤细胞对人体免疫系统产生高度耐受,使得一些疫苗难以发挥激起人体自身免疫应答的作用。但是有研究表明,这种高度的免疫耐受能防止Lm被人体内发达的免疫系统快速清除,使其能够更大程度地进入肿瘤细胞中发挥消除肿瘤的作用。研究人员发现Lm在肿瘤患者体内能作用于骨髓来源的抑制性细胞(Myeloid-derived suppressor cells,MDSCs)。MDSCs是一种存在于肿瘤微环境的免疫抑制细胞,能迁移到主要的肿瘤块,分化和激活这些不成熟的免疫抑制细胞产生免疫抑制因素,如精氨酸酶、一氧化氮合成酶和活性氧,以及细胞因子IL-6、IL-10和TGF-β。它们能够下调抗原和特异性的T细胞反应的时间。在Quispetintaya等[14]的研究中发现减毒Lm的免疫治疗显著降低了MDSCs在血液和原发性肿瘤中的数量,并将剩余的MDSC亚群转化为产生IL-12的免疫刺激表型。Chandra等[16]在乳腺癌模型中发现Lm可以感染MDSCs。而MDSCs会将Lm传递到转移瘤。在转移瘤中,Lm可以在细胞间传播而不被免疫系统消灭。这一过程不会出现在正常组织中,因为正常组织部位的免疫细胞会将Lm清除。
2 Lm作为疫苗载体的减毒策略
应用Lm作为肿瘤疫苗,其安全性是关键。通常Lm不会持续感染,但仍可使免疫功能低下的患者患上脑膜炎和败血症[17]。因此将Lm进行减毒是疫苗研发的第一步。毒力基因敲除菌株、平衡致死菌株、“Killed but metabolically active” (KBMA)菌株是当前几种常见Lm减毒株,且基本可以满足作为疫苗载体中低致病性和高免疫原性这两个重要条件。
2.1 毒力基因敲除菌株
将Lm中关键的毒力基因通过基因工程手段敲除是最基本的构建Lm减毒株的方式。actA和inlB基因双缺失菌株是最常用到的减毒活疫苗载体,actA基因能指导Lm聚合宿主细胞肌动蛋白分子,实现在细胞质内移动,并最终在细胞间传播。缺失actA基因会限制菌的传播,使得该突变体的毒力降低103~104,但仍保留菌株诱导功能性免疫应答的作用[3]。inlB蛋白是Lm内化进入非吞噬细胞系的关键所在,实验证明其为侵袭细胞关键物质,缺失inlB突变体其毒力会被减弱,同时由于减少了进入肝细胞的数量而降低了肝毒性[18]。Brockstedt等[19]同时删除了actA和inlB两种毒力基因,使Lm突变株在免疫效果得以维持的基础上毒性降低了1 000倍以上。在小鼠实验中,这种缺失株得以在免疫后诱导有效和持久的免疫反应,同时未发现可测量的肝毒性。双基因的敲除菌株在保证免疫原性的同时大大减低毒性,提高了安全性。
转录激活因子prfA是Crp/Fnr家族的成员,大多数与Lm致病相关基因产物的表达受这一转录调节因子调控,该调控因子在Lm的致病性中起着核心作用。研究发现,缺乏prfA的Lm突变菌株与野生型亲本株相比,毒性降低了105[20],Maciag等[21]的研究使用prfA缺失株XFL-7作为宫颈癌疫苗靶标抗原的载体。
plcB基因能编码广谱性磷脂酶C(PC-PLC),是引起小鼠脑李斯特病的重要毒力因子之一[22]。Jia等[23]构建的宫颈癌疫苗使用actA和plcB双基因敲除减毒载体递呈E7抗原,结果显示该疫苗能靶向聚集在肿瘤部位,并能激起强烈的CD8+T细胞反应。
编码溶血素O(listeriolysin O,LLO)蛋白的hly基因是Lm的一个重要毒力基因。LLO蛋白作为一种穿孔毒素在帮助Lm逃逸出吞噬体,增强胞内增殖,以及开启MHC I类抗原递呈途径中起到关键作用。因此虽然LLO蛋白是一种毒力蛋白,但在肿瘤疫苗载体的构建中,将编码LLO蛋白的启动子和分泌信号肽部分与外源蛋白组成融合蛋白的方式已经相对成熟。这种方式在降低Lm毒性的同时,能达到其分泌外源蛋白的作用。研究发现肿瘤抗原与LLO前420aa左右的融合(排除了溶血结构域)可以促进抗原的分泌,增加抗原呈递并且有助于刺激DC的成熟[24]。Howard Safran等[25]已将HPV-16 E7与截短后的LLO(tLLO)组成融合蛋白,应用于ADXS11-0011 Lm-LLO疫苗的研究。
2.2 平衡致死菌株(Balanced lethal vector system)
在敲除毒力因子的Lm载体构建中的质粒通常使用抗生素标记基因以便于筛选,但是抗生素的滥用已经引发了一系列耐药菌事件,超级细菌的出现更是威胁到人类的生存。因此用抗生素筛选的方式构建疫苗并不是一种最佳策略。而研究人员发现丙氨酸消旋酶基因dal和D-丙氨酸转氨酶基因dat对于Lm等细胞壁黏肽成分的合成十分重要。若Lm菌株同时缺失dal/dat两个基因将无法在没有外源D-丙氨酸的环境中生存,尤其是在真核寄主细胞的细胞质中。平衡致死载体,即利用“质粒携带,菌株缺失”的原则,敲除菌株自身携带的dal和dat基因的同时在携带质粒中回补其中一个基因,使得菌株的生存依赖于携带这个基因的质粒,同时细菌的繁殖数量也受到了限制。
研究者还发现这种减毒突变菌株能激起和野生菌株几乎同等程度的保护性免疫,诱导CTL的免疫反应[26]。Yang等[15]研究的肝癌疫苗使用复制缺陷型Lmdd载体,通过穿梭质粒PKSV7连接枯草芽胞杆菌的dal和dat基因来保证菌株可以在宿主体内生存,而且限制了细菌的增殖,避免引起强烈的器官损伤。
2.3 “Killed but metabolically active”(KBMA)菌株
使用灭活病原体是安全诱导机体免疫的最早方法之一。虽然这种灭活方法足以诱导对病原体相关免疫原的体液反应,但是对于Lm而言,无法诱导针对Lm衍生抗原的CTL免疫,即抗原无法通过MHC I类途径递呈。因此,Brockstedt等[27]开发了一种新的灭活方法构建了一种被杀死但仍具有代谢活性(KBMA)的菌株。这种灭活方法是通过用DNA嵌入剂补骨脂素处理参与核苷酸切除修复的uvrAB基因,然后将这种对光化学灭活十分敏感的缺失疫苗株暴露于UV照射下诱导DNA-补骨脂素交联,最终导致细菌不能复制。虽然细菌由于DNA交联而被功能性杀死,其仍然能够转录编码的基因,合成和分泌抗原蛋白。
KBMA菌株在保留灭活疫苗安全性优势的同时能通过MHC I类途径有效递呈抗原,并诱导必要的炎性反应以保证疫苗的免疫原性。重要的是,KBMA Lm还能够从吞噬体中逃逸并将分泌的抗原递呈至细胞溶质,用于MHC I类途径的加工和呈递[28]。用靶向模型TAA的KBMA Lm疫苗接种也已显示出与活减毒Lm菌株相当的抗肿瘤功效,如构建表达流感基质蛋白(MP)、黑素瘤相关抗原MelanA/Mart-1蛋白(LmAg)和NY-ESO-1蛋白全长(另一种黑素瘤相关抗原)的KBMA Lm疫苗均可有效靶向APC,刺激DCs的成熟,并在治疗性CT-26肿瘤模型中有减少荷瘤的功效[29]。
3 Lm在肿瘤疫苗中的应用
基于Lm的肿瘤疫苗已在不同癌症领域有所成果,表1中列举了近年来Lm肿瘤疫苗的代表性研究。
3.1 乳腺癌疫苗
乳腺癌现已成为世界女性最常见的癌症,通过接种肿瘤相关抗原(TAA)增强对乳腺肿瘤的特异性辅助和CTL反应来特异性地消除肿瘤细胞成为研究重点。HER-2/neu是erbB样癌基因家族的成员,与表皮生长因子受体相关,但有所不同。已有研究显示HER-2/neu基因能在30%乳腺癌细胞中扩增2倍到20倍以上[47]。Singh等[30]构建了多个重组Lm菌株表达不同HER-2 / neu片段与截短溶血素O(LLO)的融合蛋白,分别为Lm-LLO-EC1、Lm-LLO-EC2、Lm-LLO-EC3、Lm-LLO-IC1和Lm-LLO-IC2,结果发现构建的每一株疫苗株都能使NT-2肿瘤细胞生长停滞,甚至有些出现减退现象,但对于缺乏雌激素受体(ER)、孕激素受体(PR)或HER-2基因的三阴性乳腺癌患者无效[48]。
黑素瘤抗原基因Mage是在人乳腺肿瘤活检中检测率高达92%的肿瘤相关抗原。Kim等[13,31]构建了表达Mage-bcDNA位置311~660的Lm-LLO-Mage-b/2nd疫苗,使小鼠4T1乳腺肿瘤模型中的转移灶数量显著减少了96%。由此可见,Lm-LLO-Mage-b/2nd具有作为切除原发性肿瘤后用于预防并消除转移和残留肿瘤细胞的潜力。后续实验中还发现,对照载体Lm-LLO在此类疫苗清除肿瘤中的作用甚至比肿瘤相关抗原起到的免疫作用更好。
survivin基因在4T1乳腺癌细胞系中表达,且被证实与细胞凋亡抗性相关。Jahangir等[32]通过不同治疗频次的免疫,发现Lm-survivin疫苗可以克服免疫抑制并激活TAA和Lm特异性CD8+T细胞,并且在年轻小鼠身上显示出抗肿瘤效果。
3.2 肝癌疫苗
肝脏是多种癌症的主要转移部位,尤其是胃肠部位的癌症[33],因此肝转移瘤是肝细胞癌(hepatocellular carcinoma,HCC)的一大分支。Olino等[34]评估LmD-AH1菌株在结直肠癌细胞CT26肝转移瘤模型中的效果。AH1是由2H-2Ld限制性肽段和β-半乳糖苷酶控制肽段组成,且是小鼠结肠癌细胞CT26肿瘤相关免疫显性抗原。实验结果显示,用该Lm菌株治疗肝转移瘤小鼠能产生强烈的初始肿瘤特异性细胞毒性CD8+T细胞应答,成功治疗了90%的动物。该疗法还刺激机体产生肿瘤抗原特异性中枢记忆性T细胞和效应记忆性T细胞,并保护其免受肿瘤再攻击。LmD-AH1菌株还在肿瘤微环境中表现出免疫检查点分子PD-1表达的下调作用。
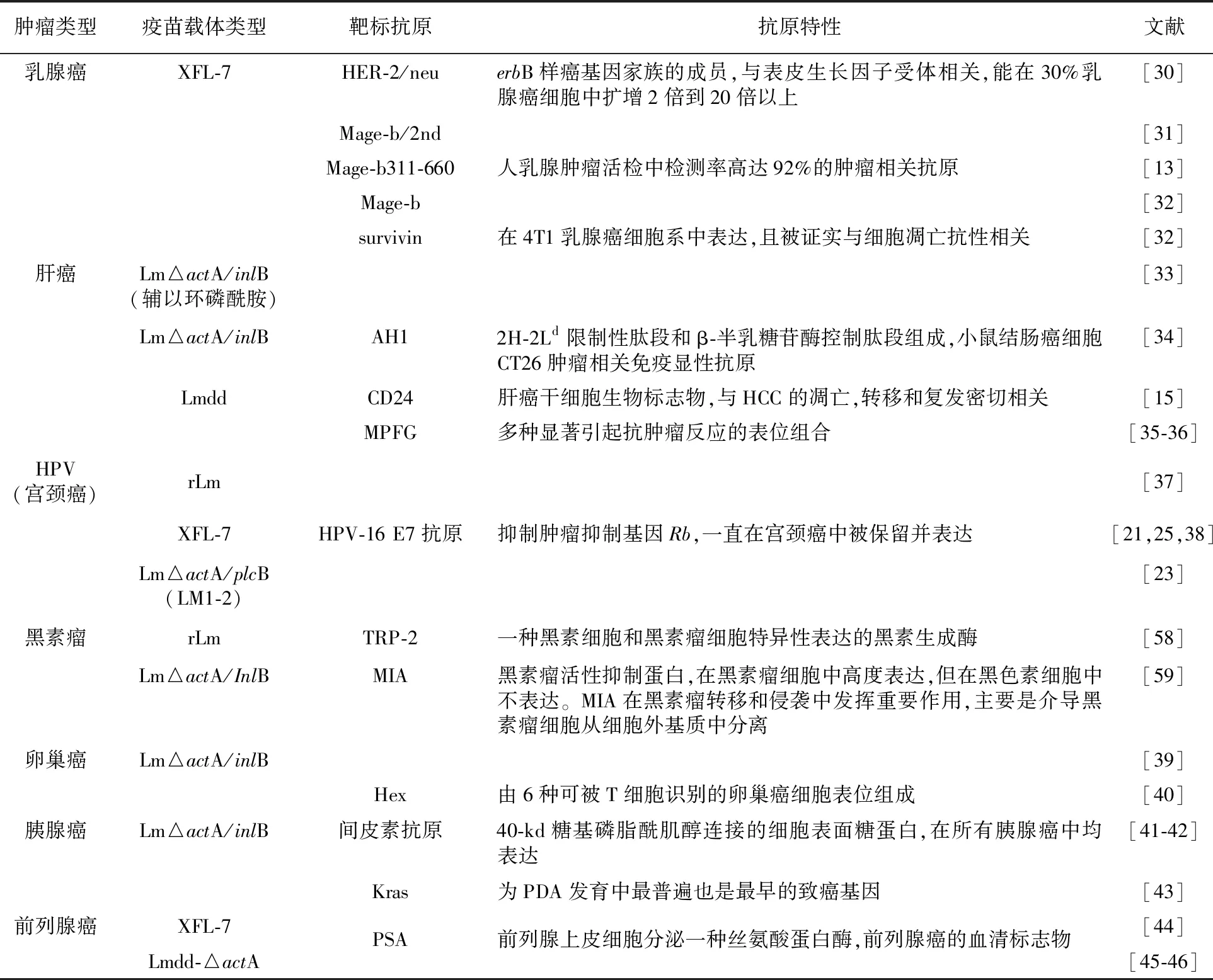
表1 Lm在不同肿瘤疫苗中的应用
已有研究表明单个靶向TAA突变的疫苗可能存在脱靶现象。为此许多研究者已开发了多价治疗性肿瘤疫苗。Chen等[35]开发的Lmdd-MPFG就是复合了多个强特异性肿瘤相关抗原肽段基因的疫苗。其融合蛋白MPFG表达了整个HBV核心蛋白(HBc)以及经过验证的HLA-A2表位,还包括HBV-X蛋白HBx52-60、 HBx140-148,甲胎蛋白AFP158-166和黑素瘤抗原基因MAGE-3271-279。在用Lmdd-MPFG第1次免疫3 d后,就出现巨噬细胞对重组菌株的清除。但Lmdd-MPFG免疫也产生了强烈的抗肿瘤反应,如在预防和治疗环境中免疫小鼠对MPFG阳性Hepa1-6细胞攻击的显著抗性。同时肿瘤消退伴随着增强的CTL应答和肿瘤中调节性T细胞的减少。Lmdd-MPFG疫苗在体外可引起DC的成熟,Wan等[36]证明了TLR4和NLRP3或NOD1信号通路在Lm诱导的DC激活中的协同作用。这些研究均证明基于Lm多价疫苗的研究确实有助于HCC的治疗。
随着对肝细胞癌研究的不断深入,新的肿瘤标志物也在不断被发现。CD24是一种肝癌干细胞生物标志物,与HCC的凋亡、转移和复发密切相关。在Yang等[15]的研究中Lmdd-CD24有效地增加了产生IFN-γ的CD8+T细胞的数量和IFN-γ的分泌量。与此同时产生IL-4和IL-10的Th2细胞数量也有增长。进一步研究Lmdd-CD24疫苗对抗Hepa1-6-CD24肿瘤的作用,发现Lmdd-CD24显著降低了小鼠的肿瘤大小并增加了它们的存活率。值得注意的是,在肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)中观察到调节T细胞数量的减少和特异性CD8+T细胞活性的增强。这些结果表明,Lmdd-CD24疫苗可能在未来治疗HCC的应用中颇具前景。
3.3 宫颈癌疫苗
1997年人们曾使用Lm构建兔乳头瘤病毒(CRPV)疫苗,结果表明表达分泌病毒E1蛋白的E1-rLm免疫产生全身性抗CRPV E1细胞介导的免疫应答,其保护远系繁殖的兔子免受CRPV或CRPV DNA诱导的肿瘤侵袭[49]。宫颈癌是最常见的病毒诱发癌症之一,是人乳头瘤病毒(HPV)转化株慢性感染的结果。人乳头瘤病毒16型(HPV-16)是宫颈癌的主要病原体,编码3种转化癌基因:E5、E6和E7。特别是早期基因E6和E7,由于它们分别抑制肿瘤抑制基因p53和Rb而使乳头状瘤恶化。其中E7蛋白一直在肿瘤中被保留并表达,因此是宫颈癌疫苗靶标抗原的理想选择[50]。Lin等[37]研究了一种基于Lm的口服疫苗rLM-E7。当口服给予同系小鼠时,rLM-E7可诱导CTL反应,通过CD8+依赖性CTL预防和根除肿瘤生长。虽然有研究表明宫颈癌患者经常表现出免疫耐受[51],但在Sewell等[52]的研究中却看到了乐观的结果:利用对E6、E7抗原免疫耐受的转基因小鼠模型进行实验,发现基于Lm的HPV 16-E7疫苗有抑制肿瘤生长的效果,并且在脾、肿瘤和外周血中能刺激产生更高数量的抗原特异性CD8+T细胞。该研究表明,基于Lm的疫苗具有减缓肿瘤生长并破坏免疫耐受的潜质。
ADXS11-001,也称为Axalimogene Filolisbac或AXAL,是一种针对由人乳头瘤病毒(HPV)引起的癌症疫苗,已进行临床研究。在以XFL-7菌株为载体的基础上,设计E7蛋白与tLLO组成分泌的融合蛋白。该免疫疗法已经表现出能够延长晚期癌症患者的生存时间。与此同时,人们还发现,这款疫苗在对口咽癌和肛门癌的免疫和临床反应方面也有功效[38,53-55]。
3.4 黑素瘤疫苗
早在1999年Pan等[56]就开始了基于Lm的黑素瘤免疫疗法的探索,在高致瘤性小鼠黑素瘤模型B16F10中使用了表达流行性感冒核蛋白NP的Lm-NP疫苗,结果表明Lm对于肿瘤有着非特异性免疫,在没有肿瘤相关抗原的情况下也能有效减少黑素瘤。在使用Lm-NP进行免疫后更是发现其黑素瘤肺转移得到改善。应用于肿瘤疫苗载体的多种减毒Lm菌株可在进入细胞质后产生I型IFN,激活NK细胞,从而抑制移植的B16F10黑素瘤细胞生长[57]。
在之后的研究中,新的肿瘤相关抗原也被逐渐发现并应用于Lm黑素瘤疫苗的构建中。酪氨酸酶相关蛋白-2(TRP-2)是一种黑素细胞和黑素瘤细胞特异性表达的黑素生成酶。Bruhn等[58]构建了单独表达TRP-2、NP蛋白,表达TRP-NP融合蛋白,以及表达TRP-hly-NP融合蛋白的4株Lm重组疫苗,在用B16肿瘤细胞攻击后发现仅带有TRP-2的Lm疫苗显示出显著降低肿瘤负荷的功效。
黑素瘤活性抑制蛋白(MIA)也是一种肿瘤相关抗原,它在黑素瘤细胞中高度表达,但在黑色素细胞中不表达。MIA在黑素瘤转移和侵袭中发挥重要作用,主要是介导黑素瘤细胞从细胞外基质中分离。在Qian等[59]的研究中,注射△actA△InlB-Lm-MIA组的效果最好,能在第7天实现87.5%的零肿瘤率。
近几年研究人员在探索将放射疗法与基于Lm的免疫疗法相结合的新疗法。Lim等[60]就在B16-OVA黑素瘤模型中试验将15Gy的放射治疗与表达OVA抗原的ΔactA/ΔinlBLm (Lm-OVA)疫苗相结合。结果表明在阻碍黑素瘤细胞增长的评估中,这种复合疗法比其中任意一种单一疗法效果都要显著,并且能增加肿瘤浸润型CD8+T细胞和CD4+T细胞。更有新的机制显示,Lm-LLO疫苗能够将黑素瘤细胞转化为被激活的成熟树突细胞,具有抗原处理能力的同时还能去除Lm[61]。
3.5 胰腺癌疫苗
在美国,胰腺癌是第四大癌症相关死亡诱因[62]。目前手术切除仍被认为是胰腺癌的惟一治愈性治疗方法,但在诊断时也仅有20%患者的肿瘤是可切除的[63]。其他的胰腺癌常用疗法有化疗和放射疗法,但目前仍无法显著提高生存期,且术后患者也有较高的复发率[64]。因此,人们试图通过靶向具有降低治疗相关毒性潜力的癌症特异性抗原,以期能达到治疗胰腺癌的目的。
间皮素是一种40 kd糖基磷脂酰肌醇连接的细胞表面糖蛋白,存在于胸膜、腹膜和心包内衬的正常间皮细胞上,这种蛋白在正常胰腺组织和慢性胰腺炎中均没有表达,但在所有胰腺癌中均表达,是在胰腺癌疫苗中使用最多的靶标抗原[65]。目前表达人类间皮素的Lm疫苗CRS-207已进入临床试验。虽然前期有数据显示CRS-207与Cy/GVAX联用能提高患者存活率,且毒性较小[42]。但2017年美国临床肿瘤学学会(American Society for Clinical Oncology)在一次会议上提交的数据显示,单独使用CRS-207(5.4个月)或使用Cy/GVAX结合CRS-207(3.8个月)与标准护理化疗(4.6个月)相比,并没有明显改善存活率,也没有重大的安全性发现[66]。
Kras基因作为人类胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDA)发育中最普遍也是最早的致癌基因,成为治疗胰腺癌疫苗的靶标[67]。Keenan等[43]发现,免疫Lm-KrasG12D菌株后可以减少Treg细胞的消耗,从而减少早期胰腺上皮内肿瘤(pancreatic intraepithelial neoplasms,PanINs)的进展。这种方法增加了病灶与炎性细胞的浸润。也许可以通过设计免疫疗法来治疗胰脏癌前病变,以减缓或防止早期PanINs发展为PDA。
3.6 其他肿瘤疫苗
Lm疫苗除了在上述癌症中有较为广泛的研究,在卵巢癌、前列腺癌等方面也有相关应用的研究。Sinnathamby等[40]构建了多组以Lm为载体单一或串联表达卵巢癌特异性T细胞表位的Lm-Hex菌株。进一步研究显示重组Lm感染后,表位特异性CTL能够识别表达单个或多表位的靶细胞。通过质谱法可从Lm-Hex感染的THP-1细胞免疫沉淀的6种HLA I类/肽复合物中鉴定出3种,说明基于Lm的卵巢癌疫苗是具有开发前景的。在Lm疫苗应用于前列腺癌的研究中已经有基于LmddA菌株表达PSA抗原的ADXS31-142疫苗进入临床试验,接种ADXS31-142后能够引发肿瘤清除所需的有效免疫应答,并检测到肿瘤内环境中显著的PSA特异性T细胞浸润,证明该疫苗具有良好的免疫治疗前列腺癌的效果[45]。
4 展 望
Lm本身具有胞内寄生特性及能激起人体免疫的MHCⅠ和MHCⅡ两种免疫递呈途径,使其在作为肿瘤疫苗载体方面更具优势。目前,我们团队在构建减毒Lm菌株上已有一定的研究基础。在之前的研究中已经成功构建actA、inlB、actA/inlB、inlA/inlB、vip、prfA、srtA、sigB等Lm基因缺失突变菌株。在此基础上检测了以上不同菌株相关毒力基因的转录水平,并且探究了各减毒株在小鼠模型中引起的免疫应答特征[68]。除以上基因缺失突变株外,我们实验室还成功构建了Lm平衡致死菌株。在减毒Lm的应用中,率先将其应用到水产疫苗方面。结果显示,携带OmpK靶标的减毒Lm能在一定程度上保护斑马鱼免受弧菌的侵害[69]。因此进一步计划将已构建的减毒Lm菌株应用到肿瘤的免疫治疗中。
在安全性方面,目前用于肿瘤疫苗研究的载体菌株在实验中已被证实在一定程度上不会出现返毒现象,具有稳定性。临床试验中,除了有少数被试者在注射Lm疫苗后出现流感症状外,并无明显的毒副作用。相比于传统的化疗和放疗,Lm疫苗所引起的副作用要小。目前由于CAR-T细胞疗法、PD-1/PD-L1等疗法的兴起,加之基于Lm的疫苗本身具有的一些缺陷,例如外源抗原表达方式不够优化,使得载体本身激起的免疫反应超过其所携带的外源抗原,造成特异性抗肿瘤效果不够明显,使Lm疫苗的研究进度略显迟缓,还有部分进入临床的Lm疫苗最终夭折,然而这并不代表Lm癌症疫苗不再具有开发前景。近年在Lm疫苗的构建中携带放射性元素,与治疗性抗体或与破坏肿瘤微环境的免疫佐剂联合使用的疫苗策略已在实验中显示出优势,可能成为未来Lm疫苗的发展趋势。

