1株水产饵料用光合细菌粪红假单胞菌的分离筛选
王 蕊, 付维来, 汪 攀, 杨章武, 林克冰, 易敢峰*
(1.福建大北农水产科技有限公司,福建 漳州 363500;2.北京大北农科技集团股份有限公司饲用微生物工程国家重点实验室,北京 100080;3.福建省水产研究所,福建 厦门 361012)
光合细菌是一类以光作为能源进行光合作用的微生物的总称。根据光合作用是否产生氧气可分为放氧光合细菌(蓝细菌)和不放氧光合细菌(Anoxygenic Phototrophic Bacteria,APB)[1]。APB能在厌氧光照或好氧黑暗条件下利用有机物、硫化物、氨等作为供氢体兼碳源进行光合作用,因此广泛应用于污水治理、餐厨垃圾处理、种植业、畜禽及水产养殖环境净化中[2-4]。光合细菌菌体具有很高的营养价值,其菌体蛋白质含量达40%~80%[5],在畜禽养殖中作为单细胞蛋白添加到饲料中,可提高畜禽的生长性能和免疫力。在水产动物鱼虾贝类的幼苗养殖中,可以为水产动物幼苗提供开口饵料或作为其饵料动物的饵料,如轮虫、卤虫等浮游动物的饵料,间接促进水产动物生长[6]。光合细菌菌体还含有丰富的类胡萝卜素及辅酶Q(CoQ)等抗氧化活性物质,并有促进抗氧化酶活性的功能[7-8]。因此在食品、化妆品及医药业中有重要的应用价值。目前对光合细菌的研究主要集中在光合细菌产氢、净化水质、高产类胡萝卜素光合细菌的筛选或高产辅酶Q的光合细菌的筛选方面,而通过综合指标筛选营养较丰富的光合细菌菌株的研究较少。本研究从对虾养殖池塘采集样品分离光合细菌,旨在通过菌液性状、蛋白质、氨基酸、类胡萝卜素、辅酶Q种类及含量综合指标的分析,筛选出适用于水产动物生物饵料的光合细菌菌株。
1 材料与方法
1.1 材料
1.1.1 样品来源 本实验室在辽宁沈阳、湖南常德、广东台山、福建漳州分别采集凡纳滨对虾养殖池塘池水和底泥样品共计42份,池水pH 8.0~8.5。
1.1.2 培养基 富集培养基参考文献[9]稍作修改:酵母粉1 g,氯化铵1 g,碳酸氢钠 2 g,三水合乙酸钠3 g,氯化钠2 g,磷酸氢二钾 0.2 g,七水合硫酸镁0.2 g,蒸馏水1 L,pH 7.0;制种培养基为ATYP培养基,参考文献[10]稍作修改:酵母粉0.5 g,蛋白胨0.3 g,氯化铵1 g,氯化钠1 g,三水合乙酸钠1 g,二水合丁二酸钠1 g,磷酸二氢钾 0.5 g,六水合氯化镁0.5 g,无水氯化钙0.1 g,蒸馏水1 L,pH 7.0。
1.1.3 主要试剂及仪器 无水乙醇和甲醇(赛默飞世尔科技,色谱级),辅酶Q10标准品(Sigma),氢氧化钠、4%硼酸溶液、五水合硫酸铜、无水硫酸钠、浓硫酸、0.1 mol/L盐酸标准液、丙酮、正己烷、石油醚,除无水乙醇和甲醇为色谱醇,其余试剂为分析纯,北京化工厂生产。厌氧培养箱(Thermo Scientific 1029),旋转减压蒸馏仪(上海亚荣生化仪器厂),消煮炉(苏州江东精密仪器有限公司),酸式滴定管(杭州优育化工仪器有限公司),氨基酸自动分析仪(日立835-50型),离心机(HITACHI 16RXII)、酶标仪(BioTek),液相色谱仪(北京创新通恒科技有限公司,LC3000)、盐度计WZ201(北京万成北增精密仪器有限公司)。
1.2 方法
1.2.1 菌株富集、分离、纯化及形态观察 将样品加入含15 mL富集培养基的厌氧管中,覆盖1~2 cm石蜡油,30 ℃光照培养至液体变红。取10-3~10-6稀释度菌液均匀涂布于富集培养基琼脂平板上,30 ℃置于厌氧培养箱光照培养5~7 d至有红色菌落长出,纯化2~3次,-80 ℃冰箱甘油保存。吸取少量无菌生理盐水于干净载玻片上,接种环蘸取培养好的菌液,涂匀玻片,干燥、固定,革兰染色,镜检观察。
1.2.2 菌株培养 取单菌落接种于含ATYP培养基的厌氧管中,30 ℃光照培养至液体变红。以2%接种量接种于灭菌的500 mL ATYP培养基盐水瓶中。30 ℃光照培养7 d,观察菌液颜色、均一度。选取培养液颜色鲜艳、均一、不易贴壁的菌株备用。
1.2.3 蛋白质含量测定 ①制备干菌体:活化光合细菌菌株。从甘油管中取出1 mL至装有10 mL培养基的厌氧管中光照培养5~7 d,OD6000.8~1.0。全部接种于含400 mL培养基的盐水瓶中,30 ℃光照培养5~7 d,OD600为0.8~1.0,8 000 r/min离心5 min,无菌生理盐水洗涤2次,收集菌体。60 ℃烘干至恒重备用。②蛋白质含量测定:参照中华人民共和国专业标准《全氮和粗蛋白测定法》ZB X 66026-87测定。以粗蛋白含量>60%为标准,筛选待测菌株。
1.2.4 类胡萝卜素的提取与含量测定 ①色素提取:按照1.2.3制备干菌体,并计算1 mL菌液中的菌体干重。抽提方法参考文献[11]稍有改动,菌液8 000 r/min离心10 min,去上清,沉淀用无菌生理盐水洗涤2次,用20 mL预冷的V丙酮∶V甲醇溶液=7∶2,溶解菌体细胞沉淀,室温下避光振荡20 min,超声10 min,再次8 000 r/min离心5 min,取上清,沉淀重复抽提2~3次直至菌体无色,记录总毫升数v。②类胡萝卜素定量分析:色素提取液经300~900 nm波段光谱扫描,得到最大吸收波长λmax,并测定ODλmax。依据Jessen[12]公式:C(mg)=D×V×f×10/2 500,计算类胡萝卜素含量,SPSS(20.0)进行显著性分析。式中:C 为总类胡萝卜素含量(mg);D为最大吸收波长处光密度值;V为提取液总体积(mL);f为稀释倍数;2 500为类胡萝卜素平均消光系数。
1.2.5 氨基酸种类及含量测定 制备光合细菌干菌体(制备方法同上),样品送农业部饲料工业中心检测。分析氨基酸种类及含量。
1.2.6 辅酶Q种类及含量测定 ①辅酶Q提取:提取方法参考文献[13]。②辅酶Q标准曲线制作及种类和含量检测:5 mg Q10标品溶于25 mL正己烷容量瓶中,震荡摇匀至刻度处,终浓度为200 μg/mL。分别量取储备液1.25、2、2.5、5 mL置10 mL容量瓶中,正己烷稀释至刻度待测。色谱柱为Diamonsil C18 (200 mm×4. 6 mm,i.d. 5 μm),以甲醇∶无水乙醇( 30∶70)为流动相,检测波长为275 nm,柱温25 ℃,进样20 μL,流速1 mL/min。进样前用无水乙醇稀释2倍,20 μL进样量。制作275 nm处的吸收峰面积与浓度的关系曲线。待测样品用无水乙醇稀释2倍,进样量20 μL,重复检测3次。
1.2.7 菌株鉴定 ①生理生化测定:参照《伯杰氏细菌鉴定手册》第9版的生理生化指标对菌株进行生理生化测定。②菌株16S rRNA基因序列测定:利用细菌16S rRNA gene通用引物27F/1492R进行菌落PCR扩增,将扩增成功的样品测序得到16S rRNA基因序列,NCBI进行BLAST比对。该菌的分类地位通过Neibour-joining系统发育进化树分析。③待测菌株对盐度的耐受性:培养基为ATYP培养基,海盐调节培养基盐度,设5‰、10‰、15‰、20‰及25‰五个梯度。接种量10%,30 ℃光照培养。测定光合细菌在不同盐度培养基中的生长情况,每隔12 h检测OD660。
2 结果与分析
2.1 菌株富集、分离筛选结果
经富集、分离纯化,从池水及底泥中共得到35株光合细菌,其中菌株Rh16菌体弧状,革兰染色阴性(图1A),厌氧培养菌落红色,针尖状(图1B),菌液鲜红色(图1C)。35株待测菌经ATYP培养基培养,培养液颜色差异较大,表现为黄色、棕色、浅粉色、鲜红色,随着培养时间的延长,部分菌株培养液有絮凝、沉淀和贴壁现象。颜色较为鲜艳且菌液均一度较好、不易贴壁的菌株有11株(样品信息见表1)。
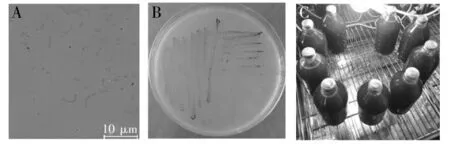
图1 菌株Rh16菌体形态(A)、菌落形态(B)及培养液外观(C)Fig.1 Microscopic image(A),colony morphology(B) and bacterial fluid appearance(C) of strain Rh16
2.2 蛋白质含量测定
如图2所示为11株待测菌株的粗蛋白含量,其中9株光合细菌菌株Rh01、Rh06、Rh16、Rh23、Rh25~Rh28及 Rh34的粗蛋白含量>60%,Rh34含量最高,达到72.09%。以粗蛋白含量>60%的菌株作为备选菌株进行后续指标检测。
2.3 类胡萝卜素的提取与含量测定
图3为菌株Rh16活细胞光谱扫描图,以菌株Rh16为例,待测菌株在365、600及770 nm处有吸收峰,表明该菌含有细菌叶绿素a。在460、480和510 nm有特征性吸收峰,表明类胡萝卜素为螺菌黄质系列。类胡萝卜素在波长480 nm处有最大吸收峰,因此以480 nm处的光密度值计算类胡萝卜素含量。经检测,每毫升菌液含0.001 g干细胞。每克干细胞类胡萝卜素含量如图4所示:菌株Rh16、Rh25及Rh34类胡萝卜素含量较高,分别为3.69、3.60 和3.49 mg/g,与菌株Rh01、Rh06、Rh23、Rh26、Rh27及Rh28差异显著(P<0.05)。
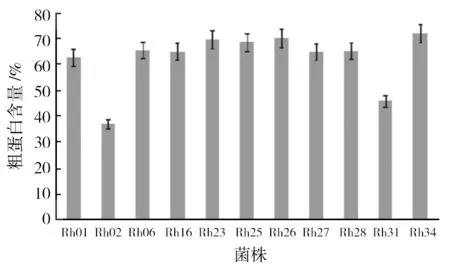
图2 光合细菌菌株粗蛋白含量Fig.2 The content of crude protein of photosynthetic bacteria isolates
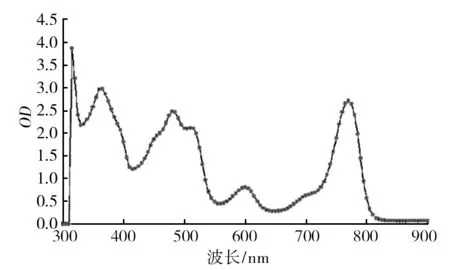
图3 Rh16活细胞吸收光谱图Fig.3 Living cell absorbtion spectrum of strain Rh16
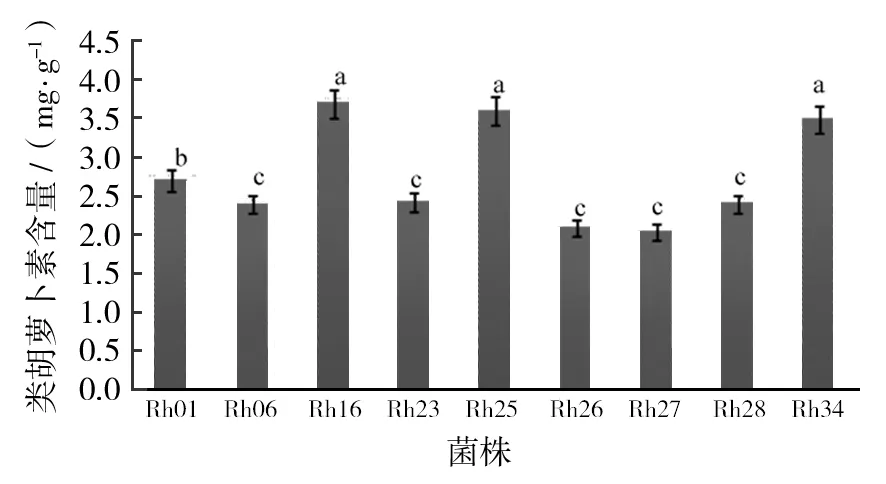
图4 各菌株类胡萝卜素总量Fig.4 Total content of carotenoid of different strainsa、b、c代表显著性差异水平,图6同a,b and c represent different significant levels,Fig.6 same
2.4 氨基酸种类及含量测定
氨基酸种类及含量如表2所示,菌株Rh16、Rh25及Rh34菌体氨基酸种类齐全,必需氨基酸种类中比例最高的均为亮氨酸,分别为5.46%、5.31%和5.28%,且3株菌必需氨基酸与总氨基酸的比值分别为41%、41%及40%。必需氨基酸(除色氨酸外)与非必需氨基酸的比例分别为0.695 3、0.682 7及0.656 7。根据FAO/WHO 联合食品标准计划理想模式,必需氨基酸与非必需氨基酸比值在0.6以上,因此所测3株菌株是氨基酸组成较为理想的光合细菌菌株。
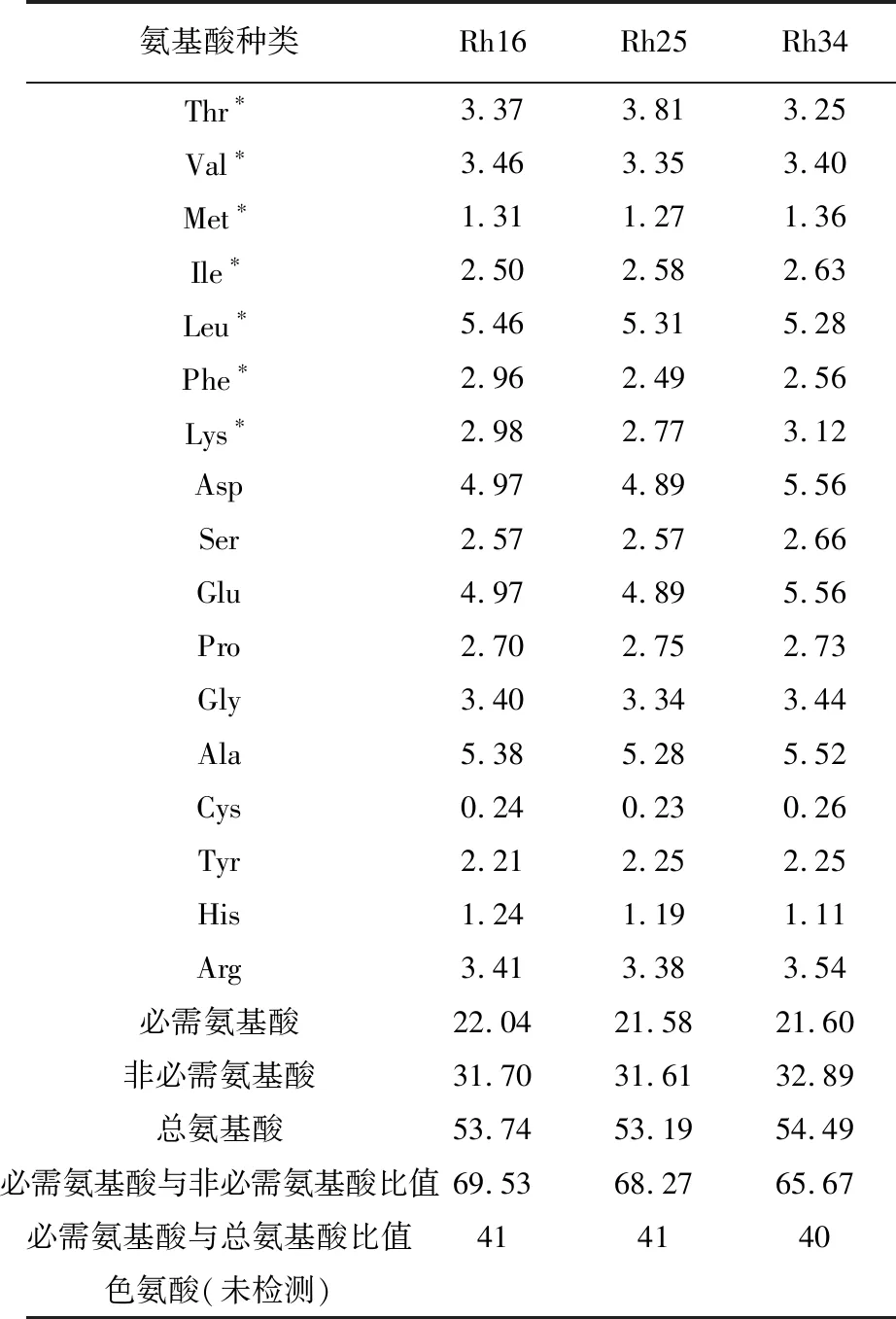
表2 待测菌株氨基酸类型及百分比含量(%)
注:*为必需氨基酸
2.5 辅酶Q种类及含量测定
经检测,菌株Rh16、Rh25及Rh34的辅酶Q检测出峰时间相同。以菌株Rh16为例,如图5所示为Q10标准品(图5A)及待测样品辅酶Q(图5B)提取液的 HPLC检测结果,可以看出待测样品的出峰时间与Q10标准品的出峰时间相同,均为16.047 min,因此所测菌株辅酶Q类型为Q10,通过标准曲线计算光合细菌样品中辅酶Q10含量,结果如图6所示,待测样品中Rh16的辅酶Q10含量最高,达6.49 μg/mL菌液,显著高于Rh34、Rh25(P<0.05)。因此Rh16菌株为综合营养指标优异菌株。
2.6 菌株鉴定
2.6.1 生理生化测定结果 菌株Rh16的生理生化测定指标如表3所示:菌体为弧状,直径0.6~0.8 μm,培养液为鲜红色,最适pH为7.0,最佳生长温度为38 ℃,可以利用丙酸盐和果糖,不能在有氧黑暗条件下生长,不能利用硝酸盐、苯甲酸、天冬氨酸、柠檬酸、葡萄糖、酒石酸、硫代硫酸盐和木糖,与模式菌株RhodopseudomonasfaecalisgcT相似。
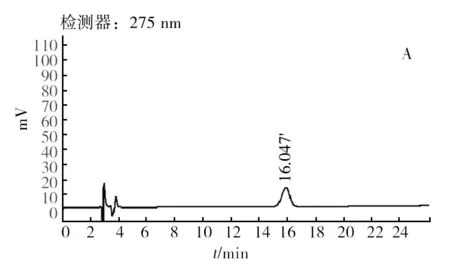
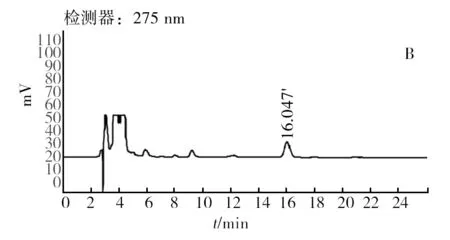
图5 CoQ10标准品(A)及待测样品(B)的HPLC检测结果Fig.5 The HPLC chromatograph of the CoQ10 standard substance solution(A) and Rh16 CoQ sample solution(B)
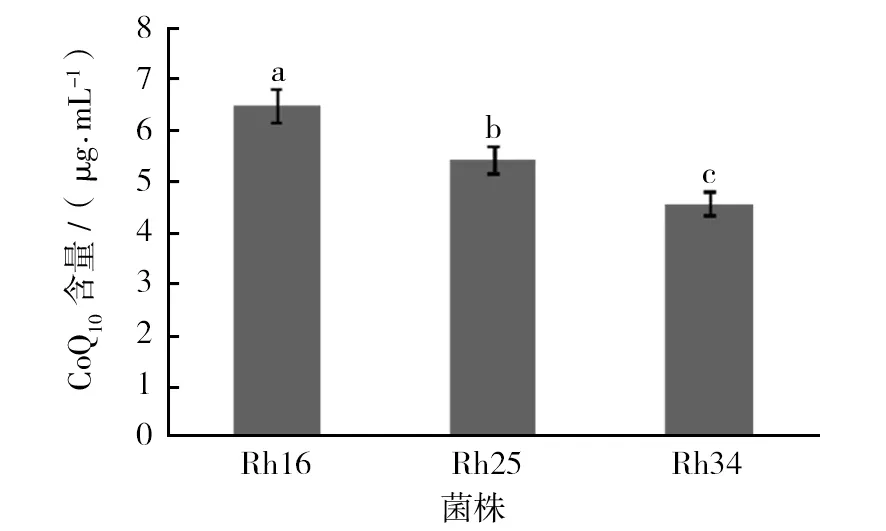
图6 菌体CoQ10含量Fig.6 The content of CoQ10 in different strains

表3 菌株Rh16与相近菌株的生理生化特征
注:+:生长;-:未生长;±:较弱
2.6.2 菌株16S rRNA基因测定结果 16S rRNA基因系统发育分析(图7)表明:菌株Rh16与Rhodopseudomonasfaecalis模式菌株gc聚在一起,处于同一小分支。相似性结果表明菌株Rh16与RhodopseudomonasfaecalisgcT最近,相似性距离为99.9%,其次与RhodopseudomonaspentothenatexigensJA 575T和RhodopseudomonaspalustrisATCC 17001T较近,相似性距离分别为99.2%、99.1%。结合其菌体形态及生理生化指标,菌株Rh16归属为Rhodopseudomonasfaecalis,16S rRNA基因GenBank序列号为KJ776421。
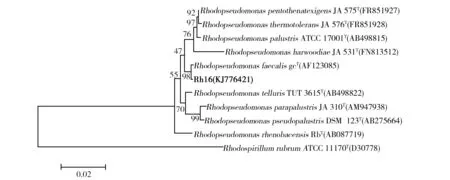
图7 菌株Rh16与近源模式种16S rRNA基因系统发育树Fig.7 Phylogenetic tree based on 16S rRNA sequences of strain Rh16 and type strains in genus Rhodopseudomonas分支点处的数字代表邻接法分析中计算1 000次重复数据集的步长值,0.02代表序列差异Numbers at the branch points indicated the bootstrap values on Neighbor-Joining analysis of 1 000 replications deta sets,Bar 0.02 represents sequence divergence
2.6.3 待测菌株对盐度的耐受性 由于菌株Rh16来自于淡水样品,因此本研究探究了该菌在不同盐度条件下的生长情况。图8为菌株Rh16菌株在5‰~25‰盐度范围内的生长曲线。结果表明,5‰~15‰是菌株Rh16较为合适的生长盐度,OD660可以达到0.8,盐度在20‰以上时生长缓慢,25‰时OD660达到0.5趋于稳定。
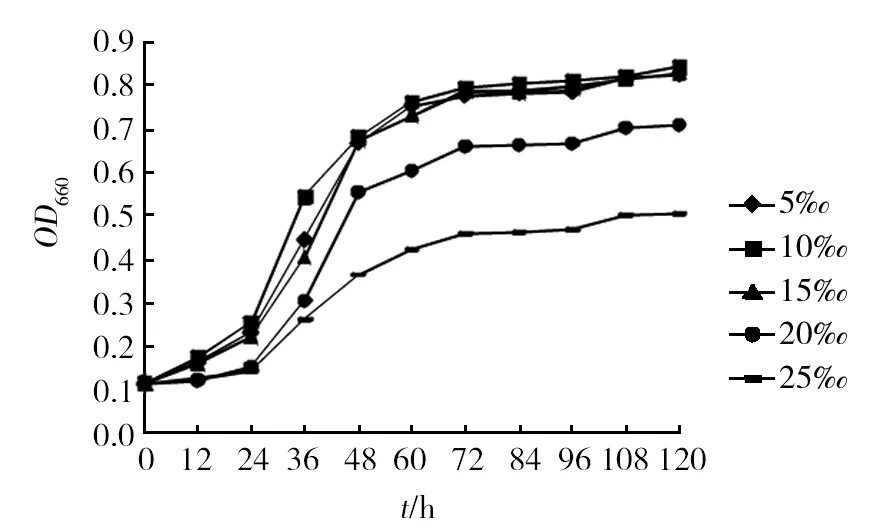
图8 菌株Rh16对盐度的耐受性Fig.8 Salt tolerance test of strain Rh16
3 讨 论
光合细菌在自然界中分布广泛,在水生环境中尤为丰富。其营养成分受菌株、培养基种类及培养条件的影响,因此在同一生长条件下衡量菌株的营养价值十分重要。本研究从对虾养殖池塘采集样品,分别用富集培养基分离,ATYP培养基培养。30 ℃光照下统一获得光合细菌菌液。按照粗蛋白、类胡萝卜素、氨基酸、辅酶Q依次进行检测筛选。
蛋白质及氨基酸是水产动物饲料的主要营养成分,也是评价饲料营养价值的重要指标。本研究中检测的光合细菌,粗蛋白含量>60%的菌株有9株,最高达72.09%,比吴向华等[14]报道的沼泽红假单胞菌高10%,比庄传东[15]报道的沼泽红假单胞菌Z2高14%。王绍校等[16]报道4株海洋光合细菌的粗蛋白含量为55%左右,最高达64.2%,也低于本研究中筛选菌株的粗蛋白含量。本研究中筛选到的菌株Rh16氨基酸总量为53.74%,氨基酸比值为41%,比张新英等[17]分离自罗氏沼虾苗池的红假单胞菌氨基酸总量高42.35%,其氨基酸比值低45%。
类胡萝卜素是一类天然的着色剂,其中β-胡萝卜素是维生素A的前体,具有增加机体免疫力和抗氧化的功能。据已有研究报道生产类胡萝卜素的微生物有霉菌、酵母菌、光合细菌及奇球菌属的部分种[11,18]。虽然霉菌及酵母菌生产类胡萝卜素的产量远远高于细菌,但是其种类较为单一。而光合细菌合成的类胡萝卜素种类高达80种,受到众多研究学者的重视。类胡萝卜素含有共轭双键系统,其共轭双键的数量及位置使其呈现鲜艳的颜色及特定的吸收光谱,大多数类胡萝卜素具有三指状特征吸收峰[19]。与已有报道相似,本研究中提取到的类胡萝卜素呈现三指状吸收峰,为螺菌黄质系列。含量可达3.69 mg/g干细胞,高于肖亦农等[20]人研究的2.125 mg/g,但是低于李尽哲等[21]的9.43 mg/g。
泛醌,又称辅酶Q(CoQ),是一类脂溶性的醌类化合物,是呼吸链中重要的电子传递体和递氢体,具有抗氧化、抗衰老、提高机体免疫力的功能。其侧链异戊二烯单元的数目可以作为细菌及酵母菌的常规鉴定及新种分类鉴定[22]。光合细菌的泛醌类型为Q10,以红假单胞菌属产量最高。本研究中筛选的菌株Rh16Q10含量达到6.49 μg/mL,相当于6.49 mg/g干细胞,低于方立超等[23]选育的菌株2c及李迅等[24]选育的LZC的辅酶Q10产量。辅酶Q10目前的主要获得途径是化学合成,因此筛选高产Q10的菌株具有十分重要的意义。
本研究中筛选到的菌株Rh16与红假单胞菌属中的RhodopseudomonasfaecalisgcT的特征相似。异养、光照厌氧生长,不能在好氧黑暗状态下生长,不能利用天冬氨酸。且与RhodopseudomonasfaecalisgcT的16S rRNA 基因相似性最高,为99.9%;而RhodopseudomonaspentothenatexigensJA 575T和RhodopseudomonaspalustrisATCC 17001T均可以在好氧黑暗条件下生长,可以利用天冬氨酸,与菌株Rh16的相似性为99.2%和99.1%。因此,菌株Rh16鉴定为Rhodopseudomonasfaecalis。
不同生态环境样品分离的菌株对环境的适应性差异明显。光合细菌作为活细胞制剂应用时,只有在符合其生长条件的环境中才能发挥相应的作用。黄宁宇等[25]的研究表明:对于高pH、高碳酸盐的盐碱水质中可选用荚膜红假单胞菌,而在离子比例失调和水型复杂的盐碱水质可选用广盐性的球形红假单胞菌。李坤等[26]研究了环境条件对沼泽红假单胞菌的影响,表明8‰~16‰是该光合细菌较为适合的盐度。本研究中筛选到的菌株Rh16来自于淡水养殖池塘,较适合在淡水和盐度为20‰以下的水体使用。因此,此菌株在实际使用中要考虑到当地养殖水体的盐度。

