工厂化生产海鲜菇菌包污染霉菌的鉴定及防治
赵瑞华, 张旭辉, 贺晓龙, 宋 飞
(1.延安大学 生命科学学院,陕西 延安 716000;2.陕西瑞福兴生物科技有限公司,陕西 渭南 714000)
海鲜菇(Hypsizygusmarmoreus)又名玉蕈、蟹味菇,形态美观、味道鲜美、质地脆嫩,人们常把它与珍稀的松茸相比较,并被冠以“假松茸”之称[1-2],是一种高蛋白、低脂肪,富含矿物质和维生素的保健食品,具有平衡膳食,提高免疫力,延年益寿的功效[3-9],也是我国重要的食用菌种植资源,深受消费者喜爱,产量逐年提高。但由于海鲜菇栽培周期较长,生长速度较慢,抑制杂菌能力较差,所以生产中任何时期都可能发生霉菌污染,尤其是菌丝生长阶段最易感染霉菌。霉菌病害的发生严重影响了海鲜菇的产量与品质,造成了巨大的经济损失,同时给海鲜菇产业的发展带来了严重的影响和阻碍[10-17]。在食用菌易污染的霉菌中,以毛霉、青霉和木霉的污染最为严重,青霉和毛霉可以分解有机物、产生毒素,与菌丝竞争营养与水分[18];而木霉则通过溶壁、缠绕等方式作用于食用菌菌丝细胞壁,产生毒素抑制菌丝的生长[19-21]。近年来,国内外科研人员针对食用菌霉菌污染问题做过一些相关研究,Johanna等[22]研究了木霉的生长特性;覃培升等[23]对平菇栽培料中的青霉、木霉特性进行了探究。但目前还未有关于海鲜菇栽培中污染霉菌的报道。本研究通过对海鲜菇工厂化生产菌包常见霉菌病害的调查,分离纯化得到病原菌株,将传统形态学和现代分子生物学手段相结合,对污染霉菌进行鉴定。并以此为基础探讨了常用抑菌药剂对霉菌的防治作用,为海鲜菇霉菌病害的综合防治提供参考。
1 材料与方法
1.1 材料
1.1.1 供试海鲜菇菌包 海鲜菇菌包由陕西瑞福兴生物科技有限公司提供,随机采集污染菌包,4 ℃冰箱保存备用。
1.1.2 培养基 PDB培养基:去皮土豆200 g,葡萄糖20 g,加蒸馏水定容至1 000 mL;PDA培养基:PDB培养基添加2%琼脂。
1.1.3 主要试剂 二氧化氯消毒剂(夏县瑶台生物科技有限公司)、二氯异氰尿酸钠消毒剂(威岛生物公司)、40%可湿克霉灵(湖北随缘食用菌消毒剂有限公司)、新洁尔灭(德州德新康消毒制品有限公司)、多菌灵(运城市应用化学厂)、乳酸酚棉蓝染色液(青岛捷世康生物科技有限公司)。
1.1.4 仪器与设备 全自动高压灭菌锅(CLG,致微厦门仪器有限公司);超净工作台(VD-650,力辰仪器);PCR仪(MiniAmp,赛默飞世尔科技(中国)有限公司);恒温培养箱(HAD-303A-4,北京恒奥德仪器仪表有限公司);双目生物显微镜(DM500,沈阳利昂科技有限公司)。
1.2 方法
1.2.1 霉菌的分离鉴定 ①分离纯化:对污染菌包表面杀菌消毒,用无菌剪刀切开菌包的发病部位,挑取霉菌孢子,25 ℃ PDA平板培养3 d,待长出菌落后立即纯化培养,纯化2~3次,菌株依次编号;②柯赫法则验证:将分离纯化的霉菌回接生长状态良好的海鲜菇菌包,25 ℃培养,每天观察发病情况,按照1.2.1①的方法重新分离纯化;③形态学鉴定:获得的菌株于25 ℃培养3~7 d,观察描述菌落特征。取盖玻片插入长有病原菌的PDA平板中,培养一段时间后用镊子取出,布满菌丝的一面向下置于载玻片上,用乳酸酚棉蓝染色液染色,显微镜下观察并记录菌丝和孢子特征,参照《真菌鉴定手册》进行形态描述[24];④ITS分子鉴定:将菌株接种于PDB培养基中,25 ℃,120 r/min振荡培养3 d后,挑取菌丝提取基因组DNA[25]。PCR扩增所用引物为真菌通用引物ITS 1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS 4:5′-TCCTCCGCTTATTGATGC-3′,PCR产物委托华大基因进行纯化和序列测定。测序结果与GenBank数据库中已知序列进行BLAST比较,确定种属,并从数据库获得相关ITS序列,利用MEGA 5.10计算菌株之间的遗传距离,构建系统发育树。
1.2.2 抑菌药剂的筛选 ①抑菌药剂的配制: 将二氧化氯、二氯异氰尿酸钠、40%可湿克霉灵、多菌灵和新洁尔灭与PDA培养基混匀,分别制成终浓度为0、50、100、200 mg/mL梯度的PDA平板备用;②对菌丝生长抑制作用的测定:在长满霉菌和海鲜菇菌丝的PDA平板上,用打孔器取菌龄相同的菌块(直径0.6 cm),接种于1.2.2①中制备的PDA平板中央位置,25 ℃避光培养,采用十字划线法测量菌丝生长速度。根据菌丝生长速度分析抗菌药剂的抑菌效果。
2 结果与分析
2.1 样品采集
调查发现,海鲜菇工厂化生产中菌包大面积感染霉菌的情况时有发生,主要是由于培养料灭菌不彻底或人工接种过程操作不规范等造成的,被霉菌污染的菌包外观可见明显的霉变、变色、凹陷(见图1)。
2.2 形态学鉴定
实验共分离霉菌菌株35株,经形态学鉴定初步划分为7类,分别为哈茨木霉(Trichodermaharzianum)、拟康氏木霉(Trichodermapseudoknoingii)、脉孢霉(Neurosporasitophila)、长枝木霉(Trichodermalongibrachiatum)、黑曲霉(Aspergillusniger)、产红青霉(Penicilliumrubrum)、产黄青霉(Penicilliumchrysogenum)。污染经常不是单一的,同一污染菌包一般都有几种霉菌并存。形态学鉴定结果如下:
脉孢霉:从菌落形态上看,菌丝为白色,匍匐生长;菌丝生长迅速,可在培养皿边缘产生大量白色至灰白色粉末状分生孢子团(图2A)。显微观察发现大量分生孢子,分生孢子串生成链,单细胞,易脱落,呈卵圆形,无色透明(图2B)。综合其形态学和显微观察特征,符合脉孢霉特征,初步认为该海鲜菇污染菌为脉孢霉。

图1 实验样品Fig.1 Experimental materialsA、B:受污染的海鲜菇菌包;C:1~4为受污染的海鲜菇菌包,5为正常A,B:Contaminated H. marmoreus fungus pack;C:One to four as contaminated H. marmoreus fungus pack,five as normal

图2 脉孢霉形态学特征Fig.2 Morphological characteristics of N. sitophilaA:脉孢霉的菌落形态;B:脉孢霉的显微观察特征A:Colony morphology of N. sitophila;B:Microscopic features of N. sitophila
哈茨木霉:菌落呈绒毛状,起初菌丝白色絮状,铺满整个平板后,中间部分会形成致密的产孢丛束区,呈同心圆生长;菌落逐渐老熟后,颜色由中间黄绿色边缘白色,变成整个菌落暗绿色,背面棕褐色(图3A)。孢子梗呈树状,互生或对生分枝,主轴直;小梗呈瓶状且较短,底部细,中间膨大,顶部变细;分生孢子呈球形或卵球形,由小梗相继生出(图3B)。综合其形态学和显微观察特征,符合哈茨木霉特征,初步认为该海鲜菇污染菌为哈茨木霉。
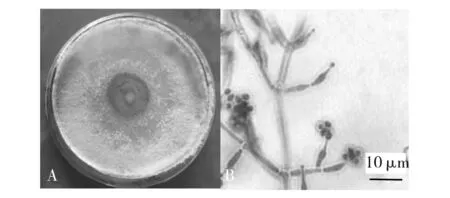
图3 哈茨木霉形态学特征Fig.3 Morphological characteristics of T. harzianumA:哈茨木霉的菌落形态;B:哈茨木霉的显微观察特征A:Colony morphology of T. harzianum;B:Microscopic features of T. harzianum
黑曲霉:菌落表面凸起,边缘粗糙,菌落初为白色,呈棉絮状;菌丝致密无褶皱,后长出黑色孢子(图4A)。分生孢子头黑褐色放射状,分生孢子梗长短不一;分生孢子呈黑褐色球形(见图4B)。综合其形态学和显微观察特征,符合黑曲霉特征,初步认为该海鲜菇污染菌为黑曲霉。

图4 黑曲霉形态学特征Fig.4 Morphological characteristics of A. nigerA:黑曲霉的菌落形态;B:黑曲霉的显微观察特征A:Colony morphology of A. niger;B:Microscopic features of A. niger
长枝木霉:菌落初为白色,最终为绿色,产孢区形成明显的同心圆环,反面变黄;气生菌丝发达,蛛网状(图5A)。分生孢子梗主轴具有较简单的次级分枝,通常具有呈直角的1~2 次分枝,单生或有时成对,常不规则;分生孢子常见单个顶生于瓶梗上,单细胞、长方形到椭圆形、绿色、光滑(图5B)。综合其形态学和显微观察特征,符合长枝木霉特征,初步认为该海鲜菇污染菌为长枝木霉。
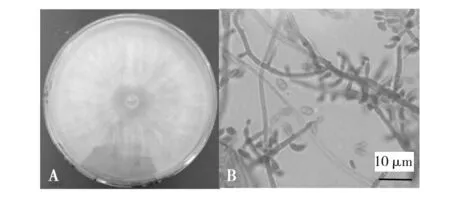
图5 长枝木霉形态学特征Fig.5 Morphological characteristics of T. longibrachiatumA:长枝木霉的菌落形态;B:长枝木霉的显微观察特征A:Colony morphology of T. longibrachiatum;B:Microscopic features of T. longibrachiatum
产黄青霉:菌落具辐射状皱纹,边缘菌丝体白色,质地绒状;分生孢子结构大量,蓝绿色,有少许浅黄色渗出液和可溶性色素,菌落背面呈浅黄褐色(图6A)。分生孢子梗上有横隔,菌丝具有隔膜,多轮分支,形状如扫帚状;分生孢子呈现圆形或椭圆形(图6B)。综合其形态学和显微观察特征,符合产黄青霉特征,初步认为该海鲜菇污染菌为产黄青霉。
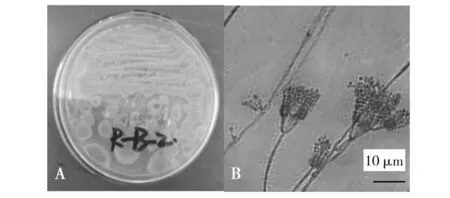
图6 产黄青霉形态学特征Fig.6 Morphological characteristics of P. chrysogenumA:产黄青霉的菌落形态;B:产黄青霉的显微观察特征A:Colony morphology of P. chrysogenum;B:Microscopic features of P. chrysogenum
产红青霉:菌落表面平坦,质地绒状或兼轻微絮状,分生孢子结构大量产生,分生孢子面绿色或灰绿色;菌丝体白色,无渗出液,背面黄绿色或淡黄色(图7A)。孢梗茎无色,壁光滑,帚状枝三轮生,偶有双轮生和四轮生,瓶梗安瓿形,梗颈短;分生孢子球形、近球形或椭圆形,壁光滑;分生孢子链呈现疏松的圆柱形(图7B)。综合其形态学和显微观察特征,符合产红青霉特征,初步认为该海鲜菇污染菌为产红青霉。
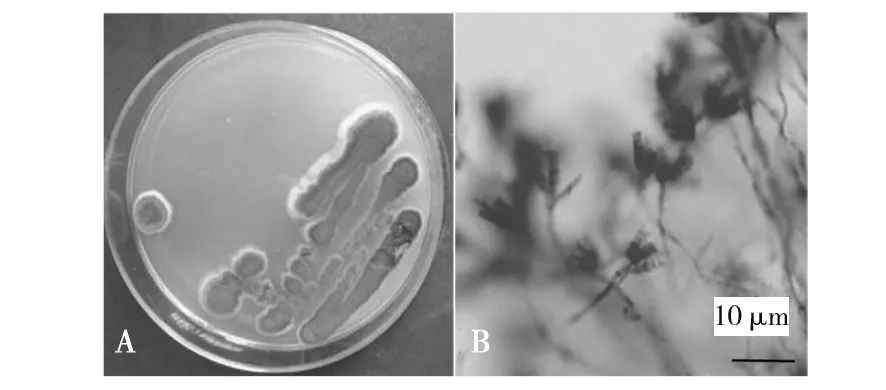
图7 产红青霉形态学特征Fig.7 Morphological characteristics of P. rubrumA:产红青霉的菌落形态;B:产红青霉的显微观察特征A:Colony morphology of P. rubrum;B:Microscopic features of P. rubrum
拟康氏木霉:菌丝初期匍匐生长,呈现毛毡状,后同心轮状生长,孢子成熟后菌落正面为明显的水绿色,背面无色或呈黄色(图8A)。菌丝有隔膜;分生孢子梗主分枝长,次级分枝多直角伸出;瓶梗2~5个对生、轮生、单生或间生,小瓶梗中间略膨大,顶部变细,终极瓶梗延长,基部不变细;分生孢子呈球形或短圆柱形,较小(图8B)。
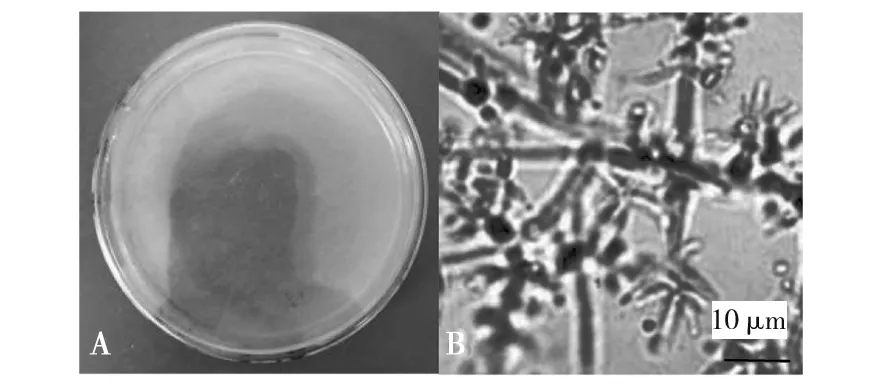
图8 拟康氏木霉形态学特征Fig.8 Morphological characteristics of T. pseudoknoingiiA:拟康氏木霉的菌落形态;B:拟康氏木霉的显微观察特征A:Colony morphology of T. pseudoknoingii;B:Microscopic features of T. pseudoknoingii
2.3 污染霉菌的回接检测
分离纯化的霉菌回接健康海鲜菇菌包,6 d后开始出现相应污染症状;再次对污染霉菌进行分离纯化镜检,鉴定霉菌为最初海鲜菇的污染菌,符合科赫法则。
2.4 ITS鉴定
35株霉菌分别用ITS 4、ITS 1作为引物进行PCR扩增,电泳图片均出现一条大小为500~600 bp较清晰的条带,与预期值相符,可用于后续测序工作,部分电泳结果见图9。
2.5 构建系统发育树
将所测序列在GenBank数据库中进行Blastn搜索,得到一系列具有一定相似性的ITS序列。经鉴定所获得的35株霉菌菌株分属4个属:木霉属、青霉属、链孢霉属和曲霉属。其中木霉属为第一大类群,包括哈茨木霉、拟康氏木霉、长枝木霉;第二大类群是青霉属,包括产红青霉、产黄青霉;另外2个类群分别是链孢霉属的脉孢霉和曲霉属的黑曲霉。下载GenBank数据库中同源性的ITS序列与所测得的ITS序列对位排列后,利用MEGA 5. 10软件的邻近相邻法构建系统发育树(见图10)。从系统发育树中可以看出,RB4、RB2、RA2、RB3、RB1、RA1和RBL分别和产红青霉、产黄青霉、长枝木霉、哈茨木霉、黑曲霉、拟康氏木霉和脉孢霉亲缘关系最近。可初步确定分离的海鲜菇菌包污染霉菌分别为P.chrysogenum、P.rubrum、T.longibrachiatum、T.harzianum、A.niger、T.pseudoknoingii和N.sitophila。

图9 部分霉菌ITS的PCR电泳图Fig.9 PCR electrophoretogram of some moldsM:DNA分子质量标准;1~3:ITS片段M:DL 2 000 bp Marker;1-3:ITS fragment
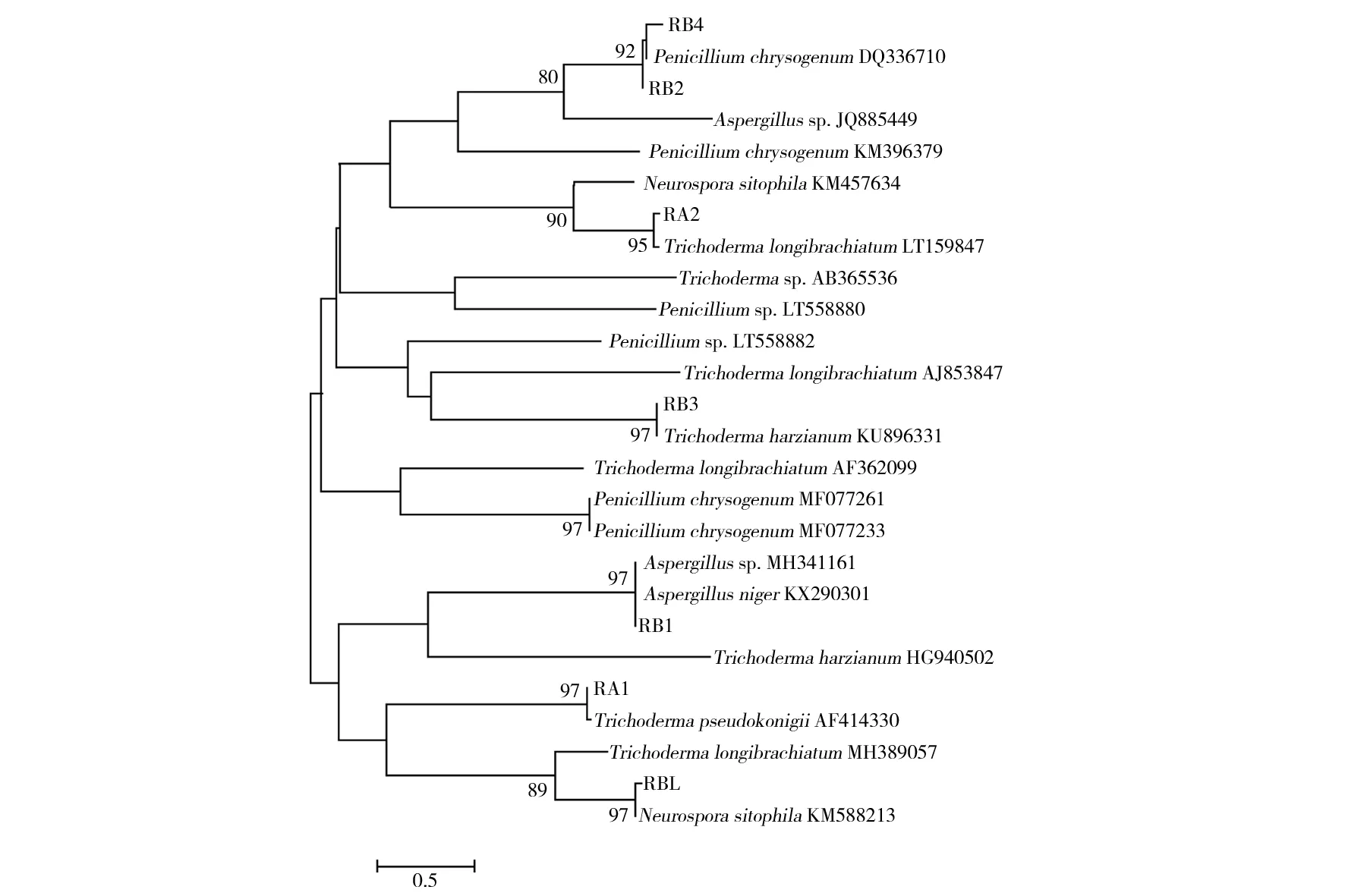
图10 基于ITS序列构建的系统发育树Fig.10 Phylogenetic tree based on ITS sequence constructionRB4、RB2、RA2、RB3、RB1、RA1和RBL分别代表产红青霉、产黄青霉、长枝木霉、哈茨木霉、黑曲霉、拟康氏木霉和脉孢霉RB4,RB2,RA2,RB3,RB1,RA1 and RBL represent P. chrysogenum,P. rubrum,T. longibrachiatum,T. harzianum,A. niger,T. pseudoknoingii,and N. sitophila,respectively
2.6 抑菌药剂的筛选
5种抑菌剂对霉菌和海鲜菇菌丝生长的影响差异较大(见表1)。二氧化氯在质量浓度为50 mg/L时对长枝木霉、哈茨木霉、黑曲霉、产红青霉、产黄青霉和拟康氏木霉均产生一定的抑制,达到100 mg/L时对黑曲霉、产红青霉、拟康氏木霉的抑制极强,但该浓度下对海鲜菇也有一定的影响;二氯异氰尿酸钠在质量浓度为50 mg/L时对各菌株的影响都不大,在100 mg/L时对哈茨木霉、黑曲霉、产红青霉、产黄青霉、拟康氏木霉、脉孢霉和海鲜菇均有较强抑制;克霉灵在质量浓度为100 mg/L时对哈茨木霉、黑曲霉、产红青霉、产黄青霉和拟康氏木霉强抑制,但对海鲜菇抑制作用小;新洁尔灭在质量浓度为100 mg/L时对各霉菌和海鲜菇都表现出较强的抑制作用;多菌灵在质量浓度为100 mg/L时对长枝木霉、产红青霉、产黄青霉和拟康氏木霉均强抑制,但对海鲜菇影响较小。 因为克霉灵和多菌灵对霉菌有着较强抑制作用,同时对海鲜菇菌丝生长影响较小,所以在海鲜菇工厂化生产中克霉灵和多菌灵是优先考虑使用的两种抑菌剂,为减少抗药性的发生可选择二者交替使用。
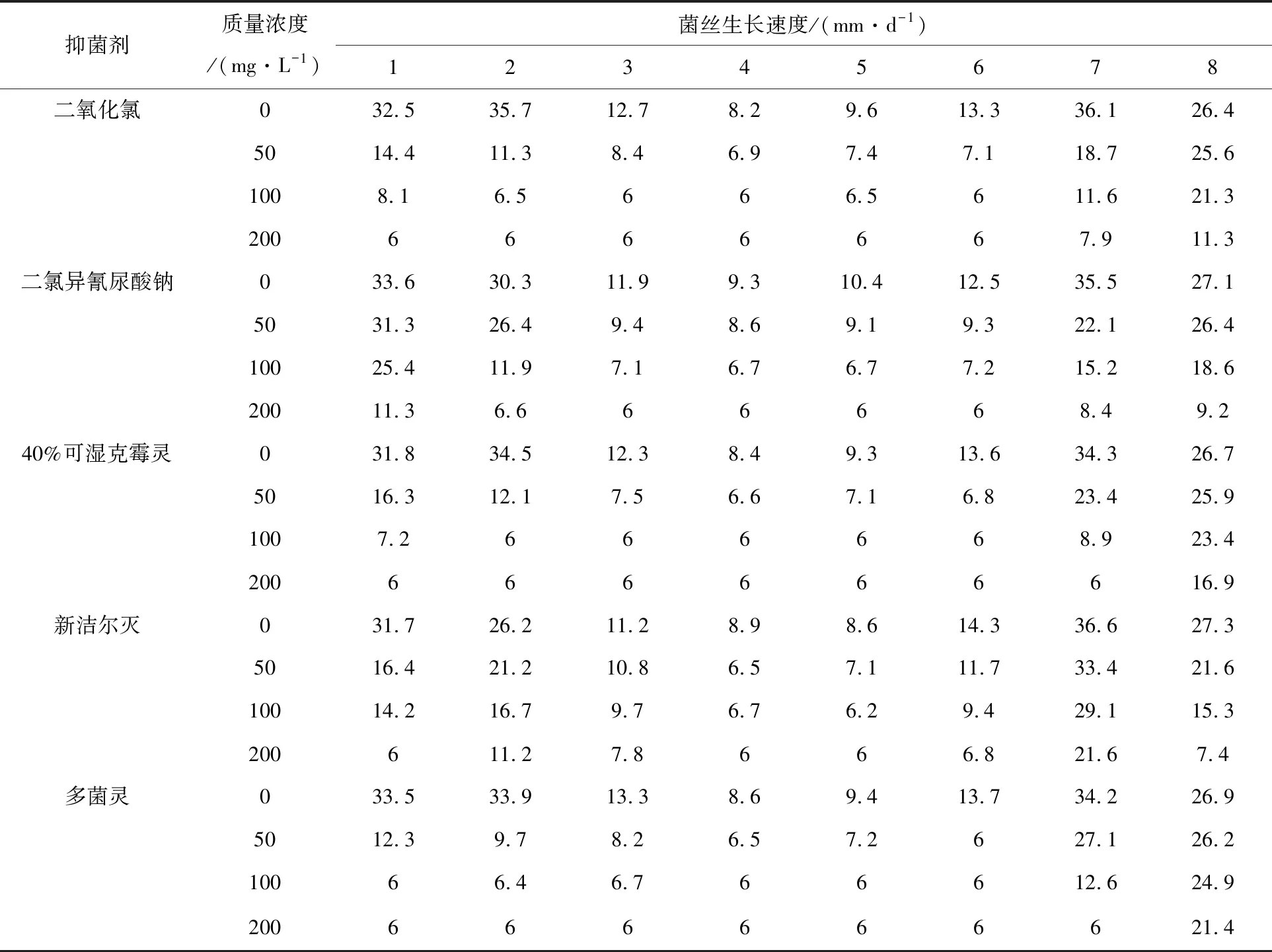
表1 抑菌剂对霉菌及海鲜菇菌丝生长的抑制作用
注:1~8分别代表长枝木霉、哈茨木霉、黑曲霉、产红青霉、产黄青霉、拟康氏木霉、脉孢霉和海鲜菇
3 讨 论
在海鲜菇工厂化生产的各个阶段都会受到霉菌的侵染,尤以培养料受污染影响最为严重。霉菌可以通过空气、灭菌不彻底的培养料、带菌的操作环境引入。本研究首次对海鲜菇工厂化栽培中污染菌包的霉菌进行调查,分离得到35株霉菌,经形态学鉴定和ITS序列分析初步确定其种属,且两者鉴定结果一致,共有4个属:木霉(哈茨木霉、拟康氏木霉、长枝木霉)、青霉(产红青霉、产黄青霉)、曲霉(黑曲霉)和链孢霉(脉孢霉),这些霉菌是海鲜菇菌包的优势污染菌,其中木霉最多。此与相关文献中报道的食用菌霉菌污染情况大体一致。霉菌种类多样,也给生产中霉菌病害的防治带来一定的难度。
目前,在海鲜菇的实际生产中,应尽量减少霉菌污染,而抑菌药剂的使用是防治食用菌病害的方法之一。本研究选取了常用的二氧化氯消毒液、二氯异氰尿酸钠、40%可湿克霉灵、新洁尔灭和多菌灵5种抑菌药剂。药剂筛选实验表明,所有药剂对霉菌菌丝生长都有抑制作用,但有明显差异。在质量浓度为100 mg/L的横向对比中,氯异氰尿酸钠对哈茨木霉、黑曲霉、产红青霉、产黄青霉、拟康氏木霉和脉孢霉均有较强的抑制作用;二氧化氯消毒液对黑曲霉、产红青霉和拟康氏木霉有很强的抑制作用;克霉灵对哈茨木霉、黑曲霉、产红青霉、产黄青霉和拟康氏木霉也有很强的抑制作用;新洁尔灭对产红青霉和产黄青霉的抑制作用很强;多菌灵对长枝木霉、产红青霉、产黄青霉和拟康氏木霉的抑制很强。纵向对比中,长枝木霉和哈茨木霉对多菌灵最敏感,对二氯异氰尿酸钠不敏感;黑曲霉对克霉灵最敏感,对新洁尔灭不敏感;产红青霉对二氧化氯消毒液、克霉灵和多菌灵比较敏感;产黄青霉对多菌灵敏感;拟康氏木霉对多菌灵最敏感;脉孢霉对克霉灵敏感。5种药剂对海鲜菇菌丝生长的影响也不同,新洁尔灭有较强抑制,而多菌灵和40%可湿克霉灵对海鲜菇菌丝生长抑制较弱,且对霉菌的防治效果良好,所以二者适宜在生产上交替使用,可降低菌株抗药性的风险。
本研究只对比了5种抑菌药剂对霉菌和海鲜菇菌丝生长的抑制,对海鲜菇孢子萌发的抑制作用、不同霉菌对海鲜菇致病性差异及致病机制等没有涉及,还有待进一步研究。另外,该实验浓度是否适合生产中使用,对实际生产中海鲜菇的产量、品质是否有影响以及农药是否残留超标,其实际应用效果等尚待生产检验。

