黑曲霉不同极性分离产物的抗真菌及抗氧化能力
郭博恺 李祝 万科 李玉环 刘芳 丛铭 胡坤 岳大历 葛永怡


摘要:进行了以从患有冠瘿病的葡萄树根际土壤中分离获得的1株黑曲霉Ⅺ用于抑制齐整小核菌的试验。其中超临界萃取段、水提醇沉段以及正丁醇段表现出较好的抑制效果。抑制率分别达到了93.22%、74.11%、79.67%。被抑制的菌丝出现了膨大、畸形、原生质聚集等现象,菌落大小也随着平板含待測样品的不同而不同。在测定电导率时,发现其随着药量浓度增高而增大,表明黑曲霉对齐整小核菌的细胞膜有较强的影响。另外还分别用DPPH法和ABTS法考察了黑曲霉不同极性分离产物的抗氧化能力。
关键词:黑曲霉;白绢病;生物防治;抗氧化
中图分类号:S432.4+4 文献标志码:A 文章编号:1002—1302(2016)01—0290—05
黑曲霉(Aspergillus niger)是生物技术应用中一种非常重要的微生物。早在1919年就被应用于工业中用来发酵柠檬酸。除了柠檬酸,黑曲霉还是果胶酶、蛋白酶和淀粉转葡糖苷酶丰富的来源。此外,在过去的20年里,黑曲霉亦被用于生物转化、湿法冶金和废物处理。经黑曲霉Asp-1#与蛇纹石尾矿作用后,可将部分尾矿中的镁浸出而生成新物质——有机酸镁。另外在接种不同体积黑曲霉菌液的处理下,Cd、Zn等元素富集量均显著低于空白对照处理。而黑曲霉作为一个安全的优势发酵菌种(GRAS),运用在抗菌药物研究与开发中的报道甚少,并且其抑制真菌病害的能力更是鲜有报道。而引起植物白绢病的齐整小核菌(Scleriti-um rolfsii)是一种在热带、亚热带地区普遍发生的植物病害病原,其寄主范围广,已知危害100多个科中的200多种植物,严重危害时,常造成作物大面积减产。所以本研究对黑曲霉抑制白绢病效果及机理进行研究,着重考察黑曲霉不同极性分离段对其抑菌能力的强弱,以及对其细胞膜的影响,旨在补充真菌病害的生防菌种库,另外还测试了黑曲霉不同极性分离段清除自由基的能力,为新型保鲜剂的研发提供理论基础。
1材料和方法
1.1菌株来源
黑曲霉(Aspergillus niger)XJ由贵州大学真菌资源研究所分离,保藏于中国典型培养物保藏中心,CCTCC编号:M206021。齐整小核菌(Sclerotium rolfsii Sacc.)由贵州大学真菌资源研究所分离并保藏。
1.2试剂
二苯代苦味酰基自由基(DPPH,日本东京化成工业株式会社);2,2′-连氨-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,日本东京化成工业株式会社);二丁羟基甲苯(BHT,上海晶纯生化科技股份有限公司);Trolox(日本东京化成工业株式会社);75%乙醇,95%乙醇;无水乙醇,过二硫酸钾,正丁醇,乙酸乙酯,石油醚,葡萄糖均为分析纯;琼脂,代森锰锌。
1.3仪器
DZG-6000电热恒温干燥箱(上海森信实验仪器有限公司);JHT-C超净工作台(上海基星生物科技有限公司);MLS-3750型独立式高温高压灭菌锅(北京诺汇诚科技有限公司);HPX-9082MBE电热恒温培养箱(江苏省科学器材有限公司);MGC-100P控温光照培养箱(北京瑞尔欣德科技有限公司);SKY-2112B双层特大容量恒温培养摇床(上海达平仪器有限公司);CX31数码生物显微镜(日本奥林巴斯);UV757CRT紫外分光光度计(上海仪电分析仪器有限公司);TopPette移液枪(大龙科技);DDS-307电导率仪(上海智理科学仪器有限公司);HAl20-40-0.5超临界萃取装置(江苏南通华安超临界萃取有限公司)。
1.4发酵液粗提物不同极性样品溶液的制备
将200 g干燥菌丝体用700 mL 75%乙醇、60℃回流2 h,滤出乙醇并重复以上步骤1次,分别用500 mL乙醇、正丁醇、乙酸乙酯等几种极性不同的有机溶剂分2次振荡并依次萃取,对有机相及水相分别浓缩,得到不同代谢液粗提物样品。
乙醇提取后取剩余残渣,加水煮沸,微沸1.5 h,合并滤液,滤液于3 000 r/min离心20 min,取上清液于喷雾干燥箱浓缩,24 h后与95%乙醇混匀,静置24 h后抽滤,即得水提醇沉萃取段样品。
将200 g干燥菌丝体粉末混合均匀后,取50 g作为设备清洗之用,余下150 g分2次萃取完成。萃取压力为5 MPa,温度为50℃,以160~200 L/h流量得15 g超临界萃取段样品。
1.5不同极性分离段对白绢病菌的抑制作用及IC50
含药培养基制备:将不同分离段用DMSO配制成浓度为80 mg/mL的样品,分别取150μL加入到15 mL已融化并冷却至60℃左右的PDA培养皿中(直径90 mm),使其充分混匀。以加入等体积DMSO的PDA平板为对照。
采用生长速率法,从PDA上培养7 d(待其长出菌核)的白绢病菌落边缘打取直径6 mm的菌饼,菌丝面向下,接种于已经凝固的含药PDA培养基中央,置于28℃恒温培养箱内光照培养。每个处理3次重复。分别于3、5、7 d后测量供试病菌在不同样品的含药培养基上的菌落直径,与对照比较计算各样品处理对菌丝生长的抑制率。
由以上试验得到最优的2个极性分离段,设置不同浓度梯度(0、5、15、30、45、60、75、80 mg/mL)进行试验,根据生物统计几率值换算表,将抑制百分率换算成抑制概率值,计算其有效中浓度IC50。
1.6不同极性样品溶液对白绢病菌细胞膜的影响
采用电导法测定2个效果最优极性分离段对病原菌细胞膜通透性的影响:在50 mL PDA培养液中接人1块直径为6 mm白绢病菌菌饼,于28℃下静置培养7 d。加入效果最优极性分离段至终浓度为0、5、15、30、45、60、75、80 mg/mL,于28℃下静置培养。分别在0、1、2、3、4、5、6 h测定培养液中电导率。
1.7抗氧化能力的测定试验
采用DPPH方法,参照文献[8]的方法并加以改良:取1 mL 0.1 mmol/L DPPH(乙醇为溶剂)、0.95 mL 0.05 mol/LTris-HCl缓冲液(pH值为7.4)、1 mL乙醇和50μL样品混合30 min后在波长517 nm处常温条件下测定吸光度,吸光度越小,其自由基清除剂的清除能力越强。计算公式为:
ABTS方法参照文献[9]的方法并加以改良:将2.5 mL7 mmoL/L的ABTS和44μL 140 mmol/L的K2S2O8溶液混合,在室温、避光条件下静置过夜(12~16 h),得到ABTS+储备液。将ABTS+储备液用磷酸盐缓冲液(PBS缓冲液,20 mmol/L,pH值为7.4)稀释,用分光光度计测量,使其在波长734 nm处吸光度为0.700±0.002,得到ABTS+工作液。取30μL不同浓度药物与3.0 mL的ABTS+工作液混合,反应6 min,常温条件下于波长734 nm处测定吸光度。抗氧化能力强弱采用Trolox当量(TEAC)来表示,即相同条件下测得的生物活性物质的抗氧化活性与Trolox的抗氧化活性作对比,由此得到的比值来反映待测生物活性物质的抗氧化能力。计算公式为:
2种方法计算得到的清除率后分别进行作图并计算其清除率的IC50值。
2结果与分析
2.1不同极性分离段对白绢病菌的抑制作用
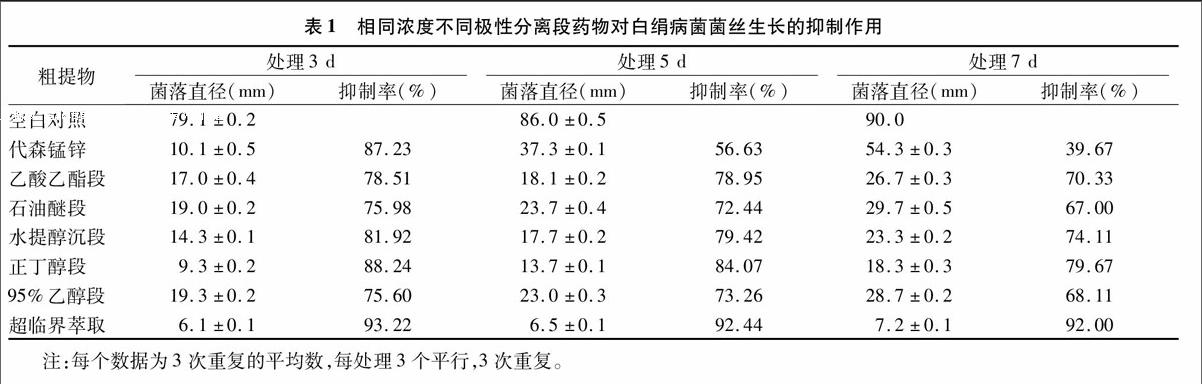
通过不同极性分离段的抑菌性试验后,得到3组效果最好的样品作为梯度试验的依据(表1)。较之其他极性分离段,超临界萃取段(图1-H)、水提醇沉段(图1-E)、正丁醇段(图1-F)抑制率在处理7 d分别达到了93.22%、79.67%、74.11%。
黑曲霉XJ不同段粗提物对白绢病菌丝生长均有不同程度的抑制作用,菌丝在含药培养基上生长缓慢,甚至在同一浓度下比阳性对照药代森锰锌(80 mg/mL)的抑制能力还要强很多(图1-B)。正常状态下菌丝无色透明,呈空心管状结构,有隔膜(图2-A),呈放射状生长,有分枝,在分枝的基部有明显的缢缩,局部有锁状联合现象(图2-D)。经过水提醇沉萃取段和正丁醇段分别处理后,出现菌丝数量减少、直径变粗、长度变短,出现褶皱、原生质凝洁、严重变形等现象(图2-B,图2-C)。同时还观察到有的菌丝呈念珠状膨大(图2-E)。
通过设置不同浓度(0、5、15、30、45、60、75、80 mg/mL)对3种待测药品进行浓度梯度试验(表2~表4),通过SPSS19.0软件计算得到超临界萃取段、水提醇沉萃取段和正丁醇段的半抑制浓度(IC50)在处理后7 d分别为6.177、71.416、19.248 mg/mL。同时发现在处理后3 d水提醇沉萃取段和正丁醇段在各浓度下均表现出较强的抑菌能力,而超临界萃取段则在处理后7 d表现的抑菌能力最强。
2.2不同极性分离段对白绢病菌细胞膜的影响
超临界萃取段、水提醇沉萃取段和正丁醇段对白绢病菌培养液电导率的影响见图3至图5。其中白绢病菌在空白对照的培養液中培养时,培养液的电导率随时间的延长表现十分稳定。3种药物处理后菌丝的电导率均在不同浓度下相较于空白对照有了显著提高,且在处理3 h电导率达到顶峰,随后呈下降趋势。代森锰锌处理在处理后2 h达到峰值,随后稳步下降。
2.3抗氧化能力的测定
表5表明,在2种方法中,水提醇沉萃取段、正丁醇萃取段和超临界萃取段均有一定的清除DPPH和ABTS自由基的能力,但相对于阳性对照还相差甚远。水提醇沉萃取段在2种方法均体现了相对于正丁醇和超临界萃取段更强的抗氧化能力。而超临界萃取段在APTS法中的抗氧化能力远强于其在DPPH法中的表现。
按照试验方法,测得对水提醇沉萃取段、正丁醇萃取段和超临界萃取段以及阳性对照品不同质量浓度下抗氧化数据,并通过Excel 2010软件对其制作出抗氧化质量浓度对DPPH自由基和ABTS自由基影响的关系图(图6、图7)。
图6显示,在试验浓度范围内,水提醇沉萃取段对DPPH自由基的清除率均与质量浓度呈正量效关系,即随着质量浓度增加,对DPPH自由基的清除率也增大。当质量浓度低于45 mg/mL时,正丁醇萃取段和超临界萃取段对DPPH自由基的清除率与质量浓度呈正量效关系,随后继续增加质量浓度,清除率几乎不变。当质量浓度低于5 mg/mL时,维生素C、Trolox和BHA对DPPH自由基的清除率与质量浓度呈正量效关系,随后继续增加质量浓度,清除率几乎不变。
图7显示,在试验浓度范围内,水提醇沉萃取段、正丁醇萃取段和超临界段萃取对ABTS自由基的清除率均同样与质量浓度呈正量效关系,即随着质量浓度增加,对ABTS自由基的清除率也增大。而水提醇沉萃取段在60 mg/mL前几乎以线性条件增长,其后在80 mg/mL时清除率达到了97.41%。
3讨论
黑曲霉Ⅺ系从患有冠瘿病的葡萄树根际土壤中分离获得的,与植物病原菌有相似的生态环境,生长快,且分泌抑菌物质多。笔者所在课题组前期的研究表明其发酵液对根癌农杆菌(Agrobacterium tumefaciens)和金黄色葡萄球菌(Staphylo-coccus aureus)有较强的抑制效果,本研究针对黑曲霉不同极性分离段对齐整小核菌(Sclerotium rolfsii)的抑菌活性、细胞膜通透胜以及药物自身抗氧化能力等几个方面做了相关的研究,为进一步完善其作用机制、明确其抑菌机理奠定了基础。
在抑菌活性方面,通过显微观察,经水提醇沉萃取段和正丁醇段处理后白绢病菌菌丝生长速率严重减缓,菌丝出现严重变形、细胞内原生质凝结和菌丝顶端膨大等现象。而且黑曲霉Ⅺ不同粗提物段也表达出了抑菌能力远强于化学农药的能力。
目前,报道的多是壳聚糖影响真菌细胞膜通透性增加以及细胞内蛋白质、核酸等物质的外泄,但是关于黑曲霉对真菌细胞膜功能的影响还未见报道。本研究发现水提醇沉萃取段和正丁醇段处理白绢病菌丝在短时间内即会使溶液电导率变化百分率明显提高,并且在测定3 h时达到峰值,且不同浓度均高于对照中的电导率变化百分率。当微生物处于不利环境或受到药物毒害时,往往会导致其生物膜流动性降低和半透性丧失,此时细胞内K+等电解质大量外泄,而经药物处理后,培养液电导率的升高可以反映细胞膜渗透性的改变,抑制物破坏了细胞膜的完整性,使细胞膜通透性增加,细胞质渗漏,电解质不断渗出,导致电导率的升高可能造成细胞流动性降低,细胞内环境稳定性被破坏,从而导致原生质外渗,破坏菌体细胞,从而起到抑菌作用。但由于未对胞内蛋白和核酸等物质测定,所以不能笼统地认为其机制与壳聚糖完全相同。
食品如果受到微生物感染以及自由基的释放会导致不饱和脂肪酸的自身氧化。而本研究发现的分离产物有与对照品相似的增强商品货架期的长短及自由基清除能力,甚至还有抑制有害微生物的能力。针对于黑曲霉XJ 3个分离段的自由基清除能力,虽相对于对照品较弱,但黑曲霉作为一种对人体无害的优势发酵菌种,体现出的发酵能力强、抑菌谱广的特性是对照品无法比拟的。另外在本研究中出现了其抑菌能力与抗氧化能力呈负增长关系,可以推测分离段对白绢病菌丝有氧化作用,以提高其抑菌能力。
综上,本研究着重对黑曲霉粗提物对白绢病菌体外的抑菌效果、细胞通透性以及药物自由基清除能力做了基本的试验,也部分揭示出了黑曲霉在这几方面上的能力。但深入的研究还需在下一步的试验中予以实践,例如黑曲霉是否导致细胞内蛋白质、核酸等物质的外泄,以及对抑制过后的菌体超微结构下观察等研究,这些对于完整阐述出黑曲霉的抑菌机制是十分必要的。

