木霉分生孢子和厚垣孢子对黄瓜叶片抗氧化系统及枯萎病防效的影响
廉 华,马光恕,靳亚忠,李 梅,张 帆
(1. 黑龙江八一农垦大学园艺园林学院,黑龙江 大庆 163319;2. 中国农业科学院植物保护研究所,北京 100081)
黄瓜(CucumissativusL.)是设施栽培的主要蔬菜之一,2017年黄瓜设施栽培面积58.29万公顷,占黄瓜总面积的47.85%[1]。由于黄瓜种植面积逐渐增大,土传病害如黄瓜枯萎病发生逐渐加重[2]。黄瓜枯萎病是一种土壤传播的真菌性病害,病原为尖孢镰刀菌黄瓜专化型(Fusariumoxysporumf.sp.cucumerinum,FOC)[3],在我国各地黄瓜种植区均有发生,发病率一般在10%~20%,重者可以达到80%~90%[4],日益成为影响黄瓜生产安全的主要病害。黄瓜枯萎病在生产上一直以化学防治为主,但随着人们环保意识加强,选择生物技术手段进行枯萎病预防和控制逐渐为业内所关注,其中利用木霉菌成为防治黄瓜枯萎病的有效手段之一[5]。
木霉菌(Trichodermaspp.)是广泛应用的植病生防真菌,对多种植物病原真菌特别是土传病原真菌有较好的拮抗作用,包括立枯丝核菌(Rhizoctoniasolani)、镰刀菌(Fusariumspp.)、疫霉菌(Phytophthoraspp)等[6]。木霉菌可以分泌细胞壁降解酶类和次级代谢产物,诱导植物抗性,促进植物生长和提高农产品产量,广泛用于生物肥料和生物制剂生产中[7-8],在世界真菌杀菌剂市场已经占据50%的市场份额[9]。
利用生防木霉菌防治枯萎病已有了较多的研究报道,如卢德鹏等[10]利用2×108cfu·g-1浓度的木霉菌可湿性粉剂设置5 000、7 500、15 000 g·hm-2剂量,施药后90 d,对番茄枯萎病的防效分别达到了64.41%、60.84%和71.10%,而对照的防效仅能达到56.65%,说明木霉菌对番茄枯萎病具有较好的防治效果;赵玳琳等[11]利用4株生防木霉菌(GYXM-1p1、GYSW-3m1、KLSD-8m3 和GYYC-15p2)进行甘蓝黑腐病大田防效试验,结果显示GYYC-15p2菌株的防效可达到79.16%,在4株木霉菌中表现最强;鲁海菊等[12]利用内生木霉P3.9 处理枇杷后,发现其对枇杷根腐病的防效可达80%以上。
生防菌防病的基础条件是诱导植物抗性,而植物抗性主要通过防御酶系统的应答体系表现出来,防御酶系统主要包括过氧化物酶(POD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)等,防御酶活性与植物抗病性之间有着密切的相关性[13]。膜脂过氧化作用会引起细胞膜的伤害,主要是因为膜中的蛋白质和类脂物质变化而导致的。当植物感病后,会引起膜脂的过氧化作用,造成细胞内电解质大量外渗,质膜透性增大[14],相对电导率增加幅度与胁迫强度和植物抗病能力紧密相关。丙二醛(MDA)作为膜脂过氧化作用的主要产物之一,对植物细胞会产生一定程度的氧化胁迫,导致细胞膜系统遭受伤害,研究中MDA和质膜透性都可以作为膜脂过氧化作用强弱的指标,在植物的抗病应答中发挥重要作用[15]。祝久香[16]研究菌株HX-140对黄瓜枯萎病对黄瓜防御反应酶系的影响,结果表明,单独施加黄瓜枯萎病菌培养液或HX-140菌悬液,或者同时施加黄瓜枯萎病菌培养液和HX-140菌悬液均能使黄瓜叶片内的CAT、POD、PPO、PAL、SOD等酶活性在48~72 h内持续升高达到峰值。其中同时施加黄瓜枯萎病菌培养液和HX-140菌悬液的黄瓜叶片内CAT、POD、PPO、PAL、SOD的酶活性分别为不接种任何菌液处理的黄瓜叶片的6.14、1.57、1.87、1.88、2.73倍。李聪[17]利用哈茨木霉TH发酵液处理芦笋,发现5倍稀释浓度对芦笋根中SOD、POD、CAT、β-1,3-葡聚糖酶和几丁质酶活性具有明显提升作用,含量分别为对照的5.89、2.32、3.12、5.21、1.22倍,而MDA含量则最低,对照是其2.5倍。
以上研究多从木霉菌的防病效果、氧化酶体系作用等方面开展的单一研究,对木霉菌孢子不同形态施用效果的研究较少。本研究通过前期筛选试验,选择出3株对黄瓜枯萎病菌有较好拮抗作用的木霉菌即哈茨木霉菌(T.harzianum) 809、拟康氏木霉菌(T.pseudokoningii) 886和棘孢木霉菌(T.asperellum) 525,研究木霉菌分生孢子和厚垣孢子施用后对黄瓜幼苗抗氧化系统及对黄瓜枯萎病的防治效果,以期为木霉菌制剂的推广提供理论依据,为黄瓜安全和高效生产提供技术支持。
1 材料与方法
1.1 材料
供试病原菌为黄瓜枯萎病菌(Fusariumoxysporum.sp.cucumebrium Owen),供试菌株分别为哈茨木霉菌(Trichodermaharzianum) 809、拟康氏木霉菌(Trichodermapseudokoningii) 886、棘孢木霉菌(Trichodermaasperellum) 525,以上材料均由中国农业科学院植物保护研究所提供;供试黄瓜品种为长春密刺;供试土壤为草炭土,高温灭菌。
供试培养基:PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂10 g,蒸馏水1 000 mL)、PD培养基(不加琼脂的PDA)、尖孢镰刀菌选择培养基[18](KH2PO41.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,Fe-Na2-EDTA 0.01 g,L-天门冬酰胺2.0 g,D-半乳糖20.0 g,蒸馏水1 000 mL,121℃灭菌20 min)、木霉选择性培养基(PDAm)[19](去皮马铃薯200 g,葡萄糖20 g,琼脂20 g,氯霉素0.3 g,玫瑰红即孟加拉红0.02 g,水1 000 mL)、木霉厚垣孢子发酵培养基[20](称取诱导剂60.0 g,酵母粉0.5 g,玉米粉1.0 g,葡萄糖1.0 g,玉米浆液3 mL,加水补足至100 mL,121℃灭菌 20 min)
1.2 病原菌孢子悬浮液和木霉孢子粉剂的制备
1.2.1 尖孢镰刀菌粉剂的制备 将黄瓜枯萎病原菌接种于马铃薯葡萄糖琼脂固体培养基(PDA)上,28℃下培养3 d,从菌落边缘取直径5 mm的菌饼5块,接种在含有100mL马铃薯葡萄糖液体培养基(PD)的三角瓶(250 mL)中,28℃、120 r·min-1摇床振荡培养7 d,用双层纱布过滤去除菌丝,滤液经5 000 r·min-1离心10 min,沉淀后的孢子重新悬浮于与发酵液等量的无菌水中,加入3%硅藻土,混匀、抽滤、干燥,制成病原菌孢子粉剂。为计算粉剂中病原菌孢子含量,将粉剂用无菌水梯度稀释后,涂布于尖孢镰刀菌选择培养基[18],放置1 h 后将培养平板倒置于28℃培养箱培养3~4 d,统计菌落数,经计算孢子含量为1.9×107cfu·g-1,按照试验要求计算应用剂量。
1.2.2 木霉分生孢子粉剂的制备 将哈茨木霉菌809(简称木霉809)、拟康氏木霉菌886(简称木霉886)、刺孢木霉菌525(简称木霉525)分别在马铃薯葡萄糖琼脂固体培养基(PDA)上,28℃活化培养3 d,从菌落边缘取直径5 mm的菌饼,转接到PDA培养基上,28℃培养7 d,用无菌水清洗孢子,制成木霉孢子悬液。小麦粒清水室温浸泡1夜,捞出沥水,装入保鲜袋,每袋1 kg,灭菌,冷却后,接入木霉孢子悬液,25℃培养箱培养2~3周,待长满孢子后,加无菌水冲洗,滤除麦粒,滤液中按10%加入硅藻土,混合后粉碎、抽滤、干燥,制成木霉分生孢子粉剂。用无菌水梯度稀释后,涂布于木霉选择培养基上[19],在25℃~28℃下倒置培养1~2 d,统计菌落数,计算木霉分生孢子含量。木霉菌809、886和525粉剂浓度分别为2×109、1.6×108cfu·g-1和2.8×107cfu·g-1,按照试验要求计算应用剂量。
1.2.3 木霉厚垣孢子粉剂的制备 将木霉菌809、886和525接入灭菌的木霉菌厚垣孢子发酵培养基[20]中,28℃,200 r·min-1摇床中发酵7 d。将发酵液经两层纱布过滤,将滤液离心得到厚垣孢子,用无菌水冲洗3次。厚垣孢子沉淀加入与发酵液等量的无菌水稀释后,再加入3%硅藻土,混匀、抽滤、干燥,制成木霉厚垣孢子粉剂。用无菌水配制成孢子悬浮液,涂布于木霉选择培养基[19]上,在25℃~28℃下倒置培养1~2 d,统计菌落数,计算木霉厚垣孢子含量。木霉菌809、886和525粉剂浓度分别为3.5×108、4.7×107cfu·g-1和1.47×108cfu·g-1,按照试验要求计算应用剂量。
1.3 盆栽试验方法
1.3.1 试验设计 试验在黑龙江八一农垦大学农学院教学基地现代化温室内进行。取灭菌后试验土,装入塑料育苗盘(34.5 cm×24 cm×11 cm)中,盘装土2.5 kg。试验采用拌土的方式,利用104cfu·g-1浓度的尖孢镰刀菌粉剂与104cfu·g-1浓度的木霉菌809、886、525厚垣孢子或106cfu·g-1浓度的分生孢子进行组合试验,以单独施用尖孢镰刀菌粉剂为对照。每组试验设置4个处理,每个处理4盘,3次重复。
每组试验处理同时将104cfu·g-1浓度的尖孢镰刀菌粉剂与104cfu·g-1浓度的木霉809厚垣孢子或106cfu·g-1浓度的分生孢子拌入土中,设为处理1;同时将104cfu·g-1浓度的尖孢镰刀菌粉剂与104cfu·g-1浓度的木霉886厚垣孢子或106cfu·g-1浓度的分生孢子拌入土中,设为处理2;同时将104cfu·g-1浓度的孢镰刀菌粉剂与104cfu·g-1浓度的木霉525厚垣孢子或106cfu·g-1浓度的分生孢子拌入土中,设为处理3;单独将104cfu·g-1浓度的尖孢镰刀菌粉剂拌入土中,设为对照(CK)。
每盘播种经过催芽处理后的黄瓜种子80粒,出苗后保留50株黄瓜苗。播种后每隔2 d浇1次无菌水,每盘浇1 000 mL,保持黄瓜正常生长状态。待黄瓜幼苗长至三叶一心(即播种后第25天)时,选取黄瓜幼苗的第二片真叶进行黄瓜幼苗各项抗氧化能力和抗病性指标的测定。
1.3.2 测定指标与方法
(1)抗氧化指标。丙二醛(MDA),采用硫代巴比妥酸法[21];质膜透性,采用相对电导率法[21];超氧化物歧化酶(SOD)活性,采用氮蓝四唑光化还原法[21];抗坏血酸过氧化物酶(APX)活性,采用抗坏血酸法[22];过氧化氢酶(CAT)活性,采用紫外吸收法[22];过氧化物酶(POD)活性,采用愈创木酚法[23]。
(2)抗病性指标。抗病性指标包括植株发病率、病情指数、防治效果。
植株发病率为黄瓜幼苗长至三叶一心时各处理发病株数占调查总株数的百分比。
黄瓜苗期枯萎病参照张素平[24]的分级标准,病情指数参照宗兆锋和康振生[25]的计算方法。
0级,无症状;1级,真叶、子叶黄化或萎蔫面积不超过总面积的50%;2级,真叶、子叶黄化或萎蔫面积超过总面积的50%;3级,叶片萎蔫或枯死,仅生长点存活;4级,全株严重萎蔫,以致枯死。
病情指数=[∑(病级株数×代表级数)÷(植株总数×最高代表级值)]×100
防治效果=(对照病情指数-处理病情指数)÷对照病情指数×100
1.4 数据统计与分析
利用Microsoft Excel 2007版软件制图,利用DPS7.05进行数据分析。
2 结果与分析
2.1 木霉菌分生孢子和厚垣孢子对黄瓜幼苗抗氧化系统的影响
2.1.1 黄瓜幼苗叶片丙二醛含量 木霉分生孢子和厚垣孢子处理下黄瓜幼苗叶片丙二醛含量测定结果见图1。对厚垣孢子而言,与CK相比,木霉809、木霉886和木霉525施用下黄瓜幼苗叶片丙二醛含量均显著降低,其中以木霉886处理下叶片丙二醛含量最低,其显著低于木霉525,但木霉809与木霉525、木霉809与木霉886之间差异均不显著;3种木霉菌厚垣孢子处理下的黄瓜幼苗叶片丙二醛含量均显著低于CK,说明木霉菌能增强黄瓜幼苗叶片膜脂过氧化抗性,减弱膜脂过氧化程度,通过减少对细胞膜的损伤以抵抗枯萎病菌的侵染。木霉886、木霉809、木霉525处理分别较CK降低了41.40%、33.16%、20.33%。
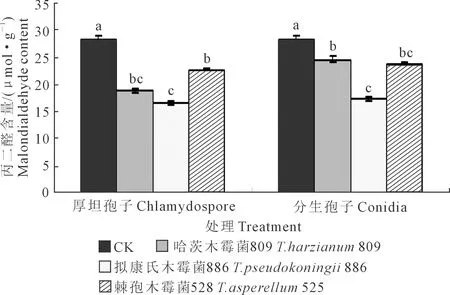
注:图中正负误差线表示标准差大小,不同小写字母表示同一种木霉在同一时期各处理间差异显著(P<0.05),下同。Note: Values in the chart are mean ± standard error, different small letters mean significant difference at 0. 05 level among different treatments for the same Trichoderma in the same period, the same as following.图1 木霉菌分生孢子和厚垣孢子对黄瓜幼苗叶片丙二醛含量的影响Fig.1 Effects of Trichoderma conidia and chlamydospore onmalondialdehyde content in cucumber seedling leaves
对分生孢子而言,与CK相比,木霉809、木霉886和木霉525施用下的黄瓜幼苗叶片丙二醛含量均显著降低,其中以木霉886处理下叶片丙二醛含量最低,其显著低于木霉809,但木霉525和木霉809、木霉525和木霉886之间差异均不显著;3种木霉菌分生孢子处理下的黄瓜幼苗叶片丙二醛含量均显著低于CK,木霉886、木霉525、木霉809处理下的叶片丙二醛含量分别较CK降低了38.87%、16.98%、13.25%。
对同一木霉菌厚垣孢子和分生孢子处理的效果而言,黄瓜幼苗叶片丙二醛含量均表现为厚垣孢子处理低于分生孢子处理,木霉809、木霉886、木霉525分生孢子处理分别高出厚垣孢子处理22.95%、4.15%、4.03%。
2.1.2 黄瓜幼苗叶片质膜透性 细胞膜对维持植物细胞的代谢发挥着重要作用,当植物遭受各种逆境时,细胞膜的透性会不同程度增大,电解质外渗加强,电导率持续加大,因此,电导率常作为反映质膜透性指标。木霉分生孢子和厚垣孢子处理下黄瓜幼苗叶片质膜透性测定结果见图2。对厚垣孢子而言,与CK相比,木霉809、木霉886以及木霉525施用下的黄瓜幼苗叶片相对电导率均显著降低,其中以木霉886处理下叶片相对电导率最低,其显著低于木霉525,但木霉809与木霉525、木霉809与木霉886之间差异均不显著;3种木霉菌厚垣孢子处理下的黄瓜幼苗叶片相对电导率均显著低于CK,说明木霉菌处理使叶片相对电导率明显下降,质膜受枯萎病原菌伤害的程度明显减轻,膜稳定性增强。木霉886、木霉809、木霉525处理下的叶片相对电导率分别较CK减小了47.74%、43.98%、39.72%。
对分生孢子而言,与CK相比,木霉809、木霉886以及木霉525施用下的黄瓜幼苗叶片相对电导率均显著降低,其中以木霉886处理下叶片相对电导率最低,其显著低于木霉809,但木霉525和木霉809、木霉525和木霉886之间差异均不显著;3种木霉菌分生孢子处理下的黄瓜幼苗叶片相对电导率均显著低于CK,木霉886、木霉525、木霉809处理下分别较CK减小了41.75%、38.77%、36.17%。
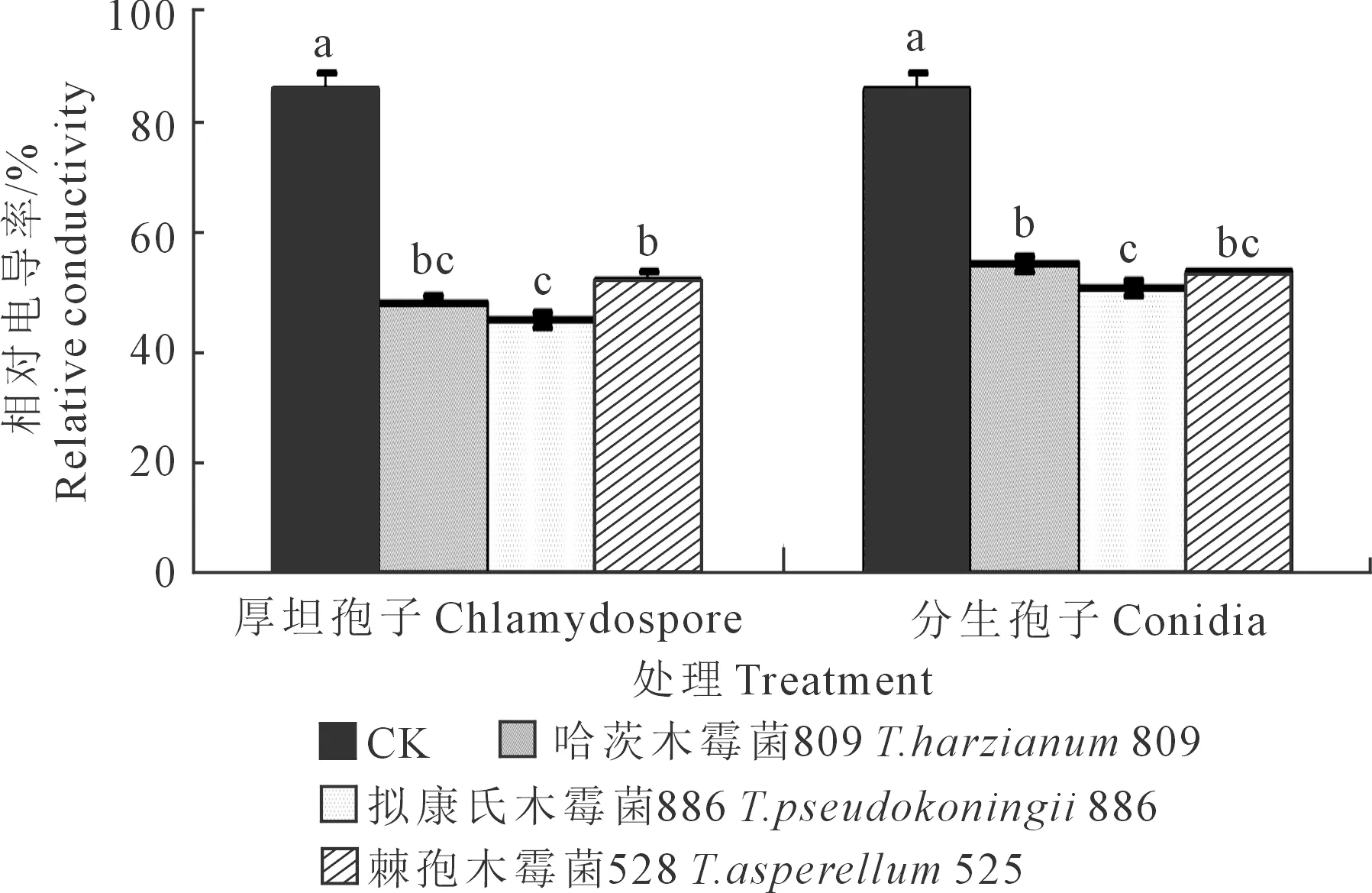
图2 木霉菌分生孢子和厚垣孢子对黄瓜幼苗叶片质膜透性的影响Fig.2 Effects of Trichoderma conidia and chlamydospore onplasma membrance permeability in cucumber seedling leaves
对同一木霉菌厚垣孢子和分生孢子处理的效果而言,黄瓜幼苗叶片相对电导率均表现为厚垣孢子处理低于分生孢子处理,木霉809、木霉886、木霉525分生孢子处理分别高出厚垣孢子处理12.23%、10.29%、1.55%。
2.1.3 黄瓜幼苗叶片超氧化物歧化酶活性 木霉分生孢子和厚垣孢子处理下黄瓜幼苗叶片超氧化物歧化酶活性测定结果见图3。对厚垣孢子而言,与CK相比,木霉809、木霉886以及木霉525施用下黄瓜幼苗叶片超氧化物歧化酶活性均显著升高,其中以木霉886处理下叶片超氧化物歧化酶活性最高,但木霉886与木霉809、木霉809与木霉525之间差异均不显著;3种木霉菌厚垣孢子处理下的黄瓜幼苗叶片超氧化物歧化酶活性均显著高于CK,说明枯萎病菌对黄瓜幼苗叶片超氧化物歧化酶活性有明显的抑制作用,而木霉菌处理能够缓解枯萎病菌对黄瓜幼苗叶片超氧化物歧化酶活性的抑制作用,说明木霉处理能提高黄瓜对枯萎病的抗病能力。木霉886、木霉809、木霉525处理下的叶片超氧化物歧化酶活性分别较CK提高了300.34%、283.49%、273.33%。
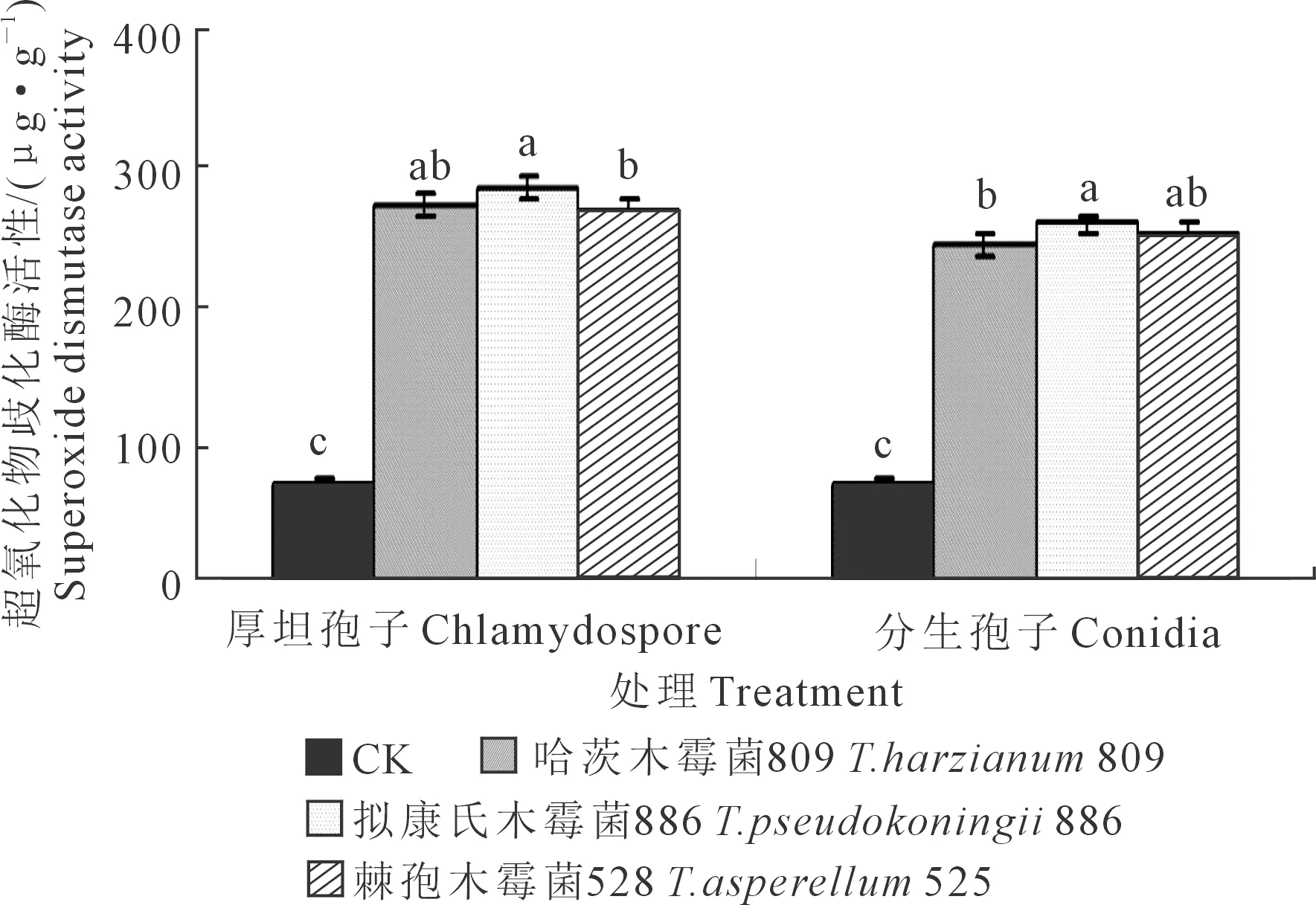
图3 木霉菌分生孢子和厚垣孢子对黄瓜幼苗叶片超氧化物歧化酶活性的影响Fig.3 Effects of Trichoderma conidia and chlamydospore onsuperoxide dismutase activity in cucumber seedling leaves
对分生孢子而言,与CK相比,木霉886、木霉809和木霉525施用下的黄瓜幼苗叶片超氧化物歧化酶活性均显著升高,其中以木霉886处理下叶片超氧化物歧化酶活性最高,但木霉886与木霉525、木霉525与木霉809之间差异均不显著;3种木霉菌分生孢子处理下的黄瓜幼苗叶片超氧化物歧化酶活性均显著高于CK,木霉886、木霉525、木霉809处理分别较CK升高了260.91%、253.02%、241.12%。
对同一木霉菌厚垣孢子和分生孢子处理的效果而言,黄瓜幼苗叶片超氧化物歧化酶活性均表现为厚垣孢子处理高于分生孢子处理,木霉886、木霉809、木霉525厚垣孢子处理分别高出分生孢子处理12.42%、10.92%、5.75%。
2.1.4 黄瓜幼苗叶片抗坏血酸过氧化物酶活性 木霉分生孢子和厚垣孢子处理下黄瓜叶片中的抗坏血酸过氧化物酶活性测定结果见图4。对厚垣孢子而言,与CK相比,木霉886、木霉809和木霉525施用下的黄瓜幼苗叶片抗坏血酸过氧化物酶活性均显著升高,其中以木霉886处理下叶片抗坏血酸过氧化物酶活性最高,木霉886显著高于木霉809和木霉525,且后二者之间差异不显著;3种木霉菌厚垣孢子处理下的黄瓜幼苗叶片抗坏血酸过氧化物酶活性均显著高于CK,说明枯萎病菌对黄瓜幼苗的抗坏血酸过氧化物酶活性有一定程度的抑制作用,而木霉菌处理能够缓解枯萎病菌对黄瓜幼苗叶片抗坏血酸过氧化物酶活性的抑制作用,说明木霉处理能提高黄瓜对枯萎病的抗病能力。木霉886、木霉809、木霉525处理下的叶片抗坏血酸过氧化物酶活性分别较CK提高了157.09%、126.67%、117.59%。
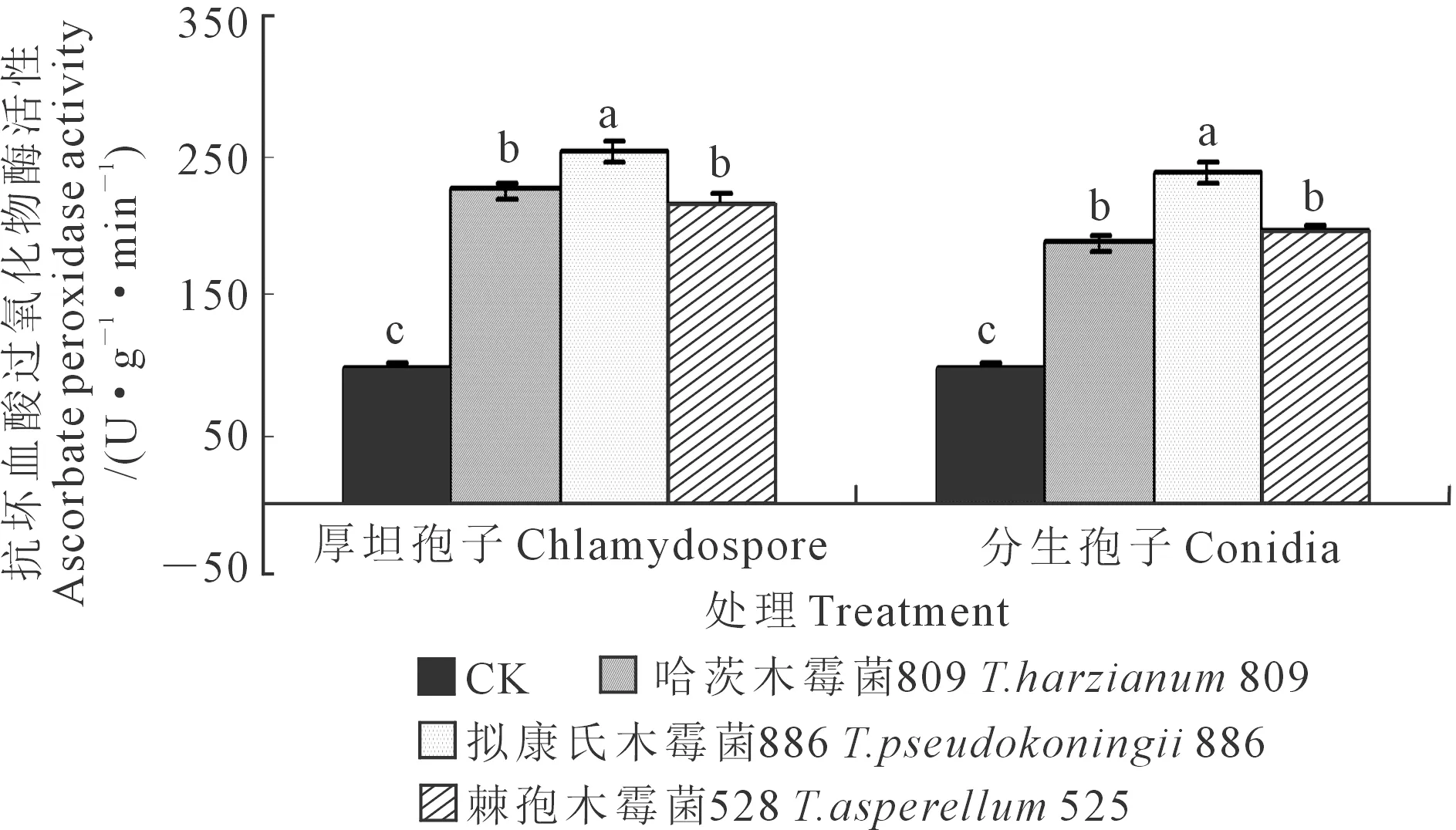
图4 木霉菌分生孢子和厚垣孢子对黄瓜幼苗叶片抗坏血酸过氧化物酶活性的影响Fig.4 Effects of Trichoderma conidia and chlamydospore onascorbate peroxidase activity in cucumber seedling leaves
对分生孢子而言,与CK相比,木霉886、木霉809和木霉525施用下的黄瓜幼苗叶片抗坏血酸过氧化物酶活性均显著升高,其中以木霉886处理下叶片抗坏血酸过氧化物酶活性最高,木霉886显著高于木霉525和木霉809,且后二者之间差异不显著;3种木霉菌分生孢子处理下的黄瓜幼苗叶片抗坏血酸过氧化物酶活性均显著高于CK,木霉886、木霉525、木霉809处理分别较CK升高了139.68%、96.27%、90.20%。
对同一木霉菌厚垣孢子和分生孢子处理的效果而言,黄瓜幼苗叶片抗坏血酸过氧化物酶活性均表现为厚垣孢子处理高于分生孢子处理,其中木霉809、木霉886、木霉525厚垣孢子处理分别高出分生孢子处理19.18%、7.27%、10.86%。
2.1.5 黄瓜幼苗叶片过氧化氢酶活性 木霉分生孢子和厚垣孢子处理下黄瓜幼苗叶片过氧化氢酶活性测定结果见图5。对厚垣孢子而言,与CK相比,木霉809、木霉886以及木霉525施用下的过氧化氢酶活性均显著升高,其中以木霉886处理下过氧化氢酶活性最高,木霉886显著高于木霉809和木霉525,且后二者之间差异不显著;3种木霉菌厚垣孢子处理,黄瓜叶片的过氧化氢酶活性均高于CK,说明枯萎病菌对黄瓜幼苗的过氧化氢酶活性有一定程度的抑制作用,而木霉处理则能够缓解枯萎病菌对过氧化氢酶活性产生的抑制作用,说明木霉处理能一定程度上提高幼苗对黄瓜枯萎病的抗病性。木霉886、木霉809、木霉525处理下的叶片过氧化氢酶活性分别较CK提高了155.36%、113.06%、101.14%。
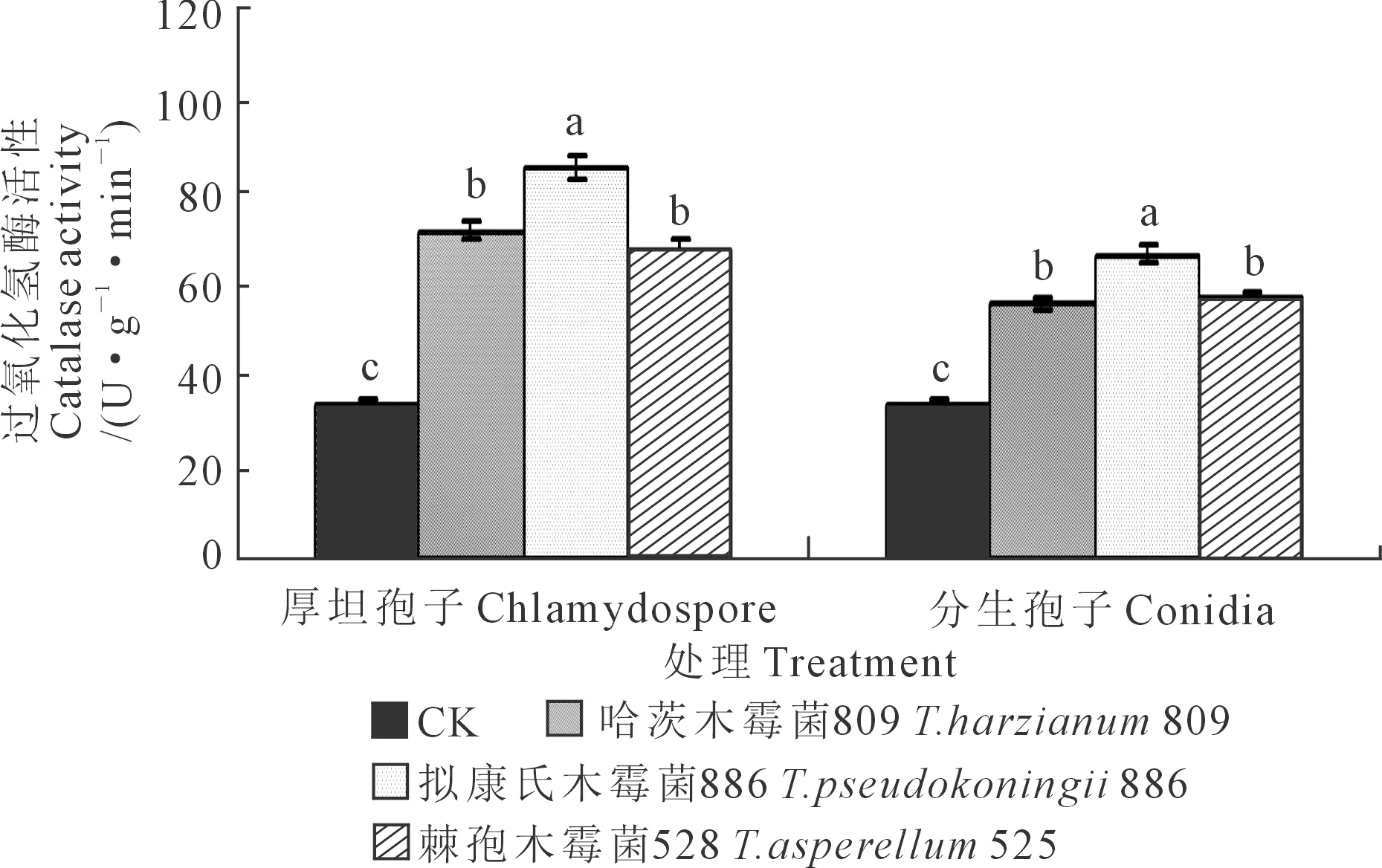
图5 木霉菌分生孢子和厚垣孢子对黄瓜幼苗叶片过氧化氢酶活性的影响Fig.5 Effects of Trichoderma conidia and chlamydospore oncatalase activity in cucumber seedling leaves
对分生孢子而言,与CK相比,木霉809、木霉886以及木霉525施用下的黄瓜幼苗叶片过氧化氢酶活性均显著升高,其中以木霉886处理下叶片过氧化氢酶活性最高,木霉886显著高于木霉525和木霉809,且后二者之间差异不显著;3种木霉菌分生孢子处理下的黄瓜过氧化氢酶活性均高于CK,木霉886、木霉525、木霉809处理分别较CK升高了98.45%、68.27%、65.61%。
对同一木霉菌厚垣孢子和分生孢子处理的效果而言,黄瓜幼苗叶片过氧化氢酶活性均表现为厚垣孢子处理高于分生孢子处理,其中木霉809、木霉886、木霉525厚垣孢子处理分别高出分生孢子处理28.65%、28.68%、19.53%。
2.1.6 黄瓜幼苗叶片过氧化物酶活性 木霉分生孢子和厚垣孢子处理下黄瓜幼苗叶片过氧化物酶活性测定结果见图6。对厚垣孢子而言,与CK相比,木霉809、木霉886以及木霉525施用下的黄瓜幼苗叶片过氧化物酶活性均显著升高,其中以木霉886处理下叶片过氧化物酶活性最高,木霉886显著高于木霉809和木霉525,且后二者之间差异不显著;3种木霉菌厚垣孢子处理下的黄瓜幼苗叶片过氧化物酶活性均高于CK,说明枯萎病菌对黄瓜幼苗的过氧化物酶活性有一定程度的抑制作用,而木霉菌处理能够缓解枯萎病菌对黄瓜幼苗叶片过氧化物酶活性的抑制作用,说明木霉处理能提高黄瓜对枯萎病的抗病能力。木霉886、木霉809、木霉525处理下的叶片过氧化物酶活性分别较CK提高了318.11%、237.98%、213.07%。
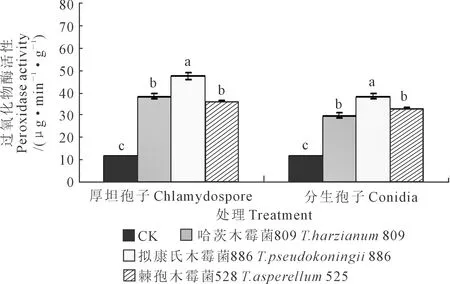
图6 木霉菌分生孢子和厚垣孢子对黄瓜幼苗叶片过氧化物酶活性的影响Fig.6 Effects of Trichoderma conidia and chlamydospore onperoxidase activity in cucumber seedling leaves
对分生孢子而言,与CK相比,木霉809、木霉886以及木霉525施用下的黄瓜幼苗叶片过氧化物酶活性均显著升高,其中以木霉886处理叶片过氧化物酶活性最高,木霉886显著高于木霉525和木霉809,且后二者之间差异不显著;3种木霉菌分生孢子处理下的黄瓜过氧化物酶均高于CK,木霉886、木霉525、木霉809处理分别较CK升高了239.58%、185.87%、164.05%。
对同一木霉菌厚垣孢子和分生孢子处理的效果而言,黄瓜幼苗叶片过氧化物酶活性均表现为厚垣孢子处理高于分生孢子处理,木霉809、木霉886、木霉525厚垣孢子处理分别高出分生孢子处理28.00%、23.13%、9.52%。
2.2 木霉菌分生孢子和厚垣孢子对黄瓜枯萎病的防治效果
当黄瓜幼苗长至三叶一心时,调查木霉分生孢子和厚垣孢子处理下黄瓜幼苗的发病率和发病情况,计算病情指数及防治效果,木霉菌分生孢子和厚垣孢子对黄瓜枯萎病发病率、病情指数、防治效果的影响分别见图7a、7b和7c。如图7a所示,对厚垣孢子而言,与CK相比,木霉809、木霉886以及木霉525施用下黄瓜幼苗的发病率均显著低于CK,其中木霉886最低,仅为7.74%,木霉886显著低于木霉809和木霉525,且后二者之间差异不显著;对分生孢子而言,与CK相比,木霉809、木霉886以及木霉525施用下黄瓜幼苗的发病率均显著低于CK,木霉886发病率最低,为10.76%,但木霉886与木霉525之间差异不显著,且二者均显著低于木霉809。图7b显示木霉菌分生孢子和厚垣孢子对黄瓜枯萎病病情指数的影响与发病率规律一致,木霉厚垣孢子和分生孢子的病情指数均以木霉886最低,其显著低于木霉809和木霉525,木霉886厚垣孢子和木霉886分生孢的病情指数分别为9.16和10.71。而对防治效果(图7c)而言,厚垣孢子和分生孢子均以木霉886处理最高,分别达到81.46%和78.32%,均显著高于木霉809和木霉525,且后二者之间差异不显著。对同一木霉菌厚垣孢子和分生孢子处理的防治效果,3种木霉均表现为厚垣孢子处理高于分生孢子处理。
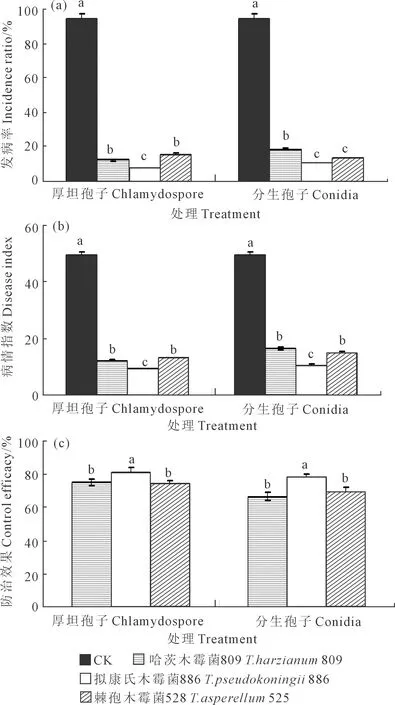
图7 木霉菌分生孢子和厚垣孢子对黄瓜枯萎病防效的影响Fig.7 Effect on the control efficiency of Trichoderma conidiaand chlamydospore against cucumber Fusarium wilt
3 讨 论
木霉作为植物有益的生防真菌类型之一,对多种病菌如白绢病菌、镰刀菌、立枯丝核菌、灰霉病菌、腐霉菌等引起的病害都具有一定的防效[26]。利用木霉进行土传病害的防治研究很多,如庄敬华等[27]利用绿色木霉(T.viride)T23处理黄瓜幼苗,分生孢子和厚垣孢子作用下的黄瓜枯萎病的病情指数由33.69分别降至13.12和10.28;张晶晶等[28]分析了木霉分生孢子和厚垣孢子制剂对黄瓜灰霉病的防治效果,在喷施后12 d防效分别达到72.09%和90.12%,厚垣孢子的防效高于分生孢子。而本研究中的3株木霉菌即哈茨木霉菌809、拟康氏木霉菌886、棘孢木霉菌525,对黄瓜枯萎病的防效均高于66%,病情指数降低到17以下;3种木霉菌厚垣孢子的防效均高于分生孢子,拟康氏木霉菌886厚垣孢子的防效最高,达到81.46%,与以上研究结果相类似,只是病情指数和防效略有差异。
许多研究得出抗氧化酶系统包括苯丙氨酸解氨酶(PAL)、PPO、SOD、CAT、POD等均与植物的抗病性有关系,抗氧化酶活性与抗病性强弱存在显著正相关,五大抗氧化酶的活性是植株抗病性的评价指标[29]。当植物受病原菌侵染后,木霉等生防微生物能够诱导植物抗病相关防御酶发生变化,增强植物体的抗病防御功能,而防御反应与各种保护性酶活性的提高关系密切[30]。同时,叶片中的MDA积累量和细胞质膜透性与保护酶活性与植物防御功能呈现密切关联[31]。MDA的积累和质膜透性增加均会造成植物体内SOD、POD 和CAT 活性下降,降低保护酶系统的功能。如覃柳燕等[32]利用棘孢木霉菌株PZ6处理香蕉植株,结果显示:与清水(CK)相比,香蕉苗SOD、CAT和POD活性显著升高;PZ6(3 d)+枯萎病菌菌液(FOC)4处理下的香蕉苗球茎枯萎病病情指数和防效最好,病情指数和防效分别为37.50%和48. 28%;高长敏等[33]利用棘孢木霉、哈茨木霉和拟康氏木霉处理黄瓜幼苗,叶片中的PPO、CAT、POD、SOD活性显著升高,而相对电导率和MDA含量显著下降,其中以拟康氏木霉促进效果最强;侯雪月等[34]利用哈茨木霉T8进行浸种和浇根处理,结果表明,施用木霉菌能显著提高芸芥的SOD、POD、CAT、PPO和脯氨酸含量,诱导植物提高其抗性;魏林等[35]选择不同浓度的哈茨木霉T2-16发酵液对豇豆浸种处理,SOD、CAT和POD等保护酶活性增强,相对电导率下降,保护了细胞膜的相对完整性,豇豆种子的活力得到改善和提高。本研究中黄瓜幼苗经木霉809、木霉886、木霉525分生孢子和厚垣孢子处理后,叶片中SOD、CAT、POD、APX等酶活性明显上升,而MDA含量、相对电导率明显下降,其中以木霉886厚垣孢子处理效果最强,与前人研究结果相类似,但由于木霉类型、形态及作用作物种类不同,略有差异。本研究仅探讨木霉菌分生孢子和厚垣孢子对黄瓜幼苗的抗氧化能力及枯萎病防效的盆栽试验效果,与大田试验存在一定的差异,因此,需要进一步进行田间试验研究。
4 结 论
综上所述,哈茨木霉菌809、拟康氏木霉菌886、棘孢木霉菌525分生孢子和厚垣孢子通过提高黄瓜幼苗保护性酶活性,降低了相对电导率和MDA含量,增强了幼苗抗氧化能力,抑制黄瓜枯萎病发病率,提高了对黄瓜枯萎病的防治效果。其中以拟康氏木霉菌886厚垣孢子应用效果最好,对黄瓜枯萎病的防效达到 81.46%,黄瓜幼苗叶片中的POD、CAT、APX、SOD活性则分别比CK增加了318.11%、155.36%、157.09%和300.34%,而相对电导率、MDA含量则分别比CK下降了47.74%、41.40%。

