发酵食品中抗氧化乳酸菌的筛选与鉴定
(浙江工业大学 生物工程学院,浙江 杭州 310014)
1956年英国学者Harmna首先提出了自由基衰老学说。自由基衰老理论(FRTA)认为细胞的老化变化是由自由基反应引起的[1]。1990年美国衰老研究权威Sohal教授指出了自由基衰老理论的缺陷[2],并首次提出了氧化应激的概念。氧化应激即机体自由基生成增加或清除能力降低,引起机体氧化系统和抗氧化系统的功能紊乱,导致自由基在体内积累而引起的一系列氧化损伤过程[3]。多种研究证明:氧化应激不仅与衰老有着密不可分的关系,氧化应激还与肿瘤的发生,哮喘、抑郁症及各种慢性炎症等疾病息息相关[4-6]。氧化应激还参与心血管疾病的病理生理过程,引发动脉粥样硬化、心力衰竭、高血压和心肌损伤等[7]。
机体自身的抗氧化能力有限,因此,通过摄入外源性的抗氧化剂已成为机体缓解氧化应激的重要途径。文献报道具有抗氧化活性的微生物有乳酸菌、酵母菌,及某些致病菌,如炭疽病菌等[8]。其中,乳酸菌是一种被人类广泛利用的益生菌,常常被应用在食品发酵工业及微生态制剂中。普通酸奶中仅添加保加利亚乳杆菌与嗜热链球菌,而这两种菌是“一过性”的保健菌,它们绝大多数不会进入肠道,不能起到调节肠道菌群的作用[9]。因此,现在越来越多的发酵乳中也开始添加除了保加利亚乳杆菌、嗜热链球菌以外的益生菌。目前,全球公认的益生菌有双歧杆菌、乳杆菌等。其中短乳杆菌是乳杆菌属中的重要种群之一,其具有高产酸、去除亚硝酸盐和产细菌素等功能[10],尤其是短乳杆菌在发酵食品中去除亚硝酸盐的作用显著,具有用量小、作用快和使用方便等特点[11]。此外,Shakibaie等[12]发现一株富硒短乳杆菌,具有作为含硒添加剂的潜力。益生菌类保健品在国外已经发展了许多年,近几年益生菌制品在国内市场上逐渐得到认可。现已有研究发现有些乳酸菌能够清除1,1-二苯基-2-三硝基苯肼(DPPH),羟自由基等活性氧自由基,缓解细胞氧化应激[13-14]。乳酸菌作为天然食品添加剂能缓解机体氧化应激以及一些疾病的发生。因此,筛选具有较好缓解氧化应激功能的乳酸菌具有重要研究意义及应用前景。本研究通过体外抗氧化实验从传统自制的发酵食品中筛选出具有缓解氧化应激功能的益生菌菌株,以期为开发具有缓解氧化应激功能的乳酸菌食品发酵剂奠定理论基础。
1 材料与方法
1.1 材料与仪器
传统自制的发酵蔬菜:萝卜、白菜、长豇豆和芥菜;婴儿粪便,采集于25 d健康婴儿;MRS液体培养基:蛋白胨10.0 g/L,牛肉膏10.0 g/L,酵母膏10.0 g/L,柠檬酸二铵2.0 g/L,乙酸钠5.0 g/L,硫酸镁0.58 g/L,硫酸锰0.25 g/L,磷酸氢二铵2.0 g/L,葡萄糖20.0 g/L,吐温-80 1 mL;二苯基苦基苯肼自由基(Sigma生物试剂有限公司);DNA抽提试剂盒,由生工生物工程(上海)股份有限公司出品;API50试剂条(生物梅里埃中国有限公司);邻菲罗琳、过氧化氢、硫酸亚铁和抗坏血酸等试剂(均为国产分析纯)。
生化培养箱(型号SPX-250B-Z,上海博迅实业有限公司);紫外/可见分光光度计(型号UV1000,上海天美科学仪器有限公司);超声波破碎仪(SONICS,型号VCX500) ;台式高速冷冻离心机(Thermo,型号Stratos);聚合酶反应仪(Eppendorf,型号Mastercycler)。
1.2 实验方法
1.2.1 样品的采集
使用一次性无菌注射器采集发酵蔬菜的汤汁,保存于已灭菌的EP管中。对婴儿粪便进行无菌采集,采样后样品封口膜封口,均保存于4 ℃备用。
1.2.2 乳酸菌的分离纯化
将样品用生理盐水进行梯度稀释,将稀释后的样品均匀涂布于pH为5.0的MRS固体培养基上,放入37 ℃普通培养箱培养24~48 h。
观察菌落形态,挑选符合乳酸菌形态的菌落进行3 次划线纯化。对纯化后的菌落进行革兰氏染色和接触酶实验。革兰氏染色阳性,接触酶实验为阴性的菌株可初步判定为乳酸菌。
1.2.3 乳酸菌耐受性实验
1) 乳酸菌的耐酸性测定:将活化后的菌株,以3%的接种量分别接种于pH为2.0,3.0,4.0,6.0的MRS液体培养基中,37 ℃培养16 h。16 h后测其在600 nm处的吸光值。
2) 乳酸菌的胆盐耐受能力测定:将活化的菌株,以3%的接种量接种于分别含有0,0.3%,0.5%猪胆盐的MRS液体培养基中,37 ℃培养16 h。16 h后测其在600 nm处的吸光值。
3) 乳酸菌的过氧化氢耐受能力测定:将活化的菌株按3%接种于过氧化氢浓度分别为0.4,0.7,1.0 mmol/L的MRS液体培养基中,37 ℃培养16 h。16 h后测其在600 nm处的吸光值。
1.2.4 乳酸菌体外抗氧化能力测定
1) 样品的处理
样品处理参考Lin等[15]的方法。完整细胞悬液:将菌以1%接种于MRS液体培养基,37 ℃培养16 h后4 ℃,4 000 r/min离心10 min,弃上清,收集菌体,收集的菌体经PBS(pH为7.2)洗涤3 次,再悬浮于PBS中,调整菌数至1×109cfu/mL。
胞内提取物:将上述菌数为1×109cfu/mL的完整细胞悬液激进行超声破碎,功率400 W,工作5 s,停5 s,60 次。破碎后将悬液4 ℃,10 000 r/min离心10 min,收集上清。
2) DPPH清除能力测定
取0.2 mmol/mL的DPPH 1 mL,加1 mL处理过的乳酸菌样品充分混匀后,室温避光反应30 min,6 000 r/min离心10 min,取上清,测定其在波长517 nm处的吸光度Ai,对照组(AO)以等体积PBS代替样品。以等体积PBS和无水乙醇调0[16-17],其表达式为
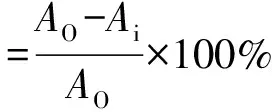
3) 羟自由基清除能力测定
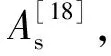
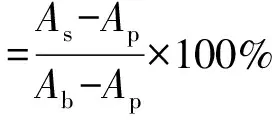
4) 抗脂质过氧化能力测定
在新鲜的鸡蛋黄中1︰1加入PBS,磁力搅拌10 min后用PBS稀释成1︰25的蛋黄悬液。取1 mL蛋黄悬液,0.5 mL样品,1 mL PBS和1 mL FeSO4(25 mmol/L)溶液混匀,37 ℃保温1.5 h。然后加入1 mL三氯乙酸(TCA,质量分数为2.5%),室温静置10 min,3 500 r/min,离心10 min。取上清加入2 mL的硫代巴比妥酸(TBA,质量分数为0.8%),充分混匀后沸水浴10 min;冷却后于532 nm处测定吸光度A1。A0用等量的样品溶剂(即PBS)代替样品[19],其表达式为
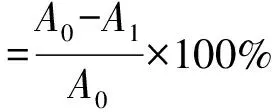
5) 还原活性分析
在0.5 mL的菌悬液中依次加入0.5 mL PBS,0.5 mL铁氰化钾(质量分数为1%),50 ℃水浴20 min,迅速冷却后加入0.5 mL 10%的三氯乙酸,4 000 r/min离心5 min。取上清1 mL加入1 mL蒸馏水和三氯化铁(质量分数为0.1%)混合均匀,反应10 min后于700 nm处测定其吸光值,用L-半胱氨酸作为标品[20]。
1.2.5 菌种鉴定
1) 16S rDNA:将乳酸菌ZJ401过夜培养后,取适量菌液利用试剂盒提取全基因组。得到的全基因组用16S通用引物进行PCR(27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3'),将PCR产物送至公司进行测序。将测序结果在NCBI上进行BLAST比对。
2) API50CH菌种鉴定:用API50CH及API50CHL进行乳酸菌的生理生化鉴定,操作步骤按照说明书进行。
3) 生长曲线分析:取50 mL已发酵24 h的菌液离心弃上清,用生理盐水洗涤后再离心弃上清,置于烘箱中烘干至恒重(65 ℃,24 h),测其干重,以此为依据分别计算出1, 2, 4, 5, 6, 8, 10 mL发酵液的菌体干重。另取1, 2, 4, 5, 6, 8, 10 mL菌液,离心弃上清后用生理盐水重悬浮混匀定容至25 mL,分别测其OD600 nm,得到吸光值OD600 nm与菌体干重的生物量标准曲线。另以1%的接种量将乳酸菌ZJ401接种于MRS液体培养基中,每隔2 h取一定量菌液进行OD600 nm测定和pH测定。
1.2.6 统计分析
每个实验重复3 次,采用SPSS 19.0的单因素方差分析显著性差异。
2 结果与讨论
2.1 乳酸菌的分离纯化
从10 种不同来源的样品中分离得到34 株菌,革兰氏染色均为阳性,接触酶实验均为阴性。因此初步鉴定这34 株菌为乳酸菌,菌落形态为乳白色,表面光滑,边缘整齐的圆形菌落,镜检下可看到这34 株菌为长杆状或短杆状。
2.2 乳酸菌耐受性
2.2.1 乳酸菌的耐酸性
乳酸菌需要有较好的耐酸性才能在胃酸环境下维持活性,对34 株菌进行了耐酸性试验后发现其中有6 株乳酸菌的耐酸性较好,图1为6株乳酸菌在不同pH条件下的生长情况。图1中:小写字母a~f表示同一菌株在不同pH条件下的显著性分析,字母一样表示没有显著性,字母不同表示有显著性(P<0.05)。从图1中可看出:当pH为6,7时,乳酸菌的OD600 nm最高活性最好,说明pH在6.0到7.0左右是这几株菌的最佳培养条件。6株菌均能在pH为4.0的坏境下生长,其中ZJ906的活性最差。当pH为3.0时,只有ZJ401还具有活性,其余5 株菌均无法生长。当环境pH为2.0时,所有菌株的生长水平与初始一致,所有菌株均无法生长。正常人体的胃液pH最低可达2以下,人体消化不同食物的时间在30 min到4 h不等。因此在pH越低的环境下具有耐受性的乳酸菌越能在胃酸中维持活性,到达肠道。由上可看出ZJ401具有较好的耐酸性。
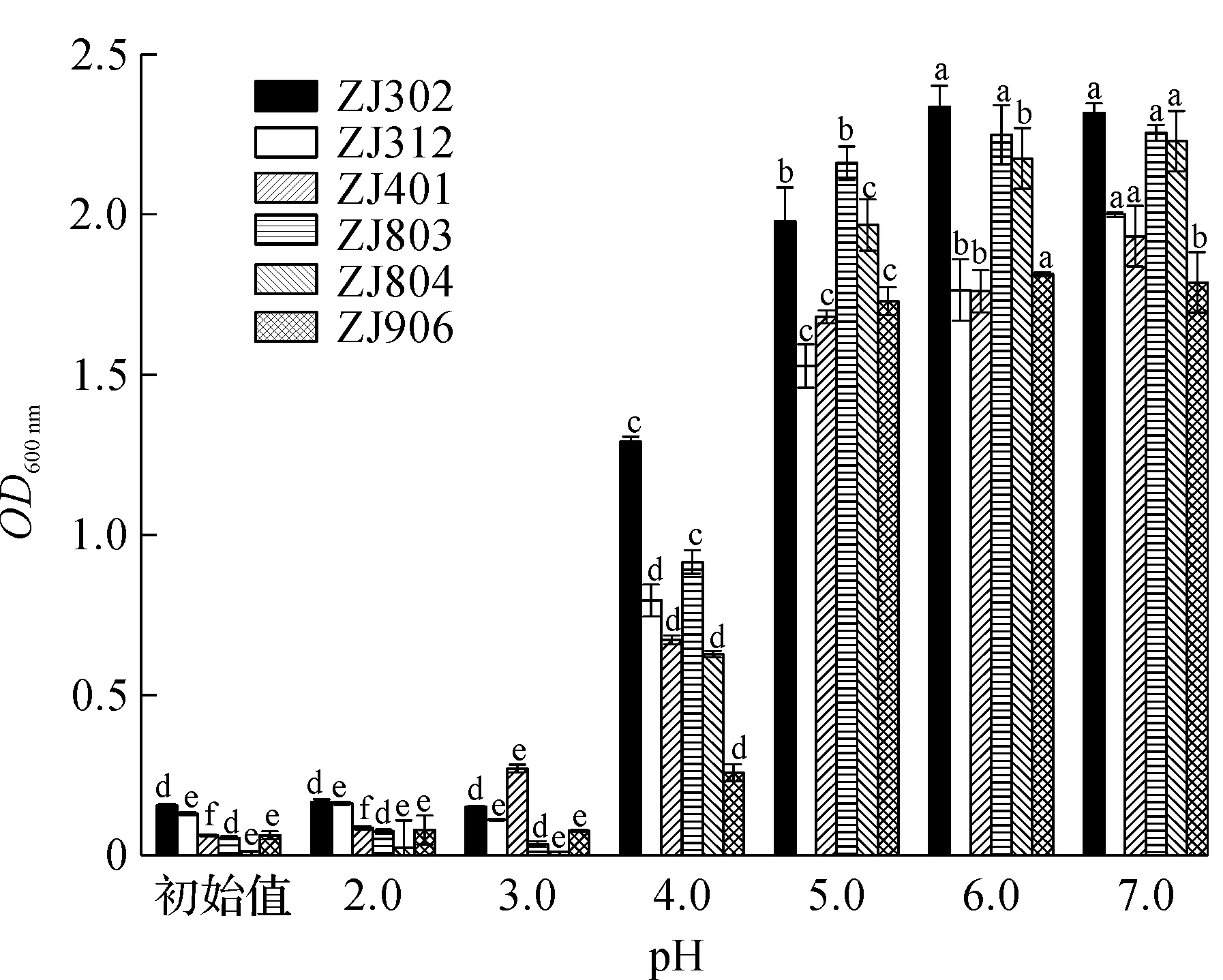
图1 乳酸菌在不同pH条件下的生长情况Fig.1 The growth of Lactic acid bacteria at different pH conditions
2.2.2 乳酸菌的胆盐耐受性
乳酸菌要顺利到达肠道,除了需要具有一定的耐酸能力以外,还需要具有一定的胆盐耐受能力,正常人体肠道中胆盐质量分数在0.03%~0.3%波动,乳酸菌在此胆盐浓度下具有活性就有可能在肠道中定植。图2为6 株乳酸菌在不同胆盐质量分数下的生长情况,图2中:小写字母a~d表示同一菌株在不同胆盐质量分数条件下的显著性分析,字母一样表示没有显著性,字母不同表示有显著性(P<0.05)。从图2中可以看到:胆盐对这6 株乳酸菌活性影响均较大,但这几株乳酸菌在胆盐质量分数为0.5%的培养条件下都具有活性,说明这几株乳酸菌对胆盐有一定耐受能力。
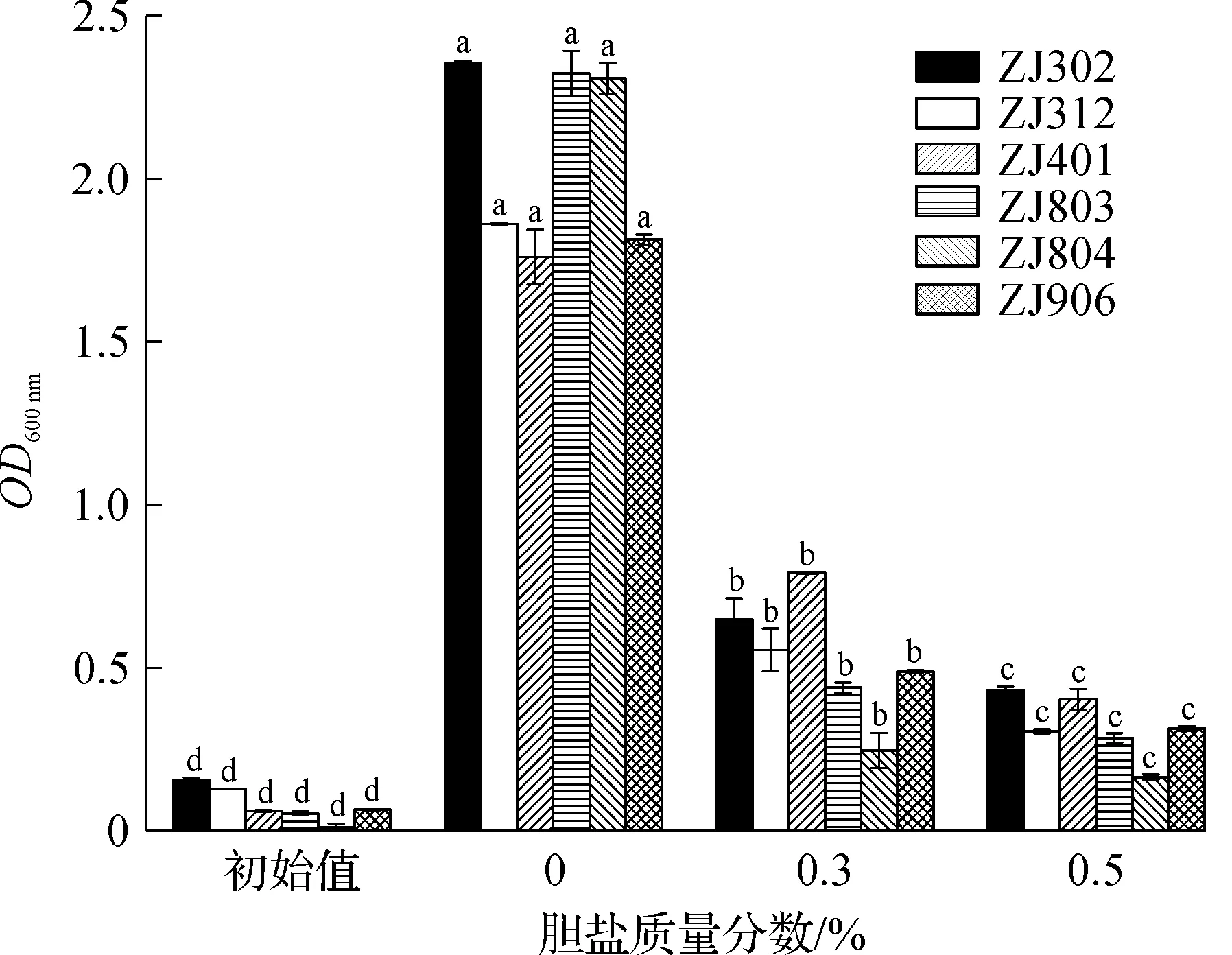
图2 乳酸菌在不同胆盐质量分数下的生长情况Fig.2 The growthof Lactic acid bacteria at different concentrations of bile salts
2.2.3 乳酸菌的H2O2耐受能力
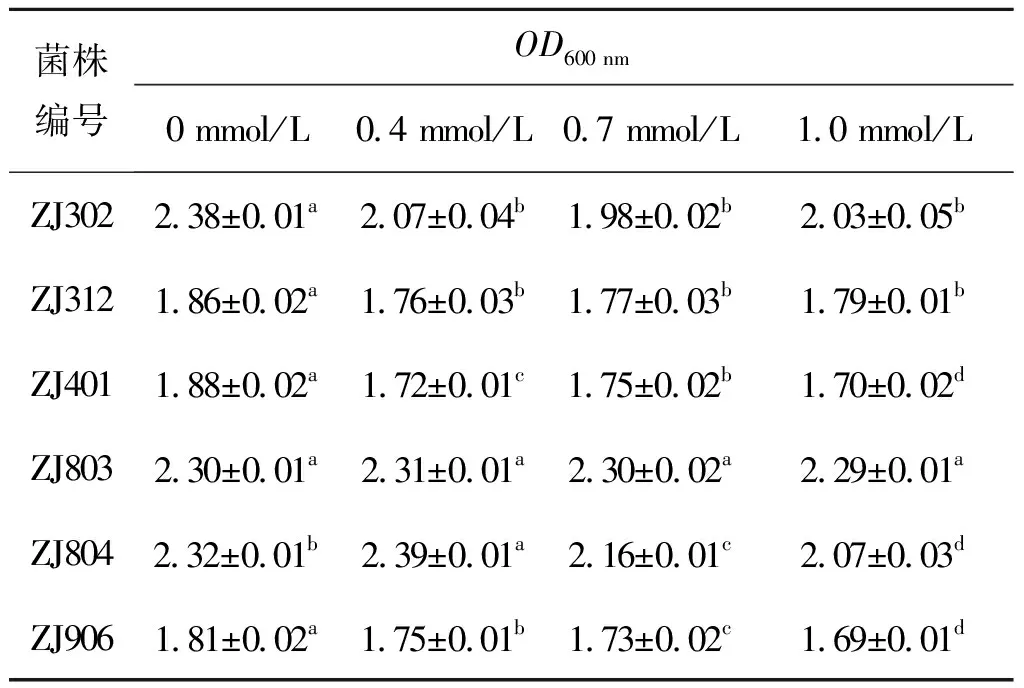
H2O2是一种弱氧化剂,会引起人体的氧化损伤。乳酸菌对H2O2的耐受性是筛选缓解氧化应激乳酸菌的重要指标之一。表1为6 株乳酸菌在不同H2O2浓度下的生长情况。从表1可看出:随着过氧化氢浓度的升高,对除ZJ803以外的菌株生长有一定的影响。但是菌株的存活率均较高,因此这6 株乳酸菌对过浓度为1 mmol/L的过氧化氢都具有耐受性。
表1 乳酸菌在不同过氧化氢浓度下的生长情况
Table 1 Thegrowth of Lactic acid bacteria at different concentrations of hydrogen peroxide
菌株编号OD600 nm0 mmol/L0.4 mmol/L0.7 mmol/L1.0 mmol/LZJ3022.38±0.01a2.07±0.04b1.98±0.02b2.03±0.05bZJ3121.86±0.02a1.76±0.03b1.77±0.03b1.79±0.01bZJ4011.88±0.02a1.72±0.01c1.75±0.02b1.70±0.02dZJ8032.30±0.01a2.31±0.01a2.30±0.02a2.29±0.01aZJ8042.32±0.01b2.39±0.01a2.16±0.01c2.07±0.03dZJ9061.81±0.02a1.75±0.01b1.73±0.02c1.69±0.01d
注:右上标小写字母a~d表示同一菌株在不同过氧化氢浓度条件下的显著性分析,字母相同表示没有显著性,字母不同表示有显著性(P<0.05)。
2.3 乳酸菌体外抗氧化能力
2.3.1 DPPH清除率
DPPH(1,1-二苯基-2-三硝基苯肼)自由基清除实验常用于抗氧化能力的评价实验中。当自由基清除剂存在时,DPPH 自由基接受一个电子或氢原子,形成稳定的DPPH-H化合物,使其乙醇溶液从深紫色变为黄色,变色程度与其接受的电子数量(自由基清除活性)成定量关系,因而可用分光光度计进行快速的定量分析[21]。对6 株乳酸菌进行DPPH清除率实验,发现其中ZJ302,ZJ804的DPPH清除率均低于5%,其余4 株菌DPPH清除率均在10%之上,如图3所示。图3中:小写字母a~c表示同一种状态下不同菌株之间的显著性分析,字母一样表示没有显著性,字母不同表示有显著性(P<0.05)。DPPH清除率最高的两株菌是ZJ401,ZJ803,且发现4 株乳酸菌的无细胞提取物的DPPH清除率均略高于完整菌体,但是实验发现ZJ803的DPPH清除率实验的重复性较差。
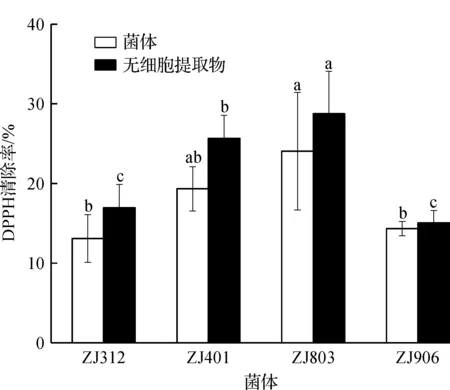
图3 DPPH清除率Fig.3 DPPH clearance rate
2.3.2 羟自由基清除能力
芬顿反应是过氧化氢和二价铁离子催化反应生成具有强氧化能力的羟基自由基,目前芬顿反正也广泛应用于抗氧化能力的评价实验中,如图4所示。图4中:小写字母a~d表示同一种状态下不同菌株之间的显著性分析,字母一样表示没有显著性,字母不同表示有显著性(P<0.05)。从图4可以看到:4 株菌中ZJ401的羟自由基清除能力最好,其次是ZJ803,ZJ312,羟自由基清除能力最差的是ZJ906。与DPPH清除率实验相同,4 株菌的无细胞提取物的羟自由基清除能力均高于完整菌体。
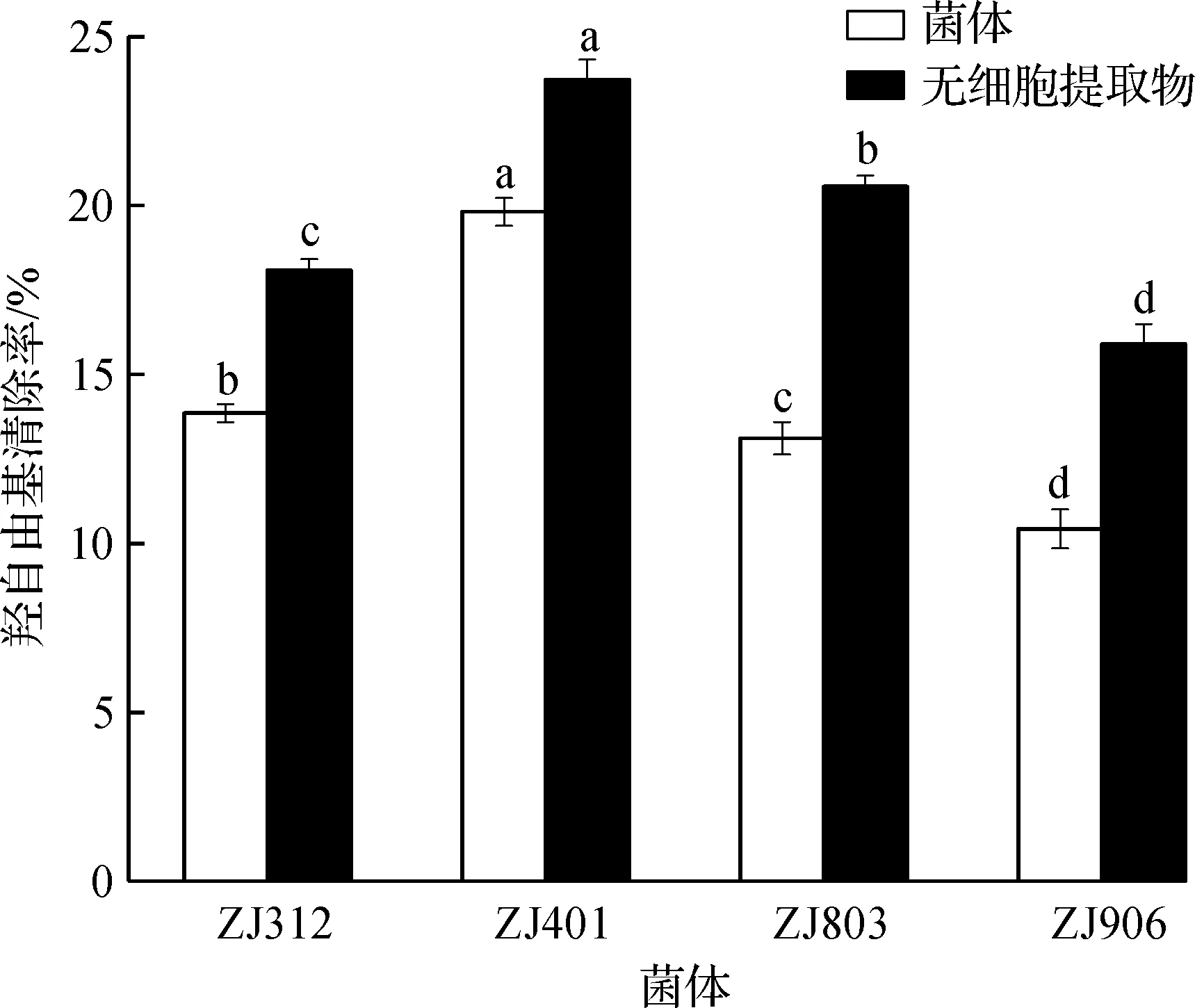
图4 羟自由基清除率Fig.4 Hydroxyl radical scavenging rate
2.3.3 抗脂质过氧化能力
采用硫代巴比妥酸法进行抗脂质过氧化能力的测定,其原理是不饱和体系的氧化产物与硫代巴比妥酸的反应物在532 nm处有一个强吸收峰,如图5所示。图5中:小写字母a~d表示同一种状态下不同菌株之间的显著性分析,字母一样表示没有显著性,字母不同表示有显著性(P<0.05)。如图5所示,抗脂质过氧化能力最好的是ZJ401,其次是ZJ803。而ZJ312的完整菌体与ZJ906的无细胞提取物均没有检测到抗脂质过氧化能力。

图5 抗脂质过氧化能力Fig.5 Anti-lipid peroxidation
2.3.4 乳酸菌还原活性
还原能力与抗氧化活性有一定的相关性,因此还原能力的测定常用于评价抗氧剂活性。如表2所示,ZJ906的还原活性最好,其次是ZJ401,且与DPPH清除率与羟自由清除率一样,4 株菌的无细胞提取物的还原活性均高于完整菌体的还原活性。
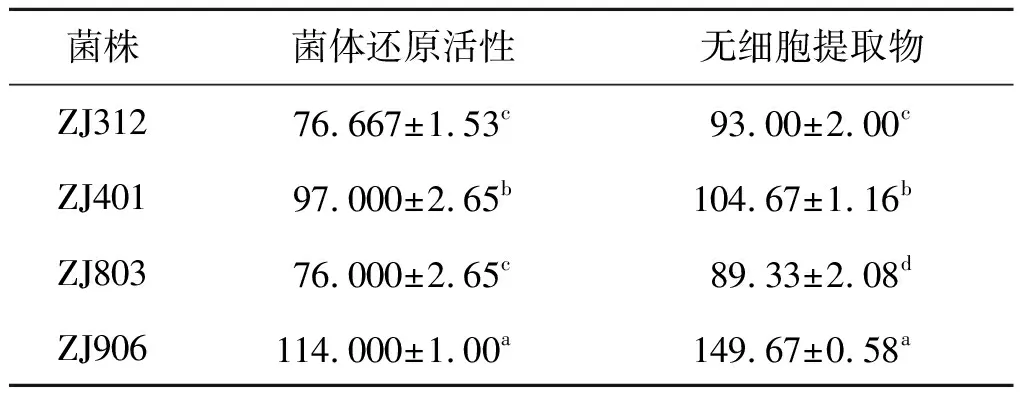
表2 乳酸菌还原活性Table 2 Lactic acid bacteria reduction activity 单位:μmol/L
注:右上标小写字母a~d表示同一种状态下不同菌株之间的显著性分析,字母相同表示没有显著性,字母不同表示有显著性(P<0.05)。
综合上述4 个抗氧化实验可以发现:4 株乳酸菌均有一定的抗氧化活性,其中综合抗氧化活性最好的是ZJ401,其无细胞提取物DPPH清除率可达25.68%,羟自由基清除率为23.72%,还原活性相当于104.67 μmol/L L-半胱氨酸。且从4 个抗氧化实验结果可以看出:不同的抗氧化实验结果有一定的相关性。
2.4 菌种鉴定
2.4.1 16S rDNA
ZJ401的16sr DNA的PCR扩增产物如图6所示,扩增条带单一,且扩增片段大小在1 500 bp左右。将PCR扩增产物送至公司进行双向测序,拼接后的序列在NCBI上进行BLAST比对。结果显示与ZJ401序列同源性最高的菌株为短乳杆菌(相似度99%,序列号NR 116238.1)。
选取同源性高的典型菌种序列,对ZJ401与其发育关系相近的菌株进行遗传距离计算。应用MAGE 5.0软件构建系统发育树,图7为ZJ401进化树。
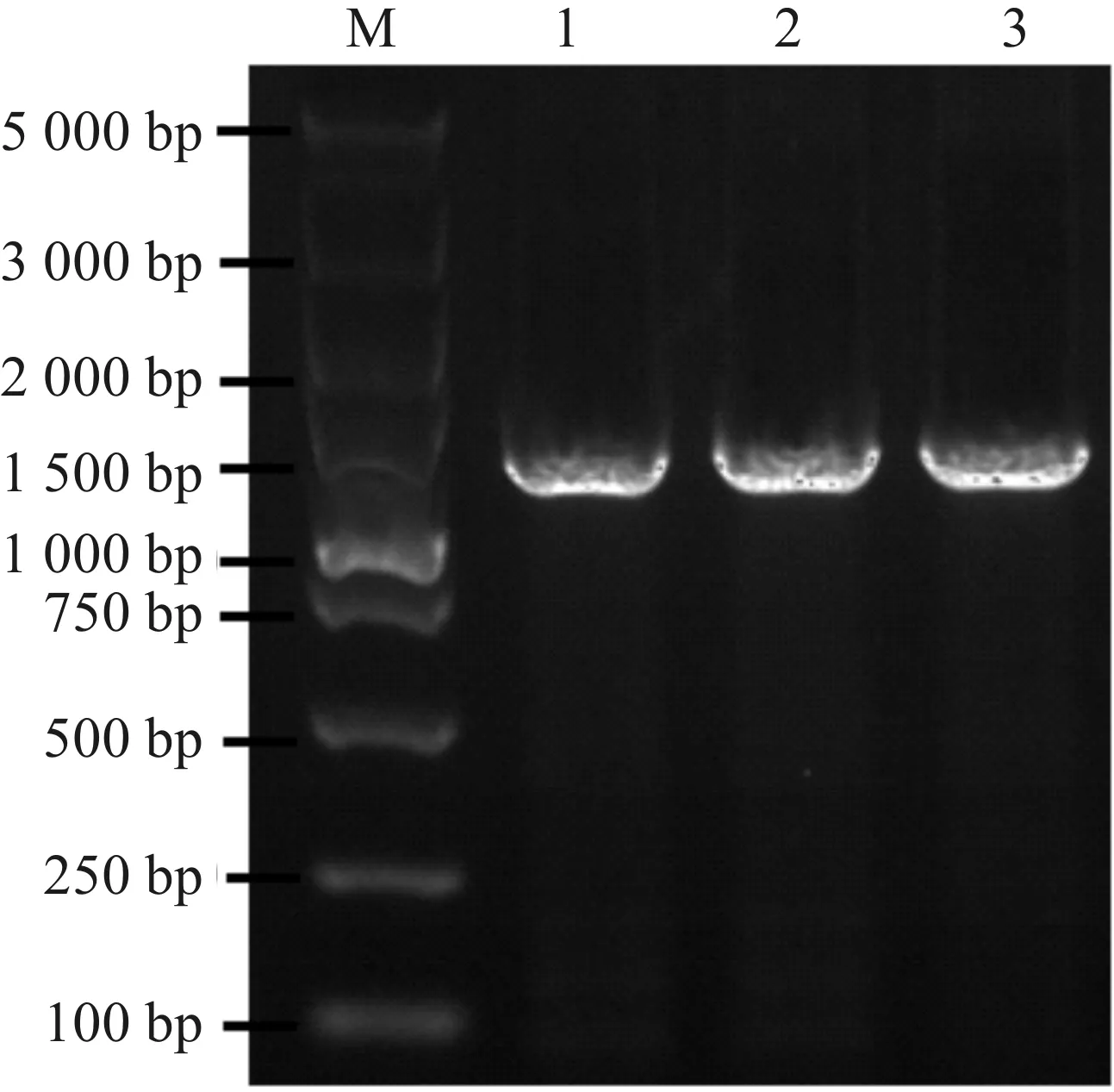
M—标准DNA分子量;1,2,3—ZJ401。图6 菌株ZJ401的基因组PCR电泳图Fig.6 Electrophoretogram of PCR products of ZJ401
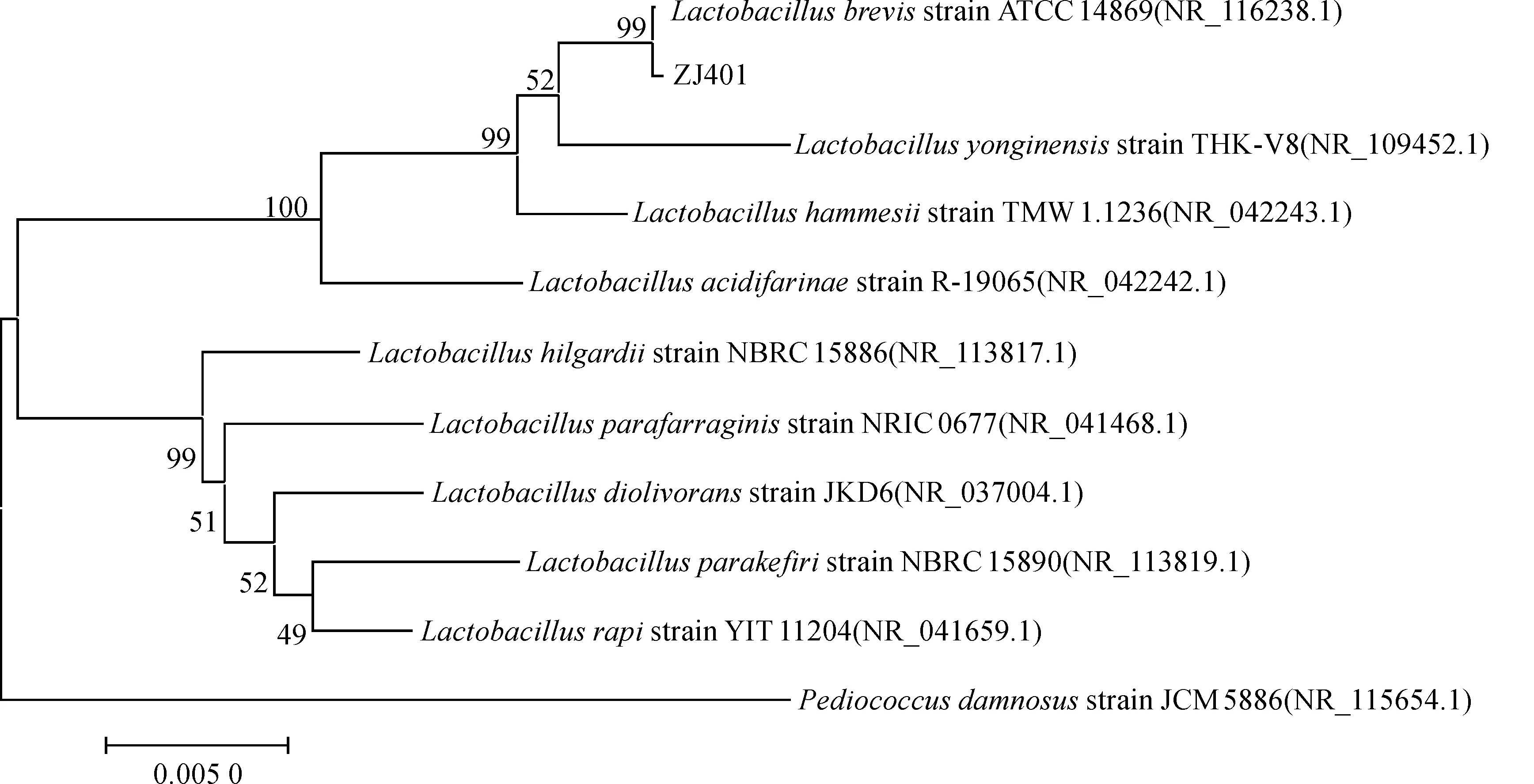
图7 ZJ401进化树Fig.7 Evolutionary trees of ZJ401
2.4.2 API50CH
对ZJ401进行生理生化鉴定,试剂条结果如表3所示,将试剂条结果通过API Lab进行分析与鉴定。结果显示菌株ZJ401的鉴定结果为短乳杆菌,其ID值(鉴定百分率)为99.6%,T值(T指数)为1.0。结合16S rDNA序列对比结果和API50CH生理生化结果,鉴定ZJ401为短乳杆菌。
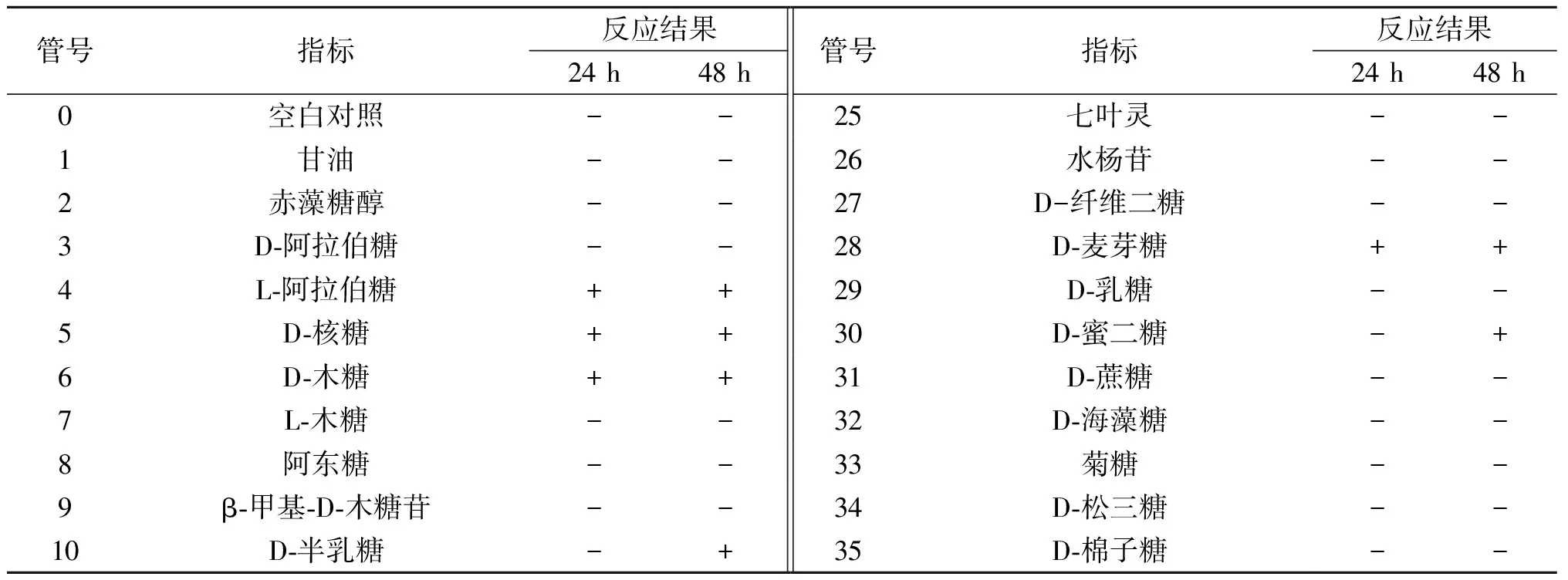
表3 API50CH生理生化鉴定结果Table 3 API50CH physiological and biochemical identification results

表3 (续)
注:+表示反应呈阳性;-表示反应呈阴性。
2.4.3 生长曲线
对抗氧化活性最佳的ZJ401进行生长曲线的测定,结果如图8所示。6 h时生长进入对数期,18 h以后菌体生长进入平稳期,短乳杆菌ZJ401的对数生长期为6~18 h。发酵液的pH从最初的6.0最后降到4.4。
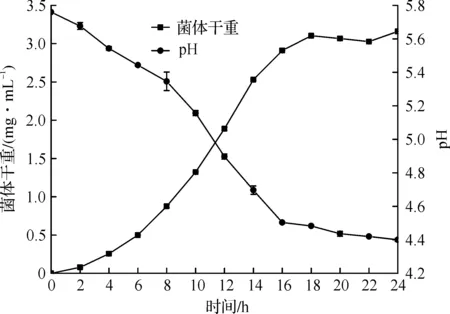
图8 ZJ401生长曲线Fig.8 The growth curve of ZJ401
3 结 论
随着科技进步和生活水平的提高,细胞抗氧化与抗衰老越来越多地为人们所关注。细胞氧化应激损伤与衰老及多种疾病都有着密不可分的关系。本实验从各种发酵食品中筛选得到34 株乳酸菌,经耐酸耐胆盐及耐过氧化氢实验得到6 株耐受性较好的乳酸菌,通过DPPH清除率,羟自由清除率,还原活性,抗脂质过氧化率实验对菌株的体外抗氧化性进行了鉴定,确定了一株具有优良抗氧化性的短乳杆菌,命名为ZJ401。ZJ401具备优良的体外抗氧化活性和益生性能,为后续乳酸菌的菌种选育,食品发酵工业中功能性抗氧化食品发酵剂的研制,以及新型的益生活菌制剂的开发奠定基础。

