阿托伐他汀联合黄芪对早期2型糖尿病肾病患者TGF-β1及肾功能的影响
王世蓉,张新
(辽宁省盘锦市辽河油田总医院 内分泌科,辽宁 盘锦 124010)
糖尿病肾病(diabetic nephropathy,DN)又称肾小球硬化症是糖尿病患者常见的微血管并发症之一,表现为广泛的肾小球结节性硬化,并逐步出现微量蛋白尿,大量蛋白尿,血肌酐上升,最终导致终末期肾功能衰竭,已逐渐成为糖尿病患者死亡的主要原因之一[1-3]。早期DN的发病机制主要包括:糖代谢异常、脂代谢异常、肾脏血流动力学改变、氧化应激、遗传因素、机体微炎症状态等[4-6]。国内外多项研究表明,转化生长因子β1(transforming growth factor-β1,TGF-β1)在DN疾病发展过程中起重要作用[7-8]。为进一步研究TGF-β1在2型糖尿病肾病(type 2 diabetic nephropathy,T2DN)患者体内的变化趋势,寻找更好的治疗方案。本研究纳入早期T2DN患者,采用随机对照的方法评估阿托伐他汀联合黄芪的安全有效性,以及这种治疗方式对早期T2DN患者TGF-β1及肾功能的影响。
1 资料与方法
1.1 临床资料
选取2013年4月-2016年3月辽河油田总医院内分泌科就诊的2型糖尿病合并早期肾病的患者135例。纳入标准:①年龄30~70岁,性别不限;②符合诊断标准:2型糖尿病按中华糖尿病学会制定的标准诊断(2010年),早期糖尿病肾病参照Megnesn Ⅲ期诊断(尿微量白蛋白30~300 mg/24 h)[9];③实验前72 h需停用影响本实验的药物;④患者知情同意,依从性好。排除标准:①近期出现急慢性感染的患者;②糖尿病合并肝肺疾病或严重的心脑血管障碍者;③半年内有住院治疗史者;④近期使用过损伤肾脏的药物或对本实验用药有过敏史者;⑤出现严重不良事件或不能耐受的患者;⑥有其他恶性消耗性疾病或影响本研究效果评价的疾病。
1.2 实验设计及治疗方法
将纳入的患者由专业统计人员按随机数字表法随机分配至对照A组,对照B组和观察组,各组均为35例。所有患者在遵循个体化治疗的基础上通过饮食、口服降糖药、注射胰岛素或联合多种常规治疗方式将血糖控制在空腹7.0 mmol/L,餐后2 h 10 mmol/L以内。待患者血糖稳定2周后,对照A组继续使用上述方式控制血糖,其余两组患者除上述治疗措施外,观察组患者再增加阿托伐他汀联合黄芪治疗,对照B组只增加阿托伐他汀。阿托伐他汀(美国辉瑞,批号JX20000048)服用方式:口服20 mg/d。黄芪注射液(上海新亚,国药准字Z32021257)50 ml加入250 ml盐水中静脉滴注,1次/d;4周后改为口服4片/次,2次/d。总疗程为3个月。本研究方案通过医院伦理委员会批准,受试者均知情同意。
1.3 观察方法
1.3.1 检测指标 分别在治疗前、治疗2周、4周及3个月后,这4个时间点测定患者糖化血红蛋白(HbA1c)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、血清瘦素(Leptin)。而肾小球滤过率(GFR)、血肌酐(SCr)、超敏C反应蛋白(hs-CRP)、转化生长因子(TGF-β1)、尿蛋白排泄率(UAER)及24 h尿微量蛋白定量均在治疗前、治疗后4周及治疗后3个月这3个时间点进行测定。除GFR由本院核医学科技术人员采用Tc-DTPA肾动态显像法检测外,其余指标均由检验科完成。为降低误差,使用ELISA方法检测的指标(Leptin、hs-CRP和TGF-β1)均在治疗结束时统一由同一名技术人员进行测定。采用WHO药物不良反应分级标准(3.0版)判定安全性,对发生低级不良反应的患者给予对症处理之后继续原治疗方案,严重反应发生时应立即停止相关治疗。
1.3.2 疗效判定标准 临床疗效依据患者疾病改善情况分为显效、有效、无效及恶化[10]。疗效评估:24 h尿蛋白定量下降至少60%或尿蛋白0.5 g/L以下,患者临床症状基本消失视为显效;患者24 h尿蛋白定量下降30~59%,临床体征好转视为有效;24 h尿蛋白定量下降0%~29%,临床症状无改善视为无效;患者尿蛋白定量增加或症状加重视为恶化。总有效率=[(显效+有效)/病例总数]×100%。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计数资料采用χ2分割法进行两两比较,计量资料以均数±标准差(±s)表示,单因素采用方差分析,在方差分析有意义的基础上,再行LSD-t检验进行两两比较,多因素采用重复测量设计的方差分析,相关性采用Pearson分析,安全性指标采用描述性分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较
符合纳入条件的患者105例,对照A组35例,3例失访,脱落率为8.57%;对照B组35例,2例失访,脱落率为5.71%;观察组35例,2例失访,脱落率为5.71%。入组时3组患者的性别、年龄、吸烟、饮酒、BMI指数、2型糖尿病病程、心率、血压等一般临床资料比较差异无统计学意义(P>0.05)。见表1。
2.2 治疗前后生化指标的变化
重复测量设计的方差分析结果显示,HbA1c组间比较差异无统计学意义(F=1.940,P=0.149),组内比较差异有统计学意义(F=375.22,P=0.000),组间与时间变化趋势的比较差异有统计学意义(F=30.920,P=0.000);LDL-C组间比较差异无统计学意义(F=1.440,P=0.243),组内比较差异有统计学意义(F=80.870,P=0.000),组间与时间变化趋势的比较差异有统计学意义(F=12.380,P=0.000);HDL-C组间、组内、组间与时间交互作用差异均有统计学意义(F=3.450,P=0.036;F=81.790,P=0.000;F=22.010,P=0.000);Leptin组间、组内、组间与时间交互作用差异均有统计学意义(F=14.730,341.320 和 92.390,均P=0.000)。
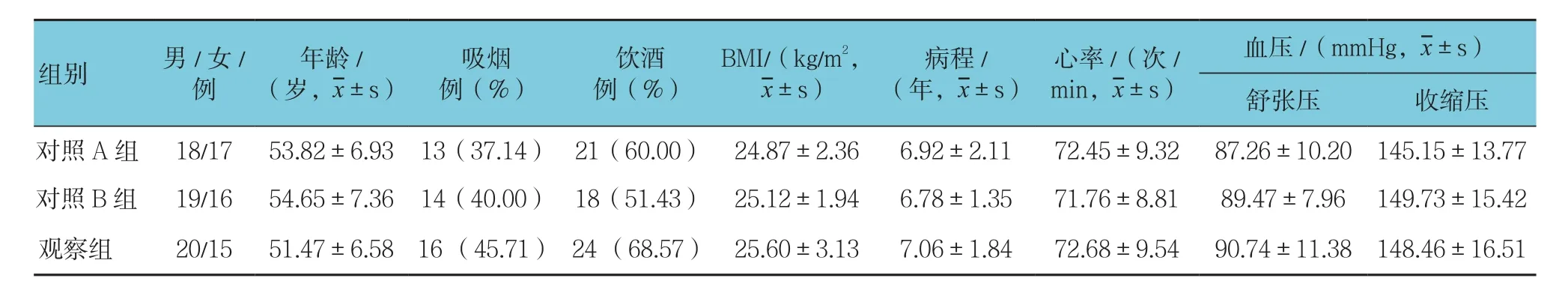
表1 一般资料比较
表2 患者生化指标的变化 (±s)
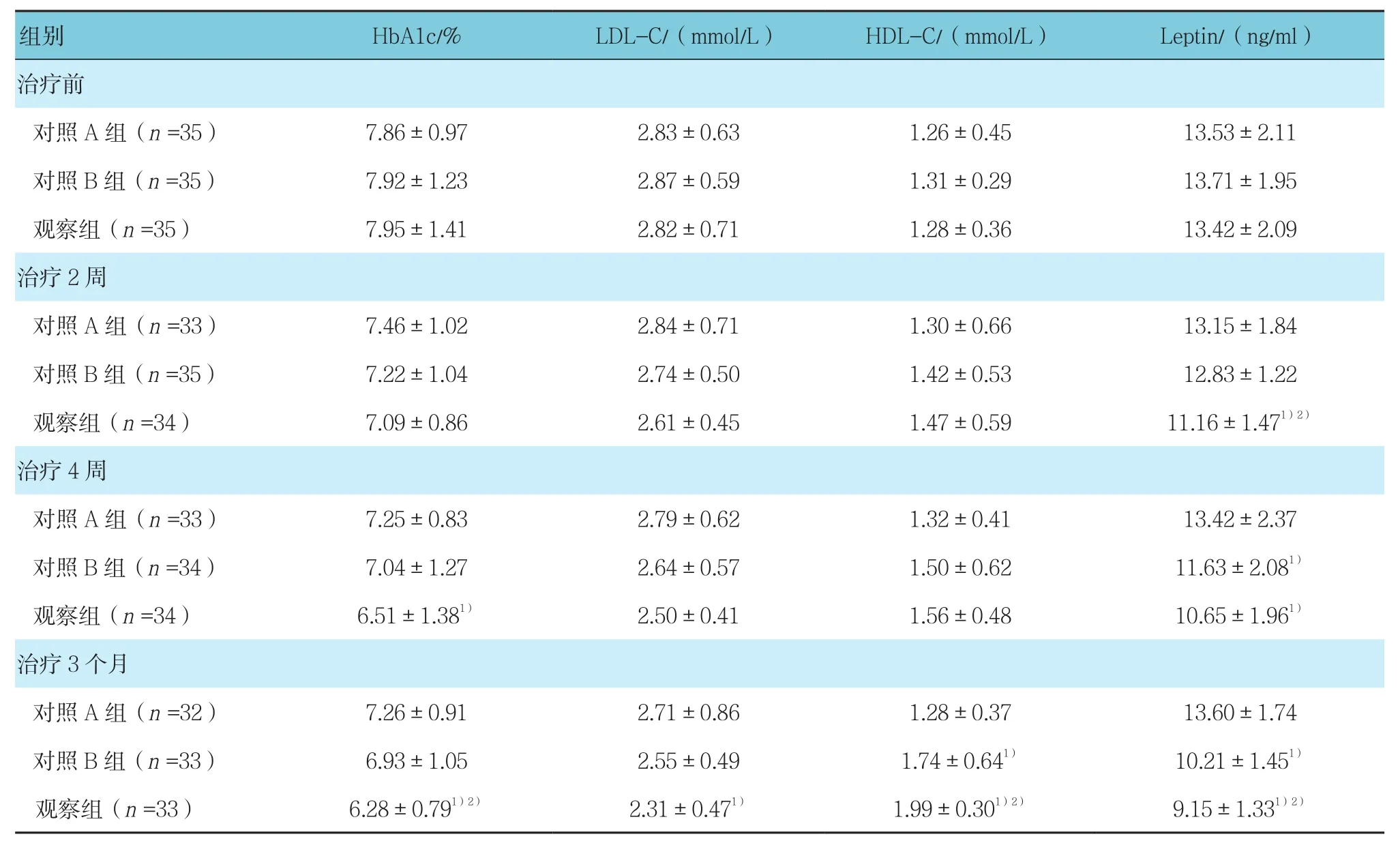
表2 患者生化指标的变化 (±s)
注:1)与对照A组比较,P <0.05;2)与对照B组比较,P <0.05
组别 HbA1c/% LDL-C/(mmol/L) HDL-C/(mmol/L) Leptin/(ng/ml)治疗前对照A组(n =35) 7.86±0.97 2.83±0.63 1.26±0.45 13.53±2.11对照B组(n =35) 7.92±1.23 2.87±0.59 1.31±0.29 13.71±1.95观察组(n =35) 7.95±1.41 2.82±0.71 1.28±0.36 13.42±2.09治疗2周对照A组(n =33) 7.46±1.02 2.84±0.71 1.30±0.66 13.15±1.84对照B组(n =35) 7.22±1.04 2.74±0.50 1.42±0.53 12.83±1.22观察组(n =34) 7.09±0.86 2.61±0.45 1.47±0.59 11.16±1.471)2)治疗4周对照A组(n =33) 7.25±0.83 2.79±0.62 1.32±0.41 13.42±2.37对照 B 组(n =34) 7.04±1.27 2.64±0.57 1.50±0.62 11.63±2.081)观察组(n =34) 6.51±1.381) 2.50±0.41 1.56±0.48 10.65±1.961)治疗3个月对照A组(n =32) 7.26±0.91 2.71±0.86 1.28±0.37 13.60±1.74对照B组(n =33) 6.93±1.05 2.55±0.49 1.74±0.641) 10.21±1.451)观察组(n =33) 6.28±0.791)2) 2.31±0.471) 1.99±0.301)2) 9.15±1.331)2)
在治疗2周后观察组患者血清Leptin水平与对照A组和对照B组比较降低(P<0.05)。治疗4周后对照B组Leptin与对照A组比较降低(P<0.05),与观察组比较升高(P<0.05);观察组HbA1c与对照A组比较降低(P<0.05)。在治疗3个月后对照B组与A组比较HDL-C升高(P<0.05),Leptin降低(P<0.05);观察组HbA1c、LDL-C、HDL-C及Leptin与对照A组比较均改善(P<0.05),且观察组HbA1c、HDL-C及Leptin与对照B组比较均改善,差异有统计学意义(P<0.05)。见表 2。
2.3 治疗前后肾功能及血清炎症因子的变化
GFR组间、组内、组间与时间交互作用差异有统计学意义(F=3.900,P=0.024;F=596.75,P=0.000;F=382.090,P=0.000);SCr组间、组内、组间与时间交互作用差异有统计学意义(F=9.020,801.940和117.410,均P=0.000);UAER组间、组内、组间与时间交互作用差异有统计学意义(F=16.740,1121.060和166.780,均P=0.000);尿蛋白组间比较差异无统计学意义(F=1.740,P=0.180),组内比较差异有统计学意义(F=409.260,P=0.000),组间与时间变化趋势的比较差异有统计学意义(F=25.270,P=0.000);hs-CRP组间、组内、组间与时间交互作用差异有统计学意义(F=3.290,P=0.042;F=534.410,P=0.000;F=145.620,P=0.000);TGF-β1组间、组内、组间与时间交互作用差异有统计学意义(F=3.230,P=0.044;F=1042.030,P=0.000;F=95.340,P=0.000)。
治疗4周后对照B组SCr、UAER及TGF-β1与对照A组比较降低(P<0.05);观察组SCr、UAER、尿蛋白及TGF-β1与对照A组比较降低(P<0.05),GFR与对照A组比较升高(P<0.05),观察组SCr、UAER及TGF-β1与对照B组比较也降低(P<0.05);在治疗3个月后对照B组和观察组患者的GFR、SCr、UAER、尿蛋白、hs-CRP及TGF-β1与对照A组比较均改善(P<0.05),观察组SCr、UAER及TGF-β1与对照B组比较也降低(P<0.05),GFR与对照B组比较升高(P<0.05)。见表 3。
表3 患者肾功能及血清炎症因子的变化 (±s)
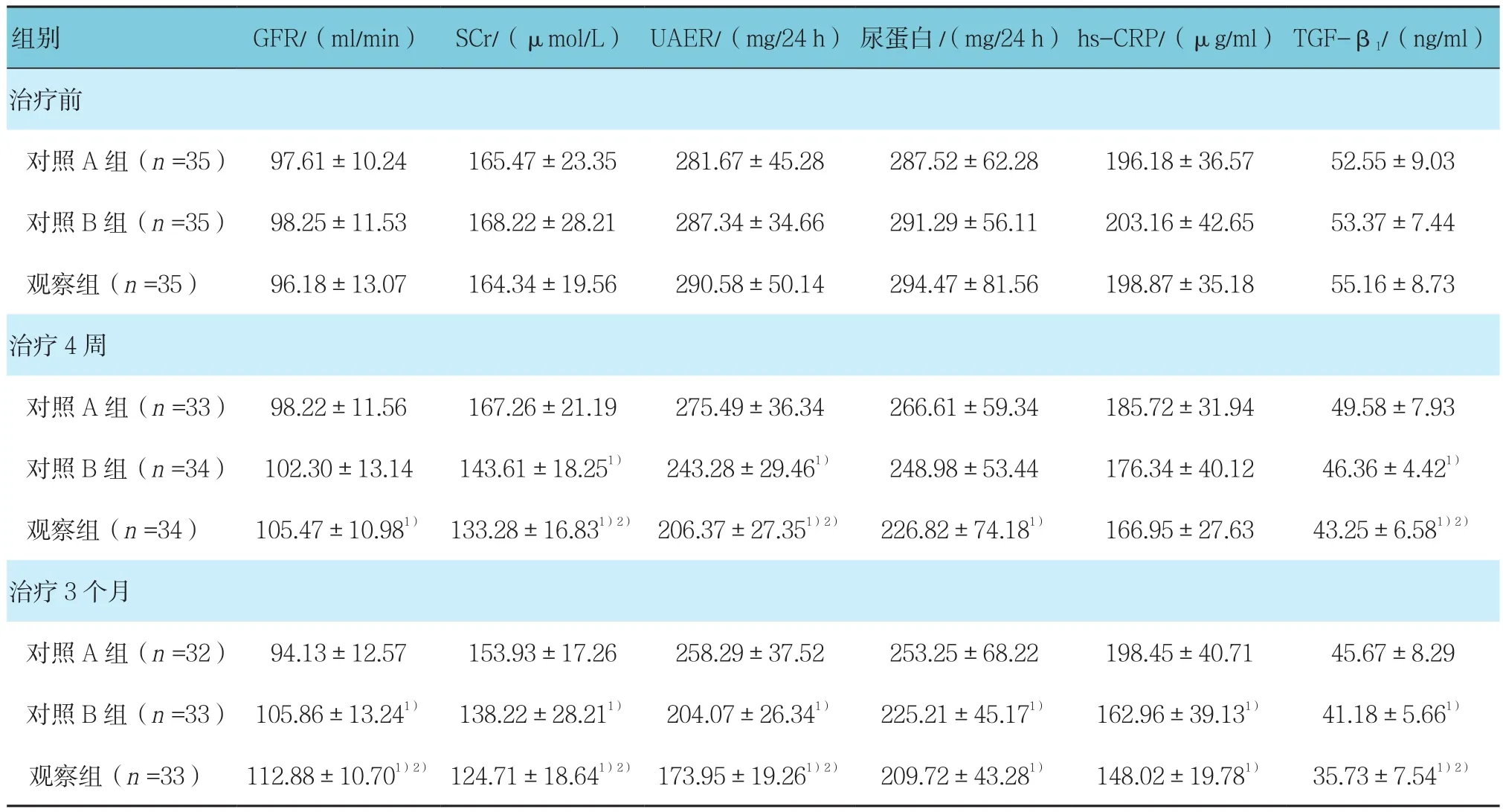
表3 患者肾功能及血清炎症因子的变化 (±s)
注:1)与对照A组比较,P <0.05;2)与对照B组比较,P <0.05
组别 GFR/(ml/min) SCr/(μmol/L) UAER/(mg/24 h) 尿蛋白/(mg/24 h) hs-CRP/(μg/ml) TGF-β1/(ng/ml)治疗前对照A组(n =35) 97.61±10.24 165.47±23.35 281.67±45.28 287.52±62.28 196.18±36.57 52.55±9.03对照B组(n =35) 98.25±11.53 168.22±28.21 287.34±34.66 291.29±56.11 203.16±42.65 53.37±7.44观察组(n =35) 96.18±13.07 164.34±19.56 290.58±50.14 294.47±81.56 198.87±35.18 55.16±8.73治疗4周对照A组(n =33) 98.22±11.56 167.26±21.19 275.49±36.34 266.61±59.34 185.72±31.94 49.58±7.93对照B组(n =34) 102.30±13.14 143.61±18.251) 243.28±29.461) 248.98±53.44 176.34±40.12 46.36±4.421)观察组(n =34) 105.47±10.981) 133.28±16.831)2) 206.37±27.351)2) 226.82±74.181) 166.95±27.63 43.25±6.581)2)治疗3个月对照A组(n =32) 94.13±12.57 153.93±17.26 258.29±37.52 253.25±68.22 198.45±40.71 45.67±8.29对照B组(n =33) 105.86±13.241) 138.22±28.211) 204.07±26.341) 225.21±45.171) 162.96±39.131) 41.18±5.661)观察组(n =33) 112.88±10.701)2) 124.71±18.641)2) 173.95±19.261)2) 209.72±43.281) 148.02±19.781) 35.73±7.541)2)
2.4 治疗后患者HbA1c与肾功能及血清炎症因子的相关性分析
治疗3个月后观察组HbA1c与GFR呈负相关(r=-0.900,P<0.05),与 SCr、UAER、尿蛋白、hs-CRP及TGF-β1均呈正相关(r =0.830、0.800、0.860、0.840和0.890,P<0.05);对照B组HbA1c与GFR呈负相关(r=-0.730,P<0.05),与 SCr、UAER、尿蛋白、hs-CRP 及 TGF-β1呈正相关(r =0.750、0.790、0.790、0.760和0.720,P<0.05);对照A组HbA1c与SCr呈正相关(r=0.640,P<0.05),与GFR、UAER、尿蛋白、hs-CRP 及 TGF-β1均无相关(P>0.05)。
2.5 治疗后临床疗效比较
治疗3个月后,对照A组患者总有效率为28.13%;对照B组总有效率为66.67%,优于A组(χ2=9.670,P=0.002);观察组总有效率为81.82%,优于对照A组(χ2=18.960,P=0.000)。见表4。
2.6 治疗期间不良事件
3组患者在治疗期间均未出现肝肾功能损害等严重不良反应事件。
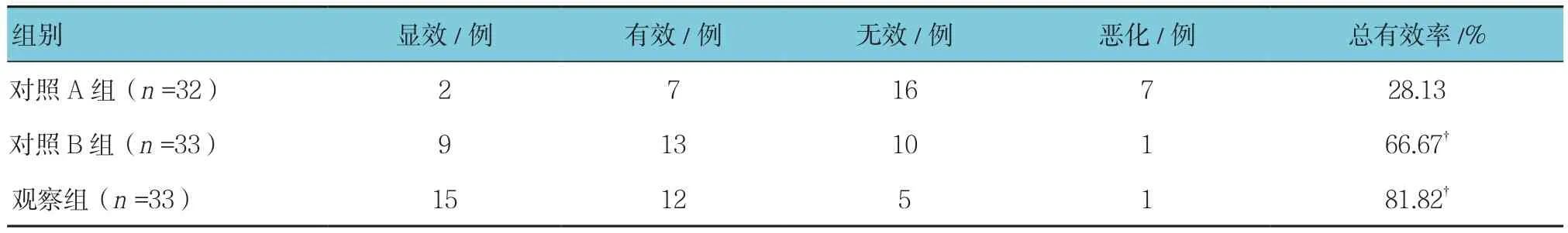
表4 治疗3个月后3组临床疗效比较
3 讨论
DN是由代谢紊乱所致的一种慢性炎症性疾病,据研究估测我国已有1.139亿糖尿病患者,且将有至少25%的1型糖尿病和30%的2型糖尿病进展为DN,最终导致终末期肾病(end-stage renal disease,ESRD)的发生,严重影响着国人的生活质量[11-14]。所以,早期干预和治疗对DN患者疾病的发生、发展具有重要意义。本研究采用随机对照的方法,观察阿托伐他汀联合黄芪治疗早期T2DN患者的安全性和有效性,以及该治疗方式对患者TGF-β1及肾功能的影响。
TGF-β1是TGF-β家族中的一员,是纤维化的关键因子,可通过促进肾脏细胞肥大、肾脏的免疫调节和细胞外基质的生成来介导肾小球硬化[12]。目前针对早期T2DN治疗西医一般是控制血糖和血压,但对于肾脏的保护效果并不理想,所以越来越多的研究者考虑中西医结合的治疗方案。阿托伐他汀是HMGCOA还原酶的竞争性抑制剂,可有效减少肝脏细胞胆固醇的合成,属于一线降血脂药。近年来的多项研究表明阿托伐他汀还有免疫调节、抑制细胞增殖和炎症诱发因素等非降脂作用,能对早期T2DN患者的肾脏起到保护作用[15]。黄芪主要成分有黄芪皂苷、黄芪多糖、微量元素、氨基酸等有效成分。黄芪提取物能减轻DN患者尿蛋白高、可利尿消肿、有改善患者体内炎症的作用,还对肾脏的基底膜有较好的保护作用,从而减缓肾小球硬化和肾脏的纤维化[11-12]。
本研究结果表明,在给予阿托伐他汀联合黄芪治疗2周后观察组患者Leptin水平均比对照A组和对照B组降低,在治疗3个月后观察组HbA1c、HDL-C及Leptin与对照A组和对照B组相比均改善,说明在联合治疗后观察组患者的各项生化指标优于对照A组和对照B组。在联合用药3个月后观察组SCr和UAER与对照A组和对照B组相比降低,GFR升高,表明观察组患者的肾脏功能优于其他两组,联合用药能更好地保护早期T2DN患者的肾脏功能。用药3个月后观察组TGF-β1与其他两组相比降低,因此,联合用药比单使用阿托伐他汀对早期T2DN患者有更好抑制炎症的效果。治疗后患者HbA1c与肾功能及血清炎症因子相关性分析的结果提示:在使用阿托伐他汀组血糖水平降低与肾功能改善及体内炎症水平降低有关。在治疗过程中未见严重不良事件,说明单用和联合用药的安全性均良好。
综上所述,早期T2DN在控制好血糖和血压的同时,使用阿托伐他汀联合黄芪能更好地控制血脂,减轻体内的炎症反应,有效延缓肾脏功能的衰退,且安全性好。
参 考 文 献:
[1] MA X, LU C, LV C, et al. The expression of miR-192 and its significance in diabetic nephropathy patients with different urine albumin creatinine ratio[J]. J Diabetes Res, 2016: 6789402.
[2] MOU X, LIU W H, ZHOU D Y, et al. Association of chinese medicine constitution susceptibility to diabetic nephropathy and transforming growth factor-β1(T869C) gene polymorphism[J].Chin J Integr Med, 2011, 17(9): 680-684.
[3] YBARRA J, POU J M, ROMEO J H, et al. Transforming growth factor beta 1 as a biomarker of diabetic peripheral neuropathy:cross-sectional study[J]. J Diabetes Complications, 2010, 24(5):306-312.
[4] WEN X, YUE L. The influence of corn silk polysaccharide on signal pathway of TGF-β1in type 2 diabetic mellitus rat[J]. Open Biomed Eng J, 2015, 9: 204-208.
[5] 刘建林, 陈明亮, 李惠, 等. 雷公藤多苷联合厄贝沙坦对糖尿病肾病患者足细胞损伤的影响[J]. 中国现代医生, 2015, 53(15):76-78.
[6] 张春亭, 郭兆安. 糖尿病肾病微炎症发生机制及中药治疗研究进展[J]. 实用中医学杂志, 2015, 31(12): 1194-1196.
[7] 郭文荣, 李兴. 糖尿病肾病与ADPN、TGF-β1、Collagen Ⅳ、ICAM-1关系的研究进展[J]. 医学研究杂志, 2015, 44(6): 170-173.
[8] 冯然, 李莉, 王宁, 等. 缬沙坦对早期糖尿病肾病患者血清TGF-β1、D-D及CysC水平的影响[J]. 中国药物评价, 2015,32(5): 280-283.
[9] MEGESEN C E, CHRIETENZEN C K. The diabetic kidney from nyperfifation and mictoallumin to end-stage renal failure[J]. Med Clin Nor Am, 1998, 72(8): 1465-1467.
[10] 唐晓君. 阿托伐他汀钙联合黄芪辅助治疗早期糖尿病肾病的临床研究[J]. 河北医学, 2013, 19(4): 492-495.
[11] 张倩, 石蒙, 檀金川. TGF-β1与糖尿病肾病的关系及中医药研究进展[J]. 中国中西医结合肾病杂志, 2014, 15(11): 1030-1032.
[12] 李敏川, 武忠. 基于转化生长因子β1靶点的中医药治疗糖尿病肾病的研究进展[J]. 疑难病杂志, 2015, 14(6): 650-653.
[13] BUGLIONI A, CANNONE V, SANGARALINGHAM S J, et al.Aldosterone predicts cardiovascular, renal, and metabolic disease in the general community: a 4-year follow-up[J]. J Am Heart Assoc, 2015, 4(12). pii: e002505.
[14] MROZIKIEWICZ-RAKOWSKA B, MAROSZEK P, NEHRING P, et al. Genetic and environmental predictors of chronic kidney disease in patients with type 2 diabetes and diabetic foot ulcer: a pilot study[J]. J Physiol Pharmacol, 2015, 66(5): 751-761.
[15] 欧阳慧玉. 黄芪注射液联合阿托伐他汀钙治疗糖尿病肾病的临床研究[J]. 中国处方药, 2013, 13(8): 5-7.

