BQ-123对蛛网膜下腔出血大鼠神经功能的保护作用研究*
赵雅宁,李建民,孙竹梅,赵旭,郭向飞,薛承景
(1.华北理工大学 护理与康复学院,河北 唐山 063210;2.华北理工大学附属医院,河北 唐山 063000)
近年的统计发现我国蛛网膜下腔出血(subarachnoid hemorrhage,SAH)的发病率为1‰,死亡率高达30%。除此之外,约有60%以上的患者疑有认知功能缺失及精神障碍等后遗症,严重影响患者生存质量及再就业[1]。目前,临床治疗中高度重视早期神经保护剂的应用,以防治SAH造成的神经缺陷。BQ-123是由5个氨基酸组成的五环肽,是内皮素受体(endothelin receptor A,ETA)拮抗剂,可降低血管痉挛、抑制交感神经系统及肾素-血管紧张素系统活性,目前已初步证实对SAH有一定的保护作用[2],但具体机制尚不明确。研究显示,SAH导致神经功能缺陷的关键是脑损伤后细胞正常的稳态环境受到破坏,某些信号转导系统发生紊乱,导致神经细胞死亡[1-3]。自噬是溶酶体对自身结构进行吞噬降解的过程。研究发现自噬广泛存在于正常的生理病理过程中,该过程包括细胞废物清除、结构重建、生长分化、营养缺乏和肿瘤发生等[4]。雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是丝氨酸/苏氨酸蛋白激酶,其激活后通过磷酸化其下游的靶蛋白,进而影响细胞自噬进程,在中枢神经系统疾病中发挥重要作用[5]。但BQ-123对SAH神经功能损伤的保护作用是否与mTOR-自噬通路的活化有关,目前报道甚少。本研究复制大鼠SAH模型,应用mTOR特异抑制剂雷帕霉素和不同剂量BQ-123进行干预,观察其对海马区磷酸化mTOR、自噬关键因子Beclin-1和微管相关蛋白1(轻链LC3)-Ⅱ(两者是自噬过程中特异因子,可折射出自噬发生、发展的程度)以及大鼠神经功能的影响,以探讨BQ-123对SAH的治疗机制。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物 清洁级雄性SD大鼠160只,体重350~450 g[购置于北京维通利华实验动物技术有限公司,合格证号SCXK(京)2009-003]。随机分为假手术组(Sham组)、蛛网膜下腔出血组(SAH组)、雷帕霉素组、BQ-123低剂量组和BQ-123高剂量组,每组32只。每组分为6、24、72及144 h 4个时间亚组。
1.1.2 主要试剂 Anti-mTOR、Anti-Beclin1、Anti-LC3-Ⅱ(兔抗大鼠)(北京博奥森公司),mTOR、Beclin-1、LC3引物(生工生物工程上海股份有限公司),实时逆转录聚合酶链反应(real-time reverse transcription-polymerase chain reaction,real-time RTPCR)试剂盒(大连宝生物公司),免疫组织化学二抗试剂盒pv6001(北京中杉金桥公司)。
1.2 仪器与设备
Nikon摄影生物光学显微镜(日本Nikon公司),5417R冷冻离心机(德国Eppendorf公司),ZH-CSC型穿梭箱及抓力测试仪(安徽正华生物仪器设备有限公司),眼科镊、眼科剪、无菌线及缝合针等(上海手术器械厂)。
1.3 方法
1.3.1 动物模型复制 参考文献[6],采用经典的自体血2次枕大池注血法(间隔48 h分别向枕大池注射自体动脉血0.3 ml)复制大鼠SAH模型。Sham组向枕大池2次注入0.3 ml生理盐水,余操作均与SAH组一致。雷帕霉素组:复制模型前30 min侧脑室注射,剂量为5 μl(10 nmol)/只。BQ-123高、低剂量组:在复制模型前30 min尾静脉注射BQ-123(将BQ-123用生理盐水按10 μg/ml稀释,低剂量组每次给予50 μg/kg、高剂量组每次给予75 μg/kg),然后再复制SAH模型。48 h后重复给药1次。
1.3.2 模型复制成功判定标准 当行2次枕大池注血时,可见少量血性脑脊液在穿刺部位渗出,该现象充分说明穿刺针位置准确;剥离脑部时肉眼可见极其显眼的血性液体散在分布脑底基底池部位。模型复制过程中,SAH组死亡7只,1只模型不符合标准被剔除;雷帕霉素组死亡8只,BQ-123低剂量组死亡4只,BQ-123高剂量组死亡2只。上述被剔除动物依次补齐,最终纳入统计学分析:Sham组、SAH组、雷帕霉素组、BQ-123 低剂量组和BQ-123高剂量组,每组32只大鼠。
1.3.3 神经功能评测 学习能力评测:每组各时间取4只大鼠,参考文献[7],采用ZH-CSC型穿梭实验视频分析系统(shuttle box system,SBS)分别测定动物行为学能力。每只大鼠被电击30次,记录被动回避潜伏期(passive avoidance latency,PAL)和主动回避反应次数,主动回避反应次数占总训练次数的百分比即为主动回避反应率(active avoidance reaction rate,AARR)。AARR越高,PAL越短,表明动物学习能力越强。抓力实验:每组各时间点取4只大鼠,将大鼠放置于抓力测试仪上恰当位置,用脚踩下踏板将显示器读数归零,用手拉住鼠尾向后下方施加轻微力量,待大鼠握紧抓力杆时,继续增加力道,直至大鼠肢体无法抵抗外力且听到“滴”的响声时,记录数值为本次拉力值。每只大鼠行3次测试,大鼠中间需休息5 min,取平均值作为最终结果。上述各组各时间完成动物神经功能评测后,分别处死,进行病理学及RT-PCR检测。
1.3.4 脑组织皮质区形态结构观察 每组各时间取4只大鼠,4%多聚甲醛灌注固定后,取脑,截取视交叉平面至大脑横裂脑组织。石蜡包埋、冠状切片,片厚5 μm,HE染色。光学显微镜下观察。在有测微尺的光学显微镜(×400)下观察海马CA1区神经元形态变化并计数该视野下的存活神经元数量(有明显细胞膜、细胞核和核仁为存活神经细胞)。具体方法:每只动物取5张海马区切片,每张切片选取5个不重复的视野,所以每组都是100个视野,选用Motic 6.0图像采集以及分析系统计算每个视野存活的神经元数,以CA1区每个视野下平均存活细胞数量表示。
1.3.5 免疫组织化学法检测mTOR、Beclin-1和LC3-Ⅱ的表达 标本采集同HE染色,切片常规脱蜡至去离子水,滴加复合消化液后入37℃温箱孵育20 min,经PBS洗涤3次,每次5 min,入3%过氧化氢封闭内源性过氧化物酶15 min,经PBS洗涤后滴加兔抗鼠mTOR、Beclin-1和LC3-Ⅱ多克隆抗体(1∶300,1∶250,1∶250),4℃过夜;37℃复温45 min,PBS洗涤后滴加生物素化二抗,37℃ 40 min,PBS洗涤;DAB显色,苏木精轻度复染,脱水透明,封片。镜下观察并摄片。
1.3.6 real time RT-PCR检测mTOR、Beclin-1及LC3 mRNA表达 各组各时间点取4只大鼠,致死后迅速取双侧海马区组织,称量0.6 g,加入1 ml RNAiso Plus溶液后匀浆,室温静置5 min后12 000 r/min 4℃离心5 min,取上清液移至新的1.5 ml离心管内,加入1/5 RNAiso Plus溶液体积的氯仿,震荡混匀后室温静置5 min,12 000 r/min 4℃离心15 min,将上清液转移至新离心管中,加入0.5~1.0倍RNAiso Plus溶液体积的异丙醇,室温静置10 min,12 000 r/min 4℃离心10 min,弃掉上清液,用与RNAiso Plus溶液等量的75%乙醇清晰沉淀,7 500 r/min 4℃离心5 min,弃上清保留沉淀,干燥(不可加热),溶解于30 μl DEPC处理水中,测量OD260/280值,根据OD260计算RNA浓度,置入-80℃冰箱冷冻保存。
1.3.7 检测步骤 m-TOR引物:正向5'-GGTGGACG AGCTCTTTGTCA-3',反向5'-AGGAGCCCTAACACT CGGAT-3';Beclin-1 引物:正向 5'-CTCTCGTCAAGGC GTCACTTC-3',反向 5'-CCTTAGACCCCTCCATTCCTC A-3;LC3引物:正向5'-ACCCTCTACGATGCTGGTG A-3', 反 向 5'-GCTGTCCTCAATGTCCTTCTG-3'。 进 行real time One Step RT-PCR反应:反应条件为95℃预变性10 min后,95℃ 5 s,60℃ 31 s进行30个循环,72℃ 延伸10 min。将所扩增的PCR产物进行熔解曲线分析。用Gen Amp 5700 SDS Software分析结果及PCR扩增产物生成曲线。以内参GAPDH mRNA CT值标化mTOR、Becline-1和LC3 mRNA的Ct值,得到相对Ct值,具体采用2-△△Ct法(△Ct=目的基因平均Ct值‐管家基因平均Ct值,△△Ct=实验组△Ct‐对照组△Ct,相对表达量=2-△△Ct)进行计算。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用SNK-q检验,P<0.05差异有统计学意义。
2 结果
2.1 组织病理学检测结果
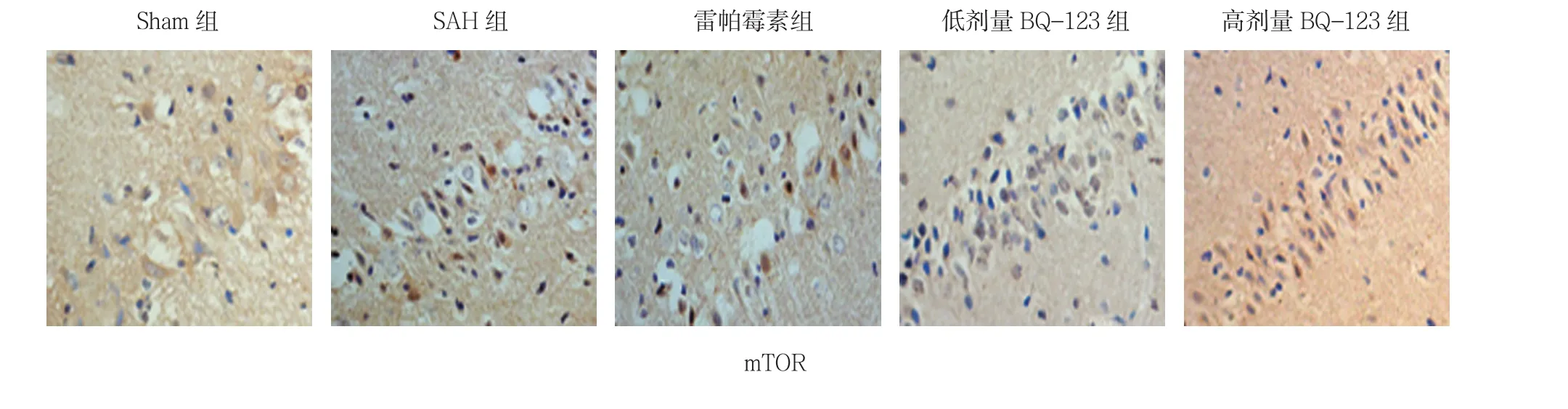
采用单因素方差分析,结果显示,各组大鼠海马区存活神经细胞数量比较,差异有统计学意义(P<0.05);与Sham组比较,SAH组术后各时间存活神经细胞数降低(P<0.05);与SAH组比较,雷帕霉素组、低和高剂量BQ-123组术后各时间点存活神经细胞数增加(P<0.05);高剂量BQ-123组术后各时间点存活神经细胞数量高于低剂量BQ-123组(P<0.05)(见表1)。Sham组,海马区神经细胞排列整齐、细胞形态结构正常,神经元胞体较大,胞核大而圆,核仁清晰;SAH组,海马区可见神经细胞变性水肿,细胞轮廓模糊,亦可见死亡神经细胞,表现为细胞出现核溶解、核碎裂或核消失结构不清;雷帕霉素组神经元结构损伤减轻,大部分细胞排列整齐、细胞结构完整;低和高剂量BQ-123组各时间点神经细胞形态结构减轻,视野中结构完整神经细胞增多,在高剂量BQ-123组变化尤为明显(见图1)。
2.2 神经功能检测结果
2.2.1 穿梭实验结果 采用单因素方差分析,结果显示各组大鼠不同时间AARR和PAL比较,差异有统计学意义(P<0.05);与Sham组比较,SAH组大鼠对刺激反应迟钝,动物的AARR减少、PAL延长(P<0.05);与SAH组比较,雷帕霉素组、低和高剂量BQ-123组大鼠对刺激反应灵敏,动物的AARR增多、PAL缩短(P<0.05),上述变化在高剂量BQ-123组最为明显。见表2、3。
表1 各组大鼠不同时间海马区存活神经细胞数量比较 (个/高倍视野,±s)
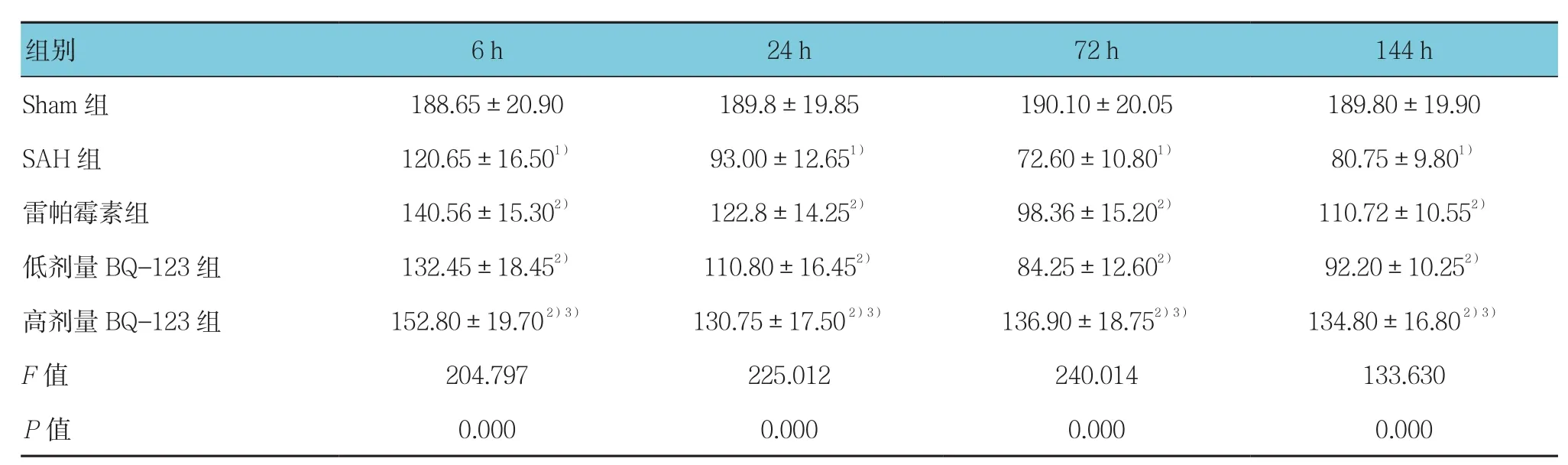
表1 各组大鼠不同时间海马区存活神经细胞数量比较 (个/高倍视野,±s)
注:1)与Sham组比较,P <0.05;2)与SAH组比较,P <0.05;3)与低剂量BQ-123组比较,P <0.05
组别 6 h 24 h 72 h 144 h Sham 组 188.65±20.90 189.8±19.85 190.10±20.05 189.80±19.90 SAH 组 120.65±16.501) 93.00±12.651) 72.60±10.801) 80.75±9.801)雷帕霉素组 140.56±15.302) 122.8±14.252) 98.36±15.202) 110.72±10.552)低剂量BQ-123组 132.45±18.452) 110.80±16.452) 84.25±12.602) 92.20±10.252)高剂量 BQ-123 组 152.80±19.70 2)3) 130.75±17.50 2)3) 136.90±18.752)3) 134.80±16.80 2)3)F值 204.797 225.012 240.014 133.630 P值 0.000 0.000 0.000 0.000
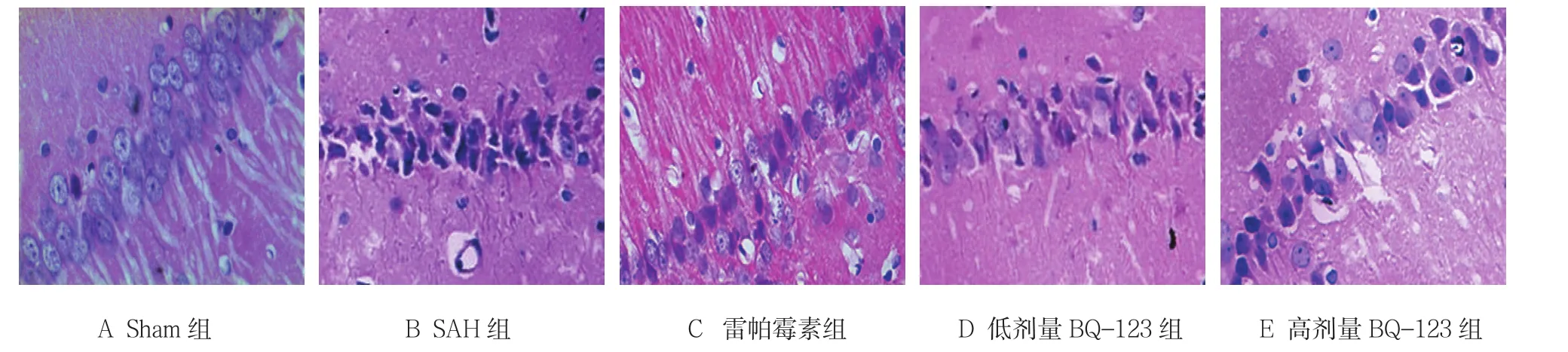
图1 各组大鼠24 h海马CA1区神经细胞形态 (HE染色×400)
表2 各组大鼠不同时间AARR比较 (%,±s)
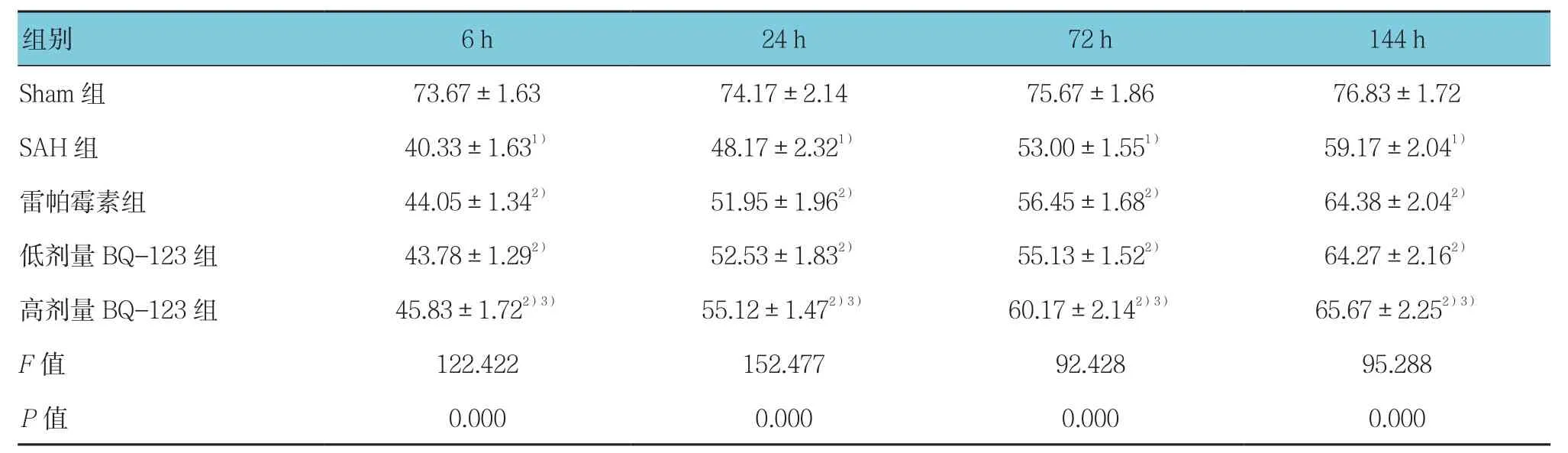
表2 各组大鼠不同时间AARR比较 (%,±s)
注:1)与Sham组比较,P <0.05;2)与SAH组比较,P <0.05;3)与低剂量BQ-123组比较,P <0.05
组别 6 h 24 h 72 h 144 h Sham 组 73.67±1.63 74.17±2.14 75.67±1.86 76.83±1.72 SAH 组 40.33±1.631) 48.17±2.321) 53.00±1.551) 59.17±2.041)雷帕霉素组 44.05±1.342) 51.95±1.962) 56.45±1.682) 64.38±2.042)低剂量BQ-123组 43.78±1.292) 52.53±1.832) 55.13±1.522) 64.27±2.162)高剂量 BQ-123组 45.83±1.722)3) 55.12±1.472)3) 60.17±2.142)3) 65.67±2.252)3)F值 122.422 152.477 92.428 95.288 P值 0.000 0.000 0.000 0.000
2.2.2 抓力实验结果 采用单因素方差分析,结果显示各组大鼠不同时间的抓力实验拉力值比较,差异有统计学意义(P<0.05);与Sham组比较,SAH组各时间抓力测定分值显著降低,其中6 h拉力值最低(P<0.05);与SAH组比较,雷帕霉素组、低和高剂量BQ-123组大鼠各时间点分值均有所升高(P<0.05);上述变化在高剂量BQ-123组最为明显。见表4。
表3 各组大鼠不同时间PAL比较 (s,±s)

表3 各组大鼠不同时间PAL比较 (s,±s)
注:1)与Sham组比较,P <0.05;2)与SAH组比较,P <0.05;3)与低剂量BQ-123组比较,P <0.05
组别 6 h 24 h 72 h 144 h Sham 组 16.33±1.21 16.67±1.03 16.67±1.21 17.33±0.82 SAH组 50.83±1.471) 40.17±1.601) 34.17±1.721) 28.33±1.501)雷帕霉素组 47.56±1.672) 36.85±1.352) 30.23±1.662) 23.96±1.522)低剂量BQ-123组 48.12±1.552) 37.50±1.522) 29.83±1.602) 24.83±1.382)高剂量 BQ-123组 46.00±1.412)3) 35.83±1.172)3) 27.67±1.372)3) 20.83±1.472)3)F值 44.492 83.102 105.428 97.955 P值 0.000 0.000 0.000 0.000
2.3 各组大鼠mTOR、Beclin-1、LC3-II阳性表达比较
mTOR、Beclin-1、LC3-Ⅱ阳性表达主要位于细胞核,阳性细胞的胞核可见细小的棕黄色颗粒。Sham组可见少量mTOR、Beclin-1、LC3-Ⅱ阳性细胞,染色棕黄。与Sham组比较,SAH组各时间的磷酸化mTOR、Beclin-1、LC3-Ⅱ免疫阳性反应增强;与SAH组比较,雷帕霉素组mTOR免疫阳性反应降低,Beclin-1、LC3-Ⅱ免疫阳性反应增高;与SAH组比较,BQ-123干预组mTOR免疫阳性反应降低,Beclin-1、LC3-Ⅱ免疫阳性反应进一步增强。见图2。
表4 各组大鼠不同时间的抓力实验拉力值比较 (±s)
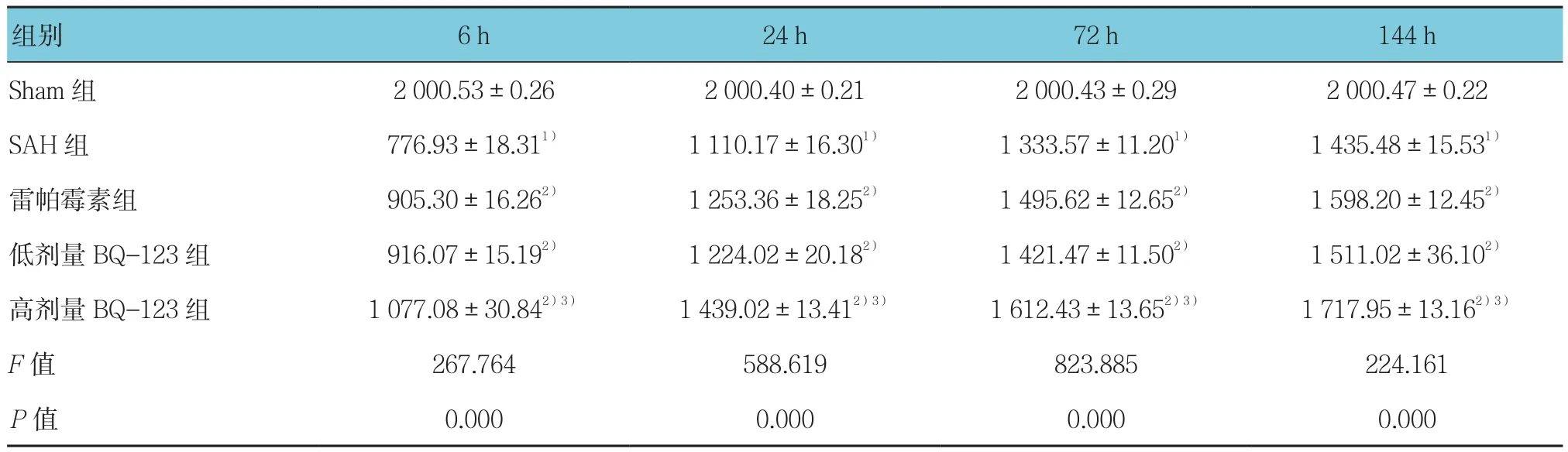
表4 各组大鼠不同时间的抓力实验拉力值比较 (±s)
注:1)与Sham组比较,P <0.05;2)与SAH组比较,P <0.05;3)与低剂量BQ-123组比较,P <0.05
组别 6 h 24 h 72 h 144 h Sham 组 2 000.53±0.26 2 000.40±0.21 2 000.43±0.29 2 000.47±0.22 SAH 组 776.93±18.311) 1 110.17±16.301) 1 333.57±11.201) 1 435.48±15.531)雷帕霉素组 905.30±16.262) 1 253.36±18.252) 1 495.62±12.652) 1 598.20±12.452)低剂量BQ-123组 916.07±15.192) 1 224.02±20.182) 1 421.47±11.502) 1 511.02±36.102)高剂量 BQ-123组 1 077.08±30.842)3) 1 439.02±13.412)3) 1 612.43±13.652)3) 1 717.95±13.162)3)F值 267.764 588.619 823.885 224.161 P值 0.000 0.000 0.000 0.000
2.4 各组大鼠mTOR、Beclin-1、LC3 mRNA表达比较
由表5~7可见,采用单因素方差分析,结果显示各组大鼠海马区mTOR、Beclin-1及LC3 mRNA表达水平比较,差异有统计学意义(P<0.05);与Sham组比较,SAH组各时间mTOR、Beclin-1及LC3 mRNA表达水平增高,其中mTOR mRNA 24 h达高峰,持续至72 h仍有较高水平表达,而Beclin-1、LC3 mRNA表达水平于24 h达高峰后,72 h迅速下降,但仍高于Sham组(P<0.05);与SAH组比较,雷帕霉素组各时间点mTOR mRNA表达降低,Beclin-1和LC3 mRNA表达水平增高(P<0.05);与SAH组比较,BQ-123干预组各时间mTOR mRNA表达水平降低、Beclin-1和LC3 mRNA表达水平增高(P<0.05),且Beclin-1和LC3 mRNA高表达持续至72 h。
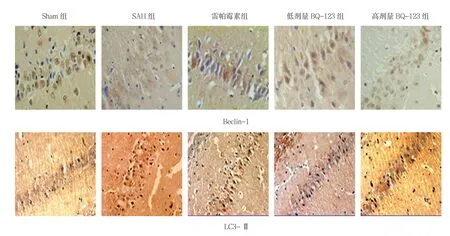
图2 各组大鼠24 h海马CA1区mTOR、Beclin-1和LC3-Ⅱ表达 (免疫组织化学法×400)
表5 各组大鼠海马区mTOR的mRNA相对表达量比较 (±s)
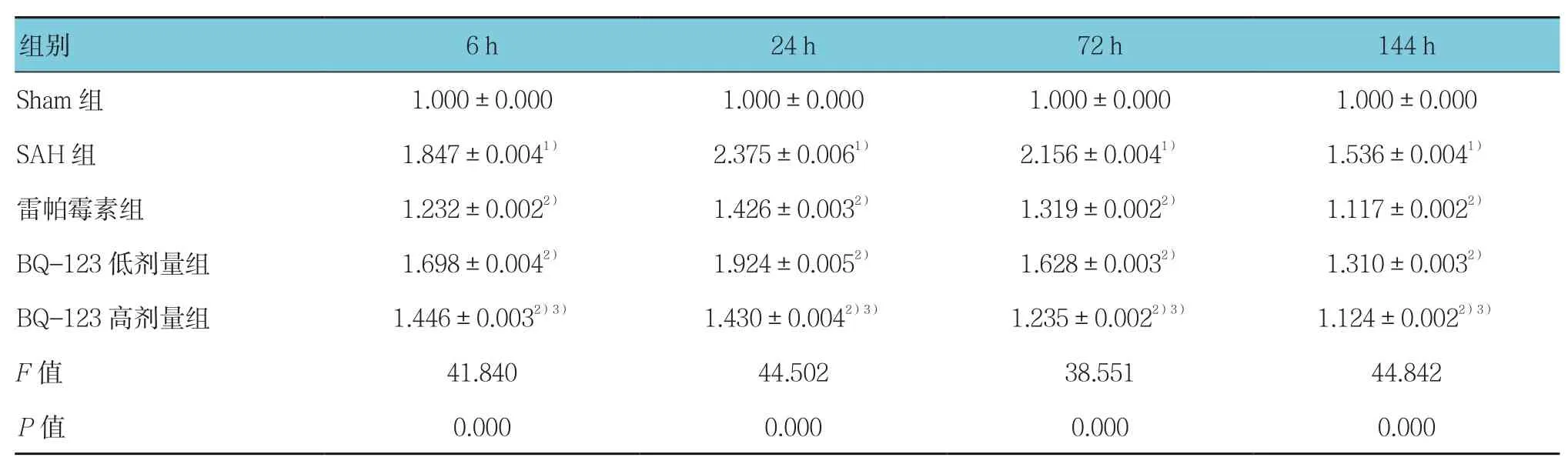
表5 各组大鼠海马区mTOR的mRNA相对表达量比较 (±s)
注:1)与Sham组比较,P <0.05;2)与SAH组比较,P <0.05;3)与低剂量BQ-123组比较,P <0.05
组别 6 h 24 h 72 h 144 h Sham 组 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 SAH 组 1.847±0.0041) 2.375±0.0061) 2.156±0.0041) 1.536±0.0041)雷帕霉素组 1.232±0.0022) 1.426±0.0032) 1.319±0.0022) 1.117±0.0022)BQ-123低剂量组 1.698±0.0042) 1.924±0.0052) 1.628±0.0032) 1.310±0.0032)BQ-123 高剂量组 1.446±0.0032)3) 1.430±0.0042)3) 1.235±0.0022)3) 1.124±0.0022)3)F值 41.840 44.502 38.551 44.842 P值 0.000 0.000 0.000 0.000
表6 各组大鼠海马区Beclin-1的mRNA相对表达量比较 (±s)
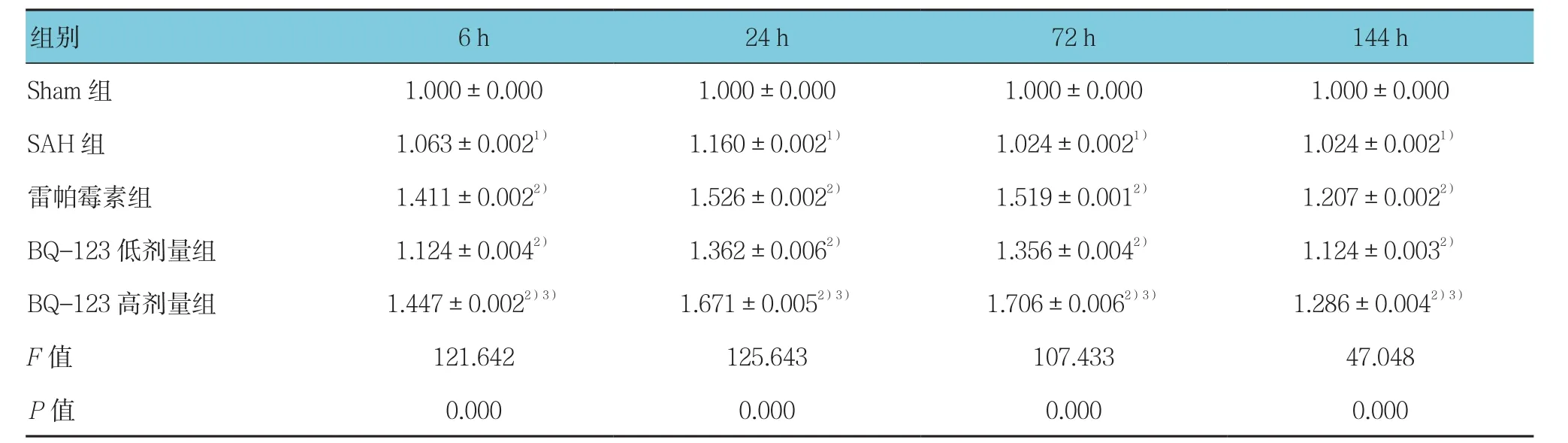
表6 各组大鼠海马区Beclin-1的mRNA相对表达量比较 (±s)
注:1)与Sham组比较,P <0.05;2)与SAH组比较,P <0.05;3)与低剂量BQ-123组比较,P <0.05
组别 6 h 24 h 72 h 144 h Sham 组 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 SAH 组 1.063±0.0021) 1.160±0.0021) 1.024±0.0021) 1.024±0.0021)雷帕霉素组 1.411±0.0022) 1.526±0.0022) 1.519±0.0012) 1.207±0.0022)BQ-123低剂量组 1.124±0.0042) 1.362±0.0062) 1.356±0.0042) 1.124±0.0032)BQ-123 高剂量组 1.447±0.0022)3) 1.671±0.0052)3) 1.706±0.0062)3) 1.286±0.0042)3)F值 121.642 125.643 107.433 47.048 P值 0.000 0.000 0.000 0.000
表7 各组大鼠海马区LC3 mRNA相对表达量比较 (±s)
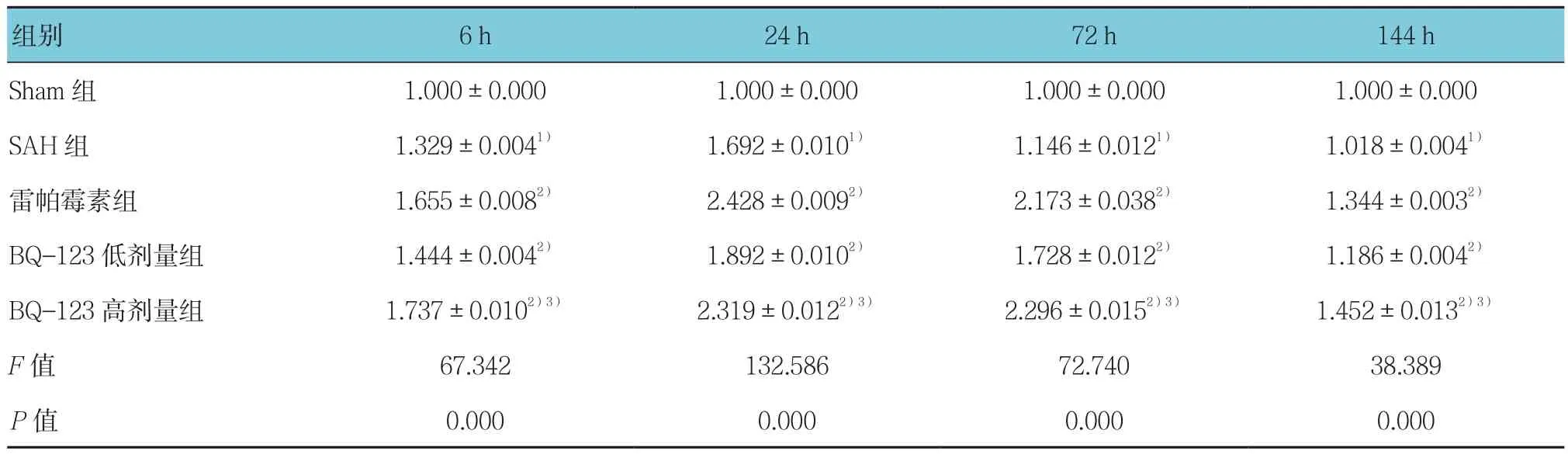
表7 各组大鼠海马区LC3 mRNA相对表达量比较 (±s)
注:1)与Sham组比较,P <0.05;2)与SAH组比较,P <0.05;3)与低剂量BQ-123组比较,P <0.05
组别 6 h 24 h 72 h 144 h Sham 组 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 SAH 组 1.329±0.0041) 1.692±0.0101) 1.146±0.0121) 1.018±0.0041)雷帕霉素组 1.655±0.0082) 2.428±0.0092) 2.173±0.0382) 1.344±0.0032)BQ-123低剂量组 1.444±0.0042) 1.892±0.0102) 1.728±0.0122) 1.186±0.0042)BQ-123 高剂量组 1.737±0.0102)3) 2.319±0.0122)3) 2.296±0.0152)3) 1.452±0.0132)3)F值 67.342 132.586 72.740 38.389 P值 0.000 0.000 0.000 0.000
3 讨论
本实验中组织病理学和动物行为学结果显示,BQ-123对SAH大鼠有较好的神经保护作用,与国外学者的研究结果基本一致[8-9]。BQ-123是特异性内皮素受体ETA阻断剂,可以直接阻断ETA活性而对ETB受体几乎无作用,具有高特异性、高亲和力和水溶的特点。药理学研究显示BQ-123可抑制血管的痉挛,改善脑组织灌注压,保证脑组织的血供,使细胞的缺血缺氧得到相应的改善,缓解脑组织的缺血缺氧,神经细胞得到保护[10]。
目前,自噬已经成为医学研究领域的一个新热点。研究表明[4],在帕金森病中,自噬功能的紊乱导致蛋白质出现变构或错误折叠与发病密切相关,提示自噬在神经系统疾病中的调节作用。最近有研究结果提示[11-12],在缺血性脑卒中及脑出血动物模型中,自噬被不同程度地激活。也有文献报道自噬的相关通路在SAH后被激活,石晓勇等[13]通过复制蛛网膜下腔出血模型,应用自噬激动剂RAP干预自噬后,发现自噬相关蛋白LC3和Beclin-1的表达增高,自噬增强,同时大鼠神经功能评分好转,脑水肿指数下降,血脑屏障通透性好转。Beclin-1和LC3被认为是自噬过程的特征调控基因和蛋白,其表达水平是检测自噬高低水平的重要指标。本研究中BQ-123组Beclin-1 mRNA、LC3 mRNA不仅表达水平较SAH组增加,且两者高表达状态持续至72 h,且上述指标呈BQ-123剂量依赖式变化,说明BQ-123可以提高SAH后大鼠海马区Beclin-1、LC3的表达水平,即增强神经细胞自噬激活的程度。结合上述形态学和行为学变化特征,笔者认为在BQ-123的干预下,脑供血得到改善,细胞低氧、氧自由基及ATP耗竭等各种因素缓解[14],使自噬过程或程度增加,丢失的神经细胞明显减少,神经功能恢复。
研究显示[15],mTOR信号通路对于抑制细胞自噬的发生、调节细胞的生长代谢及增殖有重要作用。有学者[16]应用小鼠脑中动脉阻塞缺血性脑卒中模型,发现通过调制神经元内Akt-mTOR信号通路可使其介导的自噬水平提高,减轻小鼠缺血性卒中脑缺血损伤,提高缺血神经元存活率。在神经元氧糖剥夺(OGD)模型中,应用细胞自噬抑制剂3-MA抑制mTOR信号后,能够诱导醇母基因(SIR3)表达增加,减少OGD诱导的乳酸脱氢酶(LDH)的释放和神经元凋亡,并且通过调节AMPK-mTOR通路减轻过度自噬造成的缺血后神经元损伤[17]。本研究发现应用mTOR抑制剂雷帕霉素后,发现Beclin-1和LC3表达增多,存活神经细胞数量增多,说明SAH后海马区神经细胞自噬与mTOR信号活化有关。笔者发现与SAH组比较,BQ-123组mTOR mRNA表达降低,而Beclin-1 mRNA、LC3 mRNA表达增高,3者变化均与BQ-123剂量密切相关,说明BQ-123通过抑制mTOR活性,进而提高SAH后自噬程度,发挥神经保护作用。目前关于BQ-123调节mTOR信号活性的原因尚未明确。但研究显示BQ-123可增加组织中内源性一氧化氮含量,减轻钙离子超载、维持微环境稳定,具有对抗氧化应激及抗炎等作用[18],该因素的变化可使mTOR上游的PI3K/Akt途径活化,可能是BQ-123提高mTOR信号活性的原因之一。
综上所述,BQ-123可减轻SAH后脑组织神经细胞的丢失,促进神经功能的恢复;同时BQ-123可部分抑制SAH后mTOR活性,提高神经细胞自噬程度。这为临床救治SAH提供了新思路,亦为BQ-123在临床的应用提供理论基础,具有重要的指导意义。
参 考 文 献:
[1] SEHBA F A, HOU J, PLUTA R M, et al. The importance of early brain injury after subarachnoid hemorrhage[J]. Prog Neurobiol,2012, 97(1): 14-37.
[2] 许松, 周文泉, 张征宇, 等. 内皮素A受体拮抗剂BQ123对前列腺癌PC-3M细胞增殖与凋亡的影响[J]. 中华男科学杂志,2009, 15(4): 341-345.
[3] TOPKORU B C, ALTAY O, DURIS K, et al. Nasal administration of recombinant osteopontin attenuates early brain injury after subarachnoid hemorrhage[J]. Stroke, 2013, 44(11): 3189-3194.
[4] 陈敬寅. 褪黑素调节的自噬在蛛网膜下腔出血早期脑损伤中的作用及机制研究[D]. 杭州: 浙江大学, 2015: 4.
[5] SENGUPTA S, PETERSON T R, SABATINI D M. Regulation of the mTOR complex 1 pathway by nutrients, growth factors, and stress[J]. Mol Cell, 2010, 40(2): 310-322.
[6] 马朝晖, 李贵福, 罗望池, 等. 改良“二次枕大池注血法”构建Wistar大鼠蛛网膜下腔出血模型[J]. 中国神经精神疾病杂志,2012, 38(3): 190-192.
[7] 孙竹梅, 赵雅宁, 李建民, 等. 不同强度运动对脑缺血再灌注大鼠学习能力及氧自由基代谢的影响[J]. 中国康复理论与实践,2015, 21(1): 26-30.
[8] JOSKO J. Cerebral angiogenesis and expression of VEGF after subarachnoid hemorrhage (SAH) in rats[J]. Brain Res, 2003,981(1-2): 58-69.
[9] JOŚKO J, GWÓŹDŹ B, HENDRYK S, et al. Expression of vascular endothelial growth factor (VEGF) in rat brain after subarachnoid haemorrhage and endothelin receptor blockage with BQ-123[J]. Folia Neuropathol, 2001, 39(4): 243-251.
[10] 张邓新, 陈莺, 季永, 等. 七氟烷对小鼠短期记忆功能和海马突触短时程增强的影响[J]. 中华行为医学与脑科学杂志, 2012,21(10): 884-886.
[11] LI L, CHEN J, SUN S, et al. Effects of estradiol on autophagy and Nrf-2/ARE signals after cerebral ischemia[J]. Cell Physiol Biochem, 2017, 41(5): 2027-2036.
[12] LI H, WU J, SHEN H, et al. Autophagy in hemorrhagic stroke:mechanisms and clinical implications[J]. Prog Neurobiol, 2017,13 (16): 30156-30153.
[13] 石晓勇, 王中, 陈罡, 等. 自噬在大鼠蛛网膜下腔出血后早期脑损伤中作用的实验研究[J]. 临床神经外科杂志, 2015, 12(6):449-452.
[14] 赵明明, 赵永博, 罗鹏, 等. PI3K/Akt信号通路对神经元机械性损伤诱导的自噬调节作用[J]. 中华神经外科疾病研究杂志,2012, 11(6): 491-494.
[15] KAUR A, SHARMA S. Mammalian target of rapamycin(mTOR) as a potential therapeutic target in various diseases[J].Inflammopharmacology, 2017, 25(3): 1-20.
[16] 魏海萍. cPKCγ通过Akt-mTOR通过调制神经元自噬减轻缺血性卒中鼠脑损伤[D]. 北京: 首都医科大学, 2016: 4.
[17] DAI S H, CHEN T, LI X, et al. Sirt3 confers protection against neuronal ischemia by inducing autophagy: Involvement of the AMPK-mTOR pathway[J]. Free Radic Biol Med, 2017, 7(108):345-353.
[18] KOWALCZYK A, JELEŃ A, ŻEBROWSKA M, et al. BQ123 stimulates skeletal muscle antioxidant defense via Nrf2 activation in LPS-treated Rats[J]. Oxid Med Cell Longev, 2015, 9(28):2356853.
——雷帕霉素

