针刺对砷中毒小鼠肝肾抗氧化能力影响研究
马微,林艳,冯中贤
(1.张家口学院护理学院,河北 张家口 075000;2.河北北方学院附属第一医院 中医科,河北 张家口 075000)
砷广泛分布于土壤、岩石和水环境中,是自然界存在的一种有毒类类金属元素,同时也是一种严重影响人类健康的环境毒物及已知的人类致癌物[1],具有致畸、致癌、致突变等作用[2-3],目前,砷及其化合物污染已经成为一种重要的环境危险因素,许多国家及地区已经出现砷及其化合物污染的报道,如印度、中国、美国、墨西哥等国家[4-8]。研究发现,砷中毒的主要机制是由于砷及其化合物导致机体生物大分子氧化损伤所致[9]。针灸实验研究是将现代科学技术与传统针灸学相结合,用以指导临床实践的一种实现方式[10]。研究发现[11],针刺通过抑制肾组织细胞凋亡对肾组织功能损伤具有一定的保护作用,但针刺对肾脏具体保护作用的分子机制并未完全清楚,可能还存在其他尚未明确的分子机制。本研究复制砷中毒模型,通过观察模型小鼠肝肾组织中MDA、GSH的含量和SOD、GSH-PX的活性等相关变化指标,探讨针刺对砷中毒的影响作用,为进一步研究针刺对砷中毒的分子机制提供理论依据。
1 材料与方法
1.1 实验动物、试剂及仪器
健康昆明种ICR雄性小鼠60只,体重(20±2)g,购自中国食品药品鉴定所。分析纯亚砷酸钠(NaAsO2)购自北京化学试剂厂,ELISA试剂盒、550型酶标仪、G6805-1A型低频电子脉冲治疗仪购自上海华谊医用仪器有限公司。
1.2 实验分组与标本采集
随机将小鼠分为正常组(15只)、模型组(15只)、针刺组(15只)及姜黄素组(15只)。正常组给予蒸馏水及饲料,模型组给予高砷水及饲料,均不做其他任何处理;针刺组给予高砷水及饲料,麻醉后采用G6805-1A型低频电子脉冲治疗仪对足三里、内庭及天枢穴(刺入4、2、4 mm)[12]进行治疗(15 min/次,1次/d);姜黄素组给予高砷水及饲料,同时给予姜黄素进行干预(200 mg/kg),每天灌胃1次。治疗30 d后采用断头法处死小鼠,快速收集肝肾标本,同时制成匀浆冷冻备用。
1.3 检测指标
检测各组小鼠的体重、肝肾组织脏器系数,严格按照ELISA试剂盒说明书测定肝肾组织中GSH、MDA的含量和SOD、GSH-PX的活性,并记录实验结果。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,采用单因素方差分析,组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
表1 各组小鼠体重和肝肾组织脏器系数 (n =15,±s)

表1 各组小鼠体重和肝肾组织脏器系数 (n =15,±s)
注 :1)与正常组比较,P <0.05;2)与模型组比较,P <0.05;3)与正常组比较,P >0.05
组别 体重/g 肝脏器系数/(g/kg) 肾脏器系数/(g/kg)正常组 32.47±2.07 54.66±7.59 17.43±1.78模型组 33.25±1.65 64.27±7.381) 22.86±3.411)针刺组 30.03±3.58 53.09±4.342)3) 15.89±1.522)3)姜黄素组 31.21±2.95 54.11±3.672)3) 16.21±1.682)3)
2 结果
2.1 小鼠体重与脏器系数比较
经单因素方差分析,各组小鼠间体重仅有微小变化,差异无统计学意义(F=1.411,P=0.296),肝肾组织的脏器系数有一定差异,且差异有统计学意义(F=9.541和10.571,P=0.006和0.003),针刺组及姜黄素组的肝肾组织的脏器系数低于模型组(t=9.485、10.180、9.128和9.561,P=0.007、0.005、0.011和0.006),稍低于正常组,但差异无统计学意义(P>0.05);正常组肝肾组织的脏器系数低于模型组(t=9.551和8.231,P=0.006和0.014),表明针刺对小鼠体重及脏器系数影响不明显。见表1。
2.2 各组小鼠肝组织中MDA、GSH的含量和SOD、GSH-PX的活性比较
经单因素方差分析,各组小鼠肝组织中MDA、GSH的含量和SOD、GSH-PX的活性比较,差异有统计学意义(F=6.473、17.571、17.521和7.418,P=0.026、0.001、0.001和0.021);针刺组和姜黄素组肝组织中MDA、GSH含量和SOD、GSH-PX的活性与正常组间比较,仅有微小变化(t=2.421、1.989、2.015、2.127、2.217、1.994、2.021 和 2.129,P=0.151、0.247、0.239、0.231、0.229、0.246、0.238和0.231);正常组与模型组比较,肝组织中MDA含量降低(t=6.481,P=0.024),GSH 含量增高(t=17.558,P=0.001),SOD、GSH-PX的活性升高(t=7.529和17.533,P=0.020和0.001);针刺组及姜黄素组与模型组比较,肝组织中MDA含量降低(t=6.491和6.387,P=0.025和0.027),GSH含量增高(t=17.561和17.547,均P=0.001),SOD、GSH-PX的活性升高(t=17.537、7.499、7.527和17.499,P=0.001、0.020、0.020和0.001);针刺组肝组织中MDA、GSH含量和SOD、GSH-PX的活性与姜黄素组间仅有微小变化(t=2.423、1.991、2.017和 2.130,P=0.150、0.246、0.239 及 0.230)。见表 2。
表2 各组小鼠肝组织中MDA、GSH的含量和SOD、GSH-PX的活性比较 (n =15,±s)
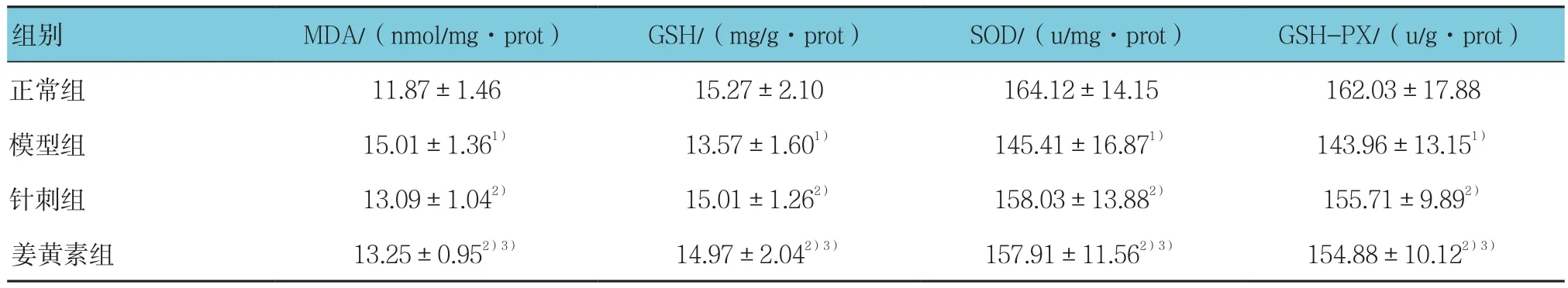
表2 各组小鼠肝组织中MDA、GSH的含量和SOD、GSH-PX的活性比较 (n =15,±s)
注 :1)与正常组比较,P <0.05;2)与模型组比较,P <0.05;3)与针刺组比较,P >0.05
组别 MDA/(nmol/mg·prot) GSH/(mg/g·prot) SOD/(u/mg·prot) GSH-PX/(u/g·prot)正常组 11.87±1.46 15.27±2.10 164.12±14.15 162.03±17.88模型组 15.01±1.361) 13.57±1.601) 145.41±16.871) 143.96±13.151)针刺组 13.09±1.042) 15.01±1.262) 158.03±13.882) 155.71±9.892)姜黄素组 13.25±0.952)3) 14.97±2.042)3) 157.91±11.562)3) 154.88±10.122)3)
2.3 各组小鼠肾组织中MDA、GSH的含量和SOD、GSH-PX的活性比较
经单因素方差分析,各组小鼠肾组织中MDA、GSH的含量和SOD、GSH-PX的活性比较,差异有统计学意义(F=6.469、17.569、17.519及7.421,P=0.026、0.001、0.001和0.021);针刺组和姜黄素组肾组织中MDA、GSH含量和SOD、GSH-PX的活性与正常组间仅有微小变化(t=2.419、1.990、2.017、2.127、2.219、1.996、2.024 和 2.131,P=0.151、0.247、0.241、0.231、0.229、0.246、0.238和0.231);正常组与模型组比较,肾组织中MDA含量降低(t=6.488,P=0.024),GSH含量增高(t=17.561,P=0.001),SOD、GSH-PX的活性升高(t=7.527和17.537,P=0.020和0.001);针刺组及姜黄素组与模型组比较,肾组织中MDA含量降低(t=6.496和 6.389,P=0.025和 0.027),GSH含量增高(t=17.563和17.549,均P=0.001),SOD、GSH-PX的活性升高(t=17.535、7.451、7.528 和 17.495,P=0.001、0.020、0.020和0.001);针刺组肾组织中MDA、GSH含量及SOD、GSH-PX的活性与姜黄素组间仅有微小变化(t=2.425、1.993、2.013 和 2.129,P=0.150、0.246、0.239和0.230)。见表3。
表3 各组小鼠肾组织中MDA、GSH的含量与SOD、GSH-PX的活性比较 (n =15,±s)

表3 各组小鼠肾组织中MDA、GSH的含量与SOD、GSH-PX的活性比较 (n =15,±s)
注 :1)与正常组比较,P <0.05;2)与模型组比较,P <0.05;3)与针刺组比较,P >0.05
组别 MDA/(nmol/mg·prot) GSH/(mg/g·prot) SOD/(u/mg·prot) GSH-PX/(u/g·prot)正常组 8.75±1.23 16.85±1.56 128.23±5.41 146.17±9.54模型组 16.11±1.051) 11.13±1.381) 103.56±4.181) 115.87±8.781)针刺组 9.16±1.132) 15.01±1.082) 125.78±4.252) 142.95±8.852)姜黄素组 9.78±0.982)3) 14.89±1.452)3) 123.69±6.122)3) 141.47±9.372)3)
3 讨论
研究发现,长期处于低剂量砷污染环境中机体的肝肾组织中可能出现不同程度的病理变化[13]。研究证实,机体组织中SOD、GSH-PX在机体的抗氧化系统发挥非常重要的作用[14]。同时研究证实氟、砷及其化合物通过对机体的氧化及抗氧化系统产生影响从而对机体引起一定的损伤作用[15-16]。砷中毒的机制可能是通过升高体内MDA含量及抑制体内SOD、GSH-PX的活性,造成机体内抗氧化防御系统平衡失调进而对机体造成一定的损伤作用[17-18]。砷及其化合物可使小鼠肾脏中 SOD及GSH-PX活性降低,MDA水平的增高,同时随着剂量的增加作用逐渐增强[19-20]。目前研究发现,砷及其化合物可通过扰乱机体内氧化/抗氧化平衡及引发氧化应激,进而造成机体内多种细胞和分子通路的变化,包括信号转导通路、抗氧化物酶活性的改变、以及机体自身抗氧化防御系统功能的降低等[21]。本研究采用针刺法对砷中毒进行干预治疗,研究针刺法对砷中毒所致肝肾组织损伤保护作用的分子机制。本研究发现,针刺组肝肾组织中MDA、GSH含量和SOD、GSH-PX的活性与姜黄素组间仅有微小变化;正常组与模型组比较,肝肾组织中MDA含量降低,GSH含量增高、SOD、GSH-PX的活性升高;针刺组肝肾组织中MDA含量低于模型组,GSH含量、GSH-PX及SOD的活性高于模型组。说明针刺对砷中毒所致肝肾组织损伤具有一定的保护作用。
本研究发现,砷中毒对小鼠的肝肾组织具有一定损伤作用,其损伤机制可能与肝肾组织细胞内抗氧化酶受抑制有关。本研究采用针刺法对砷中毒小鼠进行干预治疗,发现针刺通过改变砷中毒小鼠肝肾组织中抗氧化指标(MDA、GSH、SOD、GSH-PX)含量或活性,对肝肾组织损伤具有一定的保护作用,保护作用的相关分子机制还需进一步深入研究,为砷中毒治疗提供了新的研究思路。
参 考 文 献:
[1] 苏鑫, 王素华. 砷生物效应研究进展[J]. 中国地方病防治杂志,2016, 31(3): 264-265.
[2] 氟砷中毒发病机制研究[J]. 新疆医科大学学报, 2016, 39(6): 663.
[3] 李伟, 李冰. 环境砷暴露对机体损伤的研究进展[J]. 环境与健康杂志, 2016, 33(9): 836-841.
[4] JOMOVA K, JENISOVA Z, FESZTEROVA M, et al. Arsenic:toxicity, oxidative stress and human disease[J]. J Appl Toxicol,2011, 31(2): 95-107.
[5] KAPAJ S, PETERSON H, LIBER K, et al. Human health effects from chronic arsenic poisoning a review[J]. J EnvironSci Health A Tox Hazard Subst Environ Eng, 2006, 41(10): 2399-2428.
[6] 何沅卿, 罗勇军. 新疆砷污染现状及砷中毒防治研究进展[J]. 人民军医, 2017, 60(6): 616-618.
[7] 叶新贵, 陈可风, 安冬, 等. 一起饮用污染水引起亚急性砷中毒事件的调查处置[J]. 现代预防医学, 2015, 42(11): 1959-1961.
[8] MARSHALL G, FERRECCIO C, YUAN Y, et al. Fifty-year study of lung and bladder cancer mortality in Chile related to arsenic in drinking water[J]. J Natl Cancer Inst, 2007, 99(12): 920-928.
[9] 朱建忠, 刘建辉, 赵文涛, 等. 慢性砷中毒小鼠对后代出生缺陷的影响[J]. 中国地方病防治杂志, 2016, 31(3): 290-291.
[10] 高爽. 对实验针灸学一些问题的思考[J]. 中国针灸, 2008,28(5): 378-380.
[11] 梁鑫. 针刺干预对ARF大鼠肾脏的保护作用及其机制的研究[D].泸州: 泸州医学院, 2014.
[12] 王永玲, 郭勇, 千新来, 等. 针刺肥胖合并高脂血症大鼠时瘦素基因对肝细胞凋亡的影响[J]. 实用医学杂志, 2010, 26(10):1723-1725.
[13] 杨瑞瑛, 李子杰, 林勤, 等. 砷中毒大鼠体内各脏器 、组织中砷的分布[J]. 中国地方病防治杂志, 2005, 20(5): 260-262.
[14] 戴研平, 王平, 高晓勤, 等. 锌对亚慢性砷中毒雄性SD大鼠睾丸抗氧化力的影响[J]. 职业与健康, 2016, 32(24): 3359-3363.
[15] 雷琰. 针刺对慢性氟中毒大鼠肾抗氧化能力影响研究[J]. 中国地方病防治杂志, 2015, 30(5): 368-369.
[16] 石鑫, 张杰, 周小慧, 等. 龙眼参多糖对砷中毒小鼠肝脏氧化损伤的影响[J]. 中国地方病防治杂志, 2015, 30(6): 509-510.
[17] 王爱兵, 胡文博, 王宁宁, 等. 西宁地区急性砷中毒对肾脏损害的临床研究[J]. 中国地方病防治杂志, 2016, 31(1): 91-92.
[18] 胡婷, 罗鹏, 沈祥春, 等. 竹荪多糖早期和晚期干预对砷中毒大鼠肝功能的影响[J]. 环境与健康杂志, 2016, 33(12): 1039-1043.
[19] 张立华, 张贝, 杜金, 等. 姜黄素对砷中毒小鼠急性肝脏毒性与氧化损伤的拮抗作用观察[J]. 中国地方病防治杂志, 2016,31(4): 476-478.
[20] 刘圆方, 樊宏伟, 高改云, 等. 地方性砷中毒与肝肾功能损伤关系研究[J]. 中国地方病防治杂志, 2016, 31(10): 1127+1199.
[21] FLORA SJS. Arsenic-induced oxidative stress and its reversibility[J]. Free Radic Biol Med, 2011, 51(2): 257-281.

