不同浓度七氟醚麻醉对大鼠氧化应激及Caspase-9表达的影响
李繁,黎仕焕,黄奕弟
(1.海南医学院第二附属医院 麻醉科,海南 海口 571100;2.海南医学院第一附属医院 解剖教研室,海南 海口 570102)
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是指接受手术治疗的患者术后出现的中枢神经系统并发症,其特征为记忆受损、焦虑、精神错乱以及人格改变等,易发生在老年患者中[1]。近年来,有关POCD的发生与手术麻醉药物之间的关系受到越来越多学者的关注。七氟醚是临床常用的吸入型麻醉药物,被认为是吸入麻醉的里程碑式药物。其无色透明,芳香无刺激性,可迅速诱导麻醉,患者术中血液动力学平稳,且具有麻醉效果强,用量少,患者术后苏醒快以及苏醒透彻等优势[2]。但有动物研究指出,七氟醚对大鼠的认知功能有影响,其可能的途径为氧化应激反应、中枢神经系统炎症反应、细胞内钙离子稳定失调等[3]。还有动物研究指出七氟醚对大鼠神经系统有保护作用。有学者在近年来的一些研究中指出POCD发生机制可能是多种外源性因素对已经表现出退化的患者自身中枢神经系统的进一步损伤导致,主要为代谢功能和神经递质传递功能受损[4]。POCD的发生是多种因素通过多个途径,并涉及多个系统共同作用而引起的,但其发生机制到目前为止并未完全阐述清楚,有关吸入性麻醉方法对患者术后认知功能造成的影响也没有明确的结论。因此,为了进一步探讨和分析七氟醚和术后认知功能障碍发生之间的关系以及可能的机制,以减少临床术后POCD的发生,提高治疗效果,本研究以老年大鼠为研究对象,对其进行七氟醚处理,观察在不同浓度七氟醚下大鼠认知功能所受到的影响,现报道如下。
1 材料与方法
1.1 实验动物与分组
选取80只18个月龄大小清洁级健康雄性大鼠作为研究对象进行研究,平均体重(537±55)g,均由第三军医科大学动物中心提供。采用随机数字表法将其分为5组,分别为A组:吸入6 h 0%七氟醚+2 L/min氧气;B1组:吸入6 h 1%七氟醚+2 L/min氧气;B2组:吸入6 h 2%七氟醚+2 L/min氧气;B3组:吸入6 h 3%七氟醚+2 L/min氧气;B4组:吸入6 h 4%七氟醚+2 L/min氧气。
1.2 实验仪器与主要试剂
1.2.1 实验仪器 美国Thermo scientific公司-80℃冰箱,德国西门子股份公司4℃冰箱,上海雷磁电化学仪器公司PHS-3C酸度计/pH计,美国Thermo scientific公司酶标仪,美国通用公司Solar 8000M型多功能生命监测仪,德国Drager公司Drager Fabius 8000型麻醉机,西南医院麻醉科实验室提供的自制钢化玻璃麻醉诱导箱,德国Eppendorf公司微量加样枪,法国Gilson公司微量移液器,美国UVP公司GDS800凝胶图像分析软件。
1.2.2 主要试剂 七氟醚(美国雅培公司),ELISA试 剂 盒、Amyloid precursor protein、APP、MDA及SOD ELISA试剂盒(上海沪尚生物科技有限公司),戊巴比妥钠(美国Epitomics公司),ACE-1抗体(1︰1 000)(重庆海韵生物有限公司),烟酰胺腺嘌呤二核苷酸磷酸,又称还原性辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)(1 ︰ 5 000)(美国Chemieon公司),山羊抗兔IgG(H+L)抗体、HB-17显影浓缩液(北京康为世纪生物公司),兔抗大鼠IL-6、IL-8、Caspase-9(美国Abcam公司),二抗(美国Santa Cruz公司)。
1.3 实验方法
所有实验动物在实验前1周被置于恒温的动物房内,昼夜比1︰1,可自由取食。透明麻醉诱导箱内铺适量钠石灰,密封好,将实验动物均置于其中,通过螺纹管将Drager Fabius型麻醉机与麻醉箱一侧孔相连接,将另一侧作为排气口,与螺纹管相连接,在排气口同时应用Solar 8000M型多功能气体检测仪监测麻醉箱内部七氟醚的浓度。实验开始时各组大鼠分别吸入相应浓度的七氟醚+2 L/min氧气,持续时间为6 h,持续应用烤灯在该过程中进行加热,以维持大鼠体温(肛温)在(37.0±0.5)℃的范围内。应用Solar 8000M型多功能气体检测仪同时监测二氧化碳CO2和残余气体的浓度,并调节挥发罐中七氟醚的挥发浓度,维持诱导箱中七氟醚的浓度在相应的浓度范围内。预实验时,已经对各组老年大鼠在吸入过程中的血气测定维持在正常的范围内。6 h后停止吸入,之后再继续对各组大鼠吸入0.5 h 100%氧气,清醒后将其放回到恒温动物房中,自由取食。麻醉24 h后,从各组大鼠中随机各取8只注射戊巴比妥钠麻醉,然后将其迅速断头处死,快速在在覆盖有无菌锡箔纸的冰袋上分离出海马,放置在液氮中24 h冷冻存后放置在-80℃的冰箱中冷冻保存,以进行剩余指标的检测。其余的大鼠则立即开始水迷宫训练。
1.4 检测指标
1.4.1 水迷宫实验 完成七氟醚麻醉24 h后开始对各组大鼠进行水迷宫实验,实验持续5 d,均在上午9点钟开始,采用ZH00 65型Morris水迷宫系统进行认知功能的测定,前4 d进行定位航行实验,第5 d进行空间探索实验,水温维持在23℃。注意在整个实验过程中要保证实验室中物品拜访以及灯光等室内环境一致。固定一个进水点,将各组大鼠从该处面向池置入水中,记录其在2 min内寻找平台的时间并在平台上停留0.5 min(逃避潜伏期)。若大鼠在2 min内未找到平台并在平台上停留,则在第5 d时将隐匿在水中的平台撤出,从固定点处放入子代大鼠,记录其2 min内穿越前期留置平台所在象限的次数及其在平台所在象限停留的时间。
1.4.2 大鼠海马内 APP、Aβ1-42、MDA、SOD水平检测 采用酶联免疫吸附法进行测量。将冻存在-80℃冰箱中的大鼠海马标本取出,称重后置于含有50 mmol/L蛋白酶抑制剂和2%烷基硫酸钠的磷酸盐缓冲液中,在4℃下离心20 min,转速为12 500 r/min,取上清液。预先配置好实验过程中需要的工作液,测定开始前0.5 h将试剂盒从冰箱中取出,放置其至常温。APP、Aβ1-42、MDA、SOD水平的测定依照试剂盒说明书进行:首先在反应孔中加入标准品和稀释的样品,将反应孔使用封板胶纸密封,轻摇后放置在温度为37℃的孵育箱中孵育1 h。然后完全甩尽板内的液体,用洗涤液洗涤每孔,洗涤结束后尽量拍干水分,重复5次以上操作。加入显色液AB后混合均匀,避光放置在37℃的孵育箱中,10 min显色结束后分别在每孔中放入终止液反应0.5 min,10 min内读取吸光度(optical density,OD)值。以纵坐标为OD值,横坐标为标准液绘制浓度标准曲线,并根据检测获得的OD值寻找出样本的浓度。
1.4.3 大鼠海马内炎症因子和Caspase-9表达水平检测 采用Western blot进行检测。将大鼠海马标本置入-80℃冰箱冷冻保存取出,称重后按照1︰10(g/L)的比例加入蛋白提取试剂,匀浆后在4℃下离心15 min,转速为12 500 r/min,取上清液。蛋白定量按照BCA试剂盒说明书进行。根据目的蛋白的相对分子量进行十二烷基硫酸钠-聚丙烯氨酰电泳凝胶(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)的配置,并根据蛋白的浓度调整上样量,电泳分离后行蛋白质转膜。将5%的脱脂牛奶作为封闭溶液,在37℃下轻微摇动2 h,之后分别加入IL-6、IL-8、Caspase-9、NADPH和一抗BACE-1进行杂交反应。在4℃条件下轻摇过夜,用磷酸缓冲液漂洗膜,5 min/次,共进行3次。然后加入羊抗兔IgG抗体进行杂交反应,37℃下孵育1.5 h,再用磷酸缓冲液漂洗膜,10 min/次,共3次。加入发光试剂显影,在暗室内行X射线胶片曝光,显影定影。再应用GDS800凝胶图像分析软件进行半定量分析,胶片上BACE-1和内参灰度之间的比值为BACE的表达水平。
1.5 统计学方法
数据分析采用SPSS 23.0统计软件,计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,不同时间点的比较采用重复测量设计的方差分析,两组间比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 5组大鼠水迷宫实验结果
结果表明:不同时间点的潜伏期差异有统计学意义(F=18.213,P=0.000),不同时间点的游泳路程差异也有统计学意义(F=29.376,P=0.000);5组静息状态下的潜伏期和游泳路程差异有统计学意义(F=17.564和21.217,均P=0.000);5组的潜伏期变化趋势差异有统计学意义(F=8.219,P=0.000),而5组游泳路程的变化趋势比较差异无统计学意义(P>0.05)。第5天的空间探索实验结果显示,各组大鼠穿越平台次数与平台所在象限停留时间随着吸入七氟醚浓度的增加而逐渐减少,其中B1组穿越平台象限次数及停留时间与A组比较差异无统计学意义(P>0.05),而B2、B3、B4组与A组比较差异均有统计学意义(P<0.05)。同时,B2、B3、B4组穿越平台象限次数及停留时间与B1比较差异有统计学意义(P<0.05),但3组间穿越平台象限次数及停留时间比较差异无统计学意义(P>0.05)。见表 1。
2.2 5组大鼠APP、Aβ、BACE-1水平比较
B1组大鼠海马内APP和Aβ1-42蛋白表达与A组比较差异有统计学意义,B2、B3、B4组与A组和B1组比较差异有统计学意义(P<0.05),3组之间比较差异无统计学意义(P>0.05);B1、B2、B3、B4组大鼠海马内BACE-1表达随七氟醚浓度增加而逐渐增加,B3、B4组大鼠海马内BACE-1表达水平高于A、B1和B2组(P<0.05),两组间比较差异有统计学意义(P<0.05)。见表2。
2.3 5组大鼠氧化应激相关指标比较
与A组比较,B1、B2、B3、B4组大鼠海马内MDA含量随七氟醚浓度升高而升高,SOD含量下降,其中B3、B4组大鼠海马内MDA含量高于A组,SOD含量则低于A组(P<0.05);B1和B2组MDA和SOD含量与A组比较差异无统计学意义(P>0.05)。见表3。
表1 5各组大鼠水迷宫实验结果比较 (n =8,±s)
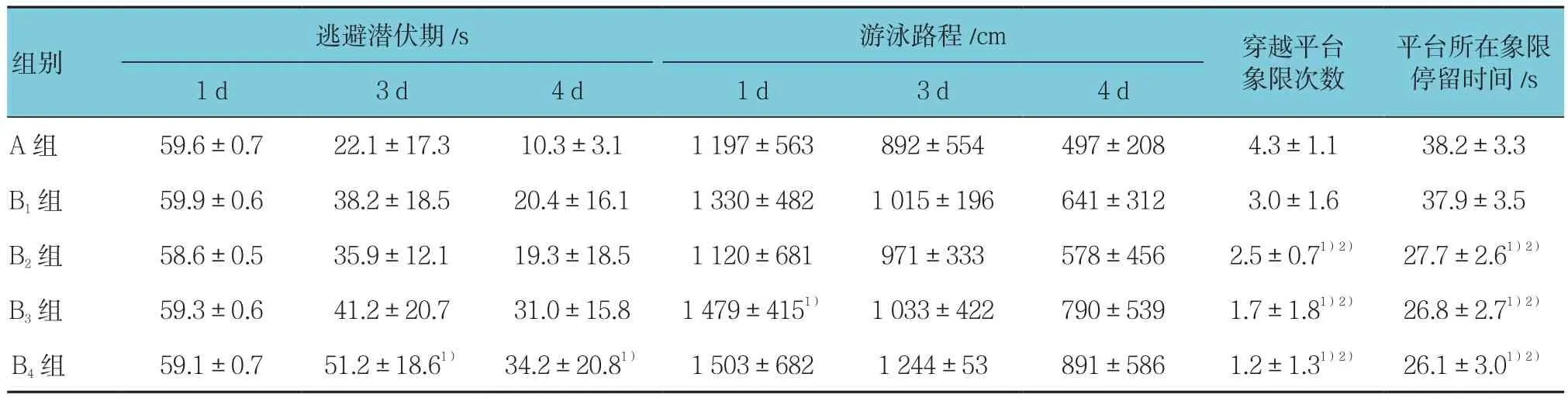
表1 5各组大鼠水迷宫实验结果比较 (n =8,±s)
注:1)与 A 组比较,P <0.05;2)与 B1组比较,P <0.05
组别平台所在象限停留时间/s 1 d 3 d 4 d 1 d 3 d 4 d逃避潜伏期/s 游泳路程/cm 穿越平台象限次数A 组 59.6±0.7 22.1±17.3 10.3±3.1 1 197±563 892±554 497±208 4.3±1.1 38.2±3.3 B1组 59.9±0.6 38.2±18.5 20.4±16.1 1 330±482 1 015±196 641±312 3.0±1.6 37.9±3.5 B2组 58.6±0.5 35.9±12.1 19.3±18.5 1 120±681 971±333 578±456 2.5±0.71)2) 27.7±2.61)2)B3组 59.3±0.6 41.2±20.7 31.0±15.8 1 479±4151) 1 033±422 790±539 1.7±1.81)2) 26.8±2.71)2)B4组 59.1±0.7 51.2±18.61) 34.2±20.81) 1 503±682 1 244±53 891±586 1.2±1.31)2) 26.1±3.01)2)
2.4 5组大鼠海马内炎症因子指标及Caspase-9表达水平比较
与A组比较,B1、B2、B3、B4组大鼠海马内IL-6、IL-8表达随七氟醚浓度增加而增强,B2、B3、B4组与A组比较差异有统计学意义(P<0.05),B1组和A组比较差异无统计学意义(P>0.05)。与A组比较,B1、B2、B3、B4组大鼠海马内Caspase-9表达随七氟醚浓度增加而增强,B3、B4组与A组比较差异有统计学意义(P<0.05),B1、B2组与A组比较差异无统计学意义(P>0.05)。见表 4。
表2 5组大鼠海马内APP、Aβ、BACE-1表达水平比较 (n =8,±s)
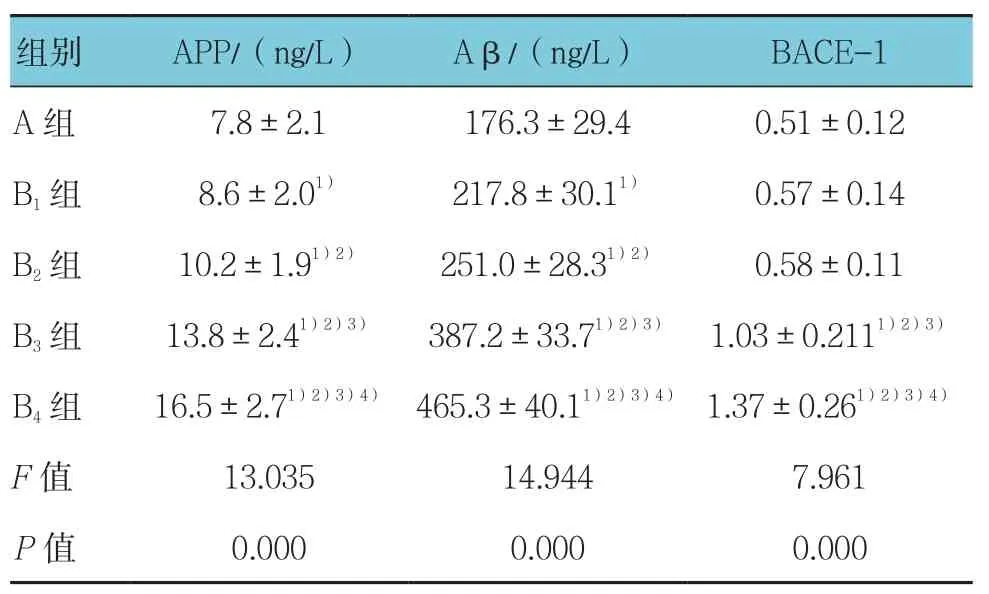
表2 5组大鼠海马内APP、Aβ、BACE-1表达水平比较 (n =8,±s)
注:1)与 A 组比较,P <0.05;2)与B1组比较,P <0.05;3)与 B2组比较,P <0.05;4)与 B3组比较,P <0.05
组别 APP/(ng/L) Aβ/(ng/L) BACE-1 A 组 7.8±2.1 176.3±29.4 0.51±0.12 B1组 8.6±2.01) 217.8±30.11) 0.57±0.14 B2组 10.2±1.91)2) 251.0±28.31)2) 0.58±0.11 B3组 13.8±2.41)2)3) 387.2±33.71)2)3) 1.03±0.2111)2)3)B4 组 16.5±2.71)2)3)4) 465.3±40.11)2)3)4) 1.37±0.261)2)3)4)F值 13.035 14.944 7.961 P值 0.000 0.000 0.000
表3 5组大鼠海马内MDA和SOD含量比较(n =8,±s)

表3 5组大鼠海马内MDA和SOD含量比较(n =8,±s)
注:†与A组比较,P <0.05
组别 MDA/(nmol/mg) SOD/(u/mg)A组 4.61±0.64 101.3±13.4 B1组 4.76±0.69 105.9±13.7 B2组 4.88±0.73 107.2±14.1 B3组 14.35±1.92† 65.1±9.7†B4组 15.67±2.24† 55.6±8.9†F值 9.871 9.732 P值 0.000 0.000
表4 5组大鼠海马内IL-6、IL-8及Caspase-9表达水平比较 (n =8,±s)

表4 5组大鼠海马内IL-6、IL-8及Caspase-9表达水平比较 (n =8,±s)
注:1)与 A 组比较,P <0.05;2)与 B1组比较,P <0.05
组别 IL-6 IL-8 Caspase-9 A 组 0.33±0.07 0.35±0.08 0.33±0.06 B1组 0.41±0.06 0.43±0.06 0.42±0.08 B2组 0.67±0.071)2) 0.68±0.061)2) 0.46±0.09 B3组 0.76±0.051)2) 0.80±0.051)2) 0.82±0.091)B4组 0.89±0.061)2) 0.87±0.071)2) 0.89±0.111)F值 5.940 5.934 4.073 P值 0.000 0.000 0.001
3 讨论
临床接受手术治疗的老年患者随着老龄化社会的到来逐渐增多,就老年患者而言,更容易出现术后认知障碍(post operative congnitive dysfunction,POCD),具体表现出记忆力损伤、情绪变化、精神错乱、人格改变等特征性症状[1]。国外研究指出,POCD的发生是多种因素共同作用的结果,包括心脑精神疾病、高龄、营养不良、感官缺陷、心理因素、长期服用某些药物等[5]。很多研究证实,随着年龄的增长,POCD的发生率明显增加,尤其是年龄在70岁以上的老年患者。在临床上,POCD更容易发生在经历心脏等大手术接受全身麻醉的老年患者中[6]。虽然手术治疗方式确实帮助很多老年人的原发疾病得到有效的治愈,但POCD的发生却无法忽视,其给患者的生理、心理、经济,以及整个社会带来巨大的负担,严重影响着老年患者术后的生活质量。本研究以容易在接受麻醉后出现POCD的老年大鼠作为对象进行研究,分别对其进行较长时间的七氟醚吸入麻醉,其麻醉后的水迷宫实验结果证实POCD的发生。近年来,有学者指出亚麻醉浓度的七氟醚吸入(1.3%浓度)在能够在一定程度上改善大鼠学习记忆功能,但也有研究指出七氟醚是导致大鼠认知功能的原因之一[7-8]。因此,本研究则进一步对不同浓度的七氟醚吸入对老年大鼠认知功能的影响作用进行探讨,分析其作用机制,以帮助临床选择合理浓度的七氟醚麻醉。
七氟醚被人多麻醉学家认为是吸入麻醉的里程碑式药物,具有起效快、麻醉作用强、对气道刺激小、对血液动力学影响小等优势,被广泛应用儿童和老年患者全麻诱导中。研究指出,七氟醚导致POCD的发生,其可能的机制为:①促进脑内β淀粉样单体寡聚化,从而导致海马内tau蛋白过度磷酸化并丧失生理功能;②诱导炎症反应和细胞凋亡;③干扰氧化还原平衡产生大量氧自由基[9-10]。Morris水迷宫是常用的从行为学角度评价动物空间学习记忆能力的一种方法,常用于观察实验动物空间认知能力的变化以及药物对实验动物学习和记忆能力的影响[11]。本实验中对所有组的老年大鼠在5 d的水迷宫训练中发现,各组大鼠随着训练时间的延长,其找到平台的时间和运动的路程均逐渐缩短,这提示通过水迷宫训练各组大鼠的学习记忆能力都有所增强。但研究结果也显示出大鼠的潜伏期随着七氟醚吸入浓度的升高而增长,这说明高浓度的七氟醚吸入会影响大鼠的学习能力。此外,研究结果还提示吸入高浓度七氟醚的大鼠在撤去平台后其寻找平台花费的时间更长,其轨迹也更加混乱,这说明老年大鼠吸入七氟醚的浓度越高,其学习和记忆能力受到的损伤也更大。
Aβ是POCD重要的病理学指标之一[12]。POCD和阿尔茨海默病(Alzheimer disease,AD)具有相似的病理学过程:β-分泌酶和γ-分泌酶的先后酶切作用使得APP产生Aβ,在正常人体状态下,非寡聚状态下的Aβ40和寡聚状态下的Aβ42维持动态平衡。当APP使得Aβ的产生增加时,寡聚化Aβ会加速沉积,从而产生神经毒性。本实验结果发现,随着七氟醚吸入浓度的升高,Aβ沉积增多,进而发生POCD的风险也就越高。分析该过程的机制可能是七氟醚可激活Caspase,并促使细胞凋亡,APP和BACE-1表达会随之增加,最终Aβ也会相应增加。淀粉样前体蛋白-APP是一种在多种组织中表达的膜内在蛋白,可在神经元的突触部位集中。作为一种急性反应蛋白,APP在炎症反应、短暂全脑缺血等应激状态下其表达水平会升高。APP可被α-、β-、γ-等蛋白酶分解,其中β-和γ-蛋白酶的连续作用会使得APP分解产生Aβ。本实验发现,七氟醚的浓度也会影响APP的表达,尤其是当七氟醚浓度超过3%时,APP的表达会明显升高。作为一种刺激性因素,七氟醚可增加APP mRNA的转录,从而提高APP的表达水平。同时在APP的分解过程中,BACE-1是起关键作用的限速酶,其表达水平会直接影响Aβ的水平[13]。本研究发现对老年大鼠进行七氟醚处理后,其海马内BACE-1表达水平增加,而且随着七氟醚浓度的升高,其增加幅度也升高。但低浓度的七氟醚对BACE-1水平无明显影响,分析原因可能是短时间、低浓度的七氟醚吸入对神经细胞凋亡和学习记忆能力的影响作用较小。
SOD则是一种能够消除生物体在新陈代谢过程中产生的有害物质的活性蛋白酶,是生物体内清除氧自由基的首要物质。MDA则是机体在酶系统和非酶系统的作用下产生的脂质过氧化物,其可对生物膜中多不饱和脂肪酸进行攻击,进而引发脂质过氧化作用,MDA的测量结果往往可以反映出机体脂质过氧化的程度以及细胞受损的程度。有研究指出七氟醚可激活内皮细胞钙依赖蛋白酶产生大量的氧自由基,进而导致氧化应激[14]。本研究结果显示,老年大鼠经七氟醚麻醉后其海马内的SOD含量降低,而MDA含量升高。这提示七氟醚引发的氧化应激也有可能是七氟醚导致POCD的机制之一。本研究结果还显示,七氟醚的浓度与IL-6、IL-8等炎症因子以及Caspase-9的表达具有相关性,随着浓度的增加,B1、B2、B3及B4组老年大鼠IL-6、IL-8和Caspase-9表达增加,这说明炎症反应也参与了七氟醚麻醉导致大鼠发生POCD的过程。同时炎症反应和细胞凋亡之间关系密切,而研究发现Caspase家族中的Caspase-9则是导致细胞凋亡所必须的物质,是细胞凋亡的起始者[15]。本研究发现,七氟醚在引发炎症反应的同时也增加了Caspase-9的表达,提示七氟醚可通过诱导炎症反应和促使细胞凋亡来引发POCD的发生。
综上所述,七氟醚和老年大鼠手术后POCD的发生密切相关,且呈现浓度依赖性的特征,在七氟醚浓度高于3%时,老年大鼠认知功能在麻醉后发生明显改变。分析其机制可能与APP和Aβ的生成,诱导氧化应激、以及促进炎症反应发生和细胞凋亡有关。
参 考 文 献:
[1] 刘楠, 刘薇, 李冰, 等. 老年轻度认知功能障碍患者的相关因素分析[J]. 中国实用神经疾病杂志, 2014, 17(8): 38-39.
[2] 桂德新, 彭丹辉, 黎阳, 等. 七氟醚吸入全麻对高龄手术患者术后认知功能的影响[J]. 右江医学, 2014, 42(5): 589-592.
[3] TIAN X S, TONG Y W, LI Z Q, et al. Surgical stress induces brainderived neurotrophic factor reduction and postoperative cognitive dysfunction via glucocorticoid receptor phosphorylation in aged mice[J]. Cns Neuroscience & Therapeutics, 2015, 21(5): 398-409.[4] PENG L, XU L, OUYANG W. Role of peripheral inflammatory markers in postoperative cognitive dysfunction (POCD): a metaanalysis[J]. PloS One, 2013, 8(11): 1-10.
[5] KRENK L, KEHLET H, BÆK H T, et al. Cognitive dysfunction after fast-track hip and knee replacement[J]. Anesthesia &Analgesia, 2014, 118(5): 1034-1040.
[6] ZHU S H, JI M H, GAO D P, et al. Association between perioperative blood transfusion and early postoperative cognitive dysfunction in aged patients following total hip replacement surgery[J]. Upsala Journal of Medical Sciences, 2014, 119(3): 262-267.
[7] 左蕾, 李琪英, 刘丹彦. 不同浓度七氟醚对老年大鼠认知功能的影响[J]. 重庆医科大学学报, 2013, 38(3): 239-243.
[8] 郑淑文, 朱昭琼, 马欢欢, 等. 哺乳期大鼠反复七氟醚麻醉对远期认知功能的影响[J]. 中华麻醉学杂志, 2013, 33(6): 669-671.
[9] FH L E, J BROUILLETTE, FJ FERNANDEZ-GOMEZ, et al.Tau phosphorylation and sevoflurane anesthesia: an association to postoperative cognitive impairment[J]. Anesthesiology, 2012,116(4): 779-787.
[10] 马冬梅, 池萍, 岳云. 七氟醚和丙泊酚对老年患者术后认知功能的影响[J]. 山西医科大学学报, 2013, 44(11): 896-898.
[11] 刘金凤, 聂坤, 栗振杰, 等. Morris水迷宫测评方法的改进及对快速老化痴呆小鼠SAMP8认知功能的再评价[J]. 中国中医急症, 2013, 22(1): 5-7.
[12] 赵国梁, 丁明. 血清NSE、S1OOβ和Aβ蛋白与老年患者术后认知功能障碍关系的临床研究[J]. 临床麻醉学杂志, 2013,29(10): 979-982.
[13] 刘悦. 糖尿病认知功能障碍患者血液硫化氢、BACE1和Aβ42变化的初步研究[D]. 重庆医科大学, 2013: 29-31.
[14] 王亚欣, 王永旺, 张彦, 等. 七氟醚后处理对大鼠局灶性脑缺血再灌注时氧化应激反应的影响[J]. 中华麻醉学杂志, 2013,33(6): 761-763.
[15] 管小萌, 徐桂萍, 王晓丽. 大鼠肝缺血再灌注后肺细胞凋亡及七氟醚对细胞凋亡及NF-κBp65的影响[J]. 安徽医药, 2015,19(12): 2272-2275.

