雾化吸入甘草酸减轻博莱霉素所致小鼠肺纤维化的机制研究*
李俸敏,王火,曹波,王宁
(1.重庆市九龙坡区中医院,重庆 400039;2.中国人民武装警察部队后勤学院附属医院,天津 300162;3.中国人民武装警察部队后勤学院,天津 300309;4.四川大学华西医院再生医学研究中心,四川 成都 610041)
肺纤维化(pulmonary fibrosis,PF)是由多种因素引起的弥漫性间质性肺疾病,其主要病理特征是弥漫性肺泡炎、成纤维细胞增殖以及细胞外基质的过度沉积[1-3],进而引起进行性肺功能下降,最终可诱发呼吸衰竭而致死亡[4]。甘草酸(glycyrrhizic acid,GA)是从传统中药光果甘草中提取的天然化合物,具有抗炎、抗氧化、抗肿瘤、抗菌及抗病毒等广泛的药物特性[5]。前期研究发现,一定剂量的GA具有抗肺纤维化的作用,但是其有效剂量较大(灌胃剂量为250 mg/kg)。结合GA具有药物特性及雾化能快速作用于靶器官等优点,本研究采用GA雾化吸入并与GA灌胃比较,研究其抗肺纤维化作用及可能的机制。
1 材料与方法
1.1 实验动物
SPF级雄性昆明小鼠90只,体重18~20 g,购自军事医学科学院实验动物研究中心。小鼠适应性喂养5 d,食物和纯净水可自由摄取。
1.2 药品、试剂及主要仪器
GA(陕西富捷药业有限公司,批号:20140605),博莱霉素(日本化药珠式会社,生产批号:650472),吸入用布地奈德悬液(普米克令舒)(澳大利亚Astra Zeneca Pty Ltd公司,产品批号:LOT 318406),欧姆龙(Omron)超声雾化器NB-150U[乐道克电子制造(南通)有限公司],羟脯氨酸检测试剂盒(碱)(南京建成生物工程研究所,批号:20160701),小鼠IL-6、TGF-β1酶联免疫吸附试验(ELISA)试剂盒购自上海拜力生物科技有限公司,羊抗兔IgG购自中彬金桥生物技术有限公司,羊抗鼠IgG(H+L)、兔抗IL-6、兔抗IL-17A抗体购自美国Proteintech公司,鼠抗β-actin、兔抗p-Smad2购自武汉博士德生物工程有限公司,兔抗TGF-β1购自美国Affbiotech公司。
1.3 方法
1.3.1 分组 SPF级雄性昆明小鼠90只随机分成6组:对照组、模型组、GA250灌胃(intragastric administration,IA)组、GA12组、GA24组及布地奈德雾化(atomizing inhalation,AI)组,每组15只。
1.3.2 复制肺纤维化模型及给药 模型组及各给药组分别给予5 mg/kg的博莱霉素溶液气管滴注,复制小鼠肺纤维化模型。24 h后IA组按250 mg/kg剂量以GA溶液灌胃,GA12和GA24组分别给予12和24 mg/ml剂量的GA溶液4 ml雾化吸入;AI组雾化吸入0.25 mg/ml的布地奈德混悬液4 ml;对照组和模型组分别雾化等量的生理盐水。各组每天雾化1次,连续21 d。第7、14和21天每组随机处死5只小鼠。小鼠眼球取血,3 000 r/min离心20 min后取上清,-80℃冷冻保存;颈椎离断处死后,取右肺上叶,4%中性甲醛固定,包埋、切片,其余组织-80℃冷冻保存。
1.3.3 HE染色和Masson染色 小鼠肺组织切片作HE染色和Masson染色。镜下(×200)观察并评价肺组织炎症及纤维化程度。
1.3.4 HYP含量检测 小鼠肺组织匀浆后,羟脯氨酸检测试剂盒检测HYP含量以明确肺组织中胶原水平,具体方法依照说明书进行操作。
1.3.5 IL-6含量检测 ELISA法测定小鼠血清中IL-6含量,检测炎症因子,具体方法依照说明书进行。
1.3.6 Western blot检测 小鼠肺组织中IL-6、IL-17A、p-Smad2及TGF-β1蛋白表达水平均经Western blot检测。
1.4 统计学方法
数据分析采用Graphpad Prism 5统计软件,计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析,检验方差齐性,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠肺组织HE染色及炎症评分比较
雾化第7天,模型组小鼠肺组织出现大量炎症细胞浸润,肺泡间隔充血、增厚,肺泡腔变窄。模型组与对照组炎症评分比较,采用t检验,差异有统计学意义(t=16.04,P=0.000),模型组炎症评分高于对照组;GA12组、GA24组及IA组与模型组炎症评分比较,采用单因素方差分析,差异无统计学意义(P>0.05);AI组与模型组炎症评分比较,差异有统计学意义(F=3.477,P=0.009),AI组炎症评分低于模型组(见图1、3)。第14天,模型组炎症评分高于对照组(t=14.23,P=0.000);各治疗组与模型组炎症评分比较,可见GA24组炎症评分低于IA和AI组(F=3.063,P=0.018)(见图1、4)。第21天,模型组炎症评分高于对照组(t=11.14,P=0.000);各给药组与模型组炎症评分比较,差异无统计学意义(见图1、5)。
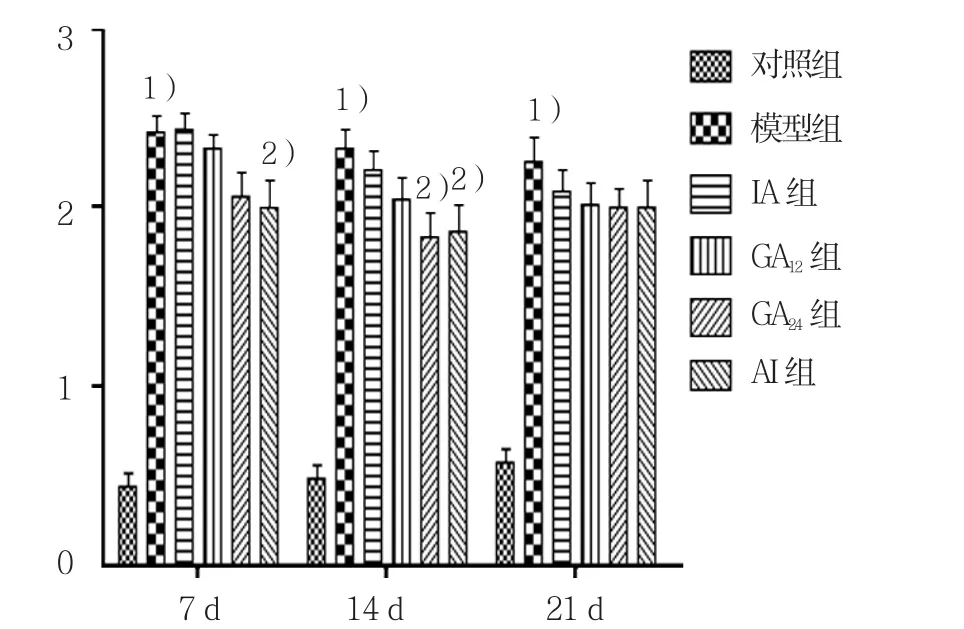
图1 雾化第7、14和21天炎症评分
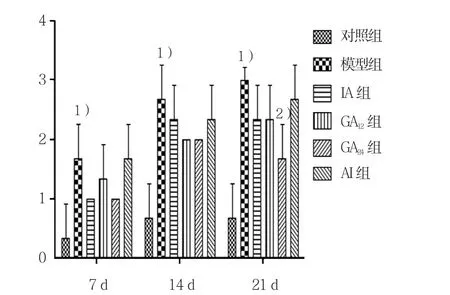
图2 雾化第7、14和21天纤维化评分
2.2 小鼠肺组织Masson染色及纤维化评分比较
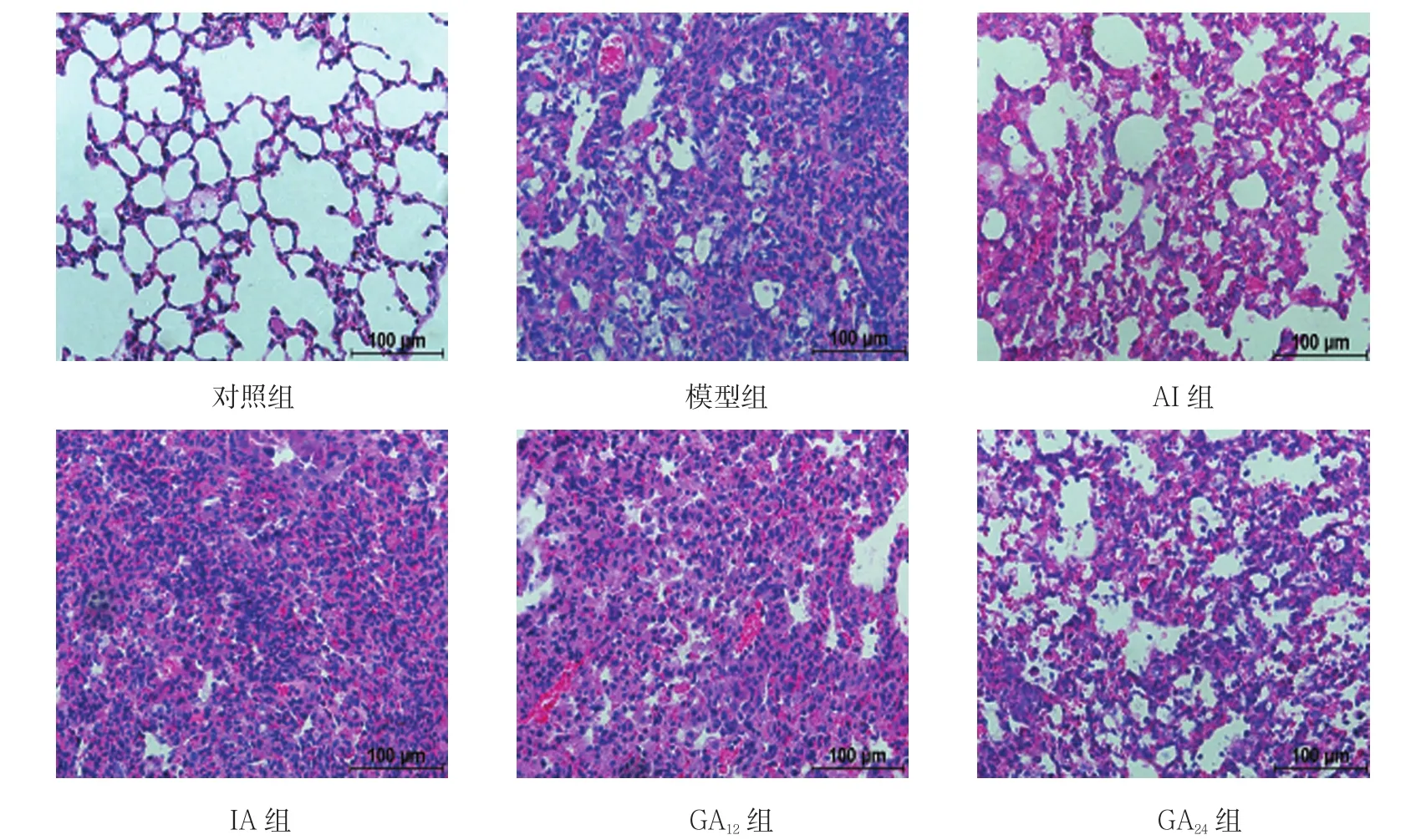
图3 雾化第7天肺组织切片 (HE染色)
雾化第7和14天,模型组逐渐出现蓝染的胶原纤维。模型组与对照组纤维化评分比较,采用t检验,差异有统计学意义(7 d:t=2.828,P=0.047;14 d:t=4.243,P=0.013),模型组纤维化评分均高于对照组;各给药组与模型组纤维化评分比较,经单因素方差分析,差异无统计学意义(见图2、6、7)。第21天,模型组可见大量增生的胶原纤维,纤维化评分高于对照组(t=7.000,P=0.020);各给药组与模型组比较,可见GA24组胶原纤维减少,纤维化评分降低,差异无统计学意义(见图2、8)。
2.3 小鼠肺组织HYP含量比较
雾化第7天,模型组与对照组HYP含量比较,采用t检验,差异有统计学意义(t=13.270,P=0.006),模型组HYP含量高于对照组;各给药组与模型组比较,差异无统计学意义(P>0.05)。第14和21天,模型组HYP含量均高于对照组(14 d:t=13.040,P=0.006;21 d:t=7.005,P=0.020);各给药组与模型组比较,GA12和GA24组可见MDA含量降低,且第21天时GA12及GA24组HYP含量低于IA组和AI组(14 d:F=12.030,P=0.009;21 d:F=24.750,P=0.002)。见图 9。
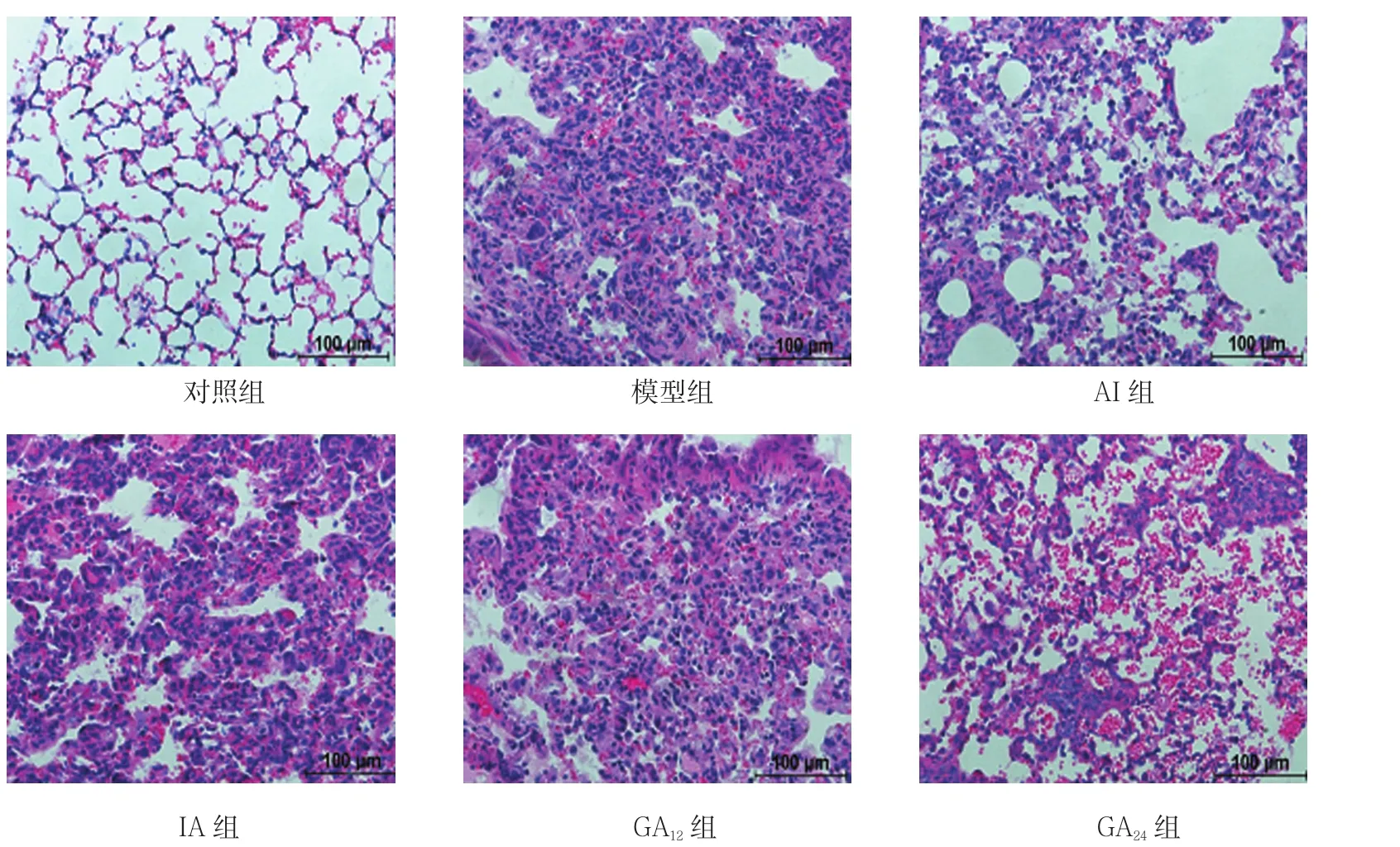
图4 雾化第14天肺组织切片 (HE染色)
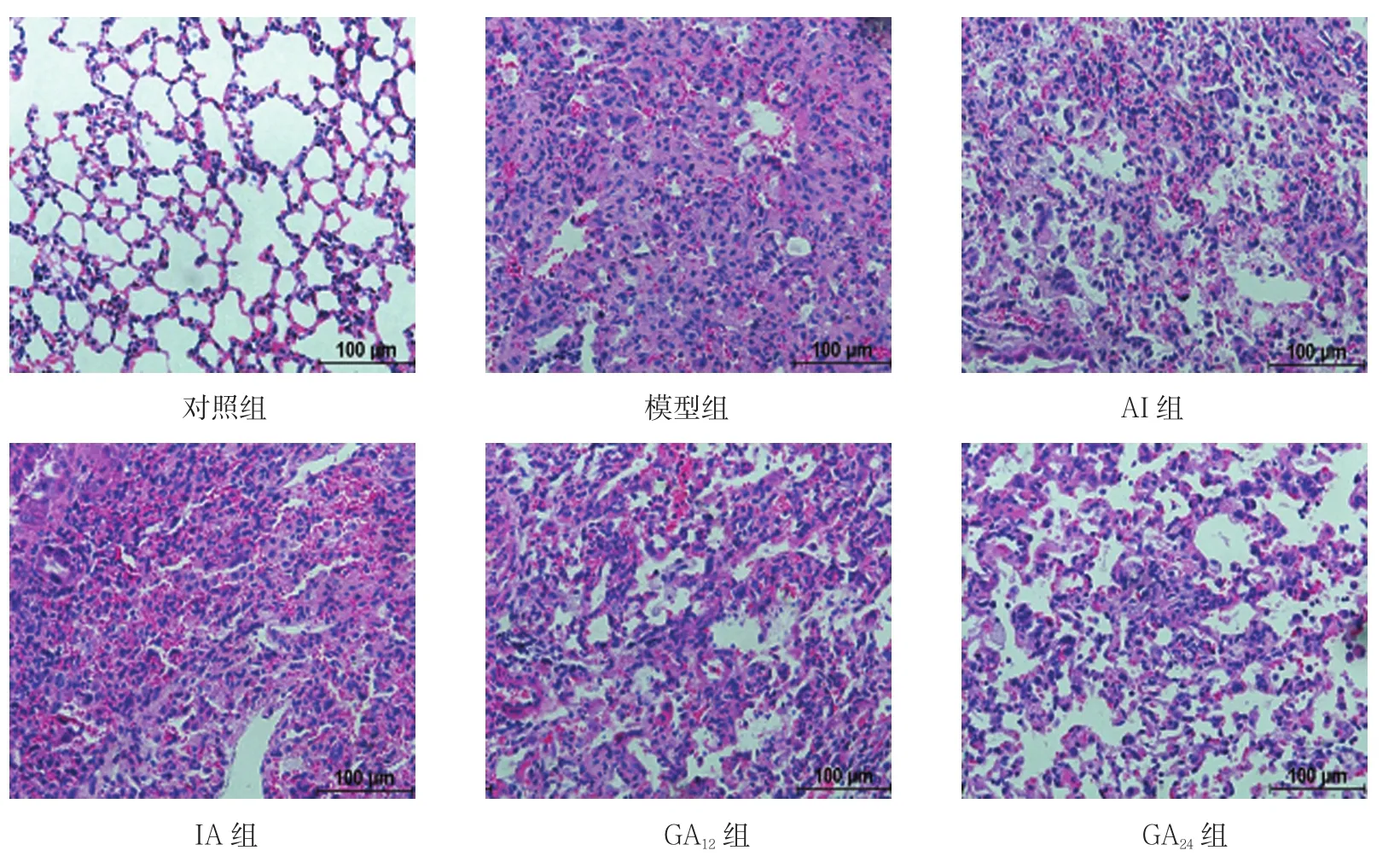
图5 雾化第21天肺组织切片 (HE染色)
2.4 小鼠血清IL-6含量比较
雾化第7天,模型组与对照组IL-6含量比较,采用t检验,差异有统计学意义(t=4.642,P=0.043),模型组小鼠血清IL-6含量高于对照组;各给药组与模型组比较,GA24组IL-6含量降低,且低于IA组和AI组(F=6.839,P=0.018)。第14和21天,模型组IL-6含量高于对照组;各给药组与模型组比较IL-6含量也有降低,差异无统计学意义(P>0.05)。见图10。
2.5 小鼠肺组织中IL-6、IL-17A、p-Smad2及TGF-β1蛋白表达水平
Western blot结果显示(见图11~15):雾化第7天,模型组与对照组IL-6的表达水平比较,采用t检验,差异有统计学意义(t=5.290,P=0.034),模型组IL-6的表达水平高于对照组;各给药组与模型组IL-6的表达水平比较,采用单因素方差分析,差异有统计学意义(F=10.52,P=0.006),GA24组IL-6的表达水平降低,且低于其余各组。第14天,模型组IL-6的表达水平高于对照组(t=4.972,P=0.008);各给药组与模型组比较,可见GA24组IL-6的表达水平降低,且低于IA组和AI组(F=12.95,P=0.000)。第21天,模型组IL-6的表达水平高于对照组(t=5.107,P=0.007),而各组间差异无统计学意义(P>0.05)。见图13。
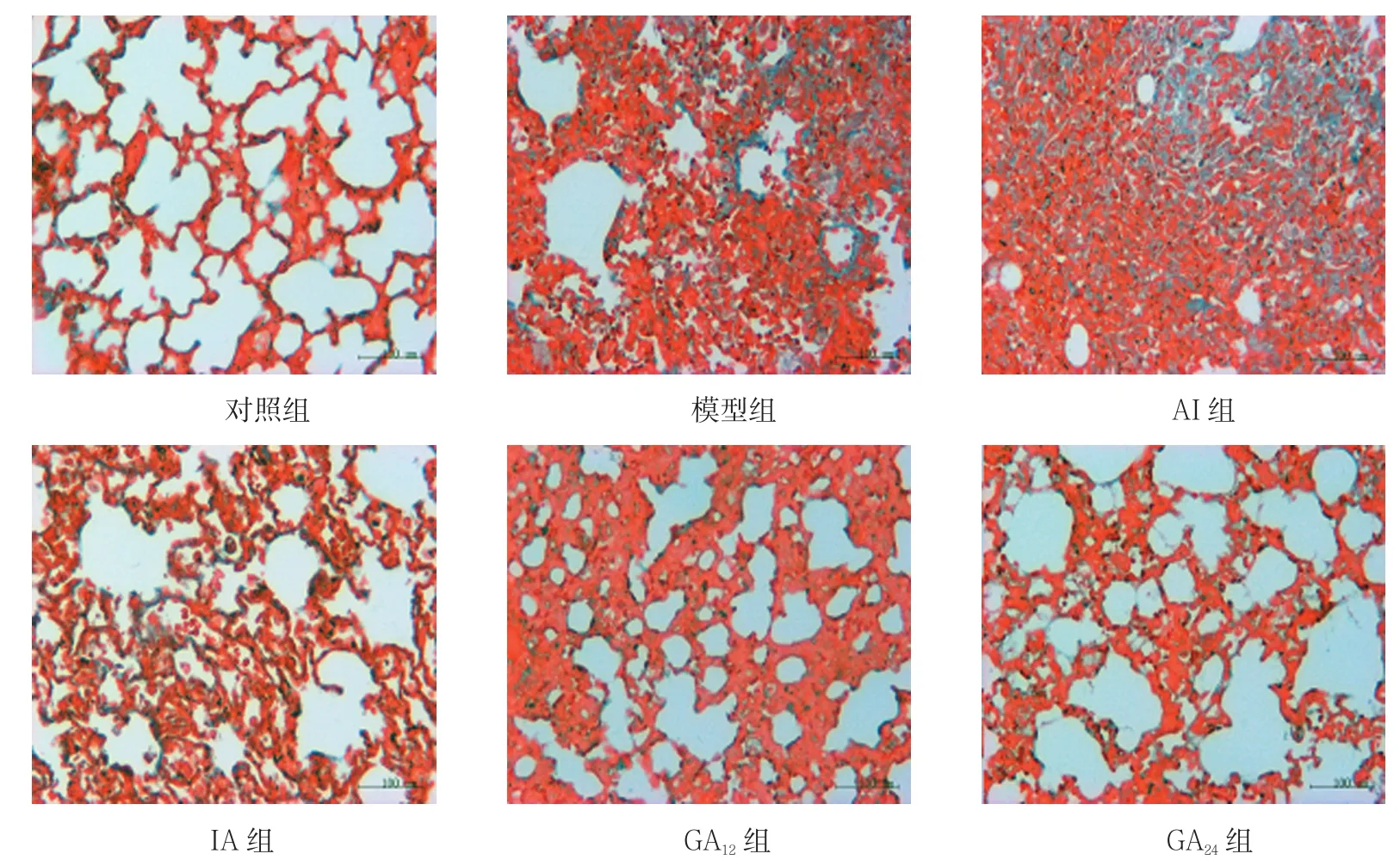
图6 雾化第7天肺组织切片(Masson染色)

图7 雾化第14天肺组织切片 (Masson染色)
第7天时,模型组与对照组IL-17A的表达水平比较,采用t检验,差异有统计学意义(t=5.294,P=0.006),模型组IL-17A表达水平高于对照组;各给药组与模型组IL-17A的表达水平比较,采用单因素方差分析,差异无统计学意义(P>0.05)。第14天,模型组IL-17A表达水平高于对照组(t=8.549,P=0.001);各给药组与模型组比较,采用单因素方差分析,差异无统计学意义(P>0.05)。第21天,模型组IL-17A表达水平高于对照组(t=5.377,P=0.006);各给药组与模型组比较,可见GA24组IL-17A表达水平降低,且低于其余各组(F=5.492,P=0.007)。见图14。
雾化第7天,模型组与对照组p-Smad2的表达水平比较,采用t检验,差异无统计学意义(P>0.05)。第14天,模型组p-Smad2的表达高于对照组(t=6.427,P=0.003);各给药组与模型组p-Smad2的表达水平比较,经单因素方差分析,差异有统计学意义(F=25.160,P=0.000),GA24组p-Smad2的表达水平低于其余各组。第21天,模型组p-Smad2的表达高于对照组(t=3.855,P=0.018);各给药组与模型组比较,GA12和GA24两组p-Smad2的表达均有降低,差异无统计学意义(P>0.05)。见图 14。

图8 雾化第21天肺组织切片 (Masson染色)
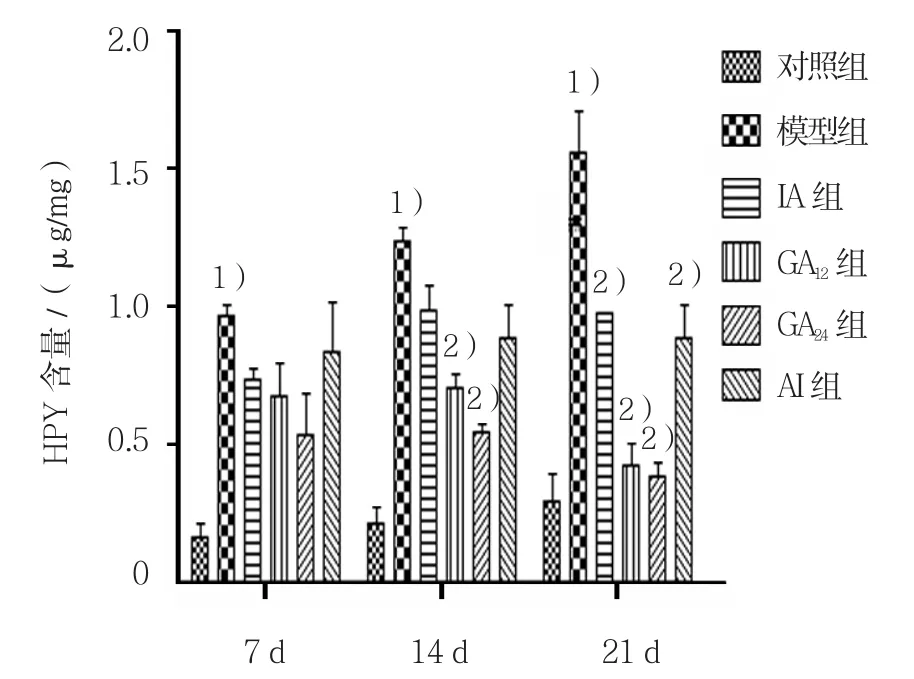
图9 肺组织HYP含量比较
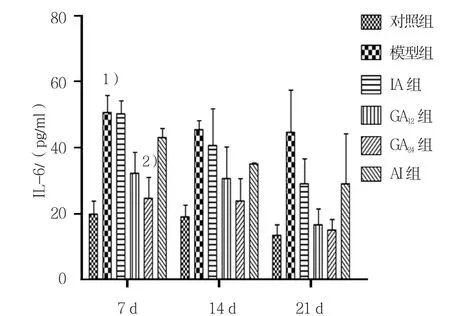
图10 血清IL-6含量比较
第7和14天时,模型组与对照组TGF-β1的表达水平比较,采用t检验,差异无统计学意义(P>0.05)。第21天,模型组与对照组TGF-β1的表达水平比较,采用t检验,差异有统计学意义(t=13.080,P=0.000),模型组TGF-β1的表达水平高于对照组;各给药组与模型组TGF-β1的表达水平比较,采用单因素方差分析,差异有统计学意义(F=86.250,P=0.000),GA24组TGF-β1表达水平降低,且低于IA组和AI组。见图15。

图11 小鼠肺组织中IL-6、IL-17A、p-Smad2及TGF-β1蛋白表达水平
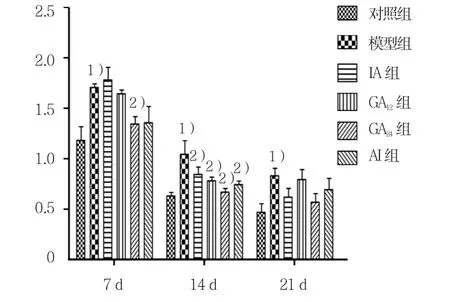
图12 肺组织IL-6表达水平
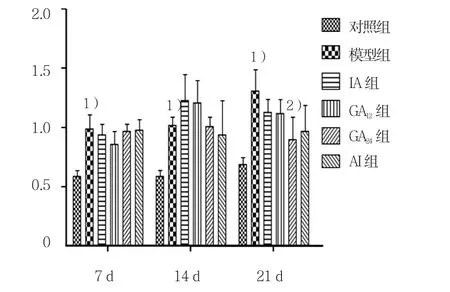
图13 肺组织IL-17A表达水平
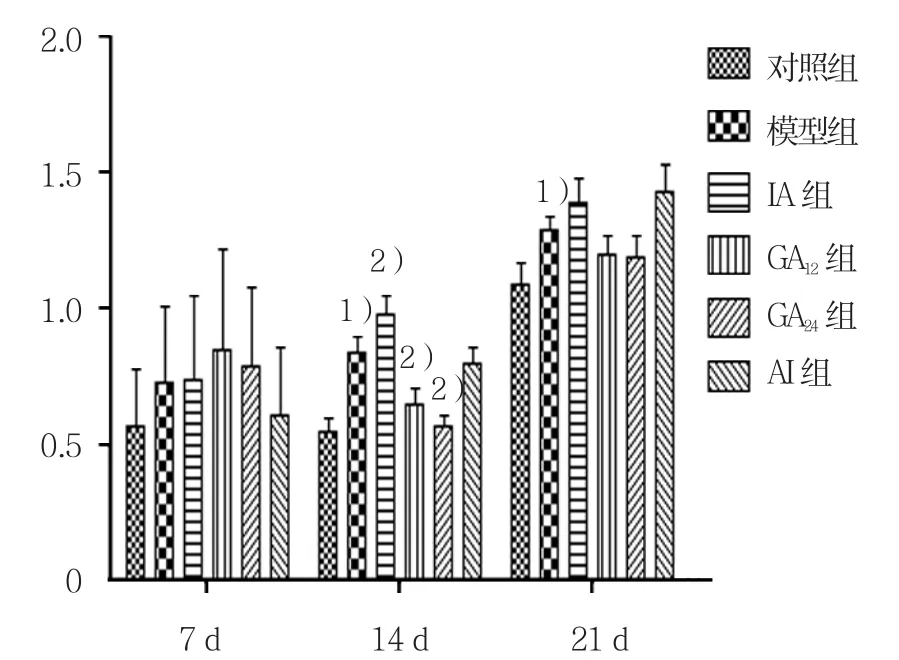
图14 肺组织p-Smad2表达水平

图15 肺组织TGF-β1表达水平
3 讨论
目前,临床治疗肺纤维化仍以激素和免疫抑制剂联合应用为主,临床疗效欠佳且伴不同程度的不良反应[6-7]。近年来,从中草药中寻找有效的治疗药物成为肺纤维化研究的热点。GA具有抗炎、抗氧化、抗肿瘤、抗菌及抗病毒等广泛的药物特性,在实验研究中已发现其具有抗肺纤维化作用。根据最新《雾化吸入疗法在呼吸疾病中的应用专家共识》[8],雾化吸入治疗呼吸系统疾病具有起效迅速、疗效佳、全身不良反应少等多种优势,是治疗呼吸系统相关疾病较理想的给药方法。因此,结合GA具有的药物特性及雾化能快速作用于靶器官等优点,本研究采用GA雾化吸入并与GA灌胃相比较,研究其抗肺纤维化作用及可能的机制。
实验结果表明,正常肺组织肺泡上皮完整,肺泡腔内少有炎症细胞浸润,未见肺间质增宽,少有蓝染的胶原纤维。雾化第7天,模型组肺组织HE染色可见肺组织结构严重破坏,大量炎症细胞浸润;Masson染色可见肺间质逐渐增宽,开始出现蓝染胶原纤维。第14天,模型组肺泡腔内炎症细胞浸润有所减轻,肺间质增宽,蓝染的胶原纤维增多。而与模型组比较,GA12和GA24两组抑制肺间质的增宽,蓝染的胶原纤维也有减少,而胶原表达的标志物HYP含量也逐渐增加。第21天,模型组病理切片可见肺间质较宽,胶原纤维大量增多,HYP表达量达到顶峰。雾化GA12和GA24两组与模型组相比胶原面积减少,且GA24组的抗纤维化效果优于IA组和AI组。
IL-17是由Th17细胞产生的一种重要的促炎症细胞因子,参与并介导多种炎症反应和自身免疫性疾病的发生和发展[9-10]。IL-6作为常见的炎症因子,在纤维结缔组织和平滑肌增生过程中发挥重要作用[11]。研究发现,IL-17和IL-6都是引起肺纤维化的关键促炎介质,与TGF-β1/Smads通路密切相关。IL-6和IL-17表达上调,尤其是IL-17表达上调时,可整体上调TGF-β1/Smads通路的表达。本研究发现,IL-6在复制模型后第7天升高后逐渐降低,而IL-17的表达逐步升高,与其相对应TGF-β1、p-Smad2表达也逐步升高。GA12和GA24组降低IL-17、TGF-β1及p-Smad2水平,优于IA组及AI组。IA初期不能减轻炎症反应,后期可逐渐减轻纤维化。而AI组第7天时能抑制IL-6的表达且效果优于GA组,说明其可抑制早期的炎症反应,而对纤维化长期变化无显著改善。因此可推测,雾化吸入GA初期可降低IL-6水平以减轻小鼠的炎症反应,然后通过抑制IL-17、p-Smad2及TGF-β1表达减轻纤维化程度,从而改善博莱霉素所致小鼠肺纤维化,其效果优于GA250灌胃;而布地奈德也可降低IL-6和IL-17水平,其减轻炎症疗效与GA24相当,但后期并未抑制p-Smad2和TGF-β1表达,可能并不通过TGF-β1/Smads通路发挥作用。
综上所诉,GA雾化吸入可通过抑制肺纤维化中TGF-β/Smads通路的表达来抑制博莱霉素所致小鼠的肺纤维化。雾化吸入GA具有应用于肺纤维化临床治疗的价值。
参 考 文 献:
[1] STRIETER R M, MEHRAD B. New mechanisms of pulmonary fi brosis[J]. Chest, 2009, 136(5): 1364-1370.
[2] BARKAUSKAS C E, NOBLE P W. Cellular mechanisms of tissue fi brosis 7. New insights into the cellular mechanisms of pulmonary fi brosis[J]. Am J Physiol Cell Physiol, 2014, 306(11): C987-996.
[3] FERNANDEZ I E, EICKELBERG O. New cellular and molecular mechanisms of lung injury and fibrosis in idiopathic pulmonary fi brosis[J]. Lancet, 2012, 380(9842): 680-688.
[4] 相炜宏, 王立锋, 苗运博. 博莱霉素诱导小鼠肺纤维化模型的差异基因表达谱分析[J]. 中国呼吸与危重监护杂志, 2015, 14(3):242-249.
[5] PLOEGER B, MENSINGA T, SIPS A, et al. The pharmacokinetics of glycyrrhizic acid evaluated by physiologically based pharmacokinetic modeling[J]. Drug Metab, Rev, 2001, 33(2): 33125-33147.
[6] COTTIN V, CRESTANI B, VALEYRE D, et al. Diagnosis and manage-ment of idiopathic pulmonary fibrosis: french practical guidelines[J]. Eur ResPir Rev, 2014, 23(132): 193-214.
[7] 郭刚, 王久存, 史颖, 等. 参麦开肺散对NIH/3T3成纤维细胞增殖及胶原合成的影响[J]. 解放军医药杂志, 2015, 27(2): 24-28.
[8] 中华医学会呼吸病学分会《雾化吸入疗法在呼吸疾病中的应用专家共识》专家制定组[J]. 中华医学杂志, 2016, 96(34): 2696-2708.
[9] SHABGAH A G, FATTAHI E, SHAHNEH F Z. Interleukin-17 in humaninflammatory diseases[J]. Advances in Dermatology &Alergology, 2014, 31(4): 256-261.
[10] WEI J, CHEN D. IL-17 cytokines in immunity and inflammation[J].Emerg Microbes Infect, 2013, 2(9): e60.
[11] LE T T, KARMOUTY-QUINTANA H, MELICOFF E, et al.Blockade of IL-6 Trans signaling attenuates pulmonary fi brosis[J].J Immunol, 2014, 193(7): 3755-3768.

