香蕉残次果及香蕉花上乳酸菌的筛选鉴定
崔坤鹏,谭海生,杨劲松*,郗恩光,张万昌,鞠雪莉,李晓雷,张桂和,郑元平,蔡锦红
(1.海南大学食品学院,海南海口570228;2.海南大学材料与化工学院,海南海口570228)
香蕉残次果及香蕉花上乳酸菌的筛选鉴定
崔坤鹏1,谭海生2,杨劲松1*,郗恩光1,张万昌1,鞠雪莉1,李晓雷1,张桂和1,郑元平1,蔡锦红1
(1.海南大学食品学院,海南海口570228;2.海南大学材料与化工学院,海南海口570228)
从海南省五指山地区采集的香蕉残次果及香蕉花上分离得到12株疑似乳酸菌菌株,通过生理生化特性及分子生物学鉴定得到4株植物乳杆菌(Lactobacillus plantarum),其中从香蕉残次果上分离得到三株编号为CG1、CG5、CG7,从香蕉花上分离得到一株编号为CH2。对比四株菌的产酸速率曲线和生长曲线,发现菌株CG1的产酸速率和生长速率均明显高于其他3株菌(P<0.05)。
香蕉残次果;香蕉花;植物乳杆菌;筛选;鉴定
乳酸菌是一类可以发酵糖类,以乳酸为主要代谢产物的革兰氏阳性细菌的统称,它不是一个分类学名词[1]。其具有调节胃肠道微生物菌群平衡、抑制病原菌的生长、增强动物的免疫力等生理功效[2]。乳酸菌还能利用青贮饲料中的糖类进行发酵,主要产物为乳酸和少量乙酸,能提高饲料的营养价值,降低饲料毒性,改善饲料的适口性,延长饲料贮存期等[3]。
海南地区可利用的土地资源有限,台风等恶劣气候频繁,加之近几年香蕉枯萎病等病虫害污染加剧,致使香蕉残次果的数量持续增加,香蕉产业逐渐失去了优势地位[4]。香蕉残次果具有单宁含量高、果实细小萎缩、含糖量低、难自然成熟等特点,即使经催熟处理,商用价值也极低。一直以来,此类残次果被弃于野外自然腐烂变质,既浪费资源又污染环境[5-6]。近几年,许多学者对香蕉茎叶资源的综合利用进行了深入研究,而对于香蕉残次果及香蕉花等副产物的研究相对较少。徐绍成[7]从香蕉茎叶中筛选得到一株产酸能力强的植物乳杆菌进行香蕉茎叶的青贮调制,明显改善了青贮饲料的品质。李志春等[8]从酸菜中分离得到具有耐温和耐酸特性的乳酸菌并将其添加到香蕉茎叶中,明显降低了茎叶饲料的单宁含量。冯焕德等[9]结合国内外研究进展阐述了香蕉副产物的营养价值及综合利用情况。广东海洋大学的薛晓宁等[10]以香蕉茎叶为原料,配合不同添加剂发明出一种发酵饲料的加工方法。针对以上现状,本研究从香蕉残次果及其香蕉花上筛选出优良特性的乳酸菌,并对筛选菌株进行生理生化特性及分子生物学鉴定,将之运用到残次果青贮饲料的调制加工中,既可以提高香蕉及其副产物的附加值,又可以避免浪费自然资源,具有十分重要的现实意义。
1 材料与方法
1.1 材料与试剂
香蕉残次果与香蕉花:采集于海南省五指山地区。
营养琼脂(nutrition agar,NA)培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:东京日水制药株式会社;MRS肉汤、MRS固体培养基:广东环凯微生物科技有限公司;Marker DL2000:北京六合华大基因科技有限公司。
1.2 仪器与设备
MDF-382E(N)超低温冰箱:日本三洋电机株式会社;SKP-01电热恒温培养箱:湖北省黄石恒丰医疗器械有限公司;YM50FGN全自动高压蒸汽灭菌锅:上海沪誉贸易有限公司;SW-CJ-IFD超净工作台:苏州佳宝净化设备有限公司;SPX-250B-Z生化培养箱:上海博迅实业有限公司医疗设备厂;UV-1100紫外分光光度计:上海美谱达仪器有限公司;PHS-3E型pH计:上海雷磁仪器厂;WD-9403C紫外可见分析仪、DYY-8C型电泳仪:北京市六一仪器厂;A300基因扩增仪:杭州朗基科学仪器有限公司。
1.3 方法
1.3.1 样品附着微生物的菌群分析
样品切碎,利用四分法均匀称取10 g样品置于90 mL灭菌的生理盐水中进行10倍梯度稀释至10-7。选取10-3、10-5、10-7三个不同梯度的样品稀释液,分别吸取0.1 mL依次涂布于NA培养基、PDA培养基和MRS培养基上进行好氧细菌、霉菌、酵母菌、乳酸菌菌群的菌落计数[11]。再选取10-1、10-2两个梯度稀释液置于水浴锅中,水浴条件为:75℃,15 min,水浴后吸取0.1mL涂布于NA培养基进行芽孢杆菌的菌落计数。
1.3.2 乳酸菌的筛选及形态学观察
从1.3.1制备的稀释液中选取三个合适的梯度(10-4、10-5、10-6),各吸取0.1 mL涂布于已添加1.5%CaCO3的MRS固体培养基中,37℃恒温条件下厌氧培养48 h,待菌落长出后,挑选出明显具有碳酸钙溶解圈的单个菌落进行分离纯化[12]。纯化3代后,观察菌落形态特征,并对菌株进行革兰氏染色、油镜下观察菌体细胞形态、接触酶试验。将纯化好的菌株进行超低温(-80℃)保藏处理。
1.3.3 乳酸菌生理生化试验
从纯化的菌株中选取具有明显碳酸钙溶解圈、革兰氏染色阳性、接触酶试验阴性特征的疑似乳酸菌[13],进行明胶液化试验、硝酸盐还原试验、葡萄糖产气试验、吲哚试验、产硫化氢试验、耐温生长试验、耐盐生长试验以及耐酸生长试验等来确定乳酸菌属的分类[14-15]。
1.3.4 乳酸菌碳源发酵试验
根据生理生化试验鉴定结果,从中挑选符合乳酸菌生理生化特性的菌株进行单糖、二糖、多糖以及糖苷和糖醇类碳水化合物发酵试验来确定乳酸菌种的划分[16-17]。
1.3.5 乳酸菌的分子生物学鉴定
菌株DNA的提取以及聚合酶链反应(polymerase chain reaction,PCR)扩增产物的测序委托北京六合华大基因科技有限公司进行鉴定。菌株DNA的提取方法采用十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)法,再利用16S序列通用引物27f和1492R作为上下游引物对菌株的16S rDNA进行聚合酶链式反应(PCR)扩增。PCR扩增反应条件为:95℃预变性5 min,95℃变性30s,55℃退火30 s,72℃延伸1.5 min,循环35次,72℃延伸10 min[18]。PCR扩增产物经1.0%琼脂糖凝胶电泳检测,并在凝胶成像仪中进行观察。之后对PCR扩增产物进行3730测序。将测序结果通过美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)网站的BLAST与GenBank数据库中同源性最高的已知菌株进行序列比对分析,通过MEGA 5.1软件,使用非加权配对算数平均法(unweight pair-group methodusing the averageapproach,UPGMA)来构建系统发育树[19]。
1.3.6 优质特性乳酸菌的筛选
将已鉴定菌株的新鲜菌液按2%(V/V)接种量转接于MRS肉汤中,进行37℃恒温培养,每间隔2h取一次发酵液,测定不同菌株发酵液的pH值以及在波长620 nm条件下的吸光度值,来分别绘制产酸速率曲线和生长曲线[20]。并从中筛选出产酸量高、产酸速率快、生长能力强的菌株作为青贮饲料调制加工的优良微生物发酵剂。
1.3.7 数据处理
利用EXCEL、DPS15.0、Origin9、MEGA5.1软件进行数据处理。
2 结果与分析
2.1 样品附着微生物菌群分析
对样品附着的微生物进行菌落计数,结果如表1所示。由表1可知,微生物菌群中好氧细菌数量最多,乳酸菌和酵母菌次之,霉菌和芽孢杆菌极少。其中乳酸菌的数量达到103~104CFU/g,并且乳酸菌菌落附近的碳酸钙溶解圈面积较大,说明菌株的产酸能力较强,有利于后续乳酸菌的分离筛选。
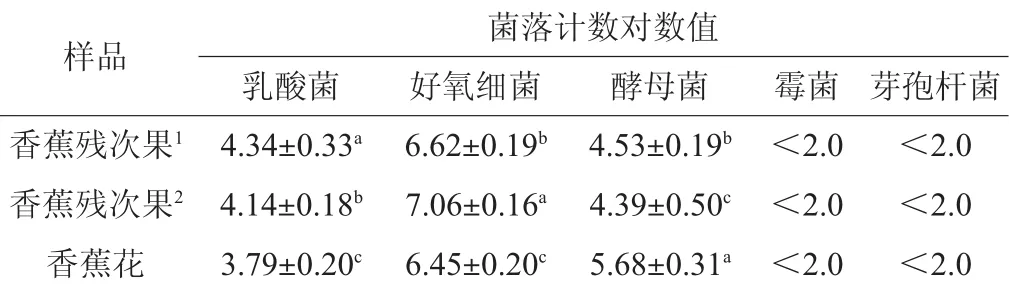
表1 不同微生物的菌落计数Table 1 Colony counting of different microorganisms
2.2 乳酸菌筛选结果及形态学观察
从样品中分离得到明显具有碳酸钙溶解圈、革兰氏染色显阳性、接触酶试验显阴性的疑似乳酸菌菌株共12株。其中从香蕉残次果上筛选出7株,编号为CG1、CG2、CG3、CG4、CG5、CG6、CG7。从香蕉花上筛选出4株,编号为CH1、CH2、CH3、CH4。由表2可知,所分离的菌落特征均为生长状态良好、边缘光滑整齐、中央凸起、乳白或浅乳白色、中小型球形菌落,符合乳酸菌菌落的特征。通过显微镜油镜观察细胞形态发现均为杆状,并以单杆或联对的方式排列,初步判定这12株菌为疑似乳酸菌。
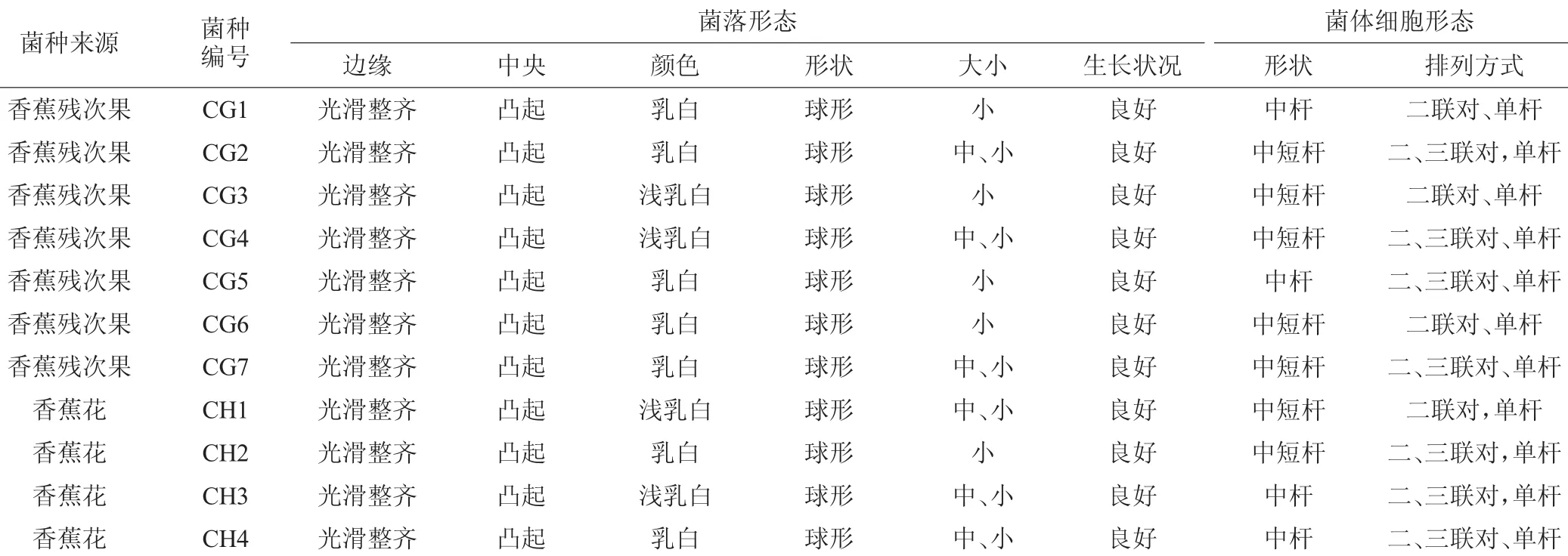
表2 菌株菌落形态及细胞形态Table 2 Colony morphology and cell morphology of strains
2.3 生理生化特征
将12株疑似乳酸菌进行生理生化鉴定,结果见表3。由表3可知,菌株CG1、CG5、CG7、CH2在接触酶试验、明胶液化试验、硝酸盐还原试验、吲哚试验、硫化氢产生试验、葡萄糖产气试验均呈现阴性,并且在10℃、45℃耐温生长试验、3.0%NaCl、6.5%NaCl耐盐生长试验、pH值为4.0耐酸生长试验中均呈现阳性[14-15]。初步判断这4株菌属于乳杆菌属(Lactobacillus),需要进一步通过碳源发酵试验来判断乳酸菌种的划分。

表3 菌株的生理生化特征Table 3 Physiological and biochemical characteristics of strains
2.4 碳源发酵分析
将菌株CG1、CG5、CG7、CH2进行碳源发酵分析,结果见表4。由表4可知,香蕉残次果上筛选的3株菌CG1、CG5、CG7与香蕉花上筛选的菌株CH2在发酵碳源方面无显著差异。这4株菌均能完全发酵大部分碳源,能完全发酵或微弱发酵阿拉伯糖、松三糖,微弱发酵木糖,但均不能发酵鼠李糖。结合乳酸菌分类鉴定的相关文献[13-14],将CG1、CG5、CG7、CH2 4株菌初步鉴定为植物乳杆菌,但还需要进一步通过分子生物学鉴定来确定最终的种类划分。

表4 菌株碳源发酵试验结果Table4 Results of carbon sources fermentation experiments of strains
2.5 分子生物学鉴定
2.5.1 菌株16S rDNA PCR扩增结果

图1 菌株16S rDNA的PCR扩增产物电泳图Fig.1 Electrophoretogram of 16S rDNA PCR amplification products of strains
将四株菌的16S rDNA序列通过PCR扩增后进行电泳检测,电泳条件:3 μL样品+1%琼脂糖凝胶[21]。图中Marker条带由下而上的大小依次为:100bp、250bp、500bp、750bp、1000bp、2000bp、3000bp、5000bp。检测结果如图1所示,4株菌PCR扩增片段长度均约为1 500 bp,说明PCR扩增成功,可以进行3730测序。
2.5.2 系统发育树的构建
将4株菌16S rDNA序列的测序结果利用NCBI网站的BLAST与GenBank数据库的标准菌株进行同源性比对,从中选择几株与测试菌株同源性比对最高的菌株,通过MEGA5.1软件,以UPGMA方法,将bootstraps值设定为1 000进行统计学重复检验来制作系统发育树[22],结果如图2所示。

图2 菌株系统发育树Fig.2 Phylogenetic tree of strains
由图2可知,4株菌中菌株CG1的BLAST结果显示,其与Lactobacillus plantarumSCP 49和Lactobacillus plantarum SCP 53两个标准菌株的同源性比对均为99%,结合其生理生化特性鉴定其为植物乳杆菌(Lactobacillus plantarum)。CG5、CG7、CH2三株菌均与其对应的标准菌株的同源性达到99%及以上,均鉴定为植物乳杆菌(Lactobacillusplantarum),进一步确认了分离出的乳酸菌的分类地位及其系统发育地位。
2.6 优质特性乳酸菌的筛选
对4株乳酸菌的产酸速率曲线和生长曲线进行测定,结果分别见图3及图4。由图3可知,4株乳酸菌从第4小时开始产酸量迅速增加,pH值下降明显,18 h左右逐步趋于稳定,平均pH值降至3.5~3.7,其中菌株CG1的pH值下降最明显,发酵后期的最终pH值也是最低,说明其产酸能力优于另外三株菌。结合图4的生长曲线可以看出,4株菌在4h后开始进入指数生长期,其中菌株CG1在4 h后的生长速度就明显高于另外三株菌,说明它的适应期相对较短,而且在整个指数生长期都呈现出快速生长的趋势。综合产酸速率曲线和生长曲线的对比结果,发现菌株CG1具有产酸能力强、产酸量高、生长速度快的优质特性,非常适合作为青贮饲料调制加工所使用的微生物发酵剂。

图3 菌株产酸曲线Fig.3 Acid production curve of strains

图4 菌株生长曲线Fig.4 Growth curves of strains
3 结论
以海南省五指山地区采集的香蕉残次果和香蕉花为原料,以传统分离方法得到12株杆状的革兰氏阳性菌。通过形态学观察、生理生化特性以及16S rDNA序列分析最终得到4株植物乳杆菌(Lactobacillus plantarum)。其中3株菌来源于香蕉残次果,其编号分别为CG1、CG5、CG7,另外1株菌来源于香蕉花,编号为CH2。
通过对4株乳酸菌产酸速率和生长速率的测定,发现菌株CG1具有产酸量高、产酸速度快、生长能力强、适应期短、可发酵多种碳源等优势,同时也具备耐高温、耐干旱等海南热带特征。综上所述,植物乳杆菌CG1非常适合用作香蕉残次果青贮饲料调制加工的优良微生物发酵剂。
[1]CAI Y M.Identification and characterization ofEnterococcusspecies isolated from forage crops and their influence on silage fermentation[J]. J Dairy Sci,1999,82(11):2466-2471.
[2]王晶,季海峰,王四新,等.饲用乳酸菌制剂的研究现状及在养猪生产中的应用[J].中国畜牧兽医,2010,37(3):38-40.
[3]王倩.香蕉茎秆生物饲料的研究[D].海口:海南大学,2013.
[4]张锡炎.香蕉枯萎病综合防控技术成效显著[J].世界热带农业信息,2016(8):54-55.
[5]杨志斌,朱湘林.海南香蕉产业的现状与前景[J].热带农业科学,2002,22(6):37-43.
[6]刘燕群,曾小红,方佳.海南香蕉产业风险及预警对策研究[J].安徽农业科学,2011,39(18):11354-11356.
[7]徐绍成.香蕉茎叶中乳酸菌的分离鉴定及运用[D].海口:海南大学,2010.
[8]李志春,游向荣,张雅媛,等.香蕉茎叶发酵生产青贮饲料乳酸菌的筛选[J].粮食与饲料工业,2014,12(1):42-45.
[9]冯焕德,谢子四,魏守兴,等.香蕉副产物综合利用研究进展[J].农学学报,2014,4(7):68-72.
[10]广东海洋大学.一种香蕉种植副产物发酵饲料及其加工方法,CN200910039573.4A[P].2010-09-15.
[11]中华人民共和国卫生部.GB 4789.2—2010食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2010.
[12]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986:72-98.
[13]布坎南RE,吉本斯,伯杰NE.伯杰细菌鉴定手册:第八版[M].北京:科学出版社,1984:797-828.
[14]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:117-127.
[15]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:370-398.
[16]YANG J S,TAN H S,CAI Y M.Characteristics of lactic acid bacteria isolates and their effect on silage fermentation of fruit residues[J].J Dairy Sci,2016,99(7):5325-5334.
[17]YANG J S,CAO Y,CAI Y M.Natural populations of lactic bacteria isolated from vegetable residues and silage fermentation[J].J Dairy Sci, 2010,93(7):3136-3145.
[18]金丹,蒋彩虹,蒋艾廷,等.塔城地区酸马奶中耐乙醇乳酸菌的筛选与鉴定[J].中国酿造,2017,36(3):44-48.
[19]冯沸,梅俊,李云飞.西藏灵菇中分离两株干酪乳杆菌及其益生特性比较研究[J].中国酿造,2016,35(6):35-39.
[20]刘飞.青贮饲料中优良乳酸菌的分离鉴定及其应用[D].哈尔滨:东北农业大学,2005.
[21]王昱敬,黄艾祥,刘雪英,等.德宏水牛乳饼中乳酸菌的分离鉴定及发酵性能研究[J].食品工业科技,2017,38(2):226-230.
[22]杜紫萱,卢士玲,王晓雯,等.新疆哈族奶酪中产蛋白酶非发酵剂乳酸菌的筛选及其系统发育分析[J].中国酿造,2016,35(5):20-24.
Screening and identification of lactic acid bacteria from defective banana fruit and banana flower
CUI Kunpeng1,TAN Haisheng2,YANG Jinsong1*,XI Enguang1,ZHANG Wanchang1,JU Xueli1,LI Xiaolei1,ZHANG Guihe1, ZHENG Yuanping1,CAI Jinhong1
(1.College of Food Science and Technology,Hainan University,Haikou 570228,China; 2.College of Materials and Chemical Engineering,Hainan University,Haikou 570228,China)
The 12 strains of suspected lactic acid bacteria were isolated from defective banana fruit and banana flower collected in Wuzhishan region of Hainan province.According to the physiological and biochemical characteristics and molecular biological identification,four strains were identified asLactobacillus plantarum,in which three strains CG1,CG5 and CG7 were isolated from the defective banana fruit and the strain CH2 was isolated from banana flower.Comparing the acid-production rate curve and the growth curve of four strains,results showed that the acid-production rate and growth rate of strain CG1 were obviously higher than other three strains(P<0.05).
defective banana fruit;banana flower;Lactobacillus plantarum;screening;identification
TS201.3
0254-5071(2017)07-0053-05
10.11882/j.issn.0254-5071.2017.07.012
2017-04-28
国家自然科学基金资助项目(31460621)
崔坤鹏(1992-),男,硕士研究生,研究方向为食品生物工程。
*通讯作者:杨劲松(1966-),女,教授,博士,研究方向为食品科学及食品微生物,农产品贮藏及加工。

