热激处理对草菇耐冷性的影响及对hsp90基因的诱导
黄金丽,赵 妍,辛苗苗,宋晓霞,陈明杰*
(1上海海洋大学食品学院,上海 201306;2上海市农业科学院食用菌研究所,上海市农业遗传育种重点开放实验室,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,上海 201403)
热激处理对草菇耐冷性的影响及对hsp90基因的诱导
黄金丽1,2,赵 妍2*,辛苗苗2,宋晓霞2,陈明杰1,2*
(1上海海洋大学食品学院,上海 201306;2上海市农业科学院食用菌研究所,上海市农业遗传育种重点开放实验室,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,上海 201403)
热激蛋白是生物体抵御逆境胁迫的重要蛋白,高温胁迫是诱导热激蛋白产生的重要因素,其中hsp90基因可以在高温诱导时大量产生。以草菇菌株V23和VH3为试验材料,首先观察了热激处理对低温胁迫后草菇菌丝恢复生长情况的影响,然后测定了经过热激处理再进行低温胁迫后草菇hsp90基因的表达量变化。研究结果显示:热激处理显著提高了V23与VH3的恢复生长速度,增加了草菇菌丝体中hsp90基因的表达量,有助于增强草菇对低温胁迫的耐受性。
草菇;热激;低温胁迫;hsp90;实时荧光定量PCR
草菇[Volvɑriellɑvolvɑceɑ(Bull.)Singer]是一种原产于中国热带、亚热带地区的美味食用菌,隶属于担子菌纲、伞菌目、光柄菇科、小包脚菇属,其菌丝体的最适生长温度为32—35℃[1]。由于草菇属高温菇种,其菌丝体或子实体在常规0—4℃的冷藏条件下便会出现低温自溶现象,表现为组织变软、液化、腐烂等[2]。草菇这种不耐低温的特性,严重影响了其菌种的低温保藏、子实体的采后贮藏与运输,阻碍了草菇产业的快速发展,因此对草菇低温应答机制的研究及其不耐低温特性的改良成为学者们十分关注的课题。
生物体在比正常生长温度高5℃以上的环境下生长时(即热激条件),大部分正常蛋白质的合成被抑制,而分子量8—110 kD的热激蛋白(Heat shock protein,Hsp)迅速地被诱导合成[3]。在真核生物中,根据热激蛋白分子量的大小可将其分为5个家族:smHsp(小分子量热激蛋白,15—30 kD)、Hsp60(约60 kD)、Hsp70(约70 kD)、Hsp90(约90 kD)、Hsp100(大于100 kD)[4]。按照热激蛋白的类型又可将其分为诱导型和组成型两类:诱导型Hsp主要在受到外界环境的刺激下被诱导表达,具有保护细胞的功能;组成型Hsp在正常生理状态下表达,与细胞的分化、发育密切相关。研究表明,真菌中Hsp的诱导合成有助于提高其耐热性[5-7],如Lindquist等[5]发现细胞内大量表达的Hsp104对酿酒酵母(Sɑcchɑromyces cerevisiɑe)的耐热性大幅度提高具有积极作用;金承涛等[6]通过研究认为,酿酒酵母耐热菌株HU-TY-1的强耐热性与Hsp72和Hsp84的组成性合成密切相关;李翠翠[7]的研究结果表明,真姬菇(Hypsizygusmɑrmoreus)Hsp70蛋白的异源表达,可显著提高大肠杆菌(Escherichiɑcoli)耐高温的能力。但是目前关于热激诱导真菌Hsp合成提高其抗冷性的研究尚未见报道,此类研究在植物中已取得阶段性的进展:如宫伟娜[8]的试验结果显示,紫茎泽兰(Agerɑtinɑɑdenophorɑ)的4个热激蛋白基因hsp17.6、hsp 60、hsp70及hsp 90在其幼苗茎、叶中的表达都受到热激的诱导,并且热激处理后紫茎泽兰对低温胁迫的抗性明显增强;Collins等[9]的研究指出,绿豆(Vignɑrɑdiɑtɑ)下胚轴经40℃热激处理3 h后诱导合成了9种Hsp,其中有两个蛋白(70 kD和79 kD)与热激诱导抗冷性增强有关,可减轻后续的冷胁迫(2.5℃)对细胞膜的损伤,并能有效降低电解质的渗漏;Lafuente等[10]将黄瓜(Cucumis sɑtivus)子叶置于37℃或42℃处理6 h诱导产生了5个Hsp,分子量分别为25 kD、38 kD、50 kD、70 kD和80 kD,这些Hsp的出现与其抗冷性的增强表现一致。
本试验在草菇全基因组测序的基础上,选取菌株V23和VH3为试验材料,拟研究热激处理对草菇耐冷性的影响,利用实时荧光定量PCR技术,比较了热激诱导后再进行低温处理不同时间的草菇菌丝体中hsp90基因表达量的变化情况,为深入开展草菇不耐低温特性的改良工作奠定了基础。
1 材料与方法
1.1 供试菌株与试剂
供试草菇菌株V23和VH3均由上海市农业科学院食用菌研究所菌种保藏中心提供。
马铃薯葡萄糖肉汤培养基购自碧迪医疗器械(上海)有限公司;Redzol试剂盒购自北京赛百盛生物技术有限公司;PrimeScriptTMRT reagent Kitwith gDNA Eraser、SYBR®Premix Ex TɑqTMⅡ购自TaKaRa公司;PCR产物纯化试剂盒、质粒小量制备试剂盒购自上海捷瑞生物工程有限公司;大肠杆菌感受态细胞Top10购自天根生化科技有限公司;AxyPrepTMDNA Gel Extraction Kit购自爱思进生物技术(杭州)有限公司;pGEM®-T Easy Vector System I、Tɑq DNA Polymerase in Storage Buffer B购自Promega公司;氯仿、异丙醇、乙醇等购自国药集团化学试剂有限公司;所用引物由上海捷瑞生物工程有限公司合成,测序由上海生工生物工程有限公司完成。
1.2 热激处理再进行低温胁迫后草菇菌丝恢复生长速度测定
在长满草菇菌丝的培养皿上均匀打孔,然后将菌块接种到新培养基的中央,静置于32℃培养箱内培养34 h,在菌丝长势均匀的地方进行第1次划线。划线后对培养皿进行40℃2 h的热激处理,然后再放在冰浴中处理2 h。将冰浴处理后的培养皿放在32℃继续培养,恢复生长24 h后进行第2次划线,记录并计算草菇菌丝的恢复生长速度。
1.3 热激处理再进行低温胁迫后草菇hsp90基因的荧光定量分析
1.3.1 草菇菌丝的处理与样品收集
将固体培养的V23和VH3菌丝用匀浆器打碎后接入到液体培养基中,置于32℃摇床中恒温培养4 d。将两菌株先进行40℃2 h的热激处理,然后放在0℃下分别处理0 h、2 h、4 h、6 h、8 h、10 h。采用灭菌的无纺布过滤,待无菌水冲洗后用灭菌滤纸吸干水分,将收集的菌丝放入液氮中迅速冷冻,并置于-80℃冰箱中保存备用。
1.3.2 草菇菌丝总RNA的提取与反转录
依照Redzol试剂盒说明书提取草菇菌丝的总RNA,并用DEPC预处理的水溶解,然后用1%琼脂糖凝胶电泳进行检测。采用PrimeScriptTMRT reagent Kitwith gDNA Eraser试剂盒,去除基因组DNA,并将其反转录为cDNA,置于-20℃保存备用。
1.3.3 目的片段的获取与标准品质粒的构建
在草菇全基因组序列信息中进行Blast搜索,获得hsp90基因的1 821个核苷酸编码区序列,并设计特异性引物(表1),交由上海捷瑞生物工程有限公司合成。以微管蛋白(Tubulin,Tub)基因作为内参基因,采用常规PCR扩增tub和hsp90基因片段。将合成的基因片段连接到T载体上,导入大肠杆菌中,构建real-time PCR试验的标准品质粒,质粒测序由上海生工生物工程股份有限公司完成。

表1 实时荧光定量PCR扩增引物Table 1 Prim ers used for real-tim e PCR
1.3.4 hsp90基因的荧光定量分析
将含有内参基因和目的基因的标准品质粒进行10倍稀释,依次获得5个梯度的标准品质粒溶液,然后在StepOne Plus荧光定量PCR仪上扩增,构建出标准曲线,并将所得数据按ΔΔCT法计算hsp90基因的相对表达量。实时荧光定量PCR的反应体系如表2所示,反应条件为:95℃预变性20 s,1个循环;95℃5 s,60℃15 s,72℃15 s,该过程进行40个循环。每组样品设置4个平行样品孔,并设置无菌ddH2O代替模板作为阴性对照。

表2 RT-PCR反应体系Table 2 Reaction system of real-time PCR
2 结果与分析
2.1 热激处理再进行低温胁迫后草菇菌丝恢复生长情况
经过热激处理再进行低温胁迫后草菇V23、VH3菌丝的恢复生长情况如图1所示,热激处理显著提高了草菇菌株低温胁迫后的恢复生长速度。与各自未进行40℃2 h热激处理的对照相比,经过热激处理的V23菌株恢复生长速度提高了26.2%,这种优势在VH3菌株中表现更为明显,经过热激处理的VH3菌株恢复生长速度提高了50.6%。

图1 热激处理再进行低温胁迫后草菇V23、VH3菌丝的恢复生长情况Fig.1 Recovery rate of V23 and VH3 strains growing for 24 h after being treated at 40℃for 2 h first and then at 0℃for 2 h
2.2 热激处理再进行低温胁迫后草菇hsp90基因的表达量变化
草菇hsp90基因扩增后的熔解曲线出现单一峰值(图2),表明hsp90基因扩增具有特异性,其相对定量的结果可信。低温胁迫下草菇V23、VH3的hsp90基因和tub基因经real-time PCR后得到CT值,然后采用ΔΔCT法计算hsp90基因的相对表达量(表3、表4),并比较了热激处理对草菇菌株耐低温性的影响。
2.2.1 热激处理再进行低温胁迫后V23菌株的hsp90基因表达量变化
由图3可知,未经40℃热激处理的草菇菌株V23在低温胁迫2 h时,hsp90基因相对表达量显著升高,约为对照组(V23,0 h)的1.76倍;低温胁迫4 h时,其相对表达量下降,仅为对照组(V23,0 h)的0.95倍;低温胁迫6 h时,其相对表达量回升至对照组(V23,0 h)的1.66倍;低温胁迫8 h、10 h时,其相对表达量连续下降。经40℃热激处理2 h后,草菇菌株V23的hsp90基因受到诱导大量表达,达到对照组(V23,0 h)的2.48倍;低温胁迫2 h时,hsp90基因相对表达量继续上升,是对照组(V23,0 h)的2.67倍;低温胁迫4 h时,其相对表达量显著降低,仅为对照组(V23,0 h)的0.87倍;低温胁迫6—10 h时,其相对表达量有所回升且较为稳定。经过40℃2 h热激处理后再进行低温胁迫与之前只受到低温胁迫相比,V23的hsp90基因相对表达量在低温胁迫前6 h内,其变化趋势基本一致,均呈现先上升后下降再上升的趋势;但在低温胁迫的0 h、2 h、8 h、10 h时,经40℃2 h热激的V23菌丝体中hsp90基因的相对表达量要显著高于未经热激处理的,表明热激处理有效提高了V23菌丝体中hsp90基因的相对表达量,有助于增强V23对低温胁迫的耐受能力。
图2 hsp90基因的熔解曲线Fig.2 M elt curve of hsp90 gene
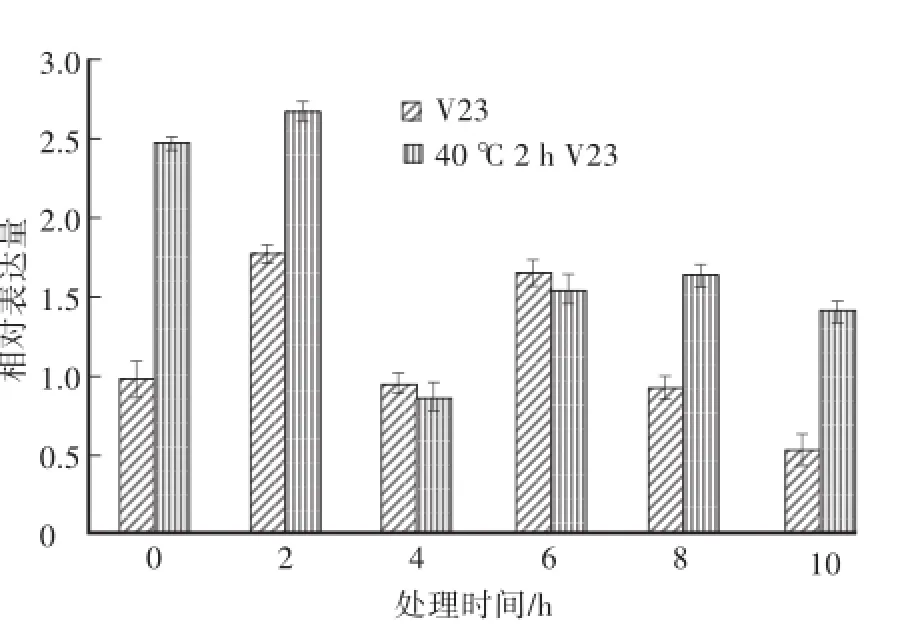
图3 低温处理不同时间下V23和40℃2 h V23中hsp90基因的表达量变化Fig.3 Relative expression of hsp90 gene during low tem perature process in m ycelia of V23 and 40℃2 h V23
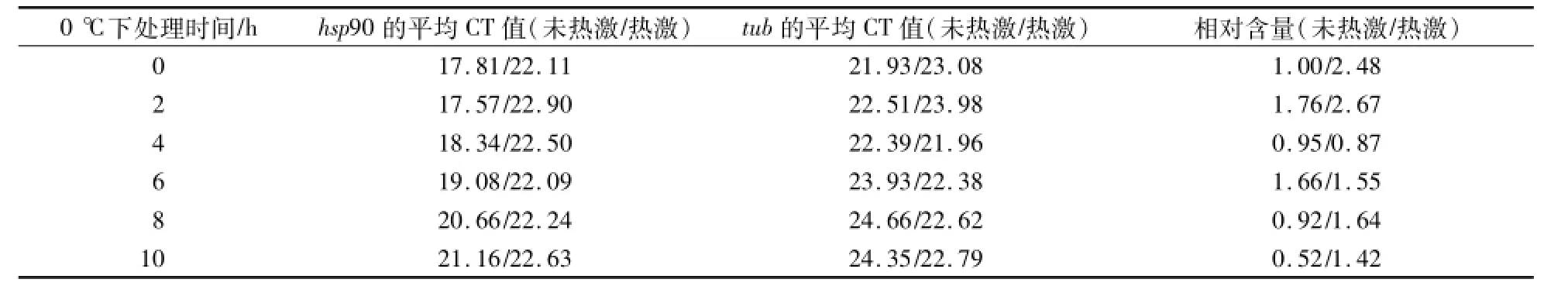
表3 低温处理下草菇V23菌丝中hsp90基因的相对表达量Table 3 Relative expression of hsp90 gene under low tem perature stress in mycelia of V23

表4 低温处理下草菇VH3菌丝中hsp90基因的相对表达量Table 4 Relative expression of hsp90 gene under low temperature stress in m ycelia of VH3
2.2.2 热激处理再进行低温胁迫后VH3菌株的hsp90基因表达量变化
未经40℃热激处理的草菇菌株VH3在低温胁迫2 h时,其hsp90基因相对表达量明显上升,为对照组(VH3,0 h)的1.81倍(图4);之后的低温胁迫4—8 h期间,其相对表达量逐渐降低;到低温胁迫10 h时,其相对表达量有所回升,达到对照组(VH3,0 h)的1.33倍。经40℃热激处理2 h后,在低温胁迫2 h、4 h时,草菇菌株VH3的hsp90基因相对表达量显著升高,分别达到对照组(VH3,0 h)的1.42倍和1.76倍;在随后的低温胁迫期间,hsp90基因的相对表达量逐渐降低。经过40℃2 h热激处理后再进行低温胁迫与之前只受到低温胁迫相比,VH3的hsp90基因的相对表达量变化趋势基本一致,均呈现出先升高再降低的趋势;但在低温胁迫4—8 h期间,经40℃2 h热激的VH3菌丝体中hsp90基因的相对表达量要显著高于未经热激处理的,表明热激处理增加了VH3菌丝体中hsp90基因的转录表达量,在一定程度上改善了VH3抵御低温胁迫的能力。
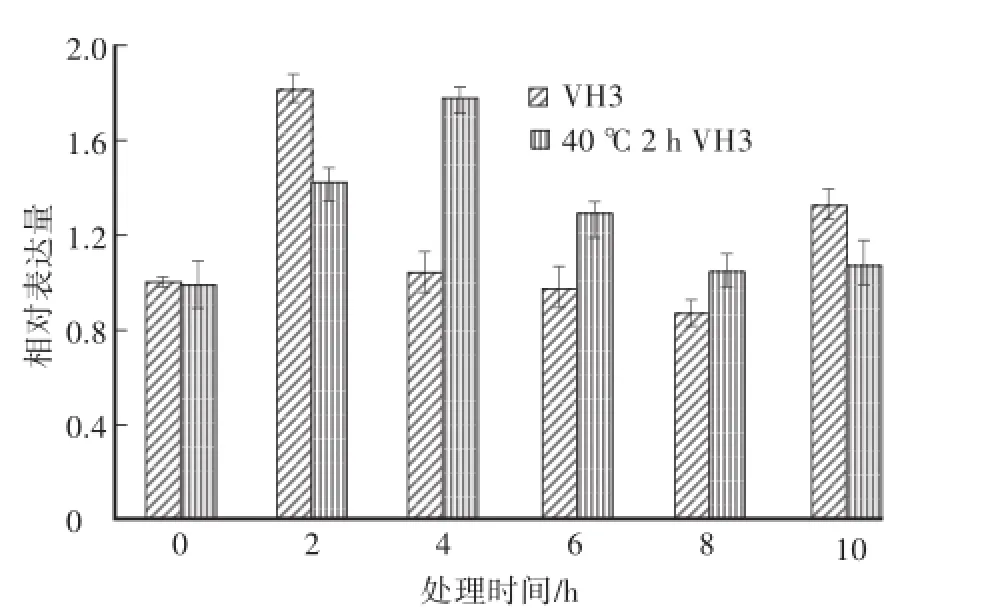
图4 低温处理不同时间下VH3和40℃2 h VH3中hsp90基因的表达量变化Fig.4 Relative expression of hsp90 gene during low tem perature process in m ycelia of VH3 and 40℃2 h VH3
3 结论与讨论
Hsp90是真核生物细胞质中表达量最丰富的蛋白质之一,在细胞的基本代谢活动中具有重要的作用[11-12]。Hsp90是一种受ATP调节的二聚体分子伴侣,结构较为保守,存在3个主要的结构域,即N端高度保守的ATPase结构域、中间结构域和介导Hsp90二聚化的C端结构域,在与底物蛋白的相互作用中这3个结构域均有参与[13]。在正常生理状态下,Hsp90以同源二聚体形式存在,细胞蛋白的折叠也并不需要Hsp90的参与;在逆境胁迫条件下,包括hsp90在内的很多热激蛋白基因大量瞬时表达[14-15],促使损伤蛋白进行修复。热激蛋白基因的表达受热激因子(Heat Shock Factor,HSF)调控,而位于hsp基因启动子上的热激元件(Heat Shock Element,HSE)是HSF的结合位点。在正常生理条件下,HSF以单体形式与Hsp90二聚体相结合;在胁迫环境下,Hsp与HSF分离去处理变形蛋白,激活的HSF结构发生变化,转化为三聚体形式紧密结合于HSE元件上,从而启动诱导hsp基因的转录[16-17]。研究表明,植物hsp90的转录表达受各种逆境胁迫的诱导。在受到热、盐和重金属胁迫后,拟南芥(Arɑbidopsis thɑliɑnɑ)的hsp90基因表达量显著增加[18-19];水稻(Oryzɑsɑtivɑ)的hsp90基因在受到盐、干旱、低温和ABA的诱导后也出现大量积累[20]。
本研究首先观察了热激处理对低温胁迫后草菇菌丝恢复生长情况的影响,发现经过40℃2 h热激处理后再进行低温胁迫与之前只受到低温胁迫相比,热激处理显著提高了草菇菌株V23与VH3的恢复生长速度,分别较各自的对照增加了26.2%和50.6%。随后,对热激处理再进行低温胁迫后草菇hsp90基因的表达量变化进行了分析,结果显示:在低温胁迫的0 h、2 h、8 h、10 h时,经40℃2 h热激的V23菌丝体中hsp90基因的相对表达量要显著高于未经热激处理的;同样在低温胁迫4—8 h期间,经40℃2 h热激的VH3菌丝体中hsp90基因的相对表达量也要显著高于未经热激处理的。这些研究结果表明,热激处理诱导了草菇菌丝体中hsp90基因的大量表达,有助于增强草菇对低温胁迫的抵御能力,这与在植物中的相关研究结果相一致。因此,本研究表明热激处理能够增加hsp90基因的表达量,有助于提高草菇的耐低温能力,但其具体作用机制还有待于进一步探讨。
[1]邓优锦,朱坚,谢宝贵.图说草菇栽培关键技术[M].北京:中国农业出版社,2011.
[2]乔娜,汪虹,陈明杰.草菇冷诱导基因Cor4在低温下表达变化的研究[J].上海农业学报,2009,25(1):14-17.
[3]LINDQUIST S,CRAIG E A.The heat shock proteins[J].Annu Rev Genet,1988,22:631-637.
[4]VIERLING E.The roles of heat shock proteins in plants[J].Annu Rev Plant Physiol Plant Mol Biol,1991,42:579-620.
[5]LINDQUIST S,KIM G.Heatshock protein 104 expression is sufficient for thermotolerance in yeast[J].Proc Natl Acad Sci USA,1996,93(11):5301-5306.
[6]金承涛,曾云中,吴雪昌,等.耐热酵母菌株HU-TY-l的耐热机理初探[J].浙江大学学报,2001,28(6):676-681.
[7]李翠翠.真姬菇热激蛋白HmHSP70基因克隆及其原核表达分析[D].青岛:青岛农业大学,2009.
[8]宫伟娜.低温胁迫过程中入侵植物紫茎泽兰热激蛋白的作用[D].北京:中国农业科学院,2009.
[9]COLLINSG G,NIE X L,SALTVEITM E.Heat shock proteins and chilling sensitivity ofmung bean hypocotyls[J].JExp Bot,1995,46(7):795-802.
[10]LAFUENTEM T,BELVER A,GUYE M G,et al.Effect of temperature conditioning on chilling injury of cucumber cotyledons:possible role of abscisic acid and heat shock proteins[J].Plant Physiol,1991,95(2):443-449.
[11]TAIPALE M,JAROSZD F,LINDQUIST S.HSP90 at the hub of protein homeostasis:emergingmechanistic insights[J].Nat Rev Mol Cell Biol,2010,11:515-528.
[12]LIJ,BUCHNER J.Structure,function and regulation of the Hsp90 machinery[J].Biomed J,2013,36(3):106-117.
[13]TERASAWA K,MINAMIM,MINAMIY.Constantly updated knowledge of Hsp90[J].JBiochem,2005,137(4):443-447.
[14]PARK H S,JEONGW J,KIM E C,et al.Heat shock protein gene family of the Porphyrɑseriɑtɑand enhancement of heat stress tolerance by PsHSP70 in Chlɑmydomonɑs[J].Marine Biotechnology,2012,14(3):332-342.
[15]郭秀林,刘子会,赵会嶶,等.热锻炼和高温胁迫下冬小麦热激蛋白与抗氧化酶基因表达[J].华北农学报,2014,29(4):13-18.
[16]LOHMANN C,EGGERS-SCHUMACHER G,WUNDERLICH M,et al.Two different heat shock transcription factors regulate immediate early expression of stress genes in Arɑbidopsis[J].Mol GenetGenom,2004,271(1):11-21.
[17]RUTHERFORD S,HIRATE Y,SWALLA B J.The Hsp90 capacitor,developmental remodeling,and evolution:the robustness of gene networks and the curiousevolvability ofmetamorphosis[J].Crit Rev Biochem Mol Biol,2007,42(5):355-372.
[18]YABE N,TAKAHASHIT,KOMEDA Y.Analysis of tissue-specific expression of Arɑbidopsis thɑliɑnɑHSP90-family gene HSP81[J].Plant Cell Physiol,1994,35(8):1207-1219.
[19]MILIONID,HATZOPOULOSP.Genomic organization of hsp90 gene family in Arabidopsis[J].Plant Mol Biol,1997,35(6):955-961.
[20]PAREEK A,SINGLA S L,GROVER A.Immunological evidence for accumulation of two high-molecular-weight(104 and 90 kDa)HSPs in response to different stresses in rice and in response to high temperature stress in diverse plant genera[J].Plant Mol Biol,1995,29(2):293-301.
(责任编辑:张睿)
Effect of heat treatm ent on adaptation of Volvariella volvacea to low temperature stress and on relative expression of hsp90 gene
HUANG Jin-li1,2,ZHAO Yan2*,XIN Miao-miao2,SONG Xiao-xia2,CHEN Ming-jie1,2*
(1College of Food Science&Technology,Shɑnghɑi Oceɑn University,Shɑnghɑi201306,Chinɑ;2Institute of Edible Fungi,Shɑnghɑi Acɑdemy of Agriculturɑl Sciences;Shɑnghɑi Key Lɑborɑtory of Agriculturɑl Genetics ɑnd Breeding;Key Lɑborɑtory of Edible Fungi Resourcesɑnd Utilizɑtion(South),Ministry of Agriculture,P.R.Chinɑ;Nɑtionɑl Engineering Reseɑrch Center of Edible Fungi,Shɑnghɑi201403,Chinɑ)
Heat shock proteins(HSPs)protect against cellular damage caused by environmental stress. Hsp90 is one of the HSPs,which are often induced by heat treatment.This experimentwas conducted with the mycelia of two Volvɑriellɑvolvɑceɑstrains V23 and VH3.The effect of heat treatment on recovery rate of the two strains growing for 24 h was observed.Relative expression of hsp90 gene under low temperature stress inmycelia of V23 and VH3 after being treated at40℃for 2 h was alsomeasured.The results showed that heat treatment speeded up the recovery rate of V23 and VH3 and increased the relative expression of hsp90 gene under low temperature stress.All these results suggested that heat treatment could be helpful for the adaptation of V. volvɑceɑto low temperature stress.
Volvɑriellɑvolvɑceɑ;Heat treatment;Low temperature stress;hsp90;Real-time PCR
S646.13
A
1000-3924(2017)01-015-06
2016-04-11
上海市科技兴农重点攻关项目应用基础类(沪农科攻字2014第7-1-5号);国家自然科学基金项目(31301828)作者简介:黄金丽(1989—),女,硕士,研究方向:食用菌功能基因
*通信作者,赵妍(1981—),女,博士,副研究员,研究方向:食用菌功能基因与生理生化。E-mail:jiandan289@126.com
陈明杰(1965—),男,博士,研究员,研究方向:食用菌遗传育种与生理生化。E-mail:mjchen@saas.sh.cn

