基于SNP标记的黄瓜遗传多样性分析
姚丹青,楼坚锋,朱文莹,张微微,夏建明
(1上海市种子管理总站,上海 201103;2上海交通大学农业与生物学院,上海200240;3上海农林职业技术学校,上海 201699)
基于SNP标记的黄瓜遗传多样性分析
姚丹青1,楼坚锋1,朱文莹2,张微微3,夏建明1
(1上海市种子管理总站,上海 201103;2上海交通大学农业与生物学院,上海200240;3上海农林职业技术学校,上海 201699)
通过查询NCBI、葫芦科基因组网站数据库获得42个黄瓜候选SNP位点。应用高分辨率溶解曲线技术对71个市售黄瓜品种进行SNP位点筛选,并通过焦磷酸测序进行SNP基因分型分析,探索SNP标记在黄瓜品种鉴定中的应用前景。结果表明:42个SNP位点中有30个位点的多态信息量为0.027—0.528,平均为0.247;71个黄瓜品种两两间的遗传相似系数分布在0.4032—0.9839,即30个SNP位点的基因分型数据信息可以将71份黄瓜品种区分开。
黄瓜;遗传多样性;SNP标记;高分辨率溶解曲线;焦磷酸测序
黄瓜(Cucumis sɑtivus L.)是我国重要的蔬菜作物之一。据不完全统计,1990—2011年文献报道的黄瓜品种约238个,其中1990—2000年有125个品种(含常规种16个),2001—2011年有113个品种(均为杂交种)。对现有黄瓜品种的遗传多样性进行分析,可以客观、全面地了解当前黄瓜育种的现状和种质基础[1]。
近年来,分子标记技术的应用大大促进了植物遗传学研究的发展。从早期的利用同工酶标记、RAPD、RFLP、AFLP等技术,到现在常用的SRAP、SSR标记,国内外学者已相继开展了中国黄瓜种质资源遗传多样性及其亲缘关系的研究[2-5]。在多种分子标记技术中,单核苷酸多态性标记(Single nucleotide polymorphisms,SNP)得到了越来越多研究者的关注。SNP标记是指基因组DNA序列中由于单个核苷酸替换或者较短片段的插入、缺失所引起的多态性[6],它以其二态易于分型、遗传稳定性高、密度高、易于实现自动化检测分析等优点成为继扩增片段长度多态性(AFLP)、微卫星(SSR)之后新一代的分子标记[7]。目前,SNP标记应用在黄瓜遗传多样性上的研究甚少。
SNP能够广泛用于遗传多样性研究,这对于资源保护、种质利用均有重要意义。Tanya等[8]对20对SSR引物和4对SNP引物的产物进行了分析,结果表明,两种引物的PCR产物的多态性不相同,但发现二者的聚类分析结果是相近的,这说明SNP对物种的遗传多样性分析较适用。吴金锋等[9]对480份甘蓝型油菜进行SNP与SSR遗传多样性分析,挑选出的3 900个SNP位点以及70个SSR位点可用于480份甘蓝型油菜种质资源的群体结构分析和主成分分析,结果表明,该群体可分为3个生态类型。王俊等[10]对枇杷‘大五星’和‘龙泉1号’三倍体不同单株及其二倍体(46份)的候选基因进行SNP分析,发现不同单株枇杷种质之间存在较为丰富的遗传多样性,可利用筛选出的SNP标记进行遗传多样性分析。王佳媛等[11]以野生凹叶木兰为材料,利用SNP标记进行了29份凹叶木兰的遗传多样性分析,结果表明,采自两个不同居群的凹叶木兰具有较高的遗传多样性,为后续其保护政策的制定提供了参考。
本研究通过查询NCBI(http://www.ncbi.nlm.nih.gov/)、葫芦科基因组网站(CuGenDB,http://www. icugi.org/cgi-bin/ICuGI/index.cgi)数据库,在7对染色体上平均选取42个黄瓜候选SNP位点,对71个市售黄瓜品种进行SNP基因分型分析,旨在通过筛选出的SNP标记进行遗传多样性分析。
1 材料与方法
1.1 试验材料
选用市售的71份黄瓜杂交品种作为试验材料,其详细特征见表1。
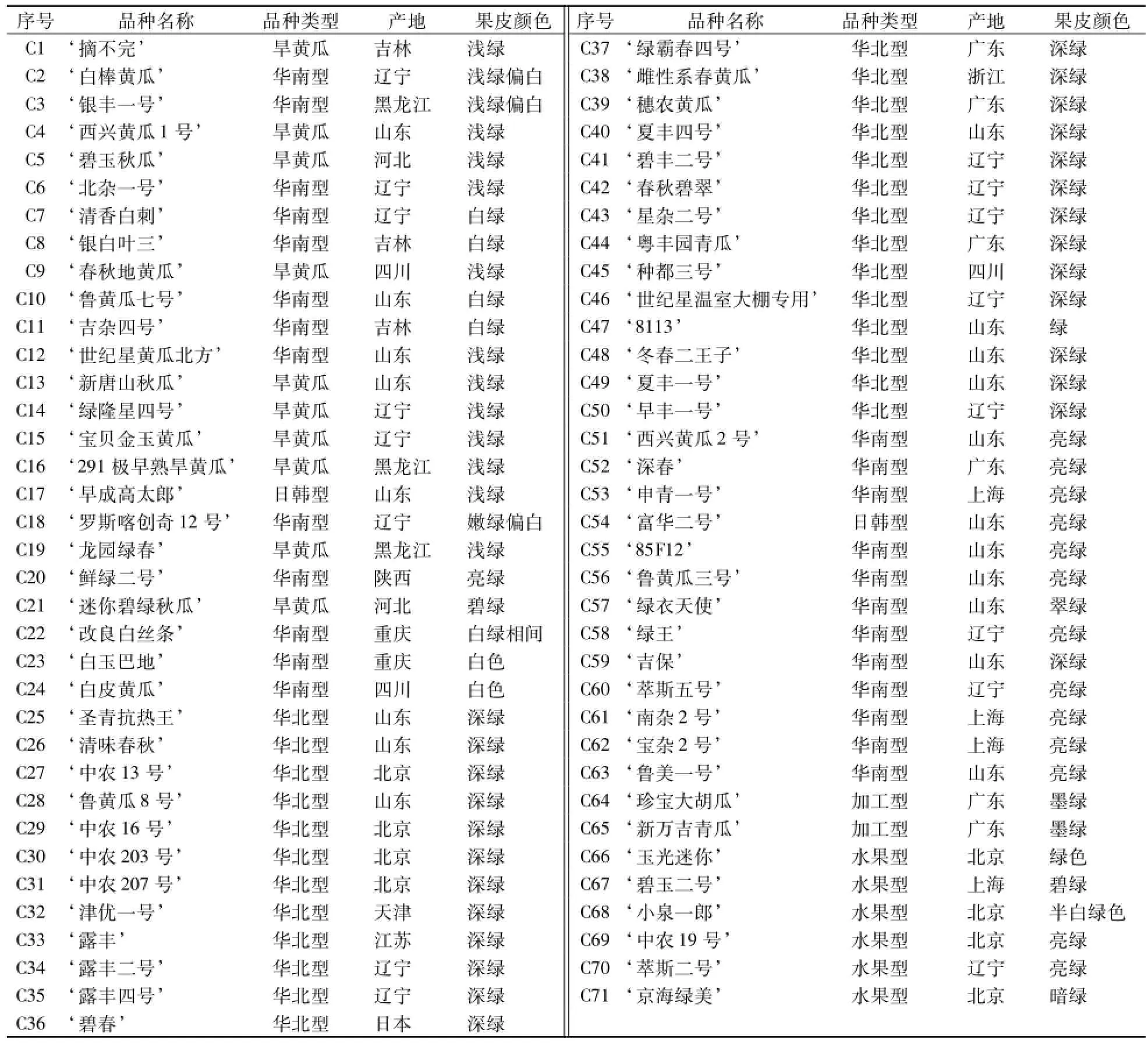
表1 市售黄瓜品种来源及特征特性Table 1 Source and characteristics of commercial available cucumber varieties
1.2 DNA提取
71个市售黄瓜品种每个品种取子叶,液氮冷冻研磨,加入CTAB裂解缓冲液(20 g/L CTAB,1.4 mol/L NaCl,0.1 mol/L Tris-HCl,20 mmol/L Na2EDTA)750μL,65℃恒温水浴裂解1 h,后续DNA提取纯化按树脂型基因组DNA提纯试剂盒操作进行。提取的DNA取2μL样品于Nanodrop 2000 C微量分光光度计上进行DNA浓度和纯度的检测。DNA提取后浓度统一稀释至90 ng/μL。
1.3 引物设计及合成
通过查询NCBI(http://www.ncbi.nlm.nih.gov/)、葫芦科基因组网站(CuGenDB,http://www.icugi.org/ cgi-bin/ICuGI/index.cgi)数据库选取42个候选SNP位点,平均分布在黄瓜7对染色体上。高分辨率溶解曲线检测(HRM)和焦磷酸测序引物使用软件PyroMark Assay Design 2.0设计,引物由上海生工生物工程有限公司合成,上下游引物纯化级别为HAP,测序引物纯化级别为ULTRAPAGE。
1.4 高分辨率溶解曲线(HRM)检测
HRM检测在Qiagen real-time PCR system上进行。PCR扩增采用20μL反应体系,其中10×Taq buffer 2μL,25 mmol/L Mg2+2.2μL,10 mmol/L dNTP mix 0.6μL,上下游引物(10μmol/L)各0.2μL,DNA模板(90 ng/μL)2μL,5 U/μL Taq Ploymerase 0.4μL,20×Evagreen(Biotium Corporation)1μL,双蒸水补足20μL。
反应程序为95℃预变性5 min;95℃30 s,58℃30 s,72℃20 s(35个循环);降温至65℃,并逐步上升至85℃。
1.5 SNP位点的分型验证
针对HRM筛选得到的SNP位点,设计引物(PyroMark Assay Design 2.0软件),包括PCR正向引物PCR-F、反向引物PCR-R和测序引物Sequencing primer,用于制备测序反应模板的PCR扩增和焦磷酸测序反应。其中Biotin-为生物素标记修饰。引物由上海生工生物工程有限公司合成,普通引物纯化级别为HAP级,生物素标记引物纯化级别为HPLC级,测序引物纯化级别为ULTRAPAGE级。
PCR扩增采用50μL反应体系,其中10×Taq buffer 5μL,25 mmol/LMg2+5μL,10 mmol/L dNTPmix 1μL,上下游引物(10μmol/L)各1μL,DNA模板(90 ng/μL)2μL,5 U/μLTaq Ploymerase1μL,双蒸水补足50μL。
反应程序为94℃预变性5 min;94℃30 s,58℃30 s,72℃40 s(50个循环);72℃延伸5 min,4℃保存。
焦磷酸测序反应在PyroMark ID焦磷酸测序仪(Qiagen)上进行。配置Binding buffer(40μL)和Sepharoe beads(2μL)的Mix 80μL体系,加入30μL PCR产物,1 300 r/min涡旋混匀15 min,使得beads与生物素结合;经Vacuum prep workstation单链分离,释放到预先加入38μL Annealing buffer和2μL测序引物(10μmol/L)的PSQ 96测序反应板中,80℃金属加热块(Labnet)上加热2—5 min后冷却至室温。将酶、底物和A、T、C、G成分加入试剂仓,即可上机测序。测序结果可通过分型分析模式(Genotyping)直接获得样品SNP类型。
1.6 数据分析
对SNP位点的等位基因频率、基因型频率数据进行统计分析,多态信息量PIC值使用PIC_CALC软件进行计算。利用NTSYS-pc(Version 2.10)软件中的SIMQUAL程序计算遗传相似系数,并获得相似系数矩阵,再用其中的SAHN程序和UPGMA方法进行聚类分析,最后通过Tree plot程序生成聚类图。
2 结果与分析
2.1 42个候选位点HRM扫描分析
分别用42对引物对71个黄瓜品种材料进行PCR扩增及HRM扫描分析。通过标准视图(图1a和图2a)和差异视图(图1b和图2b)显示,71个黄瓜品种中含有候选SNP位点的3种变异类型。通过HRM共筛选出30对多态性较好的SNP引物(表2)。
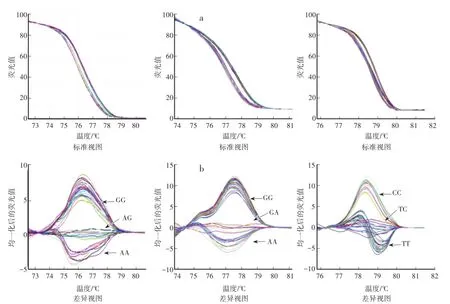
图1 Chr0106位点(左)、Chr0205位点(中)、Chr0303位点(右)HRM分析结果Fig.1 HRM analysis results of Chr0106,Chr0205,Chr0303 SNP sites
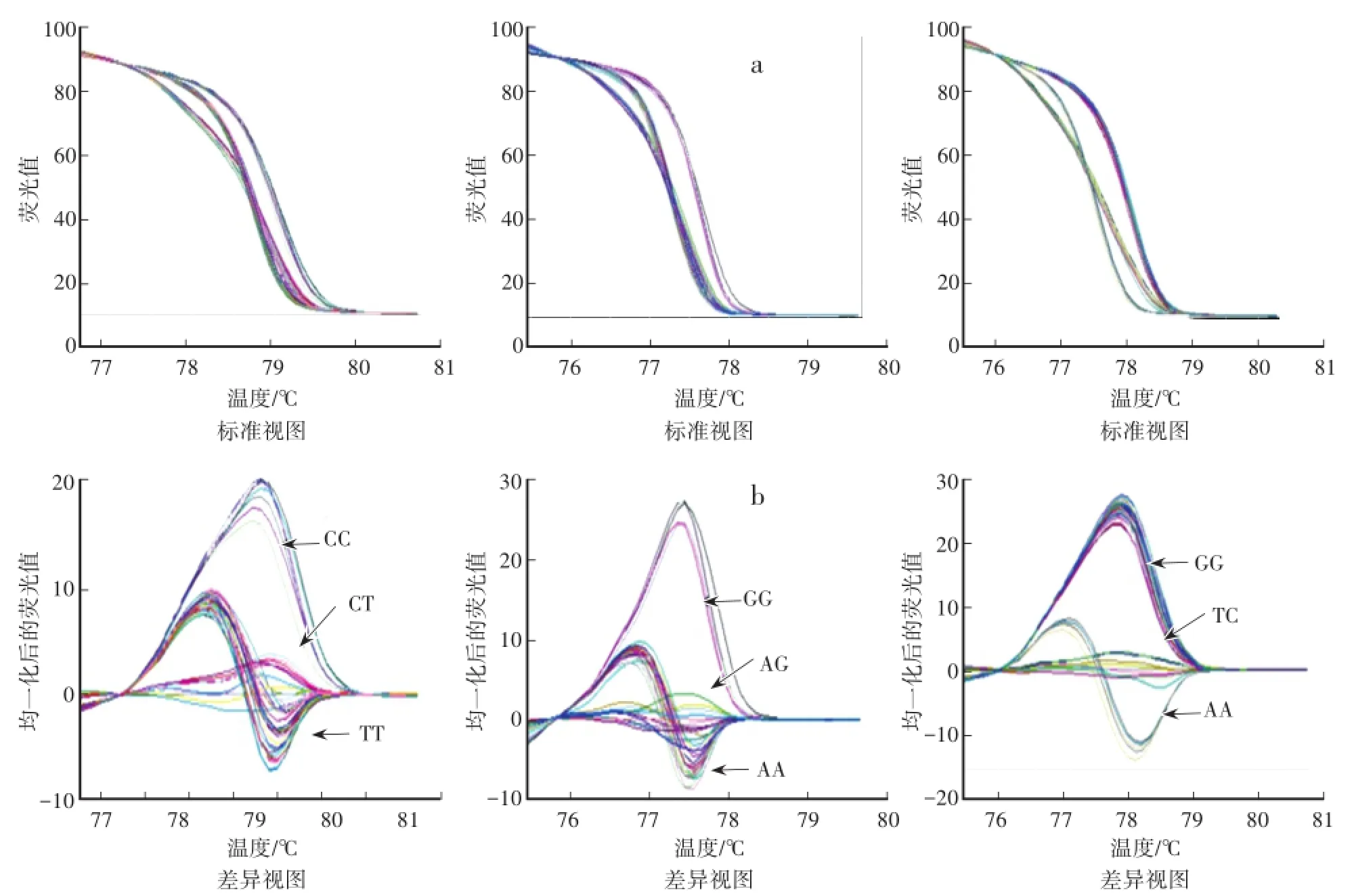
图2 Chr0505位点(左)、Chr0602位点(中)、Chr0703位点(右)HRM分析结果Fig.2 HRM analysis results of Chr0505,Chr0602,Chr0703 SNP sites

表2 筛选出的30对引物的SNP位点类型及焦磷酸测序引物序列Table 2 The genotype,pyrosequencing primers of 30 SNP sites screened out by 30 pairs of primers

(续表2)

(续表2)
2.2 30个SNP位点的分型确定
根据HRM扫描结果,对上述30个候选SNP位点的不同碱基变异类型进行PCR扩增和焦磷酸测序,确认SNP分型类型。测序结果显示,不同SNP分型的碱基序列不同,与预期序列相符(图3,图4),且结果与HRM筛选结果中变异类型分组相一致。
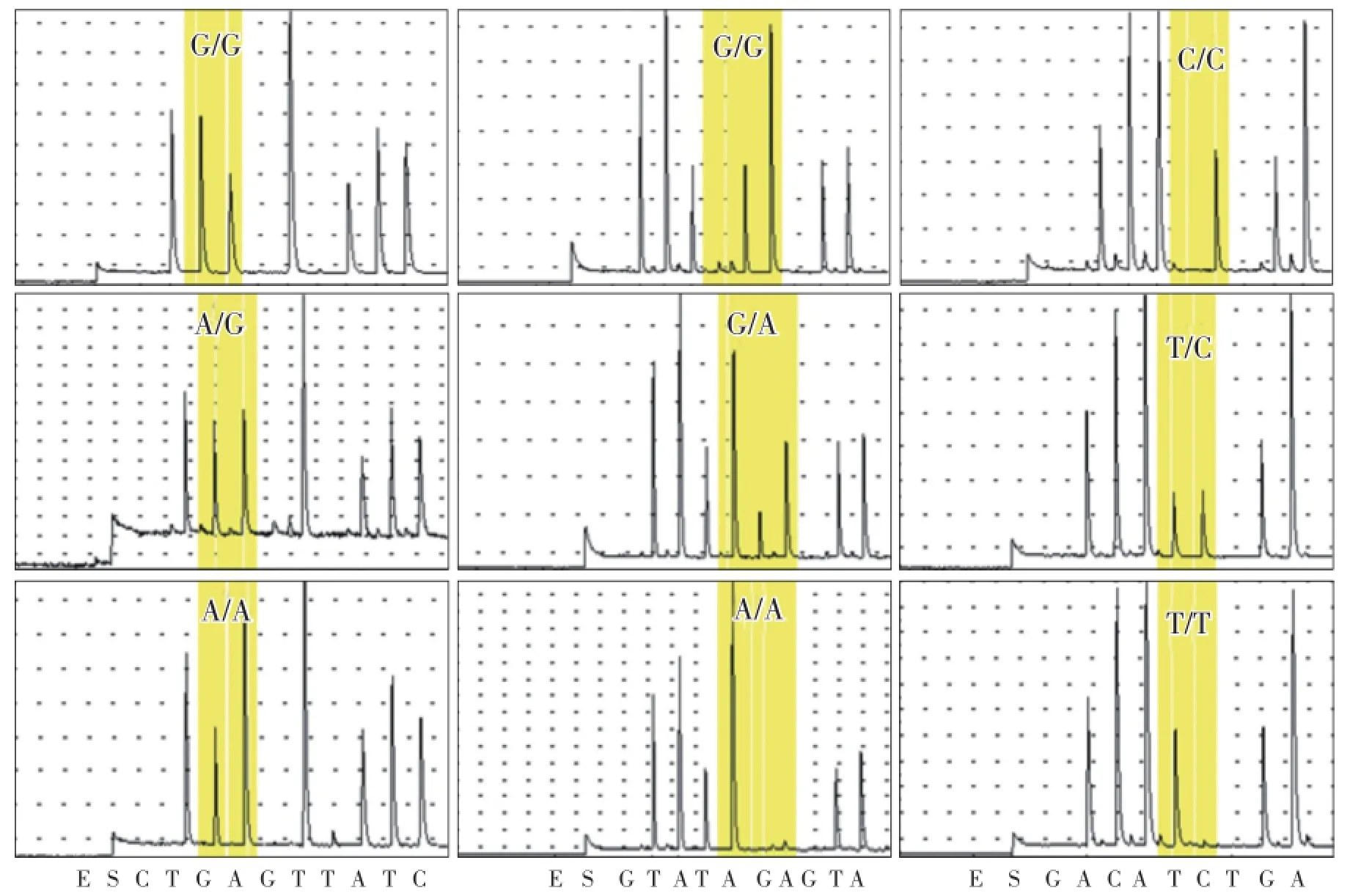
图3 Chr0106位点(左)、Chr0205位点(中)、Chr0303位点(右)焦磷酸测序验证Fig.3 The results of pyroseqencing for Chr0106,Chr0205,Chr0303 SNP sites
2.3 30个SNP位点的PIC值分析
根据30个SNP位点的基因分型结果,分析30个位点在71个市售黄瓜品种材料中的等位基因频率、基因型频率和多态信息量,结果显示(表3):30个SNP位点的PIC值在0.027—0.528,Chr0303位点的PIC值高达0.528,处于高度多态;Chr0105、Chr0106、Chr0108、Chr0203、Chr0205、Chr0206、Chr0501、Chr0505、Chr0506、Chr0602、Chr0703位点的PIC值处于中度多态。
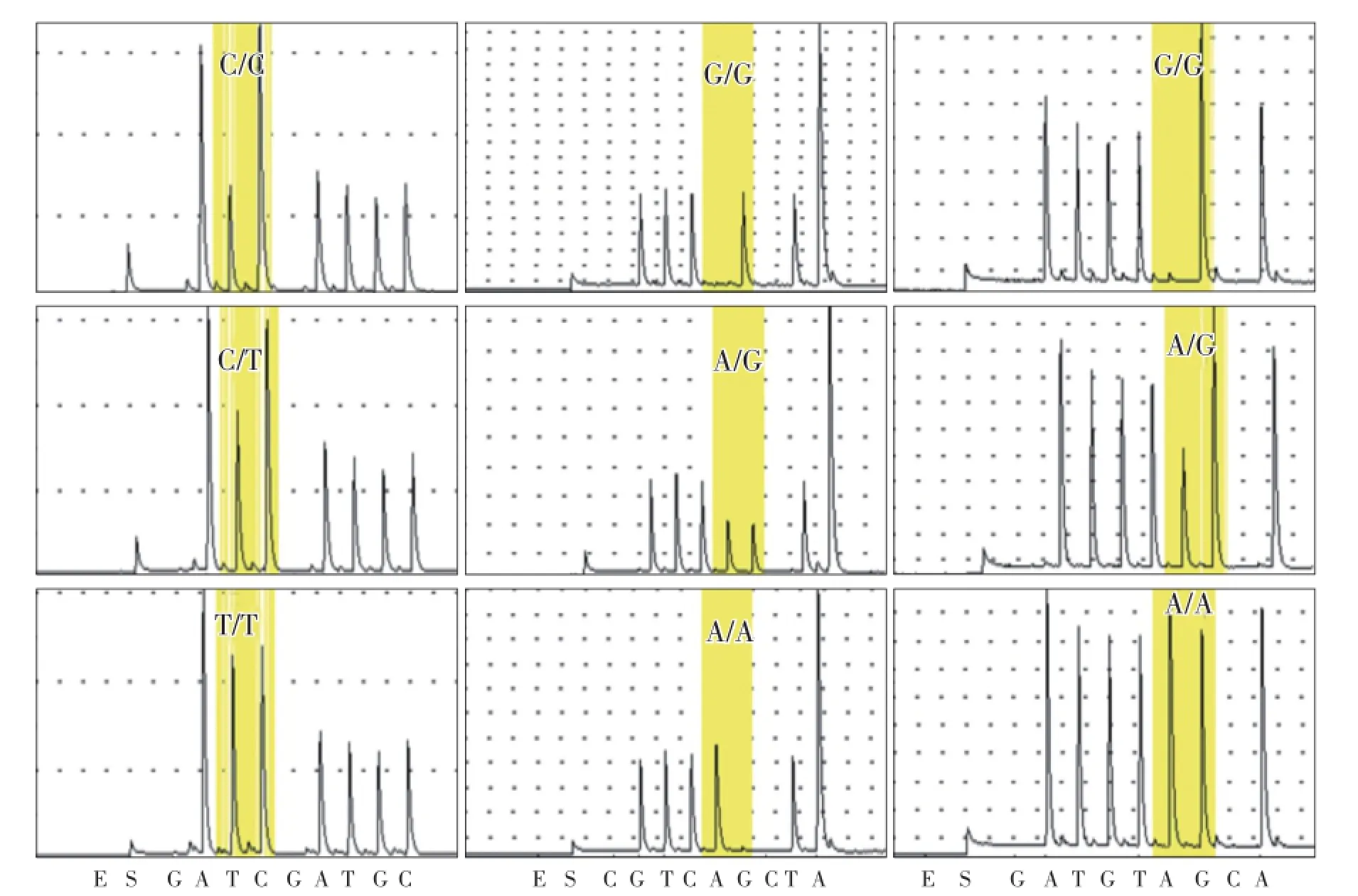
图4 Chr0505位点(左)、Chr0602位点(中)、Chr0703位点(右)焦磷酸测序验证Fig.4 The results of pyroseqencing for Chr0505,Chr0602,Chr0703 SNP sites
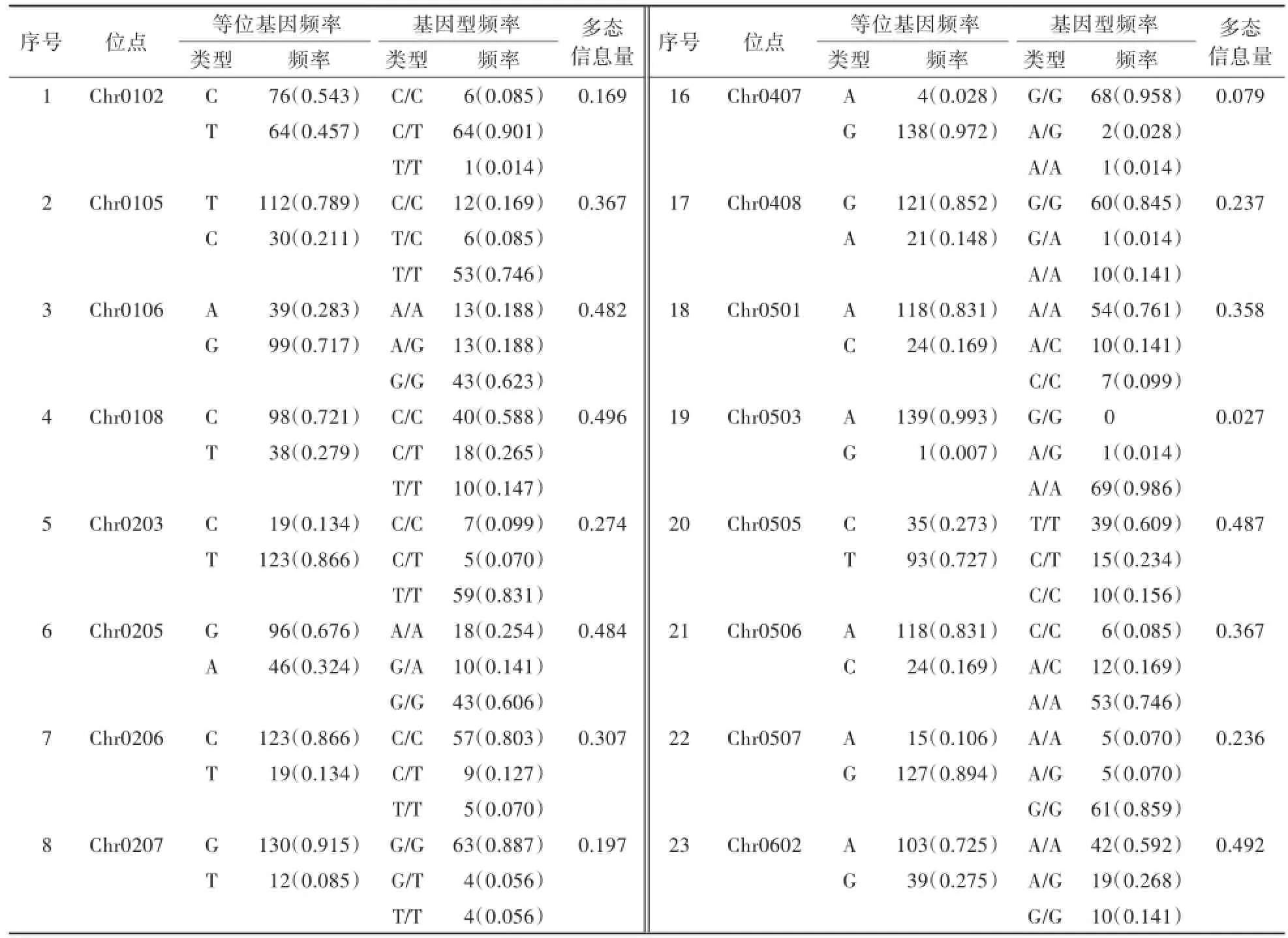
表3 SNP位点频率、多态信息量分析结果Table 3 Analysis of allele frequency,genotype frequency and polymorphism information content

(续表3)
2.4 遗传多样性分析

图5 71份市售黄瓜品种UPGM A聚类图Fig.5 The UPGMA clustering m ap of 71 cucum ber varieties
根据NTSYS软件的SIMQUAL程序计算的结果可知,71个黄瓜品种两两间的遗传相似系数分布在0.4032—0.9839。聚类分析结果(图5)显示,以0.55为阈值可以把71个黄瓜材料分为2个类群。第Ⅰ类群共65个品种,主要包括华北密刺型、旱黄瓜、华南型、日韩型这三大类型黄瓜。在0.82处,又可分为7个亚族(A、B、C、D、E、F、G)。A亚族主要包括华北密刺型、旱黄瓜和部分华南型黄瓜;在0.86处再进行细分,可将A亚族再分为6小类(a、b、c、d、e、f)。a类可分成3个小组(a1、a2、a3),a1包括30份黄瓜材料,主要为华北密刺型(棍棒状,果皮深绿色,瘤密,多白刺)和旱黄瓜类型(果实较短,果皮白绿色或浅绿,果瘤稀少,刺少),其中C50(果皮深绿,黑刺瘤稀疏)、C52和C58(亮绿色小型黄瓜,少刺光滑型)不同于其他材料。a2均为华南型和日韩型,果皮浅绿色,瘤稀少刺型;a3中的C64和C65均为加工型黄瓜,果皮墨绿色,产地均为广东;b类中C23为白皮黄瓜,其余2份材料C27和C30均为华北密刺型;c类仅有C71 1份材料,水果型黄瓜,光滑暗绿色;e类包括C7、C14、C18,均为旱黄瓜,果皮嫩绿偏白色,白刺;f类也仅包括C6一份材料,棒状,刺瘤少,果皮浅绿色。B亚族包括5份材料,均属于华南型黄瓜,少刺光滑型,果皮亮绿色。C亚族包括旱黄瓜(‘极早熟旱黄瓜291’‘龙园绿春’)和华南型黄瓜(‘宝杂2号’‘南杂2号’,产地均为上海)。D亚族包括2份材料,均为华南型黄瓜,产地均为山东,果皮绿色光滑,外形略相似。E亚族包括一份旱黄瓜材料C4和一份白皮黄瓜C24,以及一份华北密刺型黄瓜C31。F亚族为C22‘改良白丝条’,果皮白绿相间花纹。G亚族为水果型黄瓜C68‘小泉一郎’。第Ⅱ类群共6个品种,主要包括2个华南型材料(‘申青一号’‘萃斯五号’)和4个水果型黄瓜(‘中农19号’‘萃斯二号’‘碧玉二号’‘玉光迷你’)。
3 讨论
以往研究大都是利用黄瓜基因组SSR标记对黄瓜品种进行遗传多样性分析,而本研究是利用黄瓜SNP标记对71个市场上销售的黄瓜品种进行遗传多样性分析。本研究所用的SNP标记都是在现有的遗传图谱基础上,挑选均匀分布在7条染色体上的引物,并通过HRM筛选多态性较好的位点再进行SNP分型。因此,能够检测出不同品种的遗传多样性,可以更客观地反应不同生态型品种的信息差异。
从试验材料类型上看,本研究涵盖旱黄瓜、华北密刺型黄瓜、华南型黄瓜、日韩型黄瓜、白皮黄瓜、加工型黄瓜、欧洲型水果黄瓜等多种类型。研究结果表明,华北型和欧洲型的黄瓜分布相对集中,其他类型的分布比较宽广。前人研究表明,日本少刺型黄瓜与我国华南型黄瓜的亲缘关系较近,华南型黄瓜的遗传多样性较为丰富,在果皮颜色上有很大的差异,而我国特有的华北密刺型黄瓜则与其他类型黄瓜的亲缘关系较远[1]。从本研究聚类分析结果看,华北密刺型黄瓜主要集中在a1小组,只有少数旱黄瓜品种被聚类其中。a2小组中日韩型黄瓜与我国华南型黄瓜聚在一组,与前人研究结果一致,同样表明二者亲缘关系较近。另外,第Ⅱ类群中华南类型和水果型黄瓜被划在同一类群中,说明水果型和华南类型虽然在形态学存在一定的差异,但它们也有可能存在较近的亲缘关系。第Ⅱ类群中的‘申青一号’,其母本为欧洲型水果黄瓜‘戴多星’经连续6代自交选育出的全雌性自交系DS-2-1-2-1,父本为‘宝杂2号’5代自交选育出的B-2-2-1,因此‘申青一号’具有欧洲型黄瓜遗传背景,所以与水果型黄瓜的遗传距离较近,聚成一类。
黄瓜种质资源遗传差异较小,多样性水平较低,一方面利用现有资源,通过人工杂交,实现基因间相互参透,能够为拓宽黄瓜育种的遗传背景奠定基础;另一方面,从起源地大量引进资源对丰富我国黄瓜遗传背景和品种改良至关重要。目前,市场上同种多名现象较为突出,导致品种真实性问题较为严重,利用DNA分子标记技术,对种子真实性和纯度进行鉴定是目前最为有效的方法之一。
[1]苗晗,张圣平,顾兴芳,等.中国黄瓜主栽品种SSR遗传多样性分析及指纹图谱构建[J].植物遗传资源学报,2014,15(2):333-341.
[2]杨瑞环,陈德富,闵微,等.利用SSR标记分析黄瓜种质资源的遗传多样性[J].南开大学学报(自然科学版),2012,45(2):17-21.
[3]沈镝,方智远,戚春章,等.西双版纳黄瓜群体遗传多样性的SSR分析[J].园艺学报,2009,36(10):1457-1464.
[4]王惠哲,李淑菊,管炜.应用SRAP标记分析黄瓜的遗传差异[J].生物技术通报,2009(12):76-79.
[5]杨福强,李琳,李明远,等.中国刺瘤型黄瓜种质遗传多样性和亲缘关系的AFLP分析[J].西北农业学报,2009,18(6):205-211.
[6]邹喻苹,葛颂.新一代分子标记:SNPs及其应用[J].生物多样性,2003,11(5):370-382.
[7]LIU Z J,CORDES JF.DNA marker technologies and their app Iications in aquaculture genetics[1].Aquaculture,2004,238:1-37.
[8]TANYA P,SRINIVESP,TOOJINDA T,etal.Evaluation of Genetic Diversity among Soybean Genotypes Using SSR and SNP[J].Korean J. Crop Sci,2001,46(4):334-340.
[9]吴金锋.甘蓝型油菜SNP与SSR分析及耐旱性状的全基因组关联分析[D].北京:中国农业科学院,2014.
[10]王俊.枇杷(EriobotryɑjɑponicɑLindl.)SNP位点筛选及遗传多样性分析[D].重庆:西南大学,2013.
[11]王佳媛,吴传芳,唐亚.基于SNP分子标记的凹叶木兰遗传多样性初步研究[J].广西植物,2012,32(4):542-547.
(责任编辑:闫其涛)
Genetic diversity analysis of cucumber based on SNPmarkers
YAO Dan-qing1,LOU Jian-feng1,ZHUWen-ying2,ZHANGWei-wei3,XIA Jian-ming1
(1Shɑnghɑi Seed Mɑnɑgement Stɑtion,Shɑnghɑi201103,Chinɑ;2School of Agriculture&Biology,Shɑnghɑi Jiɑo Tong University,Shɑnghɑi200240,Chinɑ;3Shɑnghɑi Vocɑtionɑl College of Agricultureɑnd Forestry,Shɑnghɑi201699,Chinɑ)
Forty-two cucumber candidate single nucleotide polymorphism(SNP)loci were obtained by searching NCBI and genome database of gourd family.The SNP loci of 71 commercially available cucumber varieties were screened by high resolution melting(HRM),and the SNP genotyping was analyzed by pyrosequencing to explore the application prospect of SNPmarkers in cucumber cultivar identification.Results showed that the polymorphism information content(PIC)of 30 lociwere 0.027—0.528 in the 42 SNP loci,with an average of 0.247.The genetic similarity coefficient between any two samples was in 0.4032—0.9839. Namely,the genotyping data information of 30 SNP loci could separate the 71 cucumber varieties.
Cucumber;Genetic diversity;Single nucleotide polymorphism(SNP);High resolution melting(HRM);Pyrosequencing technology
S642.2
A
1000-3924(2017)01-021-10
2015-09-10
“十二五”国家863现代农业技术领域项目(2012AA100101);上海市科委重点科技攻关项目(12391901500);上海市科技兴农项目[沪农科攻字(2012)第2-1号]
姚丹青(1984—),女,硕士,农艺师,研究方向:分子植物育种和种子质量检验。E-mail:ydq_726@163.com

