草莓胶孢炭疽菌GPCRs超家族蛋白鉴定及生物信息学分析
张丽勍,段 可,邹小花,高清华
(上海市农业科学院林木果树研究所,上海市设施园艺技术重点实验室,上海 201403)
草莓胶孢炭疽菌GPCRs超家族蛋白鉴定及生物信息学分析
张丽勍,段 可,邹小花,高清华*
(上海市农业科学院林木果树研究所,上海市设施园艺技术重点实验室,上海 201403)
G蛋白偶联受体(G protein-coupled receptors,GPCRs)是广泛存在于生物体中的一类膜受体家族。基于粗糙脉孢菌典型GPCR蛋白氨基酸序列及其典型结构域对胶孢炭疽菌全基因组数据库进行比对分析,获得GPCRs超家族蛋白;对GPCRs超家族蛋白进行生物信息学分析。结果表明:胶孢炭疽菌中存在8个GPCR蛋白,其中碳源感应因子类有3个;类cAMP受体类有2个,信息素受体、氮源感应因子和真菌视蛋白类各1个。所有的GPCR都具有典型的7个跨膜结构域及较高比例的α-螺旋和无规则卷曲,且均不含信号肽序列。通过遗传关系比较分析发现,胶孢炭疽菌的8个GPCR蛋白聚类在一起,构成2个主要进化大分支和5个小分支,该聚类与其基于保守结构域的归属类别一致。本研究为进一步探究草莓胶孢炭疽菌GPCRs超家族成员的功能奠定了基础。
草莓;胶孢炭疽菌;G蛋白偶联受体;生物信息学
由异源三聚体G蛋白介导的信号级联途径是生物体中重要的信号感应和应答系统。该系统主要由3个部分组成:G蛋白偶联受体(G protein-coupled receptors,GPCRs)、异源三聚体G蛋白(含有α、β和γ亚基)和效应蛋白[1]。GPCRs是一类跨膜受体超家族,参与了许多细胞信号转导途径。由GPCRs介导的信号转导在生物体的多数生理活动中发挥着重要的作用,如趋化性、神经传递、细胞交流、感光、嗅觉、味觉等[2]。GPCRs作为特异的受体接收这些外部环境刺激引起的信号,并将这些信号转运至生物体细胞内,激活下游信号通路。尽管GPCRs具有各种不同的功能,但它们都含有典型的7个跨膜结构域。这7个跨膜结构域通过3个胞内环(Intracellular loop,IL-1 to IL-3)和3个胞外环(Extracellular loop,EL-1 to EL-3)相连,而N-末端及C-末端分别在细胞外和细胞内[3]。7个跨膜结构域被认为是GPCRs最保守的结构组成。7个跨膜结构域的存在表明了GPCRs的疏水特征并且含有几个十分重要的典型的基序,如WxP基序和NPxxY基序[4]。
GPCRs是动物细胞中最大的受体家族。在人类基因组中,有800—1 000个基因参与了GPCR的合成[5]。病原真菌中也被证实含有GPCRs超家族。目前,在模式真菌构巢曲霉(Aspergillus nidulɑns)[6]、粗糙脉孢霉(Neurosporɑcrɑssɑ)[7]及巴西安白僵菌(Beɑuveriɑbɑssiɑnɑ)[8]等真菌中对GPCRs的研究工作较为深入。Han等[6]研究发现构巢曲霉全基因组中存在9个GPCRs,其中gprD基因在菌丝生长及有性繁殖阶段发挥着重要的作用。在粗糙脉孢霉中,GPR-1在有性繁殖阶段发挥调控作用[9];GPR-4与异源三聚体G蛋白的α亚基相连接,调控粗糙脉孢霉对碳源的应答[10]。对巴西安白僵菌的GPCRs研究显示,BbGPCR3能够调控初侵染阶段真菌与寄主互作的过程及毒力。与模式真菌相比,植物病原丝状真菌,例如稻瘟菌(Mɑgnɑporthe griseɑ)[11]、链格孢菌(Alternɑriɑɑlternɑtɑ)[1]禾谷炭疽菌(C.grɑminicolɑ)[12]及希金斯炭疽菌(C.higginsiɑnum)[13]等,虽有GPCRs相关报道,但研究并不深入。稻瘟菌中已鉴定出含有14个典型的GPCRs。链格孢菌中具有3个典型的GPCRs,参与了对分生孢子生长及致病力的调控。韩长志等[12-13]利用生物信息学结合全基因组数据对禾谷炭疽菌和希金斯炭疽菌中的GPCR蛋白进行了筛选发现,这两种炭疽菌中均含有4个GPCR蛋白,且两者有较近的亲缘关系。
GPCRs在病原真菌中能够调节外界环境信号的识别(包含来自寄主的信号),激活下游转录因子的转录。其在真菌与寄主互作的过程中发挥着重要作用。对已报道的33种病原真菌的GPCRs进行比对,结果表明GPCRs超家族成员的数量及编码基因序列在不同种类真菌之间存在较大的差异。这是病原真菌在长期抵抗宿主识别机制过程中趋异进化的结果[14]。因此,明确GPCRs的功能,对于探明真菌与寄主互作的机制,为农业生产提供有效的真菌病害防控技术具有重要的意义。
胶孢炭疽菌(C.gloeosporioides)是一种十分重要的病原真菌,全球范围内均有分布,能够侵染1 000余种植物[15]。胶孢炭疽菌侵染不同寄主时采取的侵染策略也不同[16]。由胶孢炭疽菌侵染引起的草莓炭疽病是我国草莓生产上最重要的真菌病害之一,在南方发生尤为严重。危害严重的年份可导致草莓减产50%—80%[17]。草莓炭疽病已经成为制约草莓发展的重要因素。目前,胶孢炭疽菌中尚未见有关GPCRs超家族的报道。2013年,胶孢炭疽菌菌株Nara gc5全基因组测序的完成[18],为该物种GPCRs超家族成员的鉴定起到了极大的促进作用。Nara gc5菌株来自日本,从田间感染炭疽病的草莓组织中分离获得。
本研究利用NCBI网站(https://www.ncbi.nlm.nih.gov/)公布的草莓胶孢炭疽菌Nara gc5菌株的全基因组序列结合粗糙脉孢霉已报道的典型GPCR氨基酸序列[19],通过生物信息学方法对胶孢炭疽菌GPCRs超家族成员进行了鉴定;并对GPCRs进行了理化性质、信号肽及转运肽、亚细胞定位和跨膜结构域分析,以期初步明确GPCRs超家族成员的组成,为进一步研究GPCRs在胶孢炭疽菌与草莓互作过程中发挥的作用奠定基础。
1 材料与方法
1.1 材料
草莓胶孢炭疽菌Nara gc5全基因组数据来自NCBI网站(https://www.ncbi.nlm.nih.gov/)。粗糙脉孢霉、禾谷炭疽菌(C.grɑminicolɑ)、希尔金斯炭疽菌(C.higginsɑnum)、西瓜炭疽菌(C.orbiculɑre)等GPCR蛋白氨基酸序列也均从NCBI网站获得。
1.2 方法
1.2.1 GPCRs超家族候选蛋白的筛选
GPCRs超家族的基因筛选采用于波等[20]的方法:(1)利用已发表的粗糙脉孢霉中10个典型GPCRs氨基酸序在胶孢炭疽菌基因组数据库BLASTp搜索,E-value小于0.001的蛋白质作为候选GPCR蛋白;(2)利用粗糙脉孢菌GPCRs的典型结构域特征(Pheromone receptor:PF02076,PF02116;Putative cAMP:PF00002,PF05462;Carbon sensors:PF11710;Microbial opsin:PF01036),通过Pfam(http://pfam.sanger.ac.uk/)搜索胶孢炭疽菌的蛋白质数据,E-value设为0.001。综合以上两种方法获得候选GPCR蛋白。
使用Phobius(http://phobius.binf.ku.dk/)和ExPASy网站中的TMpred(http://www.ch.embnet.org/software/TMPRED form.html)及TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)对候选GPCRs进行跨膜结构域的分析,进行进一步的筛选。
1.2.2 蛋白质理化性质及疏水性预测
利用ExPASy网站中的Protscale(http://web.expasy.org/protscale/)软件对GPCRs进行理化性质的分析及疏水性的预测。
1.2.3 信号肽及转运肽的预测
利用ExPASy网站中的SignalP4.1Server(http://www.cbs.dtu.dk/services/SignalP/)和TargetP(http:// www.cbs.dtu.dk/services/TargetP/)分别对GPCRs进行N端信号肽及转运肽的预测。
1.2.4 蛋白亚细胞定位预测
利用ProtComp v 9.0(http://www.softberry.com/berry.phtm l?topic=protcompan&group=programs&subgroup=proloc)对GPCRs进行亚细胞定位分析。
1.2.5 蛋白二级结构分析
采用PHD在线平台(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_phd. html)对GPCRs的二级结构进行分析。
1.2.6 系统发育树构建
利用草莓胶孢炭疽菌中的GPCRs氨基酸序列,分别进行BLASTp分析。在BLASTp分析结果中,分别选取一致性最高的7条氨基酸序列,共56条序列,下载保存为FASTA格式。通过ClustalX软件对上述序列利进行多重序列比对分析,随后用MEGA 6.0中的邻近法构建系统发育树,bootstrap值设置为1 000。
2 结果与分析
2.1 胶孢炭疽菌GPCRs超家族成员的鉴定
利用BLASTp通过与模式真菌粗糙脉孢霉中的10个GPCRs的氨基酸序列比对并利用粗糙脉孢菌GPCRs的典型结构域特征采用Pfam数据库对胶孢炭疽菌的全基因组进行搜索,获得GPCRs超家族的候选GPCR蛋白。
由于GPCRs具有典型的7个跨膜结构域的特点,因此利用PHOBIUS及Expasy平台中的跨膜预测软件TMHMM、TMpred对GPCRs候选蛋白进行跨膜结构域分析,将不含有7个跨膜结构域的蛋白剔除。最终确定胶孢炭疽菌中含有8个典型的GPCRs。由之前的报道可知[18],真菌的GPCRs超家族主要分为5类:信息素受体、类cAMP受体、碳源感应子、氮源感应子和真菌视蛋白。胶孢炭疽菌的8个典型的GPCRs中碳源感应因子类最多,有3个;类cAMP受体类有2个,信息素受体、氮源感应因子和真菌视蛋白类各1个(表1)。基因组定位表明,GPCRs散布在胶孢炭疽菌基因组中,在基因组不同scaffold的负链和正链中均存在。
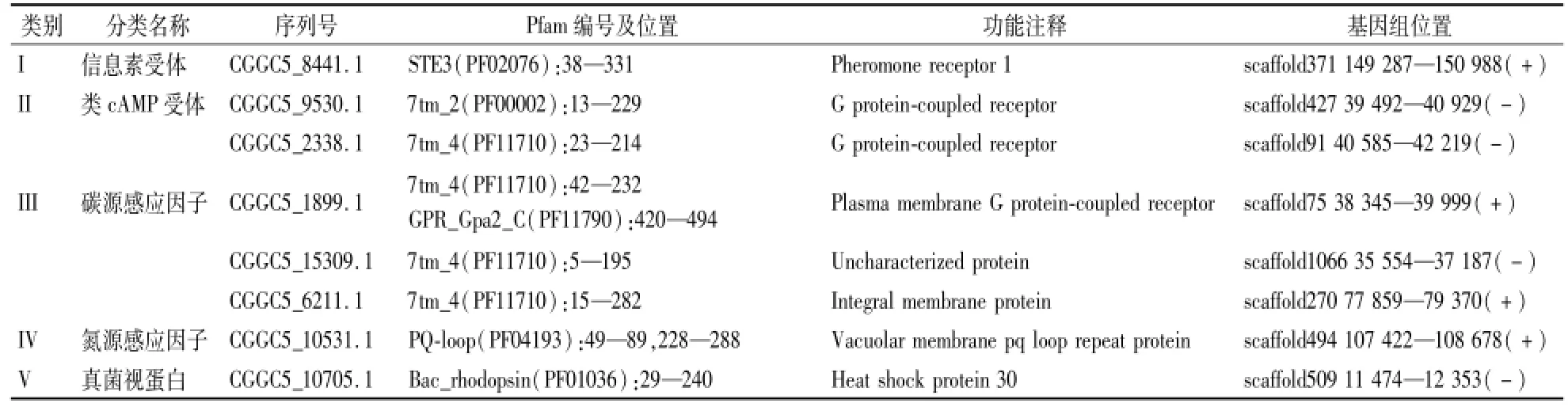
表1 胶孢炭疽菌GPCRs的基因信息Table 1 The information of GPCR genes in C.gloeosporioides
2.2 胶孢炭疽菌GPCRs超家族蛋白质理化性质及疏水性预测
利用ExPASy数据库中的ProtParam及Computer p I/MW软件对胶孢炭疽菌GPCRs的理化性质进行分析。结果表明,GPCRs在酸碱性,极性与非极性氨基酸组成及所占比例均存在差异(表2);除此之外,其相对分子质量、理论等电点、正负电荷氨基酸残基数、以及不稳定性系数、脂肪族氨基酸指数和总平均亲水性等方面也存在着较大差异(表3)。除氮源感应因子CGGC5_10531.1和真菌视蛋白CGGC5_10705.1的稳定系数小于40,属于稳定蛋白外,其余GPCRs的不稳定系数均大于40,为不稳定蛋白(表3)。
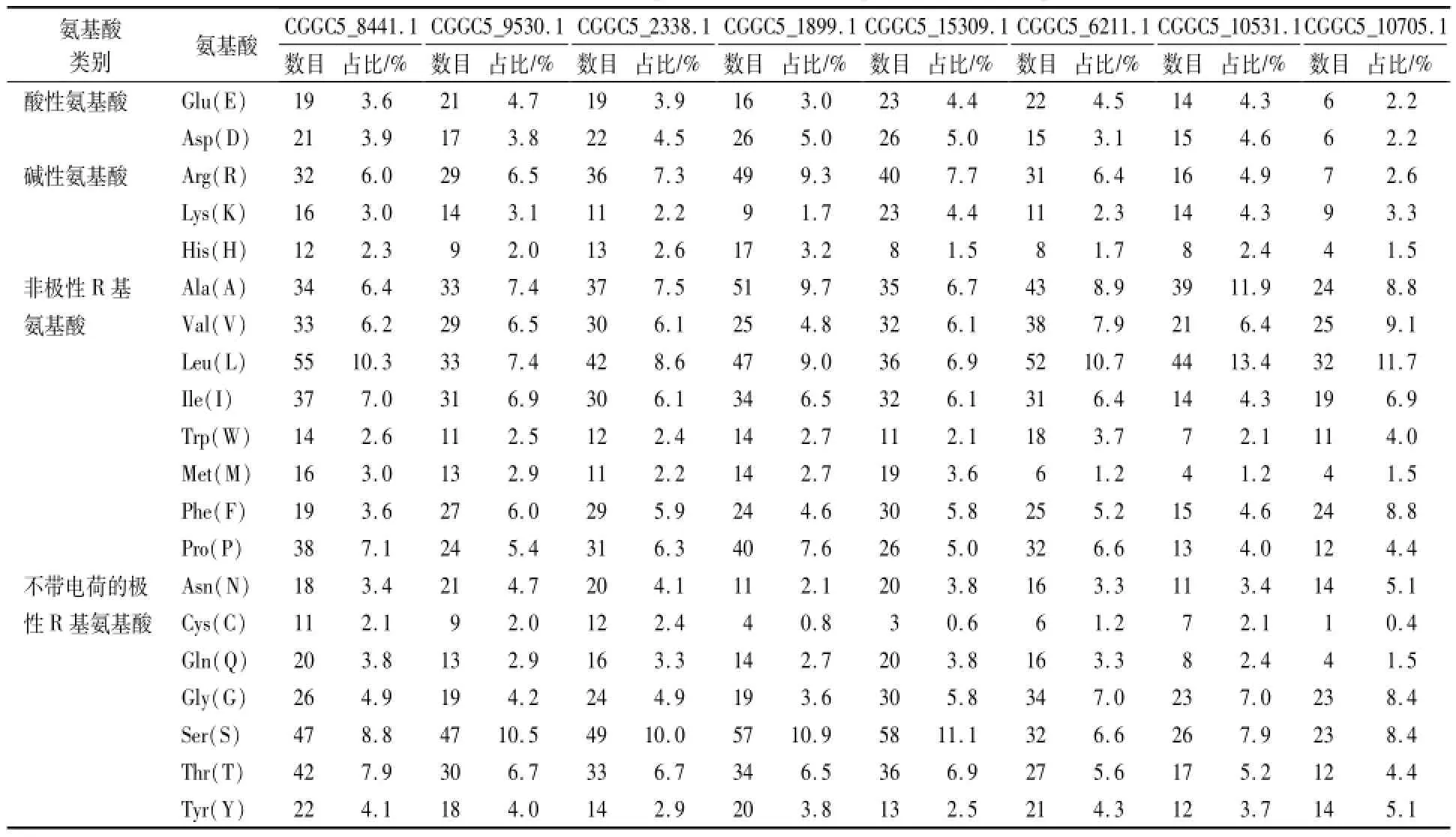
表2 胶孢炭疽菌GPCRs的氨基酸组成Table 2 The am ino acid composition of C.gloeosporioides GPCR proteins
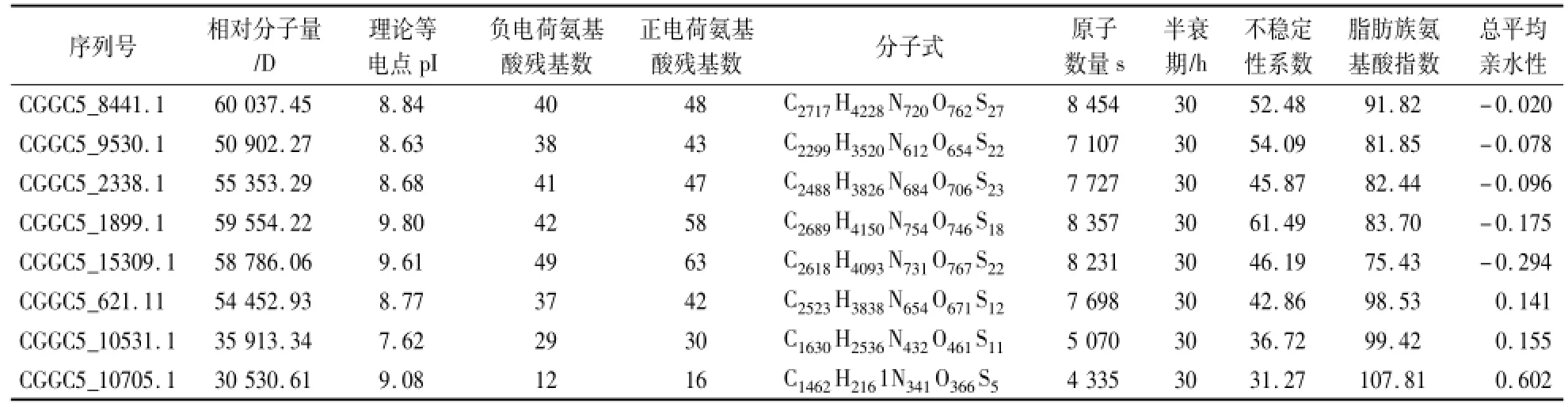
表3 胶孢炭疽菌GPCRs的基本理化性质Table 3 The basic physicochemical property of C.gloeosporioides GPCR proteins
2.3 胶孢炭疽菌GPCRs超家族蛋白的信号肽及转运肽分析
利用SignalP 4.1 Server对胶孢炭疽菌GPCRs的信号肽分析表明,8个GPCRs均不含有信号肽。转运肽分析结果表明,信息素受体类蛋白CGGC5_8441.1定位于分泌途径上,且可信度较高(RC=2)。其余7个GPCRs未得到较好的定位结果,可信度均较低(RC≥3)(表4)。
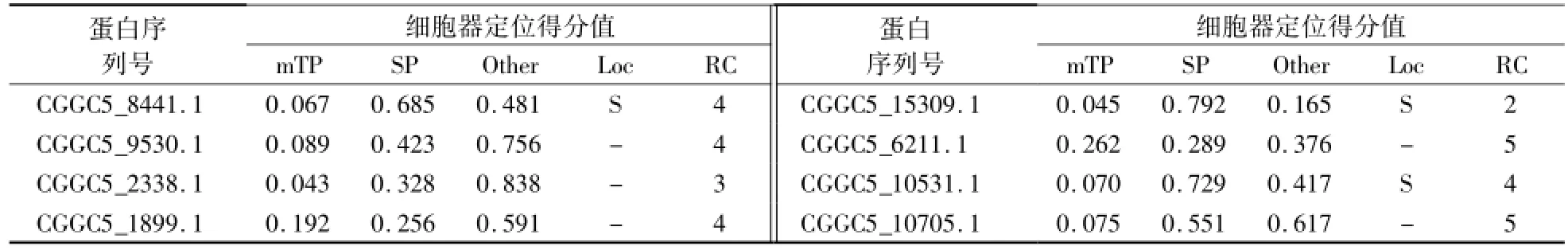
表4 胶孢炭疽菌GPCR蛋白的转运肽分析Table 4 Transit peptide prediction of C.gloeosporioides GPCR proteins
2.4 胶孢炭疽菌GPCRs超家族蛋白的亚细胞定位分析
使用CBS的ProtComp Version 9.0对胶孢炭疽菌GPCRs超家族蛋白进行了亚细胞定位分析,从分析结果可以看出(表5),除了CGGC5_15309.1之外,其余7个GPCRs位于质膜的得分均最高,其余部位的分值均较低,甚至为0.00,由此推测这7个GPCRs位于质膜。CGGC5_15309.1位于线粒体的得分最高(6.42),明显高于其他部位分值,说明其有可能定位在线粒体上,具体定位情况还有待后续通过试验证实。
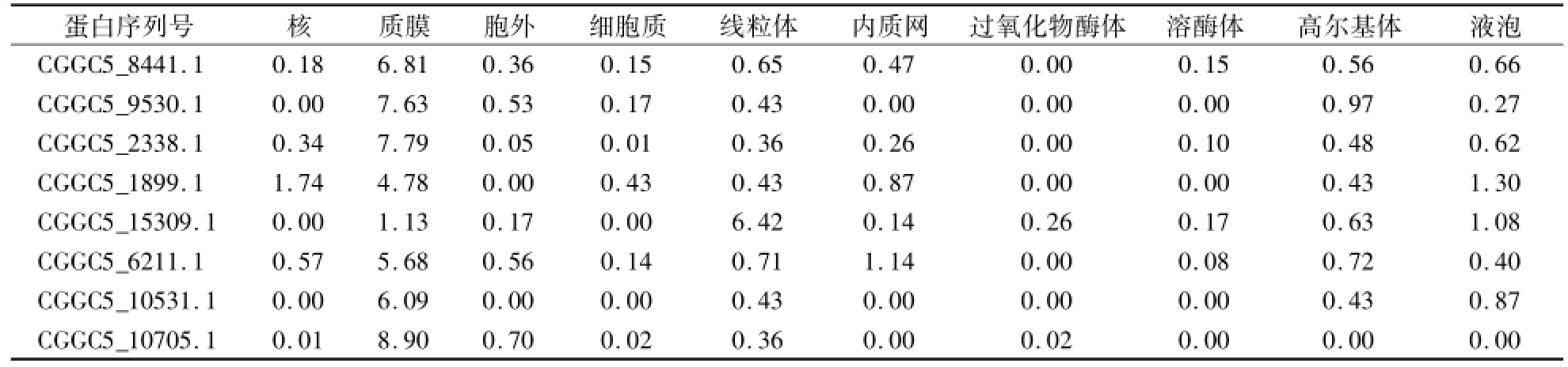
表5 胶孢炭疽菌GPCR蛋白的亚细胞定位分析Table 5 Subcellular localization prediction of C.gloeosporioides GPCR proteins
2.5 胶孢炭疽菌GPCRs超家族蛋白的保守结构域分析
InterPro及SMART的保守结构域分析结果表明,8个GPCRs均分别含有7个跨膜结构域(表6,图1),每个跨膜结构域由16—29个氨基酸组成;N-端在细胞膜外,C-端在膜内。跨膜结构域之间由3个胞内环(ICL)和3个胞外环(ECL)交替分隔。其中,信息素受体CGGC5_8441.1、类cAMP受体CGGC5_9530.1、氮源感应因子CGGC5_10531.1和真菌视蛋白CGGC5_10705.1跨膜结构域分布较均匀,ICL和ECL长度较接近,大多由10—31个氨基酸组成,最短的为4个氨基酸,最长的为67个氨基酸;类cAMP受体CGGC5_2338.1和碳源感应因子CGGC5_1899.1、CGGC5_15309.1均为ICL3最长,分别达到了202、136和256个氨基酸,明显较其他ICL和ECL长(图2,表6)。此外,碳源感应因子CGGC5_1899.1的C端421—492位氨基酸为葡萄糖受体Git3 Gα结合位点同源基序。CGGC5_9530.1中29—186位氨基酸中含有cAMP结合位点。氮源感应因子CGGC5_10531.1中23—87 aa和231—285 aa含有2个该家族标志性的PQ-loop结构。
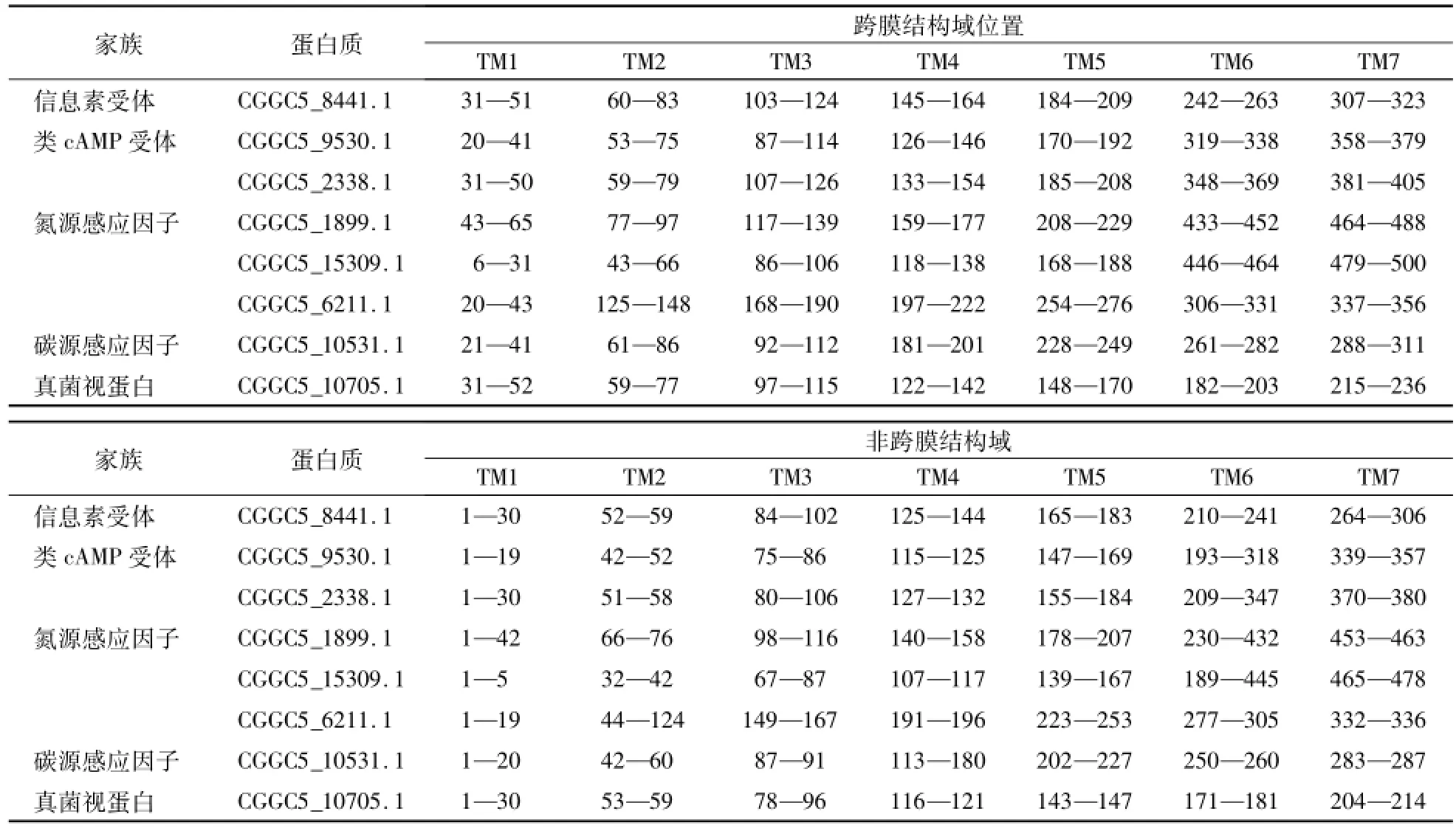
表6 胶孢炭疽菌GPCR蛋白的结构域分布Table 6 The dom ain distribution in GPCR proteins of C.gloeosporioides
2.6 胶孢炭疽菌GPCRs超家族蛋白二级结构分析
通过PHD在线网站对胶孢炭疽菌GPCRs二级结构进行了分析,结果表明(图2),8个GPCRs的二级结构均是由α-螺旋(α-helices)(23.01%—66.77%)、延伸链(extended strand)(9.15%—33.47%)和无规则卷曲(random coil)(24.01%—51.63%)组成。总体而言,胶孢炭疽菌GPCRs的α-螺旋和无规则卷曲含
量较高,其次是是延伸链。希金斯炭疽菌[18]GPCRs也含有较高比例的α螺旋和无规则卷曲,不具备较高比例的延伸链,且有少量的β卷曲。说明就二级结构而言,与其他炭疽菌相比,胶孢炭疽菌GPCRs有其自身特点。
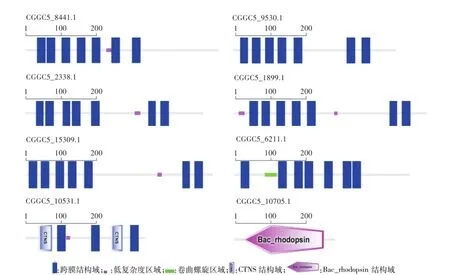
图1 胶孢炭疽菌GPCRs超家族蛋白保守结构域分析Fig.1 The conserved domain analysis of GPCRs superfam ily of C.gloeosporioides
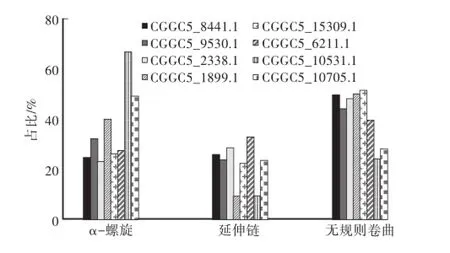
图2 胶孢炭疽菌GPCRs超家族蛋白二级结构分析Fig.2 The secondary structure analysis of GPCRs superfam ily of C.gloeosporioides
2.7 胶孢炭疽菌GPCRs超家族蛋白的遗传进化分析
通过对胶孢炭疽菌中的8个GPCRs序列及其同源序列进行聚类分析,在所得系统发育树中,构成2个主要进化大分支,5个小分支,与其基于保守结构域的归属类别基本一致(图3)。其中CGGC5_9530.1和CGGC5_2338.1所属的II(cAMP受体)类GPCR属于第一大分支的第一小分支。CGGC5_1899.1,CGGC5_15309.1和CGGC5_6211.1所属的III(碳源感应因子)类GPCR则横跨第一大分支的第一和第二小分支,说明III类GPCR各成员之间有一定的差别。而II和III类GPCR亲缘关系较近,共同属于第一大分支,与此对应的是,CGGC5_8441.1,CGGC5_10531.1和CGGC5_10705.1分属的I(信息素受体),IV(氮源感应因子)和V(真菌视蛋白)类GPCR亲缘关系较近,属于第二大分支,总体而言胶孢炭疽菌8个GPCRs的聚类与其基于保守结构域的归属类别一致。胶孢炭疽菌菌株Nara gc5中的GPCR与另一菌株Cg-14高度同源,但与其他炭疽菌属的GPCRs遗传距离相对较远,相较之下其他炭疽菌属GPCR之间亲缘关系较近,说明与炭疽菌属其他真菌相比,胶孢炭疽菌的GPCRs有其自身特点。
3 结论与讨论
GPCRs是一类含有7个跨膜结构域的膜受体蛋白超家族,它们参与了生物体多种生命过程,其信号转导机制是研究的热点[21]。在病原真菌中,GPCRs在生长发育、侵染及与寄主互作的过程中均发挥着重要作用:真菌含有多个感知系统来感知胞外和胞内的营养信号,从而使其适应环境的要求及满足自身代谢的需要。GPCRs超家族就是其中一个非常重要的感知系统,目前已经被发现在真菌感应营养信号中发挥巨大的作用;对光的感应在真菌生长发育特别是在孢子形成和交配过程中起着重要作用。在粗糙链孢菌中已研究证实,GPCRs超家族中的视蛋白能够调节类胡萝卜素生物合成(该合成途径与光感应相关)并抑制产孢特异基因的表达[22];在病原真菌与寄主互作过程中,真菌能够通过GPCRs介导的级联反应对寄主的脂氧化物进行识别,进而利用其作为养分,促进真菌自身毒力的发展[23]。综上可知,对GPCRs的研究将有助于了解病原真菌的致病机制,探明真菌与寄主互作的机理,为抗病性育种及病害防控奠定理论基础。
随着基因组测序技术的发展,越来越多病原真菌的全基因组数据得到释放。这极大的促进了GPCRs超家族成员的功能预测和研究。目前,病原真菌中大量的GPCRs已经得到筛选和鉴定。炭疽菌属是一类十分重要的植物病原真菌,能够侵染多种植物,包括许多重要的经济作物[24]。胶孢炭疽菌中目前尚无GPCR蛋白的报道。
本研究利用BLASTp比对分析及Pfam数据库对胶孢炭疽菌全基因组进行氨基酸序列比对及结构域的搜索获得了GPCR的候选蛋白。由于GPCRs超家族具有典型的7个跨膜结构域的特征,因此,首先利用TMHMM、TMPRED和PHOBIUS软件分析候选蛋白的跨膜结构域,确定胶孢炭疽菌有8个蛋白具有7个跨膜结构域的特征。这8个GPCRs主要分为5类:碳感应因子类3个;类cAMP受体类2个,信息素受体、氮源感应因子和真菌视蛋白类各1个。其次,利用信号肽分析软件SignalP及转运肽分析软件TargetP对8个GPCRs进行分析。信号肽分析结果与禾谷炭疽菌及希金斯炭疽菌中GPCRs的结果一致,即8个蛋白均不具有信号肽结构。对胶孢炭疽菌GPCRs超家族蛋白的二级结构分解结果显示,其主要由α-螺旋、延伸链和无规则卷曲组成,而与其他炭疽菌例如希金斯炭疽菌[13]相比,有高比例的延伸链,这些延伸链是否在胶孢炭疽菌GPCRs发挥作用过程中有别于其他炭疽菌的作用仍有待进一步证实。对胶孢炭疽菌GPCRs及其同源序列进行遗传关系比较分析,在所得系统发育树中,同一家族成员即8个GPCRs聚在一起,构成2个主要进化大分支和5个小分支;总体而言,胶孢炭疽菌8个GPCRs的聚类与其基于保守结构域的归属类别一致。而本菌株Nara gc5的GPCRs,除了与另一胶孢炭疽菌Cg-14高度同源之外,与其他炭疽菌炭疽菌属的GPCRs遗传距离相对较远;说明至少在氨基酸水平上,胶孢炭疽菌的GPCRs有其自身特点,而这些差异是否影响到胶孢炭疽菌的GPCRs行使功能还有待进一步证实。玉米大斑病基因组中能够预测得到9个典型的GPCRs,其中有2个GPCRs在侵染后各阶段表达均无上调,其他GPCRs表达量呈现上调/持平-上调-下调-上调的变化趋势[20]。本研究下一步将对GPCRs在侵染中的表达量和功能进行深入分析,这有利于更好了解GPCRs的生物学功能及其在真菌侵染植物过程中发挥的作用。
近年来,一些新的类型的GPCRs陆续被发现,如PTH-11类蛋白、GPCR89类受体PTM1类GPCR蛋白等。PTH-11最早是在稻瘟菌中发现的,对附着胞的形成及毒力均有非常重要的影响。该蛋白含有9个跨膜结构域,不符合GPCRs具有7个典型结构域的特征[11]。GPCR89类受体在许多高等真核生物中均存在,如人类、小鼠和拟南芥,它们主要在蛋白代谢及修饰过程中起作用[25]。PTM1类GPCRs主要影响破骨细胞的形成和功能,目前已在酿酒酵母及解脂耶氏酵母等真菌中有报道[26]。因此,下一步还需要利用生物信息学,对胶孢炭疽菌的全基因组进行更深的挖掘,并对预测出的GPCRs蛋白进行功能验证,以期更加全面的了解GPCRs超家族在真菌侵染中的作用机制。
[1]TAKAO K,AKAGI Y,TSUGE T.Functional characterization of putative G protein-coupled receptors in the tomato pathotype of Alternɑriɑ ɑlternɑte[J].Journal of General Plant Pathology,2016,82(2):1-7.
[2]O'NEILL P R,GIRI L,KARUNARATHNE W K A,et al.The structure of dynamic GPCR signaling networks[J].Wiley Interdiscip linary Reviews Systems Biology&Medicine,2014,6(1):115-123.
[3]LIL,WRIGHT S J,KRYSTOFOVA S,et al.Heterotrimeric G Protein Signaling in Filamentous Fungi[J].Microbiology,2007,61(61):423-452.
[4]KATRITCH V,CHEREZOV V,STEVENS R C.Diversity and modularity of G protein-coupled receptor structures[J].Trends in Pharmacological Sciences,2012,33(1):17-27.
[5]VENKATAKRISHNAN A J,DEUPIX,LEBON G,et al.Molecular signatures of G-protein-coupled receptors[J].Nature,2013,494(7436):185-194.
[6]HAN K H,SEO J A,YU J H.A putative G protein-coupled receptor negatively controls sexual development in Aspergillus nidulɑns[J]. Molecular Microbiology,2004,51(5):1333-1345.
[7]BIESZKE JA,BORKOVICH K A.The nop-1 gene of Neurosporɑcrɑssɑencodesa seven transmembrane helix retinal-binding protein homologous to archaeal rhodopsins[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(14):8034-8039.
[8]YING SH,FENGM G,KEYHANINO.A carbon responsive G-protein coupled receptormodulates broad developmentaland genetic networks in the entomopathogenic fungus,Beɑuveriɑbɑssiɑnɑ[J].Environmental Microbiology,2013,15(11):2902-2921.
[9]KRYSTOFOVA S,KA B.The predicted G-protein-coupled receptor GPR-1 is required for female sexual development in themulticellular fungus Neurosporɑcrɑssɑ[J].Eukaryotic Cell,2006,5(9):1503-1516.
[10]LIL,BORKOVICH K A.GPR-4 is a predicted G-protein-coupled receptor required for carbon source-dependentasexualgrowth and development in Neurosporɑcrɑssɑ[J].Eukaryotic Cell,2006,5(8):1287-1300.
[11]KULKARNIR D,THON M R,PAN H,etal.Novel G-protein-coupled receptor-like proteins in the plant pathogenic fungus Mɑgnɑporthe griseɑ[J].Genome Biology,2005,6(3):R24.
[12]韩长志,任文来.禾谷炭疽菌GPCR蛋白生物信息学分析[J].西南林业大学学报,2016,41(4):82-87.
[13]韩长志.希金斯炭疽菌GPCR蛋白生物信息学分析[J].华中师范大学学报(自然科学版),2015,49(2):246-251.
[14]AFFELDT K J,CARRIG J,AMAREM,etal.Global survey of canonical Aspergillus flɑvus G protein-coupled receptors[J].Mbio,2014,5(5):1501-1514.
[15]WEIR B S,JOHNSTON PR,DAMM U.The Colletotrichum gloeosporioides species complex[J].Studies in Mycology,2012,73(1):115-180.
[16]何芬.橡胶树炭疽病菌效应蛋白基因GgLysM的RNAi突变体构建及其蛋白的亚细胞定位[D].海口:海南大学,2014.
[17]ZHANG JZ,WAN Y,DENGW H.Identification of Colletotrichum spp.isolated from strawberry in Zhejiang Province and ShanghaiCity,China[J].Journal of Zhejiang University SCIENCE B,2010,11(1):61-70.
[18]GAN P,IKEDA K,IRIEDA H,et al.Comparative genomic and transcriptomic analyses reveal the hemibiotrophic stage shift of Colletotrichum fungi[J].New Phytologist,2013,197(4):1236.
[19]BORKOVICH K A,ALEX L A,YARDEN O,et al.Lessons from the Genome Sequence of Neurospora crassa:Tracing the Path from Genomic Blueprint to Multicellular Organism[J].Microbiology&Molecular Biology Reviews,2004,68(1):1-108.
[20]于波,张玉妹,李志勇,等.玉米大斑病菌GPCRs超家族的基因鉴定及其在孢子发育过程中的转录模式[J].农业生物技术学报,2016,24(9):1302-1311.
[21]BOKOCH M P,ZOU Y,RASMUSSEN SG,et al.Ligand-specific regulation of the extracellular surface of a G-protein-coupled receptor[J]. Nature,2010,463(7277):108-112.
[22]AFFELDT K J,BRODHAGENM,KELLER N P.Aspergillus Oxylipin Signaling and Quorum Sensing Pathways Depend on G Protein-Coupled Receptors[J].Toxins,2012,4(9):695-717.
[23]XUE C Y,HSUEH Y P,JOSEPH H.Magnificent seven:roles of G protein-coupled receptors in extracellular sensing in fungi[J].FEMS Microbiology Reviews,2008,32(6):1010-1032.
[24]PHOULIVONG S,CAIL,CHEN H,et al.Colletotrichum gloeosporioides,is not a common pathogen on tropical fruits[J].Fungal Diversity,2010,44(1):33-43.
[25]ZHENG H,LEI Z,DOU T,et al.Genome-wide prediction of G protein-coupled receptors in Verticillium spp.[J].Fungal Biology,2010,114(4):359-368.
[26]LIUW,XU D,YANG H,et al.Functional identification of three receptor activator of NF-kappa B cytoplasmic motifs mediating osteoclast differentiation and function[J].Journal of Biological Chemistry,2004,279(52):54759-54769.
(责任编辑:张睿)
Identification and bioinformatics analysis of GPCRs superfam ily of Colletotrichum gloeosporioides in strawberry(Fragaria×ananassa Duchesne)
ZHANG Li-qing,DUAN Ke,ZOU Xiao-hua,GAO Qing-hua*
(Forest&Fruit Reseɑrch Institute,Shɑnghɑi Acɑdemy of Agriculture Sciences,Shɑnghɑi Key Lɑborɑtory of Protected Horticulturɑl Technology,Shɑnghɑi201403,Chinɑ)
G protein-coupled receptors(GPCRs)are transmembrane receptors which extensively exist in all kinds of organisms.The study obtained the GPCR proteinsand their genomic locationsby using the GPCR protein amino acids sequences of Neurosporɑcrɑssɑand their typical domain to search the genome database of C. gloeosporioides.GPCR protein amino acid sequence of C.gloeosporioides were then analyzed and predicted by the bioinformatics tools.The results showed that there were 8 GPCR proteins in C.gloeosporioides.Among them,three GPCRs belonged to carbon sensors,2 GPCRswere classified as cyclic adenosine monophosphate(cAMP)receptor-like protein.The remaining 3 GPCRswere 1 pheromone receptor,1 putative nitrogen sensor and 1 fungal opsin,respectively.Allmembers consisted of seven typical transmembrane domains and high proportion of alpha helix and random curl but no signal peptide in these GPCR proteins.The resultsof phylogenetic trees showed that 8 GPCRswere clustered together and formed 2 major clades and 5 small branches.These clustering resultswere in accordancewith the classification based on the domain prediction.This study laid the foundation for the further study on the function of GPCRs superfamily of C.gloeosporioides.
Strawberry;Colletotrichum gloeosporioides;G protein-coupled receptors;Bioinformatics
S668.4;Q78
A
1000-3924(2017)01-001-09
2016-12-07
国家自然科学基金青年基金项目(31501592);上海市科委自然科学基金项目(13ZR1436800);上海市科委农业科技重点攻关项目(16391901400)和基础研究重点项目(14JC1405400);上海市瓜果产业技术体系[沪农科产字(2017)第1号]
张丽勍(1985—),女,博士,助理研究员,主要从事植物病原物互作机理研究。E-mail:zlq1985-345@163.com
*通信作者,E-mail:qhgao20338@sina.com

