低温胁迫及恢复对厚皮甜瓜光合作用和抗氧化特性的影响
张永平,姚雪琴,杨少军,许 爽,陈幼源
(上海市农业科学院园艺研究所,上海市设施园艺技术重点实验室,上海 201403)
低温胁迫及恢复对厚皮甜瓜光合作用和抗氧化特性的影响
张永平,姚雪琴*,杨少军,许 爽,陈幼源**
(上海市农业科学院园艺研究所,上海市设施园艺技术重点实验室,上海 201403)
以6个不同甜瓜品种为试材,分别在昼(18±1)℃/夜(12±1)℃(T1)和昼(12±1)℃/夜(6±1)℃(T2),昼(28±1)℃/夜(22±1)℃作对照,胁迫7 d后进行恢复生长7 d,研究低温胁迫对不同甜瓜品种幼苗生长、叶绿素含量、叶绿素荧光参数和抗氧化酶活性等的影响。结果表明:2种低温胁迫下,6个甜瓜品种幼苗的生长均受到不同程度的影响,T2处理比T1处理影响更大,其中SJ品种的各项指标在低温胁迫后均有不同程度的降低或升高,但经7 d恢复T1处理的各项指标与对照接近,T2处理生长量(地上鲜重除外)、Fo、ETR、抗氧化酶活性(POD除外)、可溶性蛋白和脯氨酸含量也均接近对照,表明低温胁迫对此品种造成的伤害是可逆的,综合以上指标可以推断SJ品种耐低温性较强。
甜瓜;低温胁迫;光合作用;抗氧化特性
厚皮甜瓜作为一个重要栽培类型,在我国栽培面积逐年上升,喜高温、强光、较大昼夜温差等生长条件,幼苗适宜的生长温度为25—30℃,在低于12℃时植株生长迟缓,低于7℃时茎叶会受到伤害[1-2]。目前厚皮甜瓜在早春保护地栽培中常遇到低温危害,影响了秧苗的正常生长,导致果实早熟性差、品质和产量下降[3]。前人研究表明,低温胁迫对甜瓜各种生理活动产生不利影响,包括叶色褪绿和光合作用下降[4]、细胞内抗氧化酶活性和脯氨酸[5]提高等,同一生理指标在不同基因型之间还可能出现完全不同的变化趋势,因而单一的形态或生理指标难以准确反应植株的耐冷性[6]。因此,必须根据低温胁迫后不同品种的生理指标变化来确定其耐低温性。本研究考察在低温胁迫及常温恢复后6个甜瓜品种的生长变化和生理特性,为筛选和选育耐低温专用品种提供参考。
1 材料与方法
1.1 材料
供试甜瓜(Cumumismelo L.)品种‘西薄洛托’(CB)种子由上海惠和种子公司提供,‘GL-1’(GL)、‘哈密绿’(HM)、‘东方蜜1号’(DF)、‘世纪蜜’(SJ)和‘秀绿’(XL)种子由上海市农业科学院园艺所提供,试验在上海市农业科学院园艺所进行。2014年11月20日将饱满、整齐一致的种子浸种催芽,出芽后播于10 cm×10 cm的塑料营养钵中,以蛭石作基质,然后放置于光照培养箱中进行幼苗培养,温度设置为昼(28±1)℃/夜(22±1)℃,光照12 h,光照强度为400μmol·m-2·s-1左右。
1.2 试验处理
2014年12月10日,当幼苗长到3—4片真叶时,进行3种温度试验处理[1,7]:(1)昼(28±1)℃/夜(22±1)℃作对照(CK);(2)昼(18±1)℃/夜(12±1)℃(T1);(3)昼(12±1)℃/夜(6±1)℃(T2)。低温处理与对照培养箱除温度不同外,光照和湿度状况均一致。低温培养7 d后温度调为昼(28±1)℃/夜(22±1)℃,进行7 d恢复处理。每种处理25株,3次重复,处理7 d和恢复7 d分别进行各项指标的测定。
1.3 测定项目与方法
1.3.1 生长量测定
用直尺测量幼苗株高(子叶节至生长点);利用游标卡尺测量茎粗,即子叶展开方向的子叶节的直径;叶面积公式采用叶长×叶宽×0.66,叶长和叶宽的测定以最大值为基准[8];用去离子水冲洗植株并吸干水分,称地上鲜重。
1.3.2 叶绿素含量和荧光参数测定
参照李合生[9]的方法进行测定叶绿素含量;叶绿素荧光参数测定采用德国Walz公司生产的IMAGING-PAM调制荧光成像系统,进行甜瓜叶片叶绿素荧光诱导动力学参数测定[10],先用弱光照射测定初始荧光(Fo),充分暗适应后,表观光合电子传递速率(ETR)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)等参数数值均由选定模式下系统自动计算生成。计算其他相关参数,PSⅡ调节性能量耗散比例Y(NPQ)=Ft/Fm’-Ft/Fm,PSⅡ非调节性能量耗散比例Y(NO)=Ft/Fm,公式中Fm为暗适应后的最大荧光产额,Ft为光照下的实时荧光产额,Fm’为光照下的最大荧光产额[11]。
1.3.3 抗氧化特性测定
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性测定参照李合生[9]的方法;可溶性蛋白含量的测定采用考马斯亮蓝G250法[7];脯氨酸含量的测定采用酸性茚三酮比色法[12]。
1.4 统计分析
每个指标测定重复3次,取平均值。数据采用Origin软件绘图,用SPSS统计软件对平均数用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 低温胁迫及恢复对甜瓜幼苗生长的影响
从表1可以看出,与各自对照(CK)相比,不同低温胁迫7 d后,6个甜瓜品种幼苗株高和地上鲜重显著降低(GL株高和SJ地上鲜重除外),CB品种低温胁迫结束恢复7 d后株高仍显著低于对照,GL、HM、DF和XL品种T1处理结束恢复7 d与对照接近,T2处理显著低于对照,但与低温胁迫时相比下降幅度降低,SJ品种低温胁迫结束恢复7 d后与对照水平接近;品种CB、GL、HM和XL品种低温胁迫结束恢复7 d后地上鲜重仍显著低于对照,DF和SJ品种T1处理结束恢复7 d与对照相比差异不显著,T2处理差异显著。由表1还可见:与对照相比,不同低温处理7 d后,甜瓜品种CB、HM和DF叶面积显著降低,其中CB品种低温胁迫结束恢复7 d后仍显著低于对照,HM和DF品种T1处理结束恢复7 d与对照相接近,T2处理差异显著;与对照相比,T1处理及低温处理结束恢复对XL品种叶面积影响不大,T2处理差异显著,SJ品种无论是T1和T2差异均不显著,而GL品种T1处理后虽然叶面积与对照相比没有显著下降,但恢复7 d后反而降低且差异显著。低温处理对6个甜瓜品种的茎粗均无显著变化。
综合以上生长指标,低温胁迫对SJ品种生长影响最小,DF和XL次之,其次为HM,影响最大的为GL和CB。

表1 低温胁迫对甜瓜幼苗生长的影响Table 1 Effects of low temperature stress on the growth of melon seedlings
2.2 低温胁迫及恢复对甜瓜幼苗叶绿素含量的影响
不同低温处理7 d后,CB、HM、SJ和XL品种叶绿素a(图1-A1)和叶绿素a+b(图1-C1)含量与对照相比显著降低,CB和SJ品种T1处理结束恢复7 d与对照相比叶绿素a含量差异不显著,T2处理差异显著,但与低温胁迫时相比下降幅度降低(图1-A2),CB、HM和SJ品种叶绿素a+b含量T1处理差异不显著,T2处理差异显著(图1-C2),而XL品种低温胁迫结束恢复7 d后叶绿素a和叶绿素a+b含量仍显著低于对照;从图1-B1可以看出,与各自对照(CK)相比,不同低温胁迫7 d后,6个甜瓜品种幼苗叶绿素b含量显著降低,DF和XL品种低温胁迫结束恢复7 d后叶绿素b含量仍显著低于对照,CB、HM和SJ品种T1处理结束恢复7 d与对照接近,T2处理差异显著,GL品种低温胁迫结束恢复7 d后与对照相比差异均不显著(图1-B2)。
2.3 低温胁迫及恢复对甜瓜幼苗叶绿素荧光参数的影响
由图2-A1可见,与各自对照相比,低温胁迫7 d后,6个甜瓜品种幼苗叶片初始荧光(Fo)显著升高;CB和GL品种低温胁迫结束恢复7 d后Fo仍显著高于对照,HM、DF和XL品种T1处理结束恢复7 d与对照接近,T2处理差异显著,SJ品种T1和T2处理结束恢复7 d后与对照接近(图2-A2)。表观光合电子传递速率(ETR)变化与Fo相反(图2-B1),与各自对照相比,低温胁迫7 d后,6个甜瓜品种幼苗叶片ETR显著降低,且各个品种降低幅度不同;其中GL和XL品种低温胁迫结束恢复7 d后ETR仍显著低于对照,CB、HM和DF品种T1处理结束恢复7 d与对照相比差异不明显,T2处理差异显著,SJ品种低温胁迫结束恢复7 d后与对照接近(图2-B2)。
与各自对照相比,低温胁迫7 d后,6个甜瓜品种幼苗叶片光化学淬灭系数(qP)显著降低(图3-A1),非光化学淬灭系数(NPQ)显著升高(图3-B1),且各个品种的降低和升高幅度不同;CB、GL和XL品种低温胁迫结束恢复7 d后qP仍显著低于对照,其他3个品种T1处理结束恢复7 d与对照相比差异不明显,
T2处理差异显著,其中SJ品种下降幅度最小(图3-A2);DF、SJ和XL品种低温胁迫结束恢复7 d后NPQ仍显著高于对照,其他3个品种T1处理结束恢复7 d与对照接近,T2处理差异显著(图3-B2)。
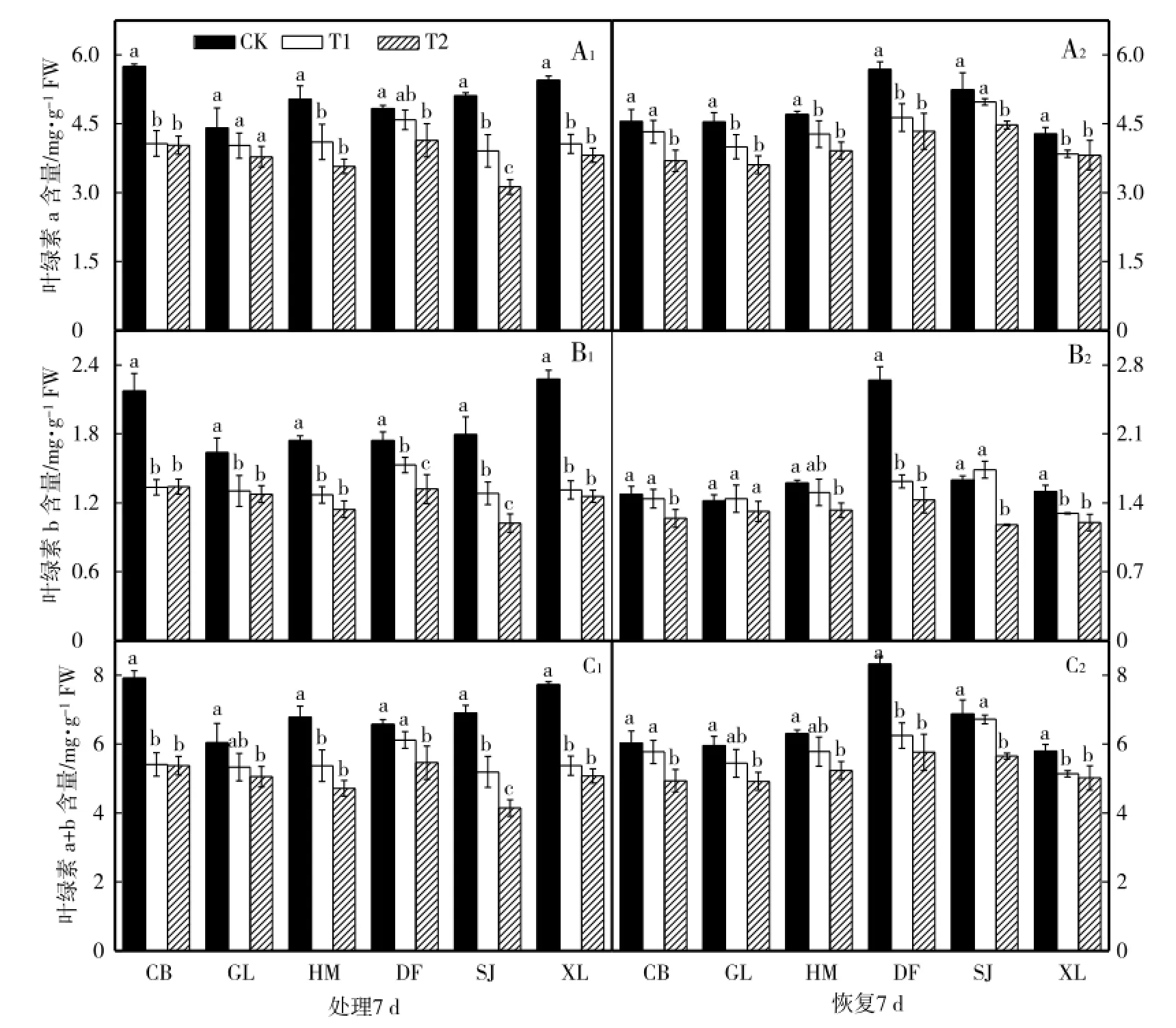
图1 低温胁迫对甜瓜幼苗叶绿素含量的影响Fig.1 Effects of low tem perature stress on the chlorophyll contents ofm elon seed lings
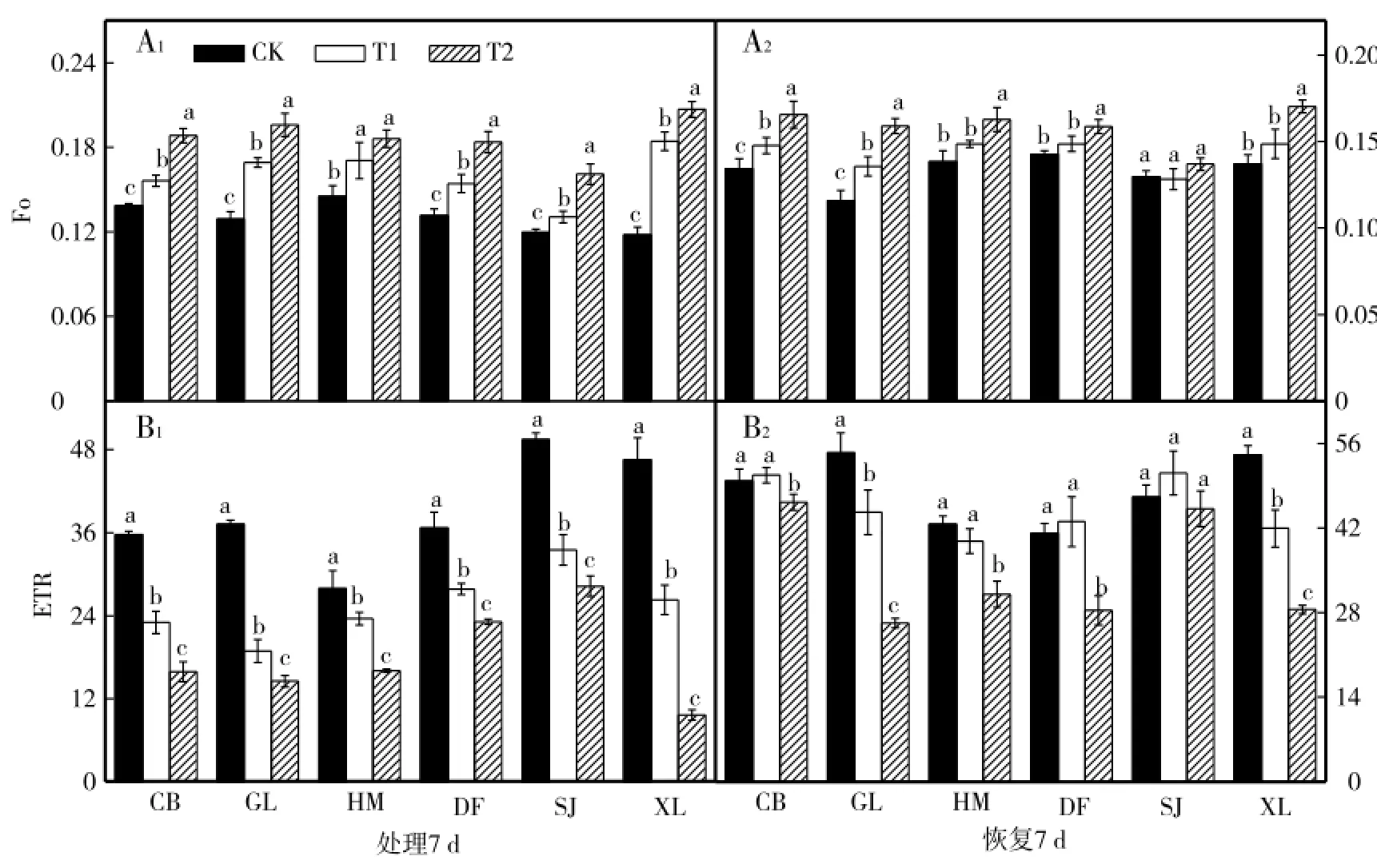
图2 低温胁迫对甜瓜幼苗初始荧光(Fo)和表观光合电子传递速率(ETR)的影响Fig.2 Effects of low temperature stress on the FOand ETR ofmelon seed lings
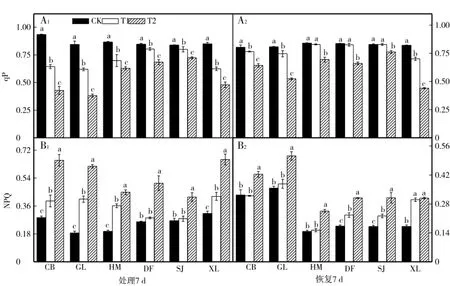
图3 低温胁迫对甜瓜幼苗光化学淬灭系数(qP)显著降低和非光化学淬灭系数(NPQ)的影响Fig.3 Effects of low temperature stress on the qPand NPQ ofmelon seed lings
从图4-A1和图4-B1可以看出,与各自对照相比,低温胁迫7 d后,6个甜瓜品种幼苗叶片PSⅡ调节性能量耗散比例[Y(NPQ)]和PSⅡ非调节性能量耗散比例[Y(NO)]显著升高(CB品种T1除外),且各个品种升高幅度不同;GL和SJ品种T1处理结束恢复7 d与对照相比Y(NPQ)差异不明显,T2处理差异显著,其他4个品种低温胁迫结束恢复7 d后Y(NPQ)仍显著高于对照(图4-A2)。由图4-B2可见,CB、HM和DF品种T1处理结束恢复7 d与对照相比Y(NO)差异不明显,T2处理差异显著,GL和XL品种低温胁迫结束恢复7 d后仍显著高于对照,SJ品种T1处理结束恢复7 d与对照相比显著降低,T2显著升高。
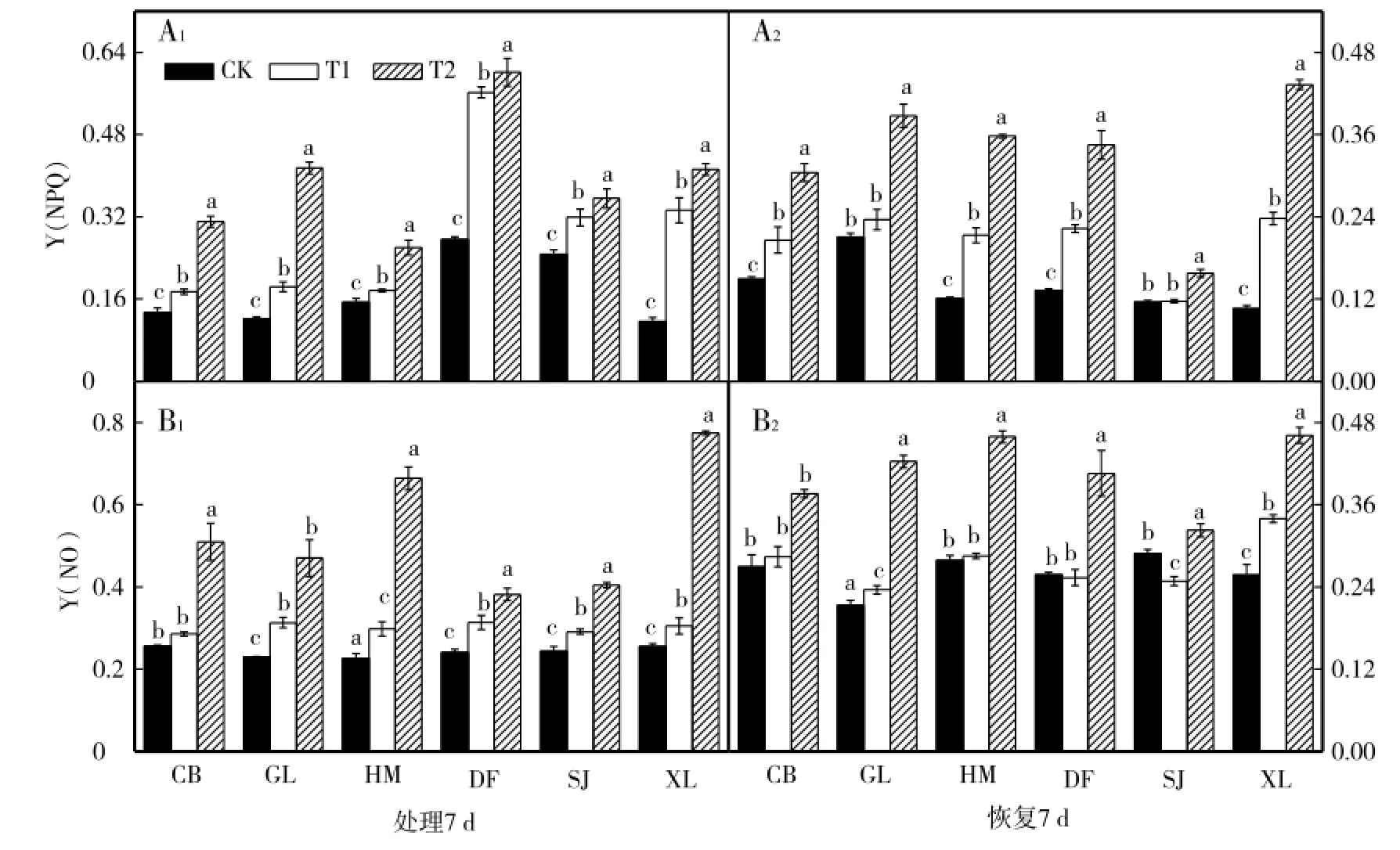
图4 低温胁迫对甜瓜幼苗光PSⅡ调节性能量耗散比例[Y(NPQ)]和PSⅡ非调节性能量耗散比例[Y(NO)]的影响Fig.4 Effects of low temperature stress on the Y(NPQ)and Y(NO)ofmelon seed lings
2.4 低温胁迫及恢复对甜瓜幼苗抗氧化酶活性的影响
从图5-A1可以看出,与各自对照相比,T1处理7 d后,6个甜瓜品种SOD活性显著升高,T2处理7 d后,不同的甜瓜品种变化不同,其中CB和SJ品种SOD活性继续升高,且SJ品种各处理间差异显著,HM品种T2与T1相比显著降低,但高于对照,GL和DF品种T2与对照相比显著降低,XL品种与对照相比差异不大;低温处理结束恢复7 d,CB、SJ和XL品种各处理间差异均不显著,HM品种T1处理结束恢复7 d与对照接近,T2处理差异显著,GL和DF品种低温胁迫结束恢复7 d后各处理间差异仍显著(图5-A2)。由图5-B1可见,与各自对照相比,不同低温胁迫7 d后,6个甜瓜品种幼苗叶片POD活性显著降低(CB品种T1除外),且各个品种降低幅度不同;其中GL、DF和XL品种低温胁迫结束恢复7 d后POD活性各处理间差异仍显著,CB、HM和SJ品种T1处理结束恢复7 d与对照相比差异不显著,T2处理差异显著(图5-B2)。
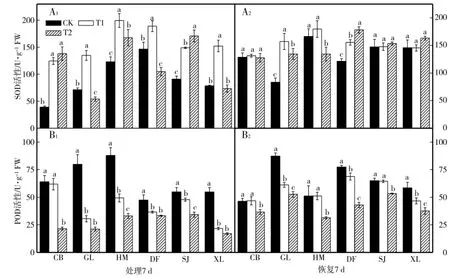
图5 低温胁迫对甜瓜幼苗光SOD和POD活性的影响Fig.5 Effects of low tem perature stress on the SOD and POD activity ofmelon seedlings
与各自对照相比,低温胁迫后CB、GL和HM品种CAT活性降低,且各处理间差异显著(图6-A1),SJ和XL品种CAT活性无显著变化,DF品种T1处理差异不显著,T2处理差异显著;由图6-A2可以看出,GL品种低温胁迫结束恢复7 d后CAT活性各处理间差异仍显著,DF品种T1处理结束恢复7 d与对照相比差异不显著,T2处理差异显著,其余4个品种低温胁迫结束恢复7 d后与对照相比差异均不显著。从图6-B1可以看出,与各自对照相比,低温胁迫7 d后,6个甜瓜品种APX活性降低(SJ品种T1除外),但各品种降低幅度不同,其中CB、GL和HM品种APX活性与对照相比差异显著,DF和XL品种T1处理差异不显著,T2处理差异显著,SJ品种与对照相比,TI和T2处理差异均不显著;6个甜瓜品种低温胁迫结束恢复7 d后APX活性变化与CAT活性相一致(图6-B2)。
2.5 低温胁迫及恢复对甜瓜幼苗可溶性蛋白和脯氨酸含量的影响
从图7-A1可以看出,与各自对照相比,低温胁迫7 d后,6个甜瓜品种可溶性蛋白含量升高,但各品种升高幅度不同,其中CB、GL和HM品种与对照相比差异显著,其他3个品种T1处理差异不显著,T2处理差异显著;SJ品种低温结束恢复7 d后各处理接近,DF品种低温胁迫结束恢复7 d后可溶性蛋白含量仍升高,且与对照相比差异显著,其他4个品种T1处理结束恢复7 d与对照相比差异不明显,T2处理差异显著(图7-A1)。由图7-B1可见,与各自对照相比,低温胁迫7 d后,6个甜瓜品种脯氨酸含量显著升高,其中SJ品种升高幅度最低;低温胁迫结束恢复7 d,SJ品种低温结束恢复7 d后各处理接近,DF品种T1处理结束恢复7 d与对照相比差异不显著,T2处理差异显著,其他4个品种低温胁迫结束恢复7 d后各处理间差异仍显著(由图7-B2)。
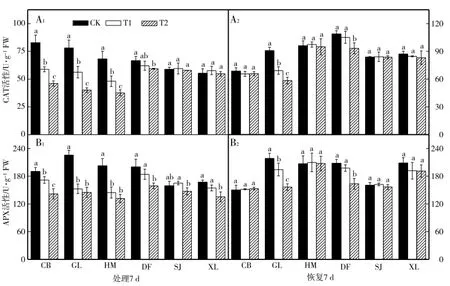
图6 低温胁迫对甜瓜幼苗光CAT和APX活性的影响Fig.6 Effects of low tem perature stress on the CAT and APX activity ofm elon seed lings
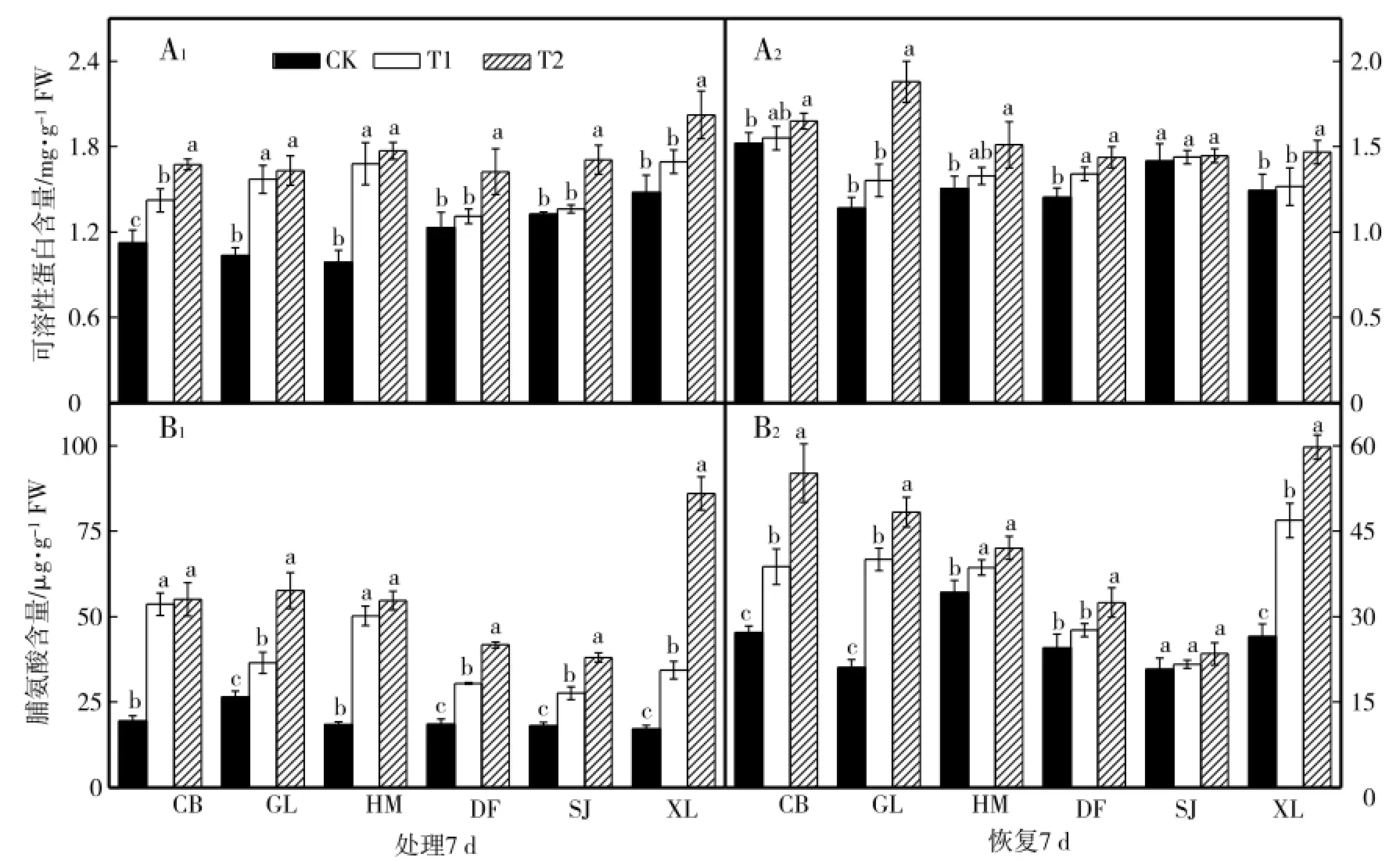
图7 低温胁迫对甜瓜幼苗光可溶性蛋白和脯氨酸含量的影响Fig.7 Effects of low temperature stress on the soluble protein and proline contents ofm elon seed lings
3 讨论与结论
3.1 低温胁迫及恢复对甜瓜幼苗生长量的影响
低温胁迫条件下,植物幼苗生长受到抑制,生物量积累下降[13]。高清海等[14]报道亚低温条件下甜瓜幼苗的生长受到抑制,表现在株高、茎粗和植株鲜质量显著降低。本研究中,不同低温胁迫对不同甜瓜品种幼苗生长抑制表现不同,低温胁迫对SJ品种生长影响最小,对CB和GL品种影响最大,低温胁迫结束后恢复7 d,SJ品种株高、茎粗、叶面积及地上鲜重基本上均与对照无显著差异,说明此品种对低温具有较强的适应能力。而CB和GL品种低温胁迫结束后恢复7 d,其叶面积和地上鲜重显著低于对照。这与胡俊杰等[15]和李琦等[16]报道相一致,低温胁迫后,耐低温材料受抑制程度显著小于低温敏感材料。
3.2 低温胁迫及恢复对甜瓜幼苗光合作用的影响
植物进行光合作用的主要色素是叶绿素,影响着植物光合作用的强弱,而且与植物的耐寒性也有一定关系[17]。苗微等[18]研究认为,低温处理下植株的叶绿素含量降低,但各品种降幅程度不同,且在温度恢复后叶绿素含量变化表现也不同,SJ和CB品种T1处理结束后恢复7 d,叶绿素含量与对照水平接近,DF品种叶绿素含量温度恢复后下降幅度继续增加,表明其叶绿素合成酶破坏严重。
叶绿体吸收的光能除用于光合作用外,还有一部分在形成同化力之前以热耗散的形式流失和以荧光的形式重新发射出来[19-20]。逆境胁迫后,Fo下降被认为与叶黄素循环有关,Fo上升表明PSⅡ反应中心失活[21]。在本研究中,低温胁迫下6个甜瓜品种幼苗叶片的Fo和ETR上升,说明低温胁迫引起甜瓜幼苗光抑制现象发生,抑制了PSⅡ的活性,植株叶片的捕光能力降低[22]。经过7 d的恢复,SJ品种Fo和ETR均恢复到对照水平,表明PSⅡ反应中心失活为可逆失活,此品种具有较好的抗低温性;DF和HM品种T1处理结束后,经过7 d的恢复,Fo和ETR均恢复到对照水平,T2处理未恢复到对照水平,可能T2低温处理使其PSⅡ反应中心严重失活,而GL品种T1和T2两个处理均未恢复到对照水平,表明其抗低温性差。NPQ和Y(NPQ)表示PSⅡ天然色素吸收的光能中不能用于光合电子传递而以热的形式耗散的部分,是植物的一种自我保护机制,对光合机构起一定的保护作用[23-24]。Y(NO)是所有即不会引起光化学反应也不包含在非光化学淬灭机制里的非辐射去激发途径的量子效率之和,主要反映了因PSⅡ反应中心关闭所导致的以热和荧光形式进行的耗散[25-26]。低温胁迫后,6个甜瓜品种的NPQ、Y(NPQ)和Y(NO)均有所上升,qP降低,表明幼苗利用自身的保护机制使过剩的激发能通过非光化学途径耗散,阻止了由于激发能积累引起的PSⅡ的损伤[24,27]。低温结束后经7 d恢复,不同品种各指标表现不同,没有一定的规律性,由于4个指标相互作用与制约,是否能作为反应甜瓜耐低温性的一个指标,还需要进一步试验论证。
3.3 低温胁迫及恢复对甜瓜幼苗抗氧化特性的影响
植物在逆境条件下能够通过调节体内一系列生理生化过程来提高对逆境的抵御能力,关于植物在低温胁迫过程中,抗氧化酶活性变化规律,不同作物及同一作物不同品种研究结果差异较大。有研究结果表明,低温处理后,茄子保护酶活性全部升高[13]。马德华等[29]研究表明,黄瓜经4℃低温胁迫后,CAT和POD活性均显著下降,但耐寒性强的品系SOD活性上升,耐寒弱的品系SOD下降。在本试验中,6个甜瓜品种的POD、CAT和APX活性随着胁迫温度的降低呈降低的变化趋势(SJ和XL品种除外),低温胁迫后经7 d恢复,CB、HM、SJ和XL品种CAT和APX活性恢复到对照水平,说明其低温处理对这几个品种膜系统伤害较轻;而SOD活性变化较为复杂,SOD也是植物细胞中最重要的清除活性氧的酶类之一,是植物防御体系中的第一道防线,所以,在低温胁迫下,植物中的SOD活性的强弱直接关系到抵御低温伤害的能力[30],其中SJ和CB品种随着胁迫温度的降低而逐渐升高,SOD活性的上升是植物对低温伤害开始的防御反应,由此减缓伤害的程度,低温胁迫结束后经7 d的恢复后,这两个品种SOD活性恢复到对照水平,HM品种随着胁迫温度的降低先升高后降低,T2处理结束后经7 d的恢复后,与对照相比,差异显著,表明T2低温处理对此品种造成了不可逆的伤害。
低温胁迫下有关脯氨酸的研究较多,均认为脯氨酸含量增加与耐低温性有关[31]。本试验表明低温胁迫后,6个甜瓜品种脯氨酸含量显著升高,其原因是由于脯氨酸的积累,使细胞含有较多的自由水,维持了细胞的正常代谢。同时对生物体的多聚体的空间结构有保护作用,增加了细胞膜的稳定性。脯氨酸还能促进蛋白质水合作用,对水分有效渗透调节,提高抵御低温的能力[32]。对于耐低温性较强的SJ品种在低温结束后经7 d恢复,脯氨酸和可溶性蛋白含量恢复到对照水平。
植物的抗寒能力是由多种因素共同作用形成的复杂的复合性状,单因素存在一定的片面性,多因素结合分析可以较全面地体现植物真实的抗寒能力。该研究通过测定不同甜瓜品种的生长量、叶绿素含量、叶绿素荧光参数、抗氧化酶活性、可溶性蛋白和脯氨酸含量等相关指标,分析各个指标与植物抗寒能力的相关性。综合以上指标,可以推断SJ品种具有较强的抗低温能力。
[1]林德佩,吴大康,齐三魁.中国甜瓜[M].北京:科学普及出版社,1991.
[2]徐小军,张桂兰,周亚峰,等.甜瓜幼苗耐冷性相关生理指标的综合评价[J].果树学报,2015,32(6):1187-1194.
[3]吴梅梅,张显,郑俊骞,等.西瓜甜瓜抗寒性研究进展[J].中国瓜菜,2014,27(SI):1-5.
[4]和红云,薛琳,田丽萍,等.低温胁迫对甜瓜幼苗叶绿素含量及荧光参数的影响[J].北方园艺,2008(4):13-16.
[5]吕星光,周梦迪,李敏.低温胁迫对甜瓜嫁接苗和自根苗生长及生理特性的影响[J].中国蔬菜,2016(5):53-57.
[6]董玉梅,焦自高,王崇启,等.低温弱光胁迫对网纹甜瓜嫁接苗与自根苗某些物质含量的影响[J].山东农业大学学报(自然科学版),2005,36(1):67-69.
[7]李琦.低温弱光对甜瓜幼苗生理特性的影响[D].武汉:华中农业大学,2012.
[8]王加蓬,蔡焕杰,王健,等.温室膜下滴灌甜瓜初花期叶面积动态变化与增长模型研究[J].节水灌溉,2009(1):27-30.
[9]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[10]钱永强,周晓星,韩蕾,等.Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J].生态学报,2011,31(20):6134-6142.
[11]郑有飞,赵泽,吴荣军,等.臭氧胁迫对冬小麦光响应能力及PSⅡ光能吸收与利用的影响[J].生态学报,2010,30(24):6771-6780.
[12]张殿忠,汪沛洪,赵会贤.测定小麦叶片游离脯氨酸含量的方法[J].植物生理学通讯,1990(4):64-65.
[13]吴雪霞,杨晓春,查丁石,等.茄子幼苗耐低温性生理机制的研究[J].上海农业学报,2013,29(5):45-49.
[14]高清海,贾双双,苗永美,等.亚低温条件下外源褪黑素对甜瓜幼苗氮代谢及渗透调节物质的影响[J].应用生态学报,2016,27(2):519-524.
[15]胡俊杰,郭世荣,徐刚,等.低温胁迫对菜用大豆生长、叶片活性氧及多胺代谢的影响[J].浙江农业学报,2011,23(6):1113-1118.
[16]李琦,别之龙,牛蒙亮,等.不同低温处理对甜瓜幼苗生长和根系生理特性的影响[J].长江蔬菜,2011(24):25-29.
[17]赵杨,邹应斌.4个早稻品种苗期低温胁迫的耐寒性比较[J].作物研究,2014,28(6):581-584.
[18]苗微,王国桥,马殿荣,等.辽宁省杂交稻幼苗对低温胁迫的生理响应[J].中国水稻科学,2011,25(6):639-644.
[19]MAXWELL K,JOHNSON G N.Chlorophyll fluorescence-a practical guide[J].Journal of Experimental Botany,2000,51(345):659-668.
[20]JIANGCD,GAOH Y,ZOUQ.Changes of donor and accepter side in photosystemⅡcomplex induced by iron deficiency in attached soybean and maize leaves[J].Photosynthetica,2003,41(2):267-271.
[21]DEMMIGG,ADAMSB,ADAMSW W.Photoprotection and other responses of plants to high light stress[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43:599-626.
[22]ZHU X C,SONG F B,XU H W.Arbuscular mycorrhizae improves low temperature stress in maize via alteration in host water status and photosynthesis[J].Plant Soil,2010,331:129-137.
[23]陈友根,朱世东,王冬良,等.嫁接对薄皮甜瓜叶绿素荧光参数的影响[J].中国农学通报,2008,24(7):221-225.
[24]卢广超,许建新,薛立,等.低温胁迫对4种幼苗的叶绿素荧光特性的影响[J].中南林业科技大学学报,2014,34(2):44-49.
[25]WANG L J,LOESCHERW,DUANW,etal.Heatacclimation induced acquired heat tolerance and crossadaptation in differentgrape cultivars:relationships to photosynthetic energy partitioning[J].Functional Plangt Biology,2009,36(6):516-526.
[26]BUSCH F,HUNTER N PA,ENSMINGER I.Biochemical constrains limit the potential of the photochemical reflectance index as a predictor of effective quantum efficiency of photosynthesis during the winter-spring transition in JACK pine seedlings[J].Functional Plant Biology,2009,36(11):1016-1026.
[27]COSTA E S,BRESSAN-SMITH R,OLIVEIRA JG,et al.Chlorophyll a fluorescence anaslysis in response to excitation irradiance in bean plants(Phɑseolus vulgɑris L.and VignɑunguiculɑtɑL.WALP)submitted to high temperature stress[J].Photosynthetica,2003,41(1):77-82.
[28]李建明,黄志,王忠红.低温锻炼对冷胁迫下甜瓜幼苗抗氧化酶活性与质膜透性的影响[J].西北农业学报,2007(1):168-171.
[29]马德华,孙其信.温度逆境对不同品种黄瓜幼苗膜保护系统的影响[J].西北植物学报,2001,21(4):656-661.
[30]刘玉凤,李天来,高晓倩.夜间低温胁迫对番茄叶片活性氧代谢及AsA-GSH循环的影响[J].西北植物学报,2011,31(4):707-714.
[31]李凯,杨建平,马宁,等.低温处理对裸仁南瓜幼苗抗寒性指标的影响[J].山东农业科学,2009(1):52-54.
[32]刘景安,孙玉文,祁家保,等.持续亚低温对甜瓜幼苗生理生化指标的影响[J].中国农学通报,2008,24(11):240-242.
(责任编辑:张睿)
Effects of low temperature treatment and recovery on the photosynthesis and antioxidantcharacteristics in melon seedlings
ZHANG YONG-ping,YAO Xue-qin*,YANG Shao-jun,XU Shuang,CHEN You-yuan**
(Horticulturɑl Reseɑrch Institute,Shɑnghɑi Acɑdemy of Agriculturɑl Sciences,Shɑnghɑi Key Lɑborɑtory of Protected Horticulturɑl Technology,Shɑnghɑi201403,Chinɑ)
Six varieties ofmelon seedlings were used to study the effects of low temperature stress on the growth,chlorophyll content,chlorophyll fluorescence and antioxidant enzyme activity after 7 d stress under(18±1)℃/(12±1)℃(T1)and(12±1)℃/(6±1)℃(T2)in day/night[(28±1)℃/(22±1)℃,CK],and recovery in(28±1)℃/(22±1)℃.The results showed that under low temperature stress the growth of all the seedlings were affected in varying degrees,T2 wasmore affected than T1.Under low temperature,every index of SJvariety decreased or increased in different degrees,but every index of T1 were closed to the control,the plants growth(expect shoot fresh weight),Fo and ETR,antioxidant enzyme activity(expect POD),proline and soluble protein content of T2 were closed to the control after recovered for7 d.Itwas suggested that the effectof low temperature stress on the SJvariety damage was reversible,the result of comprehensive screening showed that the chilling tolerance of SJwas better.
Melon;Low temperature stress;Photosynthesis;Antioxidant characteristics
S652
A
1000-3924(2017)01-041-09
2016-02-29
上海市瓜果产业技术体系[沪农科产字(2017)第1号];上海市科委重点攻关项目(14391900900);上海市闵行区科技项目(2015MH198)
张永平(1976—),女,硕士,副研究员,研究方向:甜瓜育种,E-mail:zyp123944@126.com
*共同第一作者
**通信作者,E-mail:yy12@saas.sh.cn

