陆地棉m iR397b的生化功能验证
丁 妍,王燕美,刘进元
(清华大学生命科学学院植物生物学研究中心植物分子生物学实验室,北京 100084)
陆地棉m iR397b的生化功能验证
丁 妍,王燕美,刘进元*
(清华大学生命科学学院植物生物学研究中心植物分子生物学实验室,北京 100084)
植物中的漆酶(LAC)作为蓝铜氧化酶家族的一个分支,可以聚合木质素单体形成木质素。拟南芥、番茄中miR397b可以调控LAC蛋白家族的表达,但验证棉花中miR397b生化功能的相关报道目前尚无。选取开花后25 d的陆地棉纤维材料,通过RLM-5’RACE试验,验证了对GhLAC4 mRNA的切割发生在miR397b和GhLAC4的互补区域,即证明了GhLAC4是miR397b的靶基因。本研究预示着GhmiR397b可能参与棉花纤维中木质素的形成过程,为研究GhLAC4在棉花纤维发育过程中的调控作用提供了基础。
陆地棉;纤维发育;miR397b;GhLAC4;靶基因;生化功能;降解
漆酶(laccase enzymes,LAC)是一种能够结合多个铜离子的酚氧化酶[1],可以把苯二酚氧化成苯醌,同时生成水;在生物体内,一些漆酶可以聚合木质素单体形成木质素[2]。漆酶最先在漆树中被发现[3],因为单体被它催化聚合形成的木质素属于维管系统[4-5],所以在高等植物中广泛表达[6]。此外,在昆虫、微生物等多种生物中也发现了漆酶[2,5,7]。在拟南芥中有17种漆酶家族蛋白[7],其中LAC4、LAC11、LAC15、LAC17共4种漆酶蛋白参与木质素的合成[8-10]。虽然植物中漆酶参与木质素生物合成有据可查,但是与漆酶调控有关的生理功能有待探究。
MicroRNA是一类由21—24个核苷酸组成的内源性单链小分子RNA[11],可以在转录水平上调控目的基因表达[12],是植物对其生长发育及生理代谢调控的一种重要方式[13-15]。在现在已知的miRNA中,拟南芥中miR397、miR408、miR857,水稻中miR528已被证实可以调控漆酶的表达[16-17],说明植物中木质素在基因表达的转录后水平上受miRNA调控。
MicroRNA中的miR397家族是漆酶的重要转录后调控因子,但是具体靶向作用未得到证实。杨树中miR397a是LAC的负调控因子,预示着在木质形成过程中miRNA对木质素的形成有调控作用[10]。水稻中miR397通过负调控LAC基因的表达,影响对植株油菜素甾醇的敏感性,从而影响种子颗粒大小[18],这说明由miRNA调控的漆酶表达可能在木质素合成以外的其他生物过程中起作用[19],增加了研究miRNA对LAC家族基因表达调控的重要性。通过生物信息学方法预测[17,20],拟南芥中miR397可能直接切割LAC2、LAC4、LAC17 mRNA[1,7,21],但是并未得到证实。
棉花属于经济作物,不仅是天然纤维的最重要来源,也是一种重要的模式生物,在植物研究尤其是单子叶植物研究中占有重要的地位[22]。棉纤维的发育过程中已有深入研究[23-25],虽然木质化程度高,但是其中关于miRNA切割LACmRNA的研究甚少。为了研究棉花纤维中LAC是否是miR397b的靶基因,本研究以陆地棉(Gossypium hirsutum)开花后第25天纤维为材料,利用RLM-5’RACE试验方法,在体外检测GhmiR397b能否切割降解GhLAC4 mRNA。结果表明:GhLAC4 mRNA在与miR397b的配对区域的5’端第10个核苷酸处被降解,说明GhLAC4是GhmiR397b的靶基因,揭示了GhmiR397b对GhLAC4基因的切割作用。本研究的结果可为研究miRNA调控棉花纤维细胞生长发育提供有力线索。
1 材料与方法
1.1 材料
棉花品种为陆地棉‘中棉35’(Gossypium hirsutum.cv CRI35),由中国农业科学院棉花研究所提供;克隆载体pEasy Blunt Simple、感受态细菌Trans1-T1、Ex Taq、DNase、T4 DNA连接酶、各种限制性内切酶以及Real-time试剂盒购自TaKaRa公司;反转录试剂盒RNA PCR Kit(AMV)购于上海生物工程公司;琼脂糖凝胶回收试剂盒、植物总RNA提取试剂盒、DNA marker购自北京Tiangen公司;RLM-5’RACE试剂盒First Choice©RLM-RACE Kit购自Ambion公司,其他试剂均为国产分析纯以上。引物合成以及克隆载体测序在上海生工生物技术公司完成。
1.2 方法
1.2.1 棉花纤维细胞总RNA提取
摘取棉花开花后25 d棉桃,迅速置于液氮中冷冻,在液氮中充分研磨纤维,提取总RNA。确保总RNA不降解是本试验可靠性和成功率的关键所在,由于空气中含有RNA降解酶,提取总RNA、富集mRNA和反转录形成cDNA的试验中几乎所有器具都要保证RNase-free。
1.2.2 mRNA的富集
mRNA富集的原理是Oligo(dT)纤维素(以下简称纤维素)含有的多聚dT可以与mRNA 3’末端的polyA尾结合,从而吸附并富集mRNA。
1.2.3 植物RNA反转录合成cDNA
用反转录试剂盒RNA PCR Kit(AMV)反转录富集后的mRNA,按照说明书配制反应体系,反应条件:50℃30 h;95℃5 min。
1.2.4 RLM-5’RACE试验
用Tdt酶向cDNA 5’端连接dATP,条件为37℃30 min。然后用PCR法把5’RACE接头(5’-GCTGATGGCGATGAATGAACACTGCGTTTGCTGGCTTTGATGATTTTTTTTTTTTT-3’)与poly dATP连接,该连接反应的条件:95℃5 min,40℃30 s,72℃10 min,1个循环。接着以cDNA第一条链作模板,以5’端外侧引物和3’端外侧引物(表1)进行第一轮巢式PCR扩增。以第一轮巢式PCR产物为模板,以5’端内侧引物和3’端内侧引物(表1)进行第二轮巢式PCR扩增。

表1 RLM-5’RACE试验引物序列Table 1 Prim er sequence for RLM-5’RACE
1.2.5 电泳检测及PCR产物回收
为了更好区分目的片段,用2%琼脂糖凝胶和DL2000 DNAmarker检测PCR结果,如果DNA条带大小符合预期,则可以进行PCR扩增。使用2%浓度的琼脂糖凝胶和DL2000 DNAmarker对PCR扩增产物进行电泳,用120 V电压40 min,用成像系统保存图像,切取目标条带进行回收PCR产物回收。
1.2.6 连接克隆载体
把回收得到的靶标基因DNA连接到克隆载体pEASY-Blunt Simple上。按照说明书构建连接体系,连接条件为25℃,反应时间30 min。
1.2.7 转化重组质粒
将连接产物加入30μL Trans-T1感受态中,冰上静置30 min。42℃热激90 s,立即放于冰上3 min。然后加1 mL LB液体培养基,37℃摇动培养1 h。把8μL 500 mM IPTG溶液与40μL 20 mg/mL X-gal溶液混合后,均匀地涂在含氨苄青霉素和卡纳青霉素抗性的平板上培养基上。待IPTG、X-gal被吸收后,1 mL LB液体培养基(含转化菌)4 000 r/min离心1 min,弃置部分上清液。保留200μL上清用来悬浮菌体,取150μL全部菌液涂板,37℃培养过夜。
1.2.8 阳性菌落筛选
挑取单菌落,各自加入1 mL含氨苄青霉素和卡纳青霉素抗性的液体LB培养基,振荡培养1 h。用菌落PCR法筛选阳性菌,即在普通PCR体系的基础上,DNA来源为少量菌液。用1.5%琼脂糖凝胶电泳检测菌落PCR产物,如果条带大小符合预期,则可以过夜培养,提取质粒。
1.2.9 提取质粒并测序
用碱裂解法提取菌液的质粒,进行测序。如果测序结果表明GhLAC4 mRNA被切割的位点在与GhmiR397b互补序列的3’端第10个核苷酸附近,则说明GhLAC4是GhmiR397b的靶基因。
1.2.10 小RNA文库的构建和Illumina测序
以陆地棉开花后第5天、第10天、第15天、第20天、第25天纤维的RNA为材料,各自用10μg来构建小RNA文库。操作流程为:(1)用15%的变性PAGE分离纯化18—30个核苷酸的小RNA;(2)连接5’RNA接头(5’GUUCAGAGUUCUACAGUCCGACGAUC);(3)连接3’RNA接头(5’UCGUAUGCCGUCUUCUGCUUGU);(4)根据3’RNA接头序列设计引物(5’CAAGCAGAAGACGGC-ATACGA)反转录小RNA,合成cDNA链;(5)再根据5’和3’RNA接头序列设计引物(5’AATGATACGGCGACCACCGACAGGTTCAGAGTTCTACAGTCCGA,5’CAAGCAGAAGACGGCATACGA),以上述步骤的cDNA链为模板进行PCR扩增,然后纯化PCR产物,构建测序库;(6)通过接头序列将测序库中的片段连接到光学透明的玻璃表面上,桥式PCR扩增形成数以亿计的簇,每个簇都具有数千份相同模板;(7)利用Illumina Hiseq 2000测序仪,通过四种荧光标记染,通过可终止性的边合成边测序技术进行测序(测序引物5’CGACAGGTTCAGAGTTCTACAGTCCGACGATC),通过CCD采集荧光信号,合成一个碱基的同时即将生成光信号转换为核酸信息。
1.2.11 测序结果的初步处理及miR397b丰度检测
通过高通量测序得到的小RNA序列在获得高质量读数之前,需要先去掉低质量读数。所谓高质量读数,一般认为1—30个碱基中不含N(无法辨别碱基种类时,用N表示)、质量值低于10的位点不超过4个且质量值低于13的位点不超过6个的片段为高质量序列。获得高质量序列之后,去掉小于18个核苷酸的小片段、接头序列、polyA序列,剩余的序列就是清洁读数(Lean reads)。
把清洁读数和miRBase中所有的miRNA序列进行比对,如果miRNA序列库中的序列与已知的GhmiRNA397b的序列的错配数小于等于2个,则认为该序列即为GhmiRNA397b。
2 结果与分析
2.1 GhLAC4 mRNA 5’端残余片段的电泳检测
如前所述,植物中miR397b可以调控LAC4的表达,且陆地棉中GhLAC4 mRNA与GhmiR397b存在互补序列,由此预测GhmiR397b可能通过与GhLAC4 mRNA的互补序列相互识别,GhmiR397b对GhLAC4 mRNA进行切割。
在植物中,miRNA对靶基因mRNA的进行切割的位点具有一定的规律。这个切割位点通常位于mRNA与miRNA的互补区域,具体在miRNA 5’端第10个和第11个核苷酸之间。通过RLM-5’RACE试验,把GhLAC4 mRNA被降解后的残余片段在体外逆转录成cDNA,经过巢式PCR扩增得到电泳条带。琼脂糖电泳结果(图1)显示,通过设计引物扩增获得的片段大小约为430 bp,说明GhLAC4 mRNA被切割的位点在GhmiR397b与GhLAC4 mRNA互补区域附近,符合本研究的预期。这符合miRNA降解规律,说明GhLAC4是miRNA的靶基因。
2.2 GhLAC4 m RNA 5’端残余片段扩增后的测序结果
把上述带有约为430 bp扩增条带的质粒进行测序,测序结果(图2)显示,GhLAC4 mRNA的切割位点在与GhmiR397b互补序列的3’端第10个核苷酸处。箭头表示发生降解的位点,数值表示该处发生降解的克隆数与测序的克隆总数的比值。实线表示TC279559(GhLAC4)mRNA与GhmiR397b序列碱基互补配对完全正确,虚线表示碱基互补配对有误。
在RLM-5’RACE试验中,琼脂糖凝胶电泳检测扩增片段大小符合预期,且测序结果表明扩增的GhLAC4残余片段的被降解位点在与miR397b互补序列的5’端第10个核苷酸处,符合miRNA降解规律,为GhLAC4是GhmiR397b的靶基因提供了有力证据。
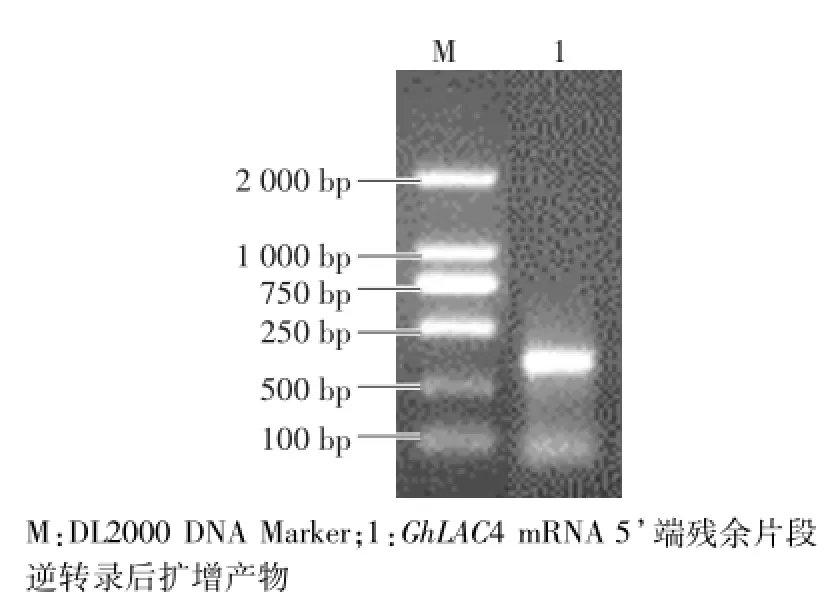
图1 GhLAC4 mRNA 5’端残余片段的琼脂糖电泳图Fig.1 Agarose gel electrophoresis of GhLAC4 mRNA 5’cleavage fragm ents
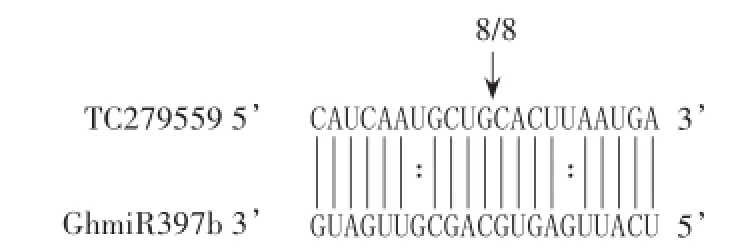
图2 Ghm iR397b对TC279559(GhLAC4)mRNA靶向降解作用示意图Fig.2 The cleavage site of TC279559(GhLAC4)mRNA targeted by GhmiR397b
2.3 棉花纤维发育过程中Ghm iR397b的丰度变化
miRNA归一化读取(Reads per ten million,RPTM)是每一千万个清洁读数中目标miRNA的个数,被用来评估每个miRNA的相对丰度。实际计算和比较中,由于miRNA的归一化读数数字较大,常用log2RPTM表示miRNA的丰度。
由图3可见,棉花纤维发育过程中,随着开花后天数增加,GhmiR397b的丰度存在变化。开花后第5天、第10天棉花纤维细胞中GhmiR397b丰度较高,第15天、第20天、第25天时GhmiR397b丰度较高逐渐下降。
在棉花纤维发育过程中,开花后第0—5天胚珠表皮细胞发育成纤维,即第5天时所需LAC4表达量较少,这与GhmiR397b较高的丰度相符合;第5—25天纤维细胞快速伸长,木质素越到后期越需大量合成[26],即需要LAC4表达量越来越多,这与GhmiR397b较丰度逐渐减少相符合。
近年来研究发现,水稻中miR397可以通过负调控LAC基因表达,影响对植株油菜素甾醇的敏感性,过表达OsmiR397能够增加种子大小、促进圆锥花序分枝和增加主穗粒数,从而使得田间试验中谷粒总产量增加25%[18],这些研究增加了miR397调控LAC基因表达的重要性。另外,生物信息学的方法预测出拟南芥中miR397可能切割LAC2、LAC17 mRNA,miR397调控LAC基因表达的研究仍然需要进一步深入。
在RLM-5’RACE试验中,靶基因mRNA被降解后的残余片段很少,很多情况下即使有残余片段也很难检测出来,造成假阴性结果,这也是RLM-5’RACE试验虽然能直接证明靶向降解作用,但是并未被广泛使用的重要原因。本试验对RLM-5’RACE试验做出了重要改进,即在提取总RNA之后,通过富集mRNA增加mRNA的纯度,从而增加靶基因mRNA被降解后的残余片段被正确扩增的可能性。RLM-5’RACE试验技术如果被进一步改进,实现miRNA在靶基因上的降解位点的批量、快速、准确检测,会是miRNA的功能研究的一个强有力的助力。
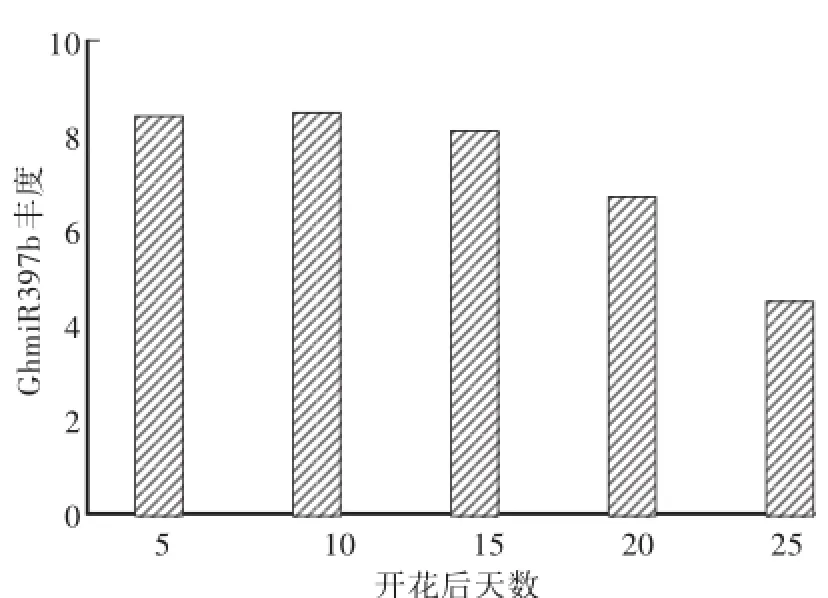
图3 陆地棉纤维细胞发育过程中m iR397b的丰度变化Fig.3 Content variation ofm iR397b at different fiber developm ental stages
3 结论
本研究以陆地棉‘中棉35’纤维为材料,提取中RNA后在体外把GhLAC4被割的残余片段逆转录成cDNA,并用RLM-5’RACE方法进行扩增。琼脂糖凝胶电泳检测扩增片段大小符合预期,且测序结果表明GhLAC4 mRNA的切割位点在与GhmiR397b互补序列的5’端第10个核苷酸处,且GhmiR397b的丰度变化与木质素含量变化有一定负相关关系,这些分析结果都为GhLAC4是GhmiR397b的靶基因提供了有力证据,预示着miR397b在棉花纤维中木质素的形成过程中起调控作用。本研究的结果可为miRNA调控棉花纤维细胞生长发育的分子机制研究提供了有力线索。
[1]ABDEL-GHANY S E,PILON M.MicroRNA-mediated systemic down-regulation of copper protein expression in response to low copper availability in Arɑbidopsis[J].JBiol Chem,2008,283(23):15932-15945.
[2]MAYER A M,STAPLESR C.Laccase:new functions for an old enzyme[J].Phytochemistry,2002,60(6):551-565.
[3]LUS,SUNY H,AMERSONH,etal.MicroRNAs in loblolly pine(Pinus tɑedɑL.)and theirassociationwith fusiform rustgalldevelopment[J]. Plant J,2007,51(6):1077-1098.
[4]BANKS JA,NISHIYAMA T,HASEBE M,et al.The Selaginella genome identifies genetic changes associated with the evolution of vascular plants[J].Science,2011,332(6032):960-963.
[5]BAIMA S,POSSENTIM,MATTEUCCIA,et al.The arabidopsis ATHB-8 HD-zip protein acts as a differentiation-promoting transcription factor of the vascularmeristems[J].Plant Physiol,2001,126(2):643-655.
[6]NOVAESE,KIRSTM,CHIANG V,et al.Lignin and biomass:a negative correlation for wood formation and lignin content in trees[J].Plant Physiol,2010,154(2):555-561.
[7]MCCAIG B C,MEAGHER R B,DEAN JF.Gene structure and molecular analysis of the laccase-likemulticopper oxidase(LMCO)gene family in Arɑbidopsis thɑliɑnɑ[J].Planta,2005,221(5):619-636.
[8]BERTHET S,DEMONT-CAULET N,POLLET B,et al.Disruption of LACCASE4 and 17 results in tissue-specific alterations to lignification of Arɑbidopsis thɑliɑnɑstems[J].Plant Cell,2011,23(3):1124-1137.
[9]LIANG M,DAVISE,GARDNER D,et al.Involvement of At LAC15 in lignin synthesis in seeds and in root elongation of Arɑbidopsis[J]. Planta,2006,224(5):1185-1196.
[10]LU S,LIQ,WEIH,et al.Ptr-miR397a is a negative regulator of laccase genes affecting lignin content in Populus trichocɑrpɑ[J].Proc Natl Acad SciU SA,2013,110(26):10848-10853.
[11]ARAZIT,TALMOR-NEIMAN M,STAV R,et al.Cloning and characterization ofmicro-RNAs from moss[J].Plant J,2005,43(6):837-848.
[12]CHEN C,RIDZON D A,BROOMER A J,et al.Real-time quantification ofmicroRNAs by stem-loop RT-PCR[J].Nucleic Acids Res,2005,33(20):e179.
[13]BRODERSEN P,VOINNET O.Revisiting the principles ofmicroRNA target recognition andmode ofaction[J].Nat Rev Mol Cell Biol,2009,10(2):141-148.
[14]FILIPOWICZW,BHATTACHARYYA SN,SONENBERG N.Mechanisms of post-transcriptional regulation by microRNAs:are the answers in sight?[J].Nat Rev Genet,2008,9(2):102-114.
[15]CHOMCZYNSKIP,SACCHIN.Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction[J].Anal Biochem,1987,162(1):156-159.
[16]LIY F,ZHENG Y,ADDO-QUAYE C,et al.Transcriptome-wide identification ofmicroRNA targets in rice[J].Plant J,2010,62(5):742-759.
[17]JONES-RHOADESM W,BARTEL D P.Computational identification of plantmicroRNAs and their targets,including a stress-induced miRNA[J].Mol Cell,2004,14(6):787-799.
[18]LUO Y C,ZHOU H,LIY,et al.Rice embryogenic calli express a unique set ofmicroRNAs,suggesting regulatory roles ofmicroRNAs in plant post-embryogenic development[J].FEBSLett,2006,580(21):5111-5116.
[19]CUIR,HAN J,ZHAOS,etal.Functional conservation and diversification of class E floral homeotic genes in rice(Oryzɑsɑtivɑ)[J].Plant J,2010,61(5):767-781.
[20]MAYER K F,SCHOOF H,HAECKER A,et al.Role of WUSCHEL in regulating stem cell fate in the Arɑbidopsis shootmeristem[J].Cell,1998,95(6):805-815.
[21]CLOUGH S J,BENT A F.Floral dip:a simplifiedmethod for Agrobacterium-mediated transformation of Arɑbidopsis thɑliɑnɑ[J].Plant J,1998,16(6):735-743.
[22]LIY,JONES L,MCQUEEN-MASON S.Expansions and cell growth[J].Curr Opin Plant Biol,2003,6(6):603-610.
[23]ABDURAKHMONOV IY,DEVOR E J,BURIEV ZT,etal.Small RNA regulation of ovule development in the cotton plant,G.hirsutum L[J]. BMC Plant Biol,2008,8:93.
[24]KHAN B M,IRFAN M,YOUSAF R,et al.Identification ofmicro-RNAs in cotton[J].Plant Physiol Biochem,2008,46(8-9):739-751.
[25]LEE J J,WOODWARD AW,CHEN Z J.Gene expression changes and early events in cotton fiber development[J].Ann Bot,2007,100(7):1391-1401.
[26]FAN L,SHIW J,HUW R,et al.Molecular and biochemical evidence for phenylpropanoid synthesis and presence of wall-linked phenolics in cotton fibers[J].J Integr Plant Biol,2009,51(7):626-637.
(责任编辑:张睿)
Identification of the biochemical function of miR397b in Gossypium hirsutum
DING Yan1*,WANG Yan-mei1,LIU Jin-yuan1
(Lɑborɑtory of Plɑnt Moleculɑr Biology,Center for Plɑnt Biology,School of Life Sciences,TsinghuɑUniversity,Beijing 100084,Chinɑ)
It is reported that plant laccase enzymes(LAC),amember of the blue copper oxidase family,can polymerize lignin monomers into lignin.miR397b plays a role in the expression of LAC protein family in Arɑbidopsis and Lycopersicon.However,there is no report about biochemical identification ofmiR397b function.In this study,RLM-5’RACE experiment was carried out on the cotton fiber sampled at 25 days post-anthesis in vitro,and itwas validated that cleavage of GhLAC4 transcripts wasmediated by miR397b via a complementary region between them,and GhLAC4 was the targeted gene of GhmiR397b.These results suggested thatGhmiR397b might be involved in the lignin formation in cotton fiber,and provided an evidence for studies on the regulation role of GhmiR397b during cotton fiber development.
Gossypium hirsutum;Fiberdevelopment;miR397b;GhLAC4;Target gene;Biochemical function;Cleavage
S562
A
1000-3924(2017)01-010-05
2016-05-14
国家重点基础研究发展计划(2010CB126003);国家转基因动植物研究项目(2011ZX08005-003,2011ZX08009-003)作者简介:丁妍(1989—),女,硕士,研究方向:植物分子生物学。E-mail:dingyan101@163.com
*通信作者,E-mail:liujy@mail.tsinghua.edu.cn

