啤酒废酵母自溶提取物的制备及抗氧化活性研究
罗依雨, 罗 维, 刘峻熙, 杨志民, 倪 贺, 李海航
(华南师范大学生命科学学院, 广东省植物发育生物工程重点实验室, 广州 510631)
啤酒废酵母自溶提取物的制备及抗氧化活性研究
罗依雨, 罗维, 刘峻熙, 杨志民, 倪贺*, 李海航
(华南师范大学生命科学学院, 广东省植物发育生物工程重点实验室, 广州 510631)
摘要:以广州本地啤酒厂废酵母为材料,通过单因素实验研究其最佳自溶条件及最佳微波水解条件.比较自溶、微波水解与外加酶制剂处理法制备酵母提取物的效果,研究了该提取物的抗氧化活性. 结果表明,啤酒酵母的最佳自溶条件为固液比1∶20、温度45.0 ℃、pH 6.0、时间48 h,在此条件下,酵母蛋白质的水解度为41.5%,提取蛋白质得率为42%. 自溶法制备啤酒酵母提取物的效率与外加酶制剂处理的效果相当,而显著高于微波水解法,提取物具有较高的抗氧化活性. 研究表明,自溶法是开发利用啤酒厂废弃的酵母和制备酵母提取物的较好方法.
关键词:啤酒酵母; 提取物; 自溶; 微波水解; 蛋白质得率; 抗氧化活性
啤酒酵母(Saccharomycescerevisiae) 是一种用于啤酒生产的繁殖极快的单细胞微生物,其蛋白质含量高达50%,且氨基酸组成齐全,富含人体所缺乏的各种维生素和微量元素,兼备美容、瘦身、养生的功效,具有很高的开发价值[1]. 中国啤酒产量连续10年保持世界第一,每年产生约50 万t的啤酒废酵母,除很少部分用作饲料外,大部分被直接排放[2].由于啤酒废酵母的蛋白质具有较高的营养价值和安全性,用啤酒废酵母提取和制备食用功能蛋白引起了研究者的关注. 但酵母具有非反刍动物难以消化的坚固的细胞壁,其细胞内各种营养物质很难释放出来;细胞内还含有较高的核酸,需将其分解,否则易引起人体的尿酸偏高,导致痛风症. 因此,开发高效和经济的啤酒废酵母蛋白质利用方法尤为重要[3].
外加酶制剂处理可使啤酒酵母细胞破壁,提高营养物的提取率、缩短提取时间,成为国内食品加工业的研究热点.研究[4-5]表明,利用蛋白内切酶、外切酶、磷酸二酯酶和AMP-脱氨酶联合酶解酵母细胞22 h,酵母固形物得率能够达到53%. 但酶制剂价格昂贵,作用效果不一.
利用活性酵母自身的水解酶(如蛋白酶、核酸酶)将啤酒酵母细胞内的大分子水解成多肽、氨基酸和核苷酸等. 影响酶促反应的因素,如温度、pH和时间等,均会影响自溶效果.研究[6-7]发现啤酒酵母在45~60 ℃、近中性pH条件下水解48~121 h,自溶效果较好. 经自溶后的酵母提取物具有广泛的生理药理活性,包括降血压、抗菌、抗癌、免疫调节、神经系统调节等,具有保健食品和药品的开发潜力. 目前,关于酵母自溶与酶解法等相关研究尚少,其在生产中的优越性并未完全体现.
本研究对啤酒废酵母的自溶条件进行了研究,并与微波水解法和外加酶制剂水解法的效果进行了比较,测试了自溶法制备的酵母多肽的抗氧化活性,为进一步开发利用啤酒废酵母资源提供依据.
1材料与方法
1.1实验材料
啤酒废酵母由广州市本地啤酒厂提供,酵母泥经水洗、烘干得到干酵母,-20 ℃保存备用. 酵母复合水解酶购于广东五洲药业有限公司,保存于-20 ℃.
1.2啤酒废酵母自溶水解
根据预实验结果,料液比为1∶20时酵母自溶的蛋白质得率最高.向装有1.0 g干酵母粉的锥形瓶中加入20.0 mL蒸馏水,分别在不同温度和不同pH条件下置于振荡培养箱中自溶不同时间,自溶后沸水浴5 min,以6 000 r/min离心10 min,收集上清液中的提取液,测定蛋白质水解度和蛋白质得率.
1.3啤酒废酵母微波水解
向装有1.0 g干酵母的锥形瓶中加入20.0 mL蒸馏水,分别在不同pH、微波水解次数等条件下置于微波炉中中低火处理6 min. 将提取液定容至5.0 mL,以6 000 r/min离心10 min,收集上清液中的提取液,测定蛋白质得率和蛋白质水解度.
1.4啤酒废酵母酶水解
酵母蛋白质的酶水解在已有研究[8]所得的最佳酶解条件下进行. 向装有1.0 g啤酒废酵母的锥形瓶中加入20.0 mL蒸馏水、酵母复合水解酶∶干酵母质量比3.5∶100,调节 pH至6.5,在60 ℃水浴中酶解6 h. 酶解后沸水浴5 min,以6 000 r/min离心10 min,收集上清液中的提取液,测定蛋白质得率和蛋白质水解度.
1.5蛋白质含量测定
采用双缩脲法[9]测定蛋白质含量. 以不同质量浓度的牛血清白蛋白为标准品制作蛋白质定量标准曲线.取各种提取液1.0 mL,置于试管内,加入双缩脲试剂4.0 mL,混匀后静置30 min,测其在540 nm下的吸光度,根据标准曲线可得提取液中蛋白质的质量浓度.
1.6蛋白质水解度测定
采用甲醛滴定法[10],取啤酒废酵母的各种提取液5.0 mL,置于250 mL的烧杯中,加入30.0 mL去二氧化碳的蒸馏水,调节pH至7.0,加入5.0 mL pH 9.2甲醛溶液,用磁力搅拌器混匀,再用 NaOH 标准溶液滴定至 pH 9.2,记录NaOH标准溶液的消耗数V1(mL),同时,取未水解的酵母提取液5.0 mL,按上述方法做空白实验,记录NaOH标准溶液的消耗数V2(mL),计算啤酒废酵母的各种提取液中蛋白质水解度.
1.7蛋白质得率测定
用凯氏自动定氮法测定蛋白质的总得率[11]. 分别取啤酒废酵母的各种提取液3.0 mL,置于消化管中,进行凯氏定氮,最后滴定的标准硫酸浓度为0.05 mol/L,记录硫酸体积消耗数,并计算各水解条件下的蛋白质得率.
1.8DPPH·清除力测定
1-二苯基-2-三硝基苯肼(DPPH·)清除力的测定参照文献[12]的方法进行.配制120 μmol/L DPPH-乙醇溶液(体积比为50%),取0.1 mL样品溶液,加入2.9 mL DPPH,室温静置20 min后按以下式计算清除力:
清除力ORSC%=(1-(A-B)/Ao)×100%,
式中A为样品与DPPH反应(样品0.1 mL+2.9 mL DPPH)后的吸光度;B为样品的空白(样品0.1 mL+2.9 mL乙醇)的吸光度;Ao为未加样的DPPH(2.9 mL DPPH+0.1 mL 50%乙醇)的吸光度.
1.9薄层色谱自显影法测体积比抗氧化活性
将最佳自溶条件下所得的提取液在2块硅胶薄层色谱板上展层分离,展层剂为正丁醇∶水∶乙酸体积比=3.5∶5.0∶1.5. 展层后的硅胶板置于室温下,使展层溶剂充分挥发. 将其中一块展层的硅胶板置于碘蒸汽罐中显色,观察样品成分的分离. 另一块展层的硅胶板采取自显影法测定抗氧化活性,用0.04% DPPH·的乙醇溶液均匀喷雾,于40 ℃加热30 min,在硅胶板上直接观察和记录各分离物质的抗氧化活性[13].
2结果与讨论
2.1啤酒酵母最佳自溶条件研究
2.1.1温度的影响已知酵母自溶中起主要作用的是蛋白酶、核酸酶和葡聚糖酶,最适反应温度一般在40~60 ℃[14].将干酵母按照1∶20的料液比加入到pH 7.0的水中,在40~60 ℃的不同温度下自溶24 h. 当温度为40 ℃时(图1A),提取液中的蛋白质含量和水解度都较低.当温度升高到45 ℃时,其蛋白质含量(3.73 g/L)和水解度(28%)均达到最大.随着温度的继续升高,提取液的蛋白质含量和水解度都随温度的上升降低.因此,确定啤酒酵母的最佳自溶温度为45 ℃.
2.1.2pH的影响啤酒酵母细胞内的蛋白酶一般在pH 5.0~8.0时有活性. 在45.0 ℃条件下自溶24 h、pH 6.0时(图1B)两者都达到最高值. 因此,确定啤酒酵母的最佳自溶pH为6.0.
2.1.3水解时间的影响在温度为45.0 ℃、pH为6.0的自溶条件下,探究自溶时间对啤酒酵母自溶的影响. 在12~48 h(图1C),提取液中蛋白质含量和水解度均随自溶时间的增加而增加,在48 h时达到最高.之后,水解度不再增加,而蛋白质含量则下降. 因此,确定啤酒酵母的最佳自溶时间为48 h. 本研究采用双缩脲法测定蛋白质含量,只能测定蛋白质中肽键的量,自溶48 h后的蛋白质含量下降可能由于有部分蛋白质被水解成氨基酸.
综上所述,确定啤酒酵母的最佳自溶条件为温度45 ℃、pH 6.0,自溶48 h.在此条件下,提取液中蛋白质含量为5.15 g/L,水解度为41.5%.凯氏定氮法测得自溶蛋白质的得率为42.3%.
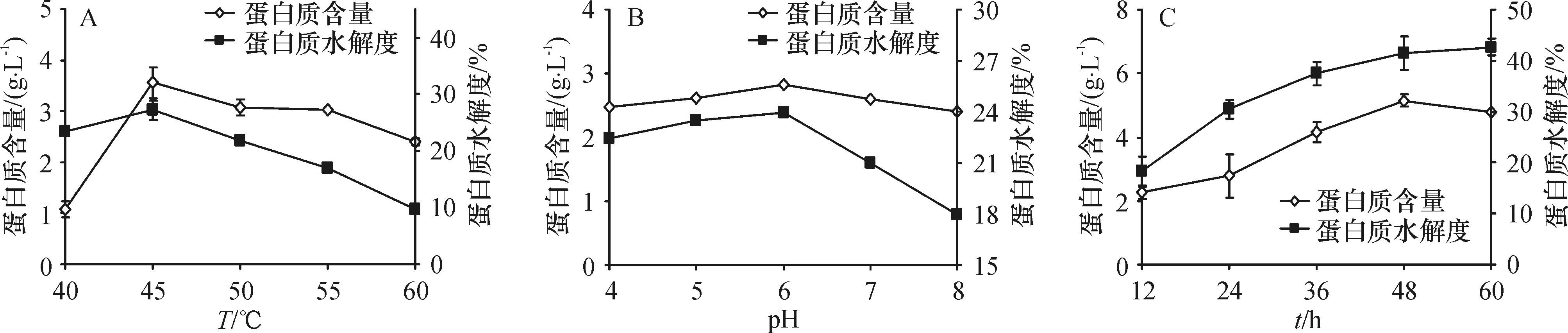
图1 温度(A)、pH(B)和时间(C)对酵母自溶的影响
2.2微波水解对啤酒酵母蛋白质提取效果的影响
2.2.1pH的影响根据提取液全部蒸干的时间确定啤酒酵母的微波水解时间.将含有1 g酵母粉的20.0 mL蒸馏水,在中低火的微波条件下处理6 min后,提取液被全部蒸干,由此确定微波水解啤酒酵母的处理时间为6 min. 在中低火的微波条件下水解啤酒酵母6 min,在pH 5.0~8.0(图2A),提取液中蛋白质含量随pH的升高逐渐增加,pH为8.0时达到最高,pH大于8.0时,蛋白质含量下降. 由此确定啤酒酵母微波水解的最佳pH为8.0.
2.2.2微波水解次数的影响在中低火、pH 8.0的微波条件下处理酵母6 min,发现提取液中蛋白质含量随着水解次数的增加而升高(图2B),微波水解4次时,提取液的蛋白质含量达到最高(4.40 g/L). 因此,确定微波水解啤酒酵母的最佳条件为料液比1∶20、pH 8.0的水溶液、用微波炉的低档能量处理4次,每次6 min.在此条件下得到的提取液的蛋白质含量为4.40 g/L.前述的最佳自溶条件下,提取液的蛋白质含量为5.15 g/L,表明微波水解法水解酵母蛋白的效率显著低于自溶处理.
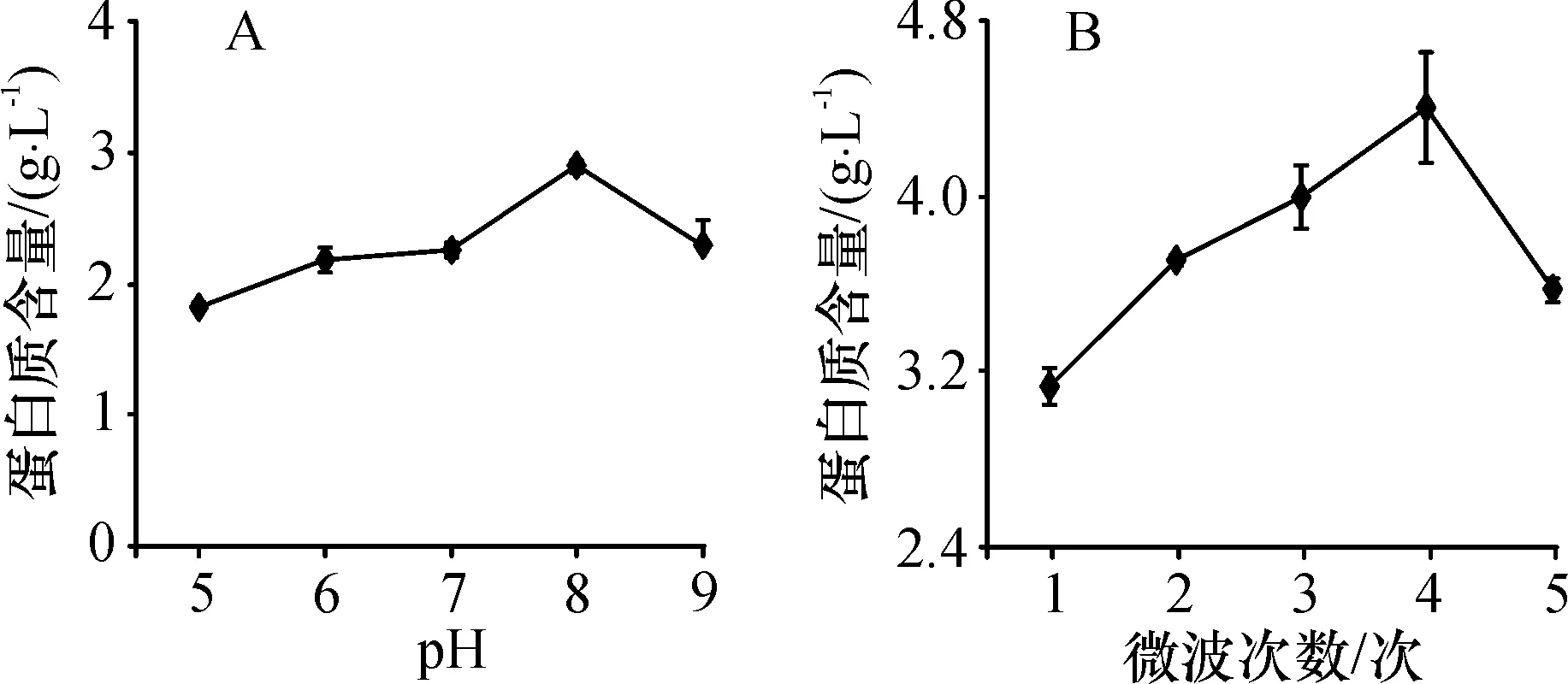
图2 pH(A)和微波水解次数(B)对酵母提取效果的影响
Figure 2Effects of pH (A) and microwave hydrolysis times (B) on yeast extraction
2.3啤酒酵母自溶水解效果
有研究[15]表明,酵母复合水解酶在其最佳反应条件下(酵母复合水解酶∶干酵母质量比为3.5∶100,反应温度60 ℃、pH 6.5、时间6 h)水解酵母蛋白,90%的蛋白质被提取并水解,水解度为25.3%. 本研究比较了酵母自溶和酵母复合水解酶酶解对啤酒废酵母制备效果的影响(图3),在啤酒酵母最佳自溶条件下,酵母蛋白质得率与外加酶制剂处理的蛋白质得率相当,均能达到42%.将啤酒酵母自溶后再加酶制剂处理,提取液中的蛋白质含量较单因素处理仅提高了2.6%. 表明自溶处理能有效水解啤酒酵母中的蛋白质,蛋白质提取率与外加酶制剂处理相当,高于微波处理. 与外加酶制剂处理和微波处理相比,自溶处理简单,可大幅度降低酵母蛋白制备的成本或能耗,是一种理想的制备啤酒废酵母蛋白质的方法.

图3酵母自溶与外加酶制剂处理对酵母蛋白的提取效果
Figure 3Effects of yeast autolysis and enzyme preparation on yeast extraction
2.4酵母提取物抗氧化活性
初步分析了具有抗氧化活性的酵母提取物的DPPH·清除能力.啤酒酵母的提取液的蛋白质含量为5.15 g/L(图4),其DPPH·的清除能力为20.6%.将提取液逐级稀释后,其DPPH·清除能力逐渐下降;将提取液浓缩后,随着蛋白质含量的增加,其DPPH·清除能力逐渐升高,当质量浓度为41.2 g/L时,其DPPH·清除能力达到62%. 与没有明显抗氧化性的酶解酵母多肽相比,自溶所得啤酒酵母提取液具有较好的抗氧化性,其DPPH·清除能力呈现质量浓度依赖性[21].
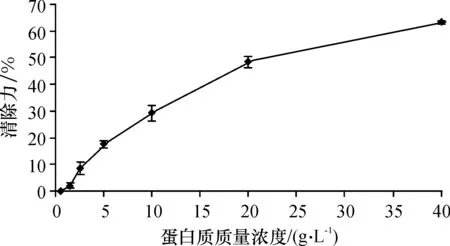
图4 酵母自溶浓度对DPPH·清除力的影响
Figure 4Effect of concentration of yeast autolysis on DPPH· radical-scavenging activity
用硅胶薄层层析法对啤酒废酵母的提取液成分进行分析,并在薄层板上进行了抗氧化活性分析. 将提取液点在硅胶薄层板上(图5),用展层剂(正丁醇∶水∶乙酸=3.5∶ 5.0∶1.5)展开后,在碘蒸汽罐中显色可观察到分离成3个主要组分(图5A). 抗氧化活性自显影结果(图5B)显示组分2、组分3部位DPPH·的紫色消失而组分1部位紫色依然存在,表明组分1无DPPH·清除活性,组分2和3具有DPPH·清除活性.

图5 薄层色谱法分离(A)和酵母提取物抗氧化活性测定(B)
Figure 5Separation(A) and identification(B) of yeast antioxidant extract with TLC
3结论
探讨了啤酒废酵母的最佳自溶条件,并将其与微波水解和外加酶制剂处理的水解效果进行了比较. 结果显示,啤酒酵母的最佳自溶条件为固液比1∶20、自溶温度45.0 ℃、自溶pH6.0、自溶时间48 h,自溶后提取液中蛋白质质量浓度为5.15 g/L,水解度为41.5%,蛋白质得率均为42%. 利用该方法制备啤酒酵母提取物,其蛋白质的得率显著高于微波水解法,且与外加酶制剂处理的作用效果相当,并能大幅缩减酶解法制备酵母多肽的生产成本. 抗氧化活性研究表明,自溶法制备的啤酒酵母提取液具有较高的抗氧化活性.
参考文献:
[1]李海霞. 啤酒废酵母泥综合利用的关键技术研究[D]. 长春: 吉林大学, 2009:11.
LI H X. Study on criticality technology of multi-utilization of the waste brewing yeast paste[D]. Changchun: Jilin University, 2009:11.
[2]李科德, 曾庆孝. 啤酒废酵母泥综合利用的研究[J]. 食品与发酵工业. 2007, 33(2): 63.
LI K D, ZENG Q X. Preparation of yeast extract and β-1, 3-glucan from spent brewer’s yeast[J]. Food and Fermentation Industries, 2007, 33(2): 63.
[3]李祥, 罗仓学, 彭莉, 等. 啤酒酵母抽提物工艺的研究[J]. 酿酒科技, 2002(1): 65.
LI X, LUO C X, PENG L, et al. Study on the techniques in extraction of waste beer yeast[J]. Liquor-making Science and Technology, 2002(1): 65.
[4]CHAE H J, JOO H, IN M J, et al. Utilization of brewer’s yeast cells for the production of food-grade yeast extract:Part I: effects of different enzymatic treatments on solid and protein recovery and flavor characteristics[J]. Bioresource Technology, 2001, 76(3): 253.
[5]MA C, NI X, CHI Z, et al. Purification and characterization of an alkaline protease from the marine yeastAureobasidiumpullulansfor bioactive peptide production from different sources[J]. Marine Biotechnology, 2007, 9(3): 343.
[6]ALCAIDE J M, PUEYO E, POLO MC, et al. Bioactive peptides released fromSaccharomycescerevisiaeunder accelerated autolysis in a wine model system[J]. Journal of Food Science, 2007, 72(7): M276-M277.
[7]TANGULER H, ERTEN H. Utilisation of spent brewer’s yeast for yeast extract production by autolysis: the effect of temperature[J]. Food and Bioproducts Processing, 2008, 86(4): 317.
[8]NI H, LI L, LIU G, et al. Isolation and identification of an angiotensin-I converting enzyme inhibitory peptide from yeast (Saccharomycescerevisiae)[J]. Current Analytical Chemistry, 2012, 8(1): 180.
[9]程涛, 孙艳波, 李健. 双缩脲法测定乳中酪蛋白含量[J]. 中国乳品工业, 2000, 28(3): 34.
CHENG T, SUN Y B, LI J. Determination of casein content in milk by biuret’s method[J]. China Dairy Industry, 2000, 28(3): 34.
[10]李晓东, 牛治霞, 张柏林. 乳清蛋白水解物水解度3种测定方法的比较[J]. 中国乳品工业, 2006, 34(10): 60.
LI X D, NIU Z X, ZHANG B L. Various methods available for the determination of hydrolyzed degree of whey protein[J]. China Dairy Industry, 2006, 34(10): 60.
[11]马丹. 凯氏定氮法测定食品中蛋白质含量[J]. 计量与测试技术, 2008, 35(6): 57-58.
MA D. Kjeldahl determination of protein content[J]. Metrology and Measurement Techique, 2008, 35(6): 57-58.
[12]彭长连, 林植芳, 林桂珠. 光对4种木本植物叶片清除有机自由基能力的影响[J]. 植物学报, 2000, 42(4): 394.
PENG C L, LIN Z F, LIN G Z. Effect of light on scavenging capacity for organic free radical in leaves of four woody plants[J]. Acta Botanica Sinica, 2000, 42(4): 394.
[13]TORBATI M, NAZEMIYEH H, LOTFIPOUR F, et al. Chemical composition and in vitro antioxidant and antibacterial activity ofHeracleumtranscaucasicumandHeracleumanisactisroots essential oil Bioimpacts[J]. Bioimpacts, 2014, 4(2): 69.
[14]杨建梅, 李红, 杜金华. 啤酒废酵母自溶条件的研究[J]. 中国酿造, 2012, 31(2): 95.
YANG J M, LI H, DU J H. Autolysis conditons of waste brewer’s yeast[J]. China Brewing, 2012, 31(2): 95.
[15]郭莎莎. 酶解酵母蛋白制备生物活性肽的研究[D]. 广州: 华南理工大学, 2012: 5.
GUO S S. Preparation of bioactive peptides from yeast protein by enzymatic hydrolysis[D]. Guangzhou: South China University of Technology, 2012:5.
[16]YAMAVCHI F, SUETSVNA K. Immunological effects of dietary peptide derived from soybean protein[J]. The Journal of Nutritional Biochemistry, 1993, 4(8): 450.
[17]HOSKIN D W, RAMAMOORTHY A. Studies on anticancer activities of antimicrobial peptides[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2008, 1778(2): 357.
[18]祝骥, 高飞, 易喻, 等. 抗菌肽的研究进展[J]. 生命科学, 2008, 20(4): 605-610.
ZHU J, GAO F, YI Y, et al. Progress on antimicrobial peptides[J]. Chinese Bulletin of Life Sciences, 2008, 20(4):605-610.
[19]凌秀梅. 利用啤酒废酵母制备多肽的研究[D]. 贵阳: 贵州大学, 2007:5.
LING X M. Preparation of bioactive peptides from beer yeast[D]. Guiyang: Guizhou Universitiy, 2007:5.
[20]倪贺. 酵母来源血管紧张素转移酶抑制多肽的制备及其抑制机理的研究[D]. 广州: 华南理工大学, 2012:5-7.
NI H. Preparation and inhibition mechanism of angiotensin converting enzyme-inhibitory peptide from yeast[D]. Guangzhou: South China University of Technology, 2012:5-7.
[21]王昕哲. 酵母β-葡聚糖和活性多肽的制备及其性质研究[D]. 广州: 华南理工大学, 2014: 5.
WANG X Z. Preparation and properties of bioactive peptides and β-glucans from yeast[D]. Guangzhou: South China University of Technology, 2014: 5.
【中文责编:成文英文责编:李海航】
Preparation and Antioxidant Activity of Peptides from Waste Saccharomyces Cerevisiae
LUO Yiyu, LUO Wei, LIU Junxi, YANG Zhimin, NI He*, LI Haihang
(Guangdong Provincial Key Lab of Biotechnology for Plant Development, School of Life Science,South China Normal University, Guangzhou 510631, China)
Abstract:The brewery waste yeast (Saccharomycescerevisiae) contains 50% proteins and has high values of application. The optimal conditions of autolysis ofS.cerevisiaecells were explored by the single-factor tests, and its efficiency was compared with the microwave-assisted hydrolysis and exogenous enzyme hydrolysis. The results showed that the optimal autolysis conditions of the yeast were with a solid-liquid ratio of 1∶20, at pH 6.0 and 45.0 ℃ for 48 h. Under these conditions, yeast proteins were hydrolyzed and extracted at the yield of 42%, the degree of hydrolysis was 41.5%. The autolysis method showed the same efficiency as the exogenous enzyme hydrolysis, but higher than that of the microwave-assisted hydrolysis. The prepared yeast extracts by autolysis showed high antioxidant activity.
Key words:Saccharomycescerevisiae; extract; autolysis; microwave-assisted hydrolysis; protein yield; antioxidant activity
收稿日期:2015-06-15《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
基金项目:广东省自然科学基金项目(2014A030313423);广东省科技计划项目 (2014A010107026);教育部高等学校博士学科点专项科研基金新教师类项目(20134407120004)
*通讯作者:倪贺,讲师,Email: 022524328@163.com.
中图分类号:Q936
文献标志码:A
文章编号:1000-5463(2016)01-0089-05

