DEC1参与顺铂诱导食管鳞癌的细胞衰老
邵琳琳 赵佳佳 朱圣韬 郭水龙 张澍田 孙秀梅 王拥军
(首都医科大学附属北京友谊医院消化内科 国家消化系统疾病临床医学研究中心 首都医科大学消化病学系 消化疾病癌前病变北京市重点实验室,北京 100050)
DEC1参与顺铂诱导食管鳞癌的细胞衰老
邵琳琳赵佳佳朱圣韬郭水龙张澍田孙秀梅王拥军*
(首都医科大学附属北京友谊医院消化内科国家消化系统疾病临床医学研究中心首都医科大学消化病学系消化疾病癌前病变北京市重点实验室,北京 100050)
【摘要】目的探究化学治疗药物顺铂对食管鳞癌细胞衰老的影响及其机制。方法检测4种食管鳞癌细胞株(ECA109、EC9706、TE-1、TE-3)和一株正常的人类永生化食管上皮细胞株(Het-1a)中细胞衰老因子p53、分化型胚胎软骨发育基因1(differentiated embryo-chondrocyteexpressed gene1, DEC1)的mRNA和蛋白的表达情况;选取TE-3为研究对象,采用MTT方法检测不同浓度的顺铂(2、4、6、8、10 μmol/L)对TE-3增生的情况,并结合衰老相关的β半乳糖苷酶染色方法,筛选出诱导细胞衰老的最适浓度。以顺铂最适浓度(4 μmol/L)作用TE-3 48 h,采用Western blotting方法检测顺铂作用前后p53、DEC1蛋白水平的表达情况。结果检测食管鳞癌细胞系中细胞衰老因子p53、DEC1的mRNA和蛋白的表达,发现食管鳞癌细胞与食管上皮细胞相比,p53的表达均有不同程度下降,DEC1的表达均有不同程度升高。用不同浓度的顺铂(2、4、6、8、10 μmol/L)作用TE3,MTT显示顺铂对细胞TE-3的增生抑制作用呈剂量和时间依赖性;结合衰老相关的β半乳糖苷酶染色,发现顺铂可诱导TE-3出现细胞衰老,并在顺铂4 μmol/L作用48 h时细胞衰老现象最明显;在顺铂4 μmol/L作用TE-3细胞48 h检测对照组与实验组的p53、DEC1的蛋白表达情况,发现实验组中TE-3的p53、DEC1的表达量分别升高了4.6倍(P=0.040)、2倍(P=0.032)。结论顺铂可诱导食管鳞癌细胞呈现细胞衰老表型,细胞衰老相关基因p53和DEC1可能参与这一过程。
【关键词】食管鳞癌;细胞衰老;DEC1;p53;顺铂
食管癌是常见恶性肿瘤之一,在全世界范围内发病率高,恶性程度高,病程进展快,预后较差,患者的生存率低。我国是食管癌发病率和病死率最高的国家,每年全世界新增的30万食管癌患者中, 约有一半发生在中国,而食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC,以下简称食管磷癌)占90%以上[1-2]。细胞衰老是细胞生长永久受抑制的状态,是对于非致命性刺激的一种应答,这些刺激包括癌基因的激活、DNA 损伤、氧化应激(reactive oxygen species, ROS)、抗肿瘤药物等;细胞衰老能够防止老化的或非正常细胞的进一步生长,对抗细胞的无限增生能力而对机体起到保护作用[3]。顺铂是食管癌的常用化学治疗药物,顺铂可诱导鼻咽癌、肺癌等发生细胞衰老。对于食管鳞癌的细胞衰老及顺铂对食管鳞癌的细胞衰老的作用尚不清楚。
1材料和方法
1.1 材料
人食管癌细胞株TE-1、TE-3、ECA109、ECA9706;正常食管永生化上皮Het-1A细胞系(本实验室传代留存),胎牛血清(美国Gibco公司);RPMI-1640 培养基(美国Gibco公司);MTT(美国Sigma公司);p53、DEC1抗体(美国Cell Signaling公司);辣根酶过氧化物标记的二抗(美国Santa Cruz 公司)。
1.2方法
1.2.1细胞培养及药物处理
人食管癌TE-1、TE-3、ECA109、ECA9706细胞系培养环境相似,为37 ℃、5%(体积分数)CO2的孵箱。培养液为含10%(体积分数)胎牛血清的RPMI1640,顺铂质量浓度为200 μg/mL。
1.2.2MTT法检测细胞体外药物敏感性
取5×103个细胞,均匀种植于Corning公司的96孔板中,代细胞贴壁后,按照不同的顺铂浓度加药,每个浓度设置5个复孔。培养0、24、48、72 h后,向96孔板的每个孔小心加入5 mg/mL的预制MTT溶液20 μL,继续孵育2 h。小心吸出96孔板孔内液体,加入150 μL二甲基亚砜(DMSO),振荡器上震摇10 min,使用酶标仪在490 nm波长处读出各孔的吸光度值。根据所得结果,以对照组的吸光度值为参照,计算与对照组的比值并绘制药物浓度抑制曲线。
1.2.3Western blotting 法分析蛋白表达
不同条件处理食管癌细胞后,弃去培养液,PBS洗2次,把PBS 液吸取干净后,加入蛋白酶抑制剂、磷酸酶抑制剂和细胞裂解液,冰上孵育15 min,用细胞刮将细胞刮下收集到1.5 mL的EP管中,4 ℃,12 000 r/min离心10 min,吸取上清至另一EP管。BCA法检测蛋白浓度,在样品中加入SDS-PAGE loading buffer,100 ℃煮沸10 min,冷冻保存备用。各组样品采取总蛋白30 μg,经SDS-PAGE电泳,转膜至PVDF膜后封闭,一抗过夜,次日加入辣根酶过氧化物标记的二抗,室温孵育1 h,加入ECL 底物,用Bio-Rad成像系统对化学发光信号进行图像采集,采用Quantity One 软件比较样本目的蛋白表达水平高低。
1.2.4衰老相关的β半乳糖苷酶(SA-β-gal)染色
取对数生长期的TE-3细胞接种6孔板,细胞浓度为3×104/孔,在不同浓度顺铂处理细胞48 h后,镜下观察细胞形态发生明显变化,按照SA-β-gal试剂盒说明书在孔板内进行SA-β-gal原位染色。(1)吸弃细胞培养液,用PBS洗涤2次;加入1 mL SA-β-gal固定液,室温固定15 min。(2)吸除固定液,用PBS洗2次,每次5 min;(3)吸除固定液,每孔加入1 mL 染色工作液。(4)37 ℃无CO2培养箱孵育过夜,用保鲜膜封住6孔板防止蒸发;(5)显微镜下观察,在细胞质内出现均匀一致的蓝色颗粒为SA-β-gal阳性。
1.3统计学方法
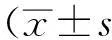
2结果
2.1检测p53和DEC1在ESCC细胞株及正常食管上皮细胞中mRNA的表达情况
采用RT-PCR方法检测在4种食管鳞癌细胞株ECA109、EC9706、TE-1、TE-3和一株永生化食管上皮细胞株Het-1a中的p53、DEC1 mRNA的表达。结果如图1所示,各细胞株均可见p53不同程度的表达,其中食管癌细胞株TE-1、TE-3和正常食管上皮细胞株Het-1a中,p53(117bp)表达相对较高,DEC1(339bp)在EC9706、TE-1、TE-3中呈高表达。各细胞株均可见GAPDH(309bp)条带。该结果提示p53、DEC1在正常食管上皮以及不同分化程度食管鳞癌细胞转录水平差异有统计学意义(P<0.05)。
2.2检测p53和DEC1在ESCC细胞株及正常食管上皮细胞中蛋白的表达情况
采用Western blotting方法检测4种食管鳞癌细胞株ECA109、EC9706、TE-1、TE-3和一株永生化正常食管上皮细胞株Het-1a中P53、DEC1蛋白的表达。结果如图2所示,P53蛋白在TE-1、TE-3、Het-1a中高表达,在ECA109、EC9706中低表达;而DEC1在TE-1、TE-3、EC9706相对高表达,在ECA109、Het-1a相对低表达,各细胞株均可见β-actin表达。与正常食管永生化细胞株Het-1a相比,P53在ESCC细胞中的表达有不同程度的降低;而DEC1在ESCC细胞表达有不同程度的升高。
2.3MTT检测不同浓度顺铂对食管癌细胞株TE-3增生的影响
以TE-3为研究对象用顺铂进行干预。分别用顺铂2、4、6、8、10 μmol/L处理TE-3细胞24 h后,将培养基更换为不含药物的全培养基,继续培养72 h,分别于给药后0、24、48、72、96 h观察细胞形态及检测细胞增生情况。与空白对照组相比,随着药物浓度及培养时间增加,细胞增生的抑制明显增加(0.550±0.275,n=6,P=0.000, 图3)。在对照组,细胞形态呈圆形或者短梭形,细胞核为圆形或椭圆形,胞质丰富;在低剂量顺铂组(4和 6 μmol/L),细胞体积增大扁平,胞质中空泡增多;在高剂量顺铂组(8和10 μmol/L),可见细胞变小变圆,数量减少。在4 μmol/L时,细胞增长曲线基本为水平线,即细胞未见明显增生,此时为诱导细胞衰老的最佳浓度;选取顺铂浓度为4 μmol/L为最佳诱导细胞衰老浓度,进行后续试验。
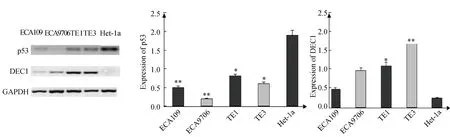
图1 DEC1、p53在永生化食管上皮细胞株Het-1a和食管鳞癌细胞株中ECA109、EC9706、TE-1、TE-3的mRNA表达
图2 DEC1、p53在永生化食管上皮细胞株Het-1a和食管鳞癌细胞株中ECA109、EC9706、TE-1、TE-3的蛋白的表达

图3 MTT检测不同浓度顺铂对食管癌
2.4衰老相关的β半乳糖苷酶染色检测食管癌细胞株TE-3衰老情况
SA-β-gal是常用的用于检测细胞衰老的标志物,在实验中用于检测不同浓度顺铂作用下细胞的衰老情况。顺铂浓度4 μmol/L作用TE-3细胞48 h后,细胞体积变大,胞质内空泡增多,突触增多变长,70%以上衰老相关β半乳糖苷酶染色阳性,呈现出细胞衰老
表型;而在8 μmol/L和10 μmol/L浓度的顺铂作用下,TE-3细胞大量死亡,数量明显减少,细胞体积变小,在作用96 h后,只有少数完整细胞(图4)。因此,低剂量的顺铂可使食管鳞癌细胞发生衰老,而高剂量的药则导致细胞死亡,选取顺铂浓度4 μmol/L作用时间为48 h进行后续实验。
2.5顺铂作用TE-3检测细胞衰老前后P53、DEC1的变化情况
顺铂可损伤DNA导致细胞凋亡,也可通过损伤DNA 而诱导细胞的加速性衰老。采用Western blotting法检测顺铂4 μmol/L作用前后细胞中DEC1、P53表达情况,结果显示,TE-3:顺铂作用48 h时,实验组中(48D)p53蛋白表达量较对照组(48C)升高 (P=0.029),实验组中(48D)DEC1表达量较对照组(48C)升高(P=0.020),差异具有统计学意义 (P<0.05,图5)。
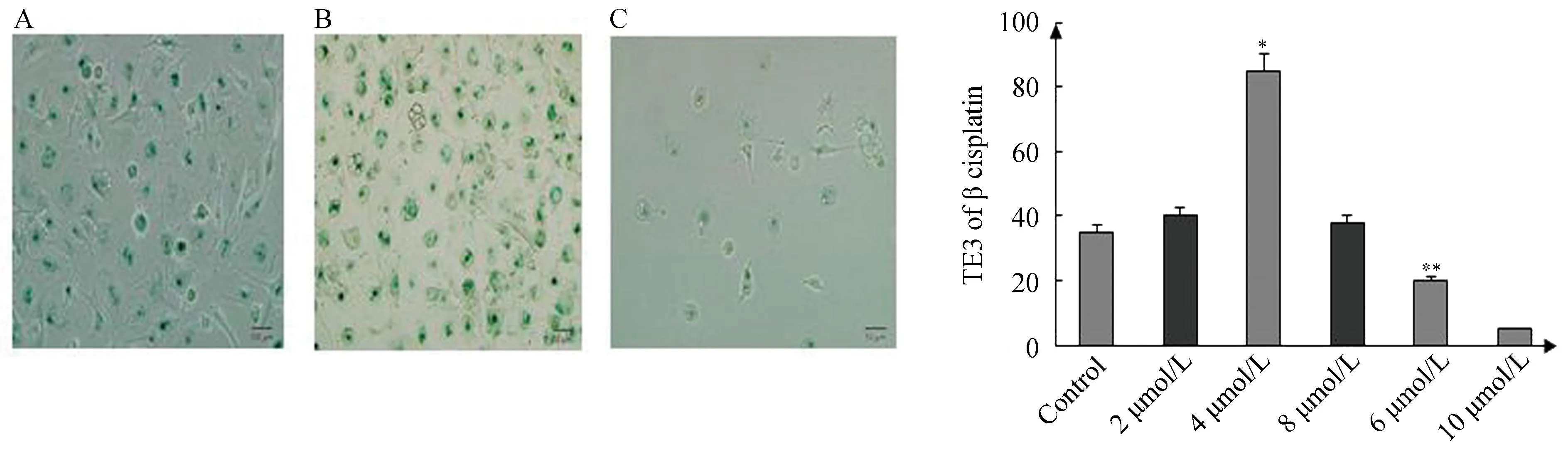
图4 不同浓度顺铂对食管癌细胞株TE-3作用及TE-3经顺铂处理后衰老相关的β半乳糖苷酶染色

图5 顺铂处理前后p53、DEC1蛋白表达变化
48C: 48 h in negative control; 48D: 48 h in the group of cisplatin;*P<0.05,**P<0.01vs48C;DEC1: differentiated embryo-chondrocyte-expressed gene1.
3讨 论
野生型p53基因,是最重要的肿瘤抑制因子之一,p53可在DNA损伤、ROS产生、端粒酶失活等因素作用下被激活。P53蛋白通过与其基因内部或上游的p53反应元件相结合的方式反式激活相应基因的转录,导致细胞周期停滞、细胞衰老和凋亡。分化型胚胎软骨发育基因1(differentiated embryo-chondrocyteexpressedgene1,DEC1) 定位于人类染色体3p25. 3-26 上,含有碱性螺旋-环-螺旋(bHLH)结构域[4],它属于转录因子,能够抑制多种细胞系的细胞增生,DEC1在肿瘤组织中也有表达,如胰腺癌[5]、口腔癌[6]、胃癌[7]、肾癌等。CHIP 技术分析p53与DEC1基因的启动子相结合,通过p53反应元件从转录水平调节DEC1。另外,DEC1 的过表达是通过诱导细胞停滞在G1 期而促进细胞衰老。因此认为,DEC1在DNA损伤诱导的早衰分子机制中可能属于p53的下游因子。
顺铂作为上皮来源肿瘤的一线类化学治疗药物,在临床上得到广泛的应用,包括:肺癌、卵巢癌、睾丸癌、膀胱癌、头颈部癌等。作用机制主要是与DNA上的核碱鸟嘌呤、腺嘌呤和胞嘧啶形成DNA单链内两点的交叉联结,也可以形成双链间的交叉联结,从而破坏DNA的结构和功能来起到促进细胞凋亡,来起到破坏肿瘤的作用,除此之外,指出顺铂能激活丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK))信号通路途径,进而参与到细胞周期相关的调控中,在一些肿瘤中呈现出细胞衰老样的形态变化。大剂量的顺铂导致细胞凋亡,低剂量顺铂可致DNA损伤,有可能参与ESCC的细胞衰老。
细胞衰老是细胞对非致命性刺激的一种应答,这些刺激包括癌基因的激活、DNA 损伤、氧化应激、抗肿瘤药物等;细胞衰老能够防止老化的或非正常细胞的进一步生长,对抗细胞的无限增生能力而对机体起到保护作用[8]。衰老的细胞仍具有生活学活性,但是细胞的基因和蛋白的表达谱发生了很大变化,使其只能维持基本代谢过程,而缺乏合成DNA和细胞增生的能力[9],即使是在分裂素的刺激下。细胞衰老存在相应的标志物。目前广泛应用的,且特异性较高的为衰老相关β-半乳糖苷酶染色[10-12],是指在pH为6时,衰老细胞内溶酶体活动,进而溶酶体水解酶增加,与x-gal反应生成的蓝色物质增多,聚集在胞质内,使细胞质呈现蓝色。此外衰老相关的异染色质聚集(senescence-associated heterochromatin foci,SAHF)是与衰老相关的表观遗传学上的改变,也可用于提示细胞衰老的存在[13-14]。
在食管鳞癌细胞株和食管永生化正常细胞株中分别从mRNA、蛋白水平检测p53、DEC1表达,P53在食管鳞癌细胞株中表达较食管永生化细胞株下降,DEC1表达则升高;而在同一细胞系列TE中,对于p53野生型及突变型,p53、DEC1表达结果也存在差异。因此,在不同的食管鳞癌细胞系中,p53、DEC1的表达存在差异。采用不用浓度的顺铂作用于TE-3,观察24、48、72、96 h时细胞的形态学及p53、DEC1的蛋白水平均发生改变。TE-3中,顺铂浓度为2 μmol/L时,随着细胞培养时间的延长,细胞数目逐渐增加,未见到明显的细胞增生抑制的现象,行衰老相关β-半乳糖苷酶染色,部分细胞呈现衰老相关表型;对于顺铂为4、6、8、10 μmol/L时随着培养时间的延长,细胞数目成下降趋势,而且细胞形态发生明显变化,细胞体积变大,突起增多,胞质内空泡增多,衰老相关β-半乳糖苷酶染色示胞质蓝染;在顺铂浓度为4 μmol/L,作用48 h时,上述形态学改变及衰老相关β-半乳糖苷酶染色最明显。因此,顺铂可使食管鳞癌细胞呈现增生抑制、细胞衰老的现象,且在一定浓度作用下,呈现出剂量和时间依赖性。
本研究表明,低剂量顺铂浓度4 μmol/L可诱导TE-3发生细胞衰老,表现为细胞体积变大,突起增多,胞质内空泡增多,衰老相关β-半乳糖苷酶染色阳性率高,并且细胞数目成下降趋势。此外,低剂量顺铂作用下p53、DEC1表达均发生改变,表明低浓度的顺铂可诱导食管鳞癌细胞发生衰老,且p53、DEC1可能参与这一过程。
总之,细胞衰老作为肿瘤发生发展的天然屏障,可以在化学治疗药物所致的应激状态下而得以呈现。化疗药物在晚期肿瘤的治疗中占据重要地位,主要通过诱导细胞凋亡而抑制细胞增生甚至消灭肿瘤细胞。本研究发现化疗药物可诱导ESCC表现出细胞衰老,而起到抑制细胞增生的作用;同时在诱导肿瘤细胞衰老的过程中,细胞衰老标志物还可能为肿瘤治疗的疗效判断及预后估计提供重要信息;就这两点而言,细胞衰老的相关研究为肿瘤的治疗提供了新的思路和方法。但是,还有一种观点认为,衰老的肿瘤细胞可以释放衰老相关分泌因子,如IL-6等,反而促进肿瘤的发生及发展,因此深入了解衰老肿瘤细胞发生机制的也是一重大命题,同样值得关注及进一步探索。
4参考文献
[1]Zhang Y. Epidemiology of esophageal cancer[J]. World J Gastroenterol,2013,19(34):5598-5606.
[2]Jemal A, Bray F, Center M M,et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[3]Campisi J, d’Adda di Fagagna F. Cellular senescence: when bad things happen to good cells[J]. Nat Rev Mol Cell Biol, 2007, 8(9):729-740.
[4]Yamada K, Miyamoto K. Basic helix-loop-helix transcription factors, BHLHB2 and BHLHB3; their gene expressions are regulated by multiple extracellular stimuli[J].Front Biosci, 2005,1 (10):3151-3171.
[5]Wang W, Reiser-Erkan C, Michalski C W, et al. Hypoxia inducible BHLHB2 is a novel and independent prognostic marker in pancreatic ductal adenocarcinoma[J]. Biochem Bioph Res Co, 2010, 401(3):422-428.
[6]Campo-Trapero J, Cano-Sánchez J, Palacios-Sánchez B,et al.Cellular senescence in oral cancer and precancer and treatment implications: A review[J]. Acta Oncol, 2008,47(8):1464-1474.
[7]Jia Y F, Xiao D J, Ma X L,et al. Differentiated embryonic chondrocyte-expressed gene 1 is associated with hypoxia-inducible factor 1α and Ki67 in human gastric cancer[J]. Diagn Pathol,2013, 8:37.
[8]Hernández Losa J, ParadaCobo C, Guinea Viniegra J,et al.Role of the p38 MAPK pathway in cisplatinbasedtherapy[J]. Oncogene, 2003, 22(26):3998-4006.
[9]梅同华, 戴玲丽,张明川. PDCD5基因对顺铂在裸鼠A549肺癌中疗效的协同作用[J]. 中国医科大学学报,2015,44(11) :1002-1006.
[10]Kurz DJ, Decary S, Hong Y,et al. Senescence-associated (beta)-galactosidase reflects an increase in lysosomal mass during replicative ageing of human endothelial cells[J].J Cell Sci,2000,113(20):3613-3122.
[11]刘贵鹏, 王爽,张春梅. 催乳素对顺铂诱导卵巢癌细胞凋亡过程的抑制作用[J]. 中国医科大学学报,2013,42(5) :447-450.
[12]陆寓非, 孙亚楠,郑晓丽,等. 食管鳞癌新辅助放化疗术后化疗疗效分析[J]. 中华肿瘤防治杂志,2015,22(6) 457-462.
[13]田广伟, 李楠,李光. 可切除食管鳞癌新辅助放化疗的Meta分析[J]. 中华肿瘤防治杂志,2013,20(16):1279-1283.
[14]曹彦坤, 李润霄,田志辉,等. 食管鳞癌单纯放化疗预后及相关因素分析[J]. 中华肿瘤防治杂志,2015,22(16) :1297-1302.
编辑慕萌
Association of DEC1 and cellular senescence of esophageal squamous cell carcinoma induced by cisplatin
Shao Linlin, Zhao Jiajia, Zhu Shengtao,Guo Shuilong,Zhang Shutian, Sun Xiumei, Wang Yongjun*
(DepartmentofGastroenterology,BeijingFriendshipHospital,CapitalMedicalUniversity;NationalClinicalResearchCenterforDigestiveDiseases;FacultyofGastroenterologyofCapitalMedicalUniversity;BeijingKeyLaboratoryforPrecancerousLesionofDigestiveDiseases,Beijing100050,China)
【Abstract】Objective To investigate whether cisplatin could induce senescence in esophageal squamous cell carcinoma (ESCC).MethodsFour ESCC cell lines (ECA109, EC9706, TE-1, TE-3)and one normal esophageal epithelial cell line (Het-1a) were analyzed for this study. Reverse-transcription polymerase chain reaction (RT-PCR) and Western blotting were employed to detect the mRNA and protein expression of p53 and differentiated embryo-chondrocyte-expressed gene1 (DEC1) in ESCC cell lines. MTT and senescence associated β-galactosidase were used to explore an appropriate cisplatin concentration to induce proliferation inhibition and cellular senescence in TE-3 cell line. Further, Western blotting was employed to detect the expression of DEC1 and p53.ResultsIn this study, we identified that p53 had a lower expression compared with normal esophageal epithelial cells by testing mRNA and protein expression of different esophageal cancer cell lines, while the expression of DEC1 had a higher expression. MTT assay showed that cisplatin inhibited the growth of TE-3 in a dose-and time-dependent manner. Combined MTT with senescence associated β-galactosidase, 4uM and 48 hours were chosen as most appropriate condition to induce cellular senescence. Elevated levels of senescence associated β-galactosidase were observed in TE-3 cells when exposed to low doses of cisplatin. TE3 cell experienced morphological changes following drug exposure accompanied with up regulation of DEC1 and p53.ConclusionOur results revealed that cisplatin could induce cellular senescence in esophageal squamous cell carcinoma. Meanwhile, p53 and DEC1 may be involved in this process.
【Key words】esophageal squamous cell carcinoma;cellular senescence; DEC1;p53;cisplatin
(收稿日期:2015-12-25)
【中图分类号】R 655.4
[doi:10.3969/j.issn.1006-7795.2016.01.004]
*Corresponding author, E-mail:wyj_30302@163.com
基金项目:国家自然科学基金(81302160, 81272447), 国家消化系统疾病临床医学研究中心基金(2015BAI13B09)。 This study was supported by National Natural Science Foundation of China (81302160, 81272447), National Clinical Research Center for Digestive Diseases (2015BAI13B09).
网络出版时间:2016-01-2718∶10网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1810.042.html
· 消化系统重大疾病的全链条研究 ·

