PINK1减轻α-突触核蛋白引起的线粒体损伤
王 雪 申甲梅 高 歌 段春礼 鲁玲玲 杨 慧
(首都医科大学基础医学院神经生物学系 北京脑重大疾病研究院 帕金森病研究所 教育部神经变性病重点实验室, 北京 100069)
PINK1减轻α-突触核蛋白引起的线粒体损伤
王雪申甲梅高歌段春礼鲁玲玲杨慧*
(首都医科大学基础医学院神经生物学系 北京脑重大疾病研究院 帕金森病研究所 教育部神经变性病重点实验室, 北京 100069)
【摘要】目的证明PINK1对α-突触核蛋白 (α-synuclein, α-syn) 引起的线粒体损伤的影响。方法将携带人源PINK1 和α-syn基因的质粒共转染MN9D多巴胺能神经细胞,流式细胞术检测细胞内活性氧 (reactive oxygen species, ROS)、线粒体渗透性转运孔 (mitochondrial permeability pore, mPTP) 的开放情况及线粒体膜电势 (ΔΨm) 变化;MTT和乳酸脱氢酶法检测细胞活力及细胞损伤情况。 结果PINK1减少α-syn引起的ROS的生成、线粒体膜孔的开放及线粒体膜电势降低,并减轻α-syn所致细胞活力下降及和细胞损伤。结论PINK1可以减轻α-syn引起的线粒体损伤。
【关键词】PINK1; α-突触核蛋白; 线粒体
帕金森病 (Parkinson’s disease, PD) 是一种常见于老年人的中枢神经系统退行性疾病,其发病率仅次于阿尔兹海默症,65岁以上人群患病率超过1 %[1]。其典型的病理特征为神经元内嗜酸性包涵体路易体 (Lewy bodies, LBs) 及路易神经突的 (Lewy neurites, LNs) 形成[2]。PD的发病因素不仅涉及遗传,还有环境和老化等因素,而线粒体功能障碍是各种致病因素导致神经元退变的中心环节。α-突触核蛋白 (α-synuclein, α-syn)过表达可以引起线粒体功能障碍[3-4]。过表达人源的α-syn可引起细胞内反应性氧自由基 (reactive oxygen species, ROS) 增高、线粒体孔的形成[5-7]。本实验室近期结果[8]也证明,α-syn主要通过其氨基端引起线粒体膜孔 (mitochondrial permeability transition pore, mPTP) 异常开放及线粒体膜电势 (ΔΨm) 降低,引起线粒体形态的改变从而损伤线粒体。
PD致病基因PINK1可以直接定位到线粒体的蛋白,对维持线粒体的功能和形态有重要作用。PINK1蛋白由581个氨基酸组成,包括氨基端的线粒体靶向序列 (1~32 氨基酸),一个假定的跨膜区,中间的丝苏氨酸激酶结构域 (156~509氨基酸) 以及羟基端的调节区[9-10]。PINK1的激酶活性对于它的神经保护作用至关重要。PINK1功能丧失可以导致线粒体的形态缺陷[11-13]、膜电势下降[14-16]以及ROS的产生增加[17],此外还可以通过减少细胞ATP的产生而对细胞起到损伤作用[18]。文献[3-4]报道,突变的PINK1和α-syn 对线粒体功能的丧失有重要的影响。本实验室前期研究[19-20]证明,PINK1可能与α-syn发生直接相互作用。然而,两者如何相互作用影响神经元的线粒体功能进而影响神经元的退变尚不清楚。
1材料和方法
1.1 材料
MN9D细胞系:小鼠神经母细胞瘤细胞系N18TG2与原代C57BL/6J小鼠胚胎腹侧中脑细胞融合形成的杂交瘤细胞 (Novartis公司Bastian Hengerer博士惠赠);F12培养基、胰蛋白酶购自美国Gibco公司;胎牛血清 (fetal calf serum, FBS) 购自美国Thermo公司;蛋白酶抑制剂、磷酸酶抑制剂、5, 5′, 6, 6′-四氯-1,1′,3,3′-甲基苯并咪唑氢碘化物 (tetrechloro-tetraethylbenzimidazol carbocyanine iodide, JC-1) 购自美国Sigma公司;2′, 7′-二氯荧光素-二酯 (dichlorodihydrofluorescein diacetate, DCFH-DA) 购自美国Sigma公司;MitoProbeTM Transition Pore Assay Kit 购自美国Invitrogen 公司;MTT购自美国Sigma公司,DMSO购自美国Sigma公司;乳酸脱氢酶 (lactate dehydrogenase, LDH)试剂盒购自瑞士Roche公司;人源PINK1及α-synuclein质粒pcDNA3.1-3xFlag-hPINK1WT, pCMV-Myc-α-syn由本实验室已构建。
1.2方法
1.2.1细胞培养及转染
MN9D细胞采用含10%(体积分数)FBS、100 U/mL青霉素和 100 U/mL链霉素的DMEM /F12培养基,置于 37 ℃的5% (体积分数) CO2培养箱中培养。质粒转染按照Lipofectamine 2000操作说明书进行。
1.2.2活性氧的测定
MN9D细胞分组转染48 h后,将细胞消化收集,离心后,加入PBS洗2遍,5 min/次,1 000 r/min, 1 min离心。用F12培养基将DCFH-DA贮存液1∶1 000稀释,稀释成染色液,其工作终浓度是10 μg/mL;弃PBS后,加1 mL 10 μg/mL DCFH-DA染色液,37 ℃,5%(体积分数) CO2培养箱内孵育15 min;吸弃染色液,以PBS洗涤细胞5 min, 3次,以洗去非特异荧光;以0.2 mL的PBS重悬细胞,利用流式细胞仪进行检测。
1.2.3细胞线粒体膜渗透性转运孔开放的检测
转染MN9D细胞48 h后,将各组细胞重悬在预热的HBSS/Ca2+液中,细胞终密度为每毫升1 × 106个/细胞,将每组细胞再平均分为2个组,Calcein AM组与Calcein AM + CoCl2组;将1 mmol/L Calcein AM储存液按1∶500 稀释成2 μmol/L工作液;向Calcein AM组和Calcein AM + CoCl2组中分别加入5 μL Calcein AM工作液,混匀;向Calcein AM + CoCl2组中加入5 μL CoCl2,混匀;将每组样品在 37 ℃条件下避光孵育15 min;加入约3 mL的HBSS/Ca2+到离心管中,1 000 r/min,5 min,离心收集细胞;向离心收集到的细胞中加入约400 μL PBS,1 h内进行流式细胞检测。
1.2.4线粒体膜电位检测
MN9D细胞转染48 h后收集,以F12培养基稀释JC-1贮存液至工作终质量浓度是10 μg/mL,37 ℃,5% (体积分数)CO2培养箱内孵育10 min 利用流式细胞仪进行检测。
1.2.5MTT细胞活性测定
将各组的MN9D细胞用200 μL培养基按5×103个/孔的密度接种于96孔板。24 h后进行转染,转染48 h后,向各孔加入MTT (5 mg/mL) 20 μL,37 ℃,5%(体积分数)CO2培养箱培养4 h。吸弃培养基,每孔加入100 μL DMSO,小心吹打混匀,不要有气泡。将孔板置于酶标仪中,读取550 nm波长处的吸光度值,统计作图。
1.2.6LDH 法细胞损伤程度检测
(1)工作液的制备: 250 μL催化液和 11.25 mL染色液混合成工作液,现配现用。
(2)细胞毒分析步骤: 收集细胞,用分析液在96孔板中分别制备下列样本:①背景对照:每孔加入200 μL正常培养液,复孔3个。计算结果时,用其他值减去背景值。低对照:向每孔加入分析液200 μL,细胞量约为1×104~2 × 104个,复孔3个。高对照:向每孔加入含1 %(体积分数)Triton X-100的分析液200 μL,细胞量约为1×104~2 × 104个,复孔3个。检测样本:向每孔加入含检测物质的分析液200 μL,细胞量约为1×104~2 ×104个,复孔3个;在37 ℃,5% (体积分数) CO2培养箱中孵育细胞,孵育时间为检测物质的适当处理时间;将细胞上清小心转移到相应的新96孔板中,每孔100 μL;每孔加入100 μL现用现配的反应混合液,室温避光孵育30 min。孵育完毕后,每孔加入50 μL终止液混匀终止反应。用微孔读板仪在490 nm检测样本的吸光度值,后进行计算分析。
1.3 统计学方法
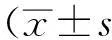
2结果
2.1PINK1抑制α-syn引起的细胞ROS增加
MN9D细胞接种于6孔板,分别过表达PINK1质粒或α-syn、空载质粒48 h后,DCFH-DA孵育,进行流式细胞术检测细胞ROS。结果显示,过表达α-syn组绿色荧光强度较空载组明显升高,而同时过表达α-syn和PINK1组的绿色荧光强度与单独表达α-syn组相比明显减少,说明过表达PINK1挽救了α-syn引起的ROS明显增加。上述结果提示,在 MN9D 细胞中,过表达PINK1可能缓解 α-syn引起MN9D细胞mPTP异常开放,线粒体膜的通透性异常增加(图1)。
2.2PINK1抑制α-syn引起的mPTP开放
在MN9D细胞分别转染及共转染PINK1与α-syn质粒及其空载组,48 h后对各组不同细胞经流式细胞术检测细胞mPTP的开放程度。结果显示,各组细胞Calcein AM组荧光强度均相对一致,过表达α-syn 的MN9D细胞较空载组的Calcein AM + CoCl2组荧光强度明显左移,而共转染α-syn和PINK1的MN9D细胞Calcein AM + CoCl2组荧光强度与单独表达α-syn峰值没有明显的左移,提示在 MN9D细胞中,过表达PINK1能够抑制α-syn引起的MN9D细胞mPTP异常开放(图2)。
2.3PINK1抑制α-syn引起的ΔΨm下降
MN9D细胞转染各组质粒48 h后用JC-1孵育,然后用流式细胞仪检测ΔΨm。膜电势正常时,JC-1呈现红色荧光;膜电势下降时,JC-1呈现绿色荧光。结果显示,过表达α-syn使ΔΨm明显降低,与对照组相比较差异有统计学意义。在同时过表达PINK1和α-syn的细胞,ΔΨm下降程度明显小于单纯过表达α-syn的细胞,提示PINK1对α-syn引起的ΔΨm下降有抑制作用(图3)。
图1 过表达PINK1可以抑制α-syn过表达引起的细胞ROS增加
ROS levels were detected with dichlorofluorescein diacetate in MN9D dopaminergic cells transfected with plasmid of vector, hPINK1 wild type, or α-syn. Cells were harvested at 48 h after transfection. The fluorescent was determined by flow cytometry and signals were acquired for 20 000 events.**P<0.01vsvector group;#P<0.05vsα-syn group;n=3; α-syn:α-synuclein; ROS:reactive oxygen species.

图2 PINK1抑制α-syn引起的线粒体膜孔异常开放
Fluorescence intensity was measured when loaded with Calcein AM with CoCl2in MN9D cell line transiently transfected with vector, α-syn, PINK1, α-syn + PINK1. Quantification of the fluorescence intensity was based on triplicates of three independent experiments and signals were acquired for 20 000 events.*P<0.05vsvector group;#P<0.05vsα-syn group;n=3;α-syn:α-synuclein; mPTP:mitochondrial permeability pore.

图3 PINK1抑制α-syn引起的膜电位降低
Plasmids of vector, hPINK1 wild type or α-syn in MN9D cells. Cells were harvested at 48 h after transfection. Δψm was visualized by treating the transfected with the probe tetrechloro-tetraethylbenzimidazol carbocyanine iodide (JC-1). Normal Δψm was detected as orange fluorescence from the aggregation of JC-1 monomers, while green fluorescence was associated with reduced Δψm as determined by flow cytometry. Signals were acquired for 20 000 events.*P<0.05vsvector group;#P<0.05vsα-syn group;n=3; α-syn:α-synuclein.
2.4PINK1抑制α-syn引起的细胞损伤
在MN9D 细胞转染各组质粒48 h后,通过酶标仪测定转α-syn质粒和空载体对细胞活力的影响。把各组的吸光度值所占百分比与空载组的比值进行统计,过表达α-syn细胞活力显著降低;同时过表达PINK1和α-syn则明显抑制了α-syn过表达引起的细胞活力下降。检测细胞培养上清中LDH的活性判断细胞受损的程度,通过LDH 试剂盒结合多标记微孔板检测仪把各组的吸光度值所占百分比与空载组的比值进行统计,过表达α-syn组LDH显著升高30 %;同时过表达PINK1和α-syn则明显抑制α-syn过表达引起的LDH的增加,结果说明PINK1可以缓解α-syn引起的细胞毒性(图4)。
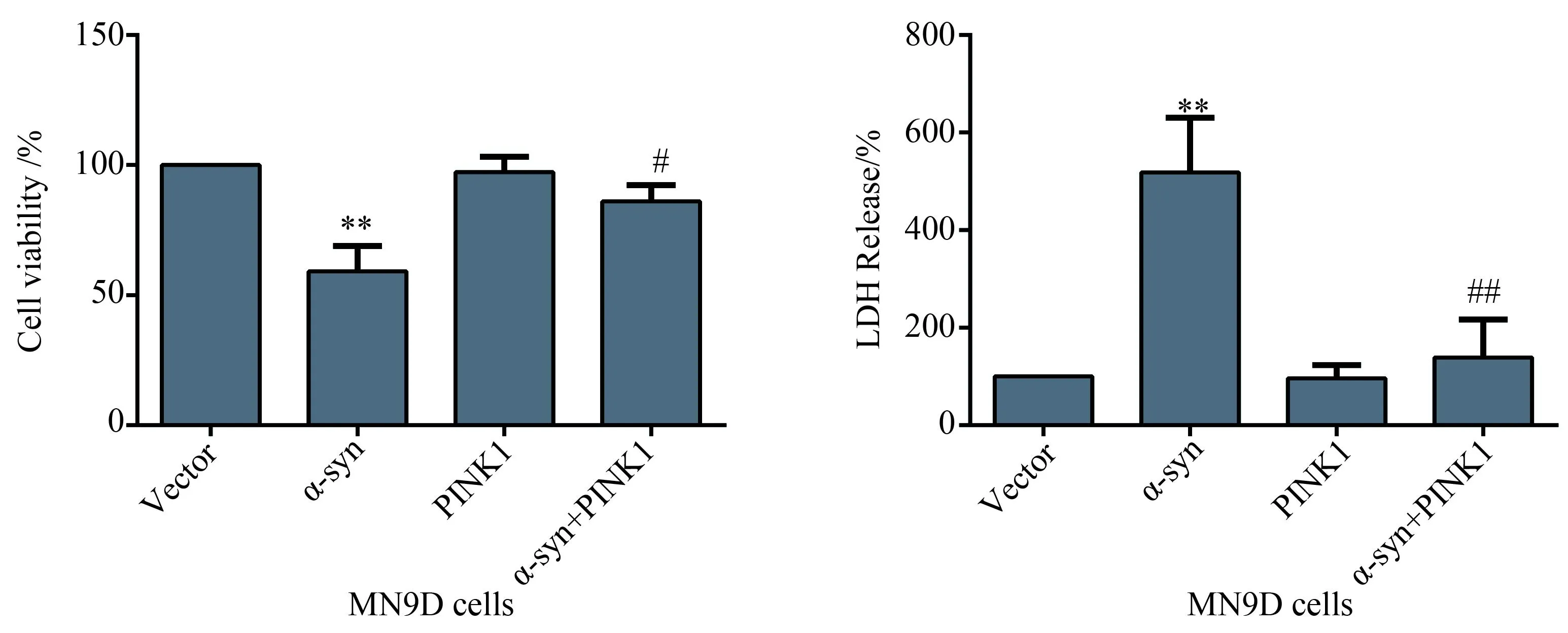
图4 PINK1抑制α-syn 引起的细胞活力的降低和LDH的释放
MN9D cells were-transfected with vector, α-syn or hPINK1 wild type. Cell viability was assessed by MTT assay and the cell injury was evaluated by LDH release after 48 h transfected.**P<0.01vsvector group;#P<0.05;##P<0.01vsα-syn group;n=6;α-syn:α-synuclein; LDH: lactate dehydrogenase.
3讨论
本研究发现,在MN9D多巴胺能神经细胞系中单纯过表达人源性α-syn可以引起细胞ROS增加,从而引起线粒体损伤。其可能的机制有如下几个方面:首先,α-syn基因转染多巴胺能神经元可以同时增加胞质及线粒体的α-syn[10];其次,文献[21]报道α-syn可以降低线粒体氧化呼吸链complex Ⅰ的活性,而complex Ⅰ的功能降低使活性氧增加,这些活性氧诱发氧应激,从而损伤细胞;最后,α-syn的过表达可以导致细胞胞质内谷胱甘肽、谷胱甘肽过氧化物酶和过氧化氢酶的下降,以及线粒体内氧化型谷胱甘肽升高,这也可以导致细胞ROS增加[22]。文献[21,23]表明,细胞活性氧增高主要是由于线粒体损伤导致。所以进一步检测α-syn是否导致线粒体损伤,结果表明α-syn的过表达可导致线粒体膜孔开放以及线粒体膜电位下降,其机制可能是由于α-syn包含可以与脂质结合的α-螺旋结构,而这个结构与膜定位密切相关,并且文献[8]表明α-syn与线粒体心磷脂降低密切相关,并且和线粒体膜蛋白电压依赖阴离子通道、腺嘌呤核苷酸转运体之间具有相互作用。这可能是α-syn导致线粒体膜孔开放及膜电势下降的原因。
本实验结果表明,共表达PINK1和α-syn,通过检测线粒体膜稳定性,发现PINK1可以挽救α-syn引起的ROS增高、膜电势下降。本实验室以往的研究[20]分别用免疫共沉淀、GST-pull-down和荧光共振能量转移等方法发现α-syn和PINK1之间存在相互作用和胞质及线粒体内共定位。而通过PINK1与α-syn复合物的形成,可以有效地缓解单纯α-syn在线粒体及胞质的浓度,进而可以有效地降低α-syn所致的ROS增高,并阻止α-syn与线粒体膜蛋白的共定位,最终发挥保护作用;同时文献[24]报道PINK1可以直接定位于线粒体,具有稳定线粒体功能,维持线粒体Complex Ⅰ活性,缓解线粒体细胞色素C的释放,从而对细胞起到保护作用[25-26]。
本实验进一步证实,单纯过表达α-syn可以引起细胞活力下降,可能与α-syn可以增加线粒体膜通透性、损伤线粒体功能、增加细胞内ROS[7-8,23]相关,而同时过表达PINK1后,可以发现PINK1明显逆转α-syn致细胞活力降低。
通过本实验,本课题组深入研究了PINK1有效缓解α-syn致细胞损伤的作用,并且讨论了其内在机制,即与线粒体功能、ROS的变化密切相关,这一结果可能为研究PD的致病机制提供新线索,并为未来开发新药提供了潜在的科学依据。
4参考文献
[1]Fearnley J M, Lees A J. Ageing and Parkinson’s disease: substantia nigra regional selectivity [J]. Brain,1991, 114 (Pt 5): 2283-2301.
[2]Kruger R, Kuhn W, Muller T, et al. Ala30Pro mutation in the gene encoding alpha-synuclein in Parkinson’s disease [J]. Nat Genet,1998, 18(2): 106-108.
[3]Polymeropoulos M H, Lavedan C, Leroy E, et al. Mutation in the alpha-synuclein gene identified in families with Parkinson’s disease [J]. Science,1997, 276(5321): 2045-2047.
[4]Li W W, Yang R, Guo J C, et al. Localization of alpha-synuclein to mitochondria within midbrain of mice [J]. Neuroreport, 2007, 18(15): 1543-1546.
[5]Spillantini M G, Schmidt M L, Lee V M, et al. Alpha-synuclein in Lewy bodies [J]. Nature,1997, 388(6645): 839-840.
[6]Feany M B. Studying human neurodegenerative diseases in flies and worms [J]. J Neuropathol Exp Neurol, 2000, 59(10): 847-856.
[7]Lo B C, Ridet J L, Schneider B L, et al. alpha-Synucleinopathy and selective dopaminergic neuron loss in a rat lentiviral-based model of Parkinson’s disease [J]. Proc Natl Acad Sci U S A, 2002, 99(16): 10813-10818.
[8]Shen J, Du T, Wang X, et al. alpha-Synuclein amino terminus regulates mitochondrial membrane permeability [J]. Brain Res, 2014, 1591: 14-26.
[9]Arima K, Ueda K, Sunohara N, et al. NACP/alpha-synuclein immunoreactivity in fibrillary components of neuronal and oligodendroglial cytoplasmic inclusions in the pontine nuclei in multiple system atrophy [J]. Acta Neuropathol, 1998, 96(5): 439-444.
[10]Hsu L J, Sagara Y, Arroyo A, et al. alpha-synuclein promotes mitochondrial deficit and oxidative stress [J]. Am J Pathol, 2000, 157(2): 401-410.
[11]Simon D K,Lin M T, Zheng L, et al. Somatic mitochondrial DNA mutations in cortex and substantia nigra in aging and Parkinson’s disease [J]. Neurobiol Aging, 2004, 25(1): 71-81.
[12]Tanner C M, Ottman R, Goldman S M, et al. Parkinson disease in twins: an etiologic study [J]. JAMA, 1999, 281(4): 341-346.
[13]Sakka N, Sawada H, Izumi Y, et al. Dopamine is involved in selectivity of dopaminergic neuronal death by rotenone [J]. Neuroreport,2003, 14(18): 2425-2428.
[14]Zhang J, Montine T J, Smith M A, et al. The mitochondrial common deletion in Parkinson’s disease and related movement disorders [J]. Parkinsonism Relat Disord,2002, 8(3): 165-170.
[15]Subramaniam S R, Vergnes L, Franich NR, et al. Region specific mitochondrial impairment in mice with widespread overexpression of alpha-synuclein [J]. Neurobiol Dis, 2014, 70: 204-213.
[16]Shimura-Miura H, Hattori N, Kang D, et al. Increased 8-oxo-dGTPase in the mitochondria of substantia nigral neurons in Parkinson’s disease [J]. Ann Neurol,1999, 46(6): 920-924.
[17]Terland O, Flatmark T, Tangeras A, et al. Dopamine oxidation generates an oxidative stress mediated by dopamine semiquinone and unrelated to reactive oxygen species [J]. J Mol Cell Cardiol,1997, 29(6): 1731-1738.
[18]Hastings T G, Lewis D A, Zigmond M J. Role of oxidation in the neurotoxic effects of intrastriatal dopamine injections [J]. Proc Natl Acad Sci U S A,1996, 93(5): 1956-1961.
[19]付越姣,段春礼, 龚普盛, 等. PINK1与α-synuclein相互作用结构域鉴定 [J]. 中国生物工程杂志,2011(12): 10-14.
[20]范春香, 崔韬, 谷利, 等. 帕金森病相关蛋白PINK1和α-突触核蛋白相互作用研究 [J]. 中国生物工程杂志,2008(12): 7-11.
[21]Sarafian T A, Ryan C M, Souda P, et al. Impairment of mitochondria in adult mouse brain overexpressing predominantly full-length, N-terminally acetylated human alpha-synuclein [J]. PLoS One,2013, 8(5): e63557.
[22]Dias V, Junn E, Mouradian M M. The role of oxidative stress in Parkinson’s disease [J]. J Parkinsons Dis, 2013, 3(4): 461-491.
[23]Banerjee K, Munshi S, Sen O, et al. Dopamine cytotoxicity involves both oxidative and nonoxidative pathways in SH-SY5Y cells: potential role of alpha-synuclein overexpression and proteasomal inhibition in the etiopathogenesis of parkinson’s disease [J]. Parkinsons Dis,2014, 2014: 878935.
[24]Beinlich F R, Drees C, Piehler J, et al. Shuttling of PINK1 between mitochondrial microcompartments resolved by triple-color superresolution microscopy [J]. Acs Chem Biol,2015, 10(9): 1970-1976.
[25]Han J Y, Kim J S, Son JH. Mitochondrial homeostasis molecules: regulation by a trio of recessive Parkinson’s disease genes [J]. Exp Neurobiol,2014, 23(4): 345-351.
[26]Morais V A, Haddad D, Craessaerts K, et al. PINK1 loss-of-function mutations affect mitochondrial complex I activity via NdufA10 ubiquinone uncoupling [J]. Science,2014, 344(6180): 203-207.
编辑孙超渊
Study ofPINK1 rescuing the mitochondrial dysfunction induced by α-synuclein
Wang Xue, Shen Jiamei, Gao Ge, Duan Chunli, Lu Lingling, Yang Hui*
(DepartmentofNeurobiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,CenterforParkinson’sDisease,BeijingInstituteforBrainDisorders,KeyLaboratoryforNeurodegenerativeDiseasesoftheMinistryofEducation,Beijing100069,China)
【Abstract】Objective To identify whether PINK1 could rescue the mitochondrial dysfunction induced by α-synuclein. MethodsMN9D cells were transfected with plasmid encoding human α-synuclein together with human wild type PINK1. The level of reactive oxygen species (ROS), mitochondrial permeability pore (mPTP) and mitochondrial membrane potential (ΔΨm) were examined by flow cytometry. The cell viability was observed by MTT assay and release of lactate dehydrogenase(LDH) respectively. ResultsWhile overexpression PINK1 could ease the opening of mPTP, reducing the generation of ROS, ΔΨm reduction percentage reduction by α-syn, reversed α-syn decreased cell viability and induced LDH release by α-syn induced. ConclusionPINK1 could alleviate α-syn-induced mitochondrial injury.
【Key words】PINK1; α-synuclein (α-syn); mitochondria
(收稿日期:2015-10-30)
【中图分类号】R 741
[doi:10.3969/j.issn.1006-7795.2016.01.014]
*Corresponding author, E-mail:huiyang@ccmu.edu.cn
基金项目:国家重点基础研究发展计划项目(2011CB504102, 2012CB722407),国家自然科学基金(81371398),北京市自然科学基金(7131001),北京市创新团队建设提升计划 (IDHT20140514),北京脑重大疾病研究院项目(BIBD-PXM2013 014226 07 000084),首都医科大学校基金(2015JS21)。 This study was supported by Major State Basic Research Development Program of China (2011CB504102, 2012CB722407), National Natural Science Foundation of China (81371398),Natural Science Foundation of Beijing (7131001), The Project of Construction of Innovative Teams and Teacher Career Development for Universities and Colleges Under Beijing Municipality (IDHT20140514),Beijing Institute for Brain Disorders-PXM (BIBD-PXM2013 014226 07 000084), Science Foundation of Capital Medical University(2015JS21).
网络出版时间:2016-01-2718∶10网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1810.032.html
· 基础研究 ·

