PHF8基因对食管鳞状细胞癌裸鼠移植瘤生长的影响
朱圣韬 孙秀静 李 鹏 郭庆东 朱圣泉 张澍田*
(1.首都医科大学附属北京友谊医院消化内科,北京 100050;2.国家消化系统疾病临床医学研究中心, 北京 100050; 3.首都医科大学消化病学系, 北京 100050;4.首都医科大学附属北京天坛医院消化内科, 北京 100050)
PHF8基因对食管鳞状细胞癌裸鼠移植瘤生长的影响
朱圣韬1,2,3孙秀静2,3,4李鹏1,2,3郭庆东1,2,3朱圣泉1,2,3张澍田1,2,3*
(1.首都医科大学附属北京友谊医院消化内科,北京 100050;2.国家消化系统疾病临床医学研究中心, 北京 100050; 3.首都医科大学消化病学系, 北京 100050;4.首都医科大学附属北京天坛医院消化内科, 北京 100050)
【摘要】目的利用慢病毒(lentivirus)介导的短发卡RNA(short hairpin RNA,shRNA)建立人食管鳞状细胞癌(esophageal squamous-cell carcinoma,ESCC,以下简称食管鳞癌)裸鼠移植瘤模型,观察锌指蛋白8(plant homeodomain finger protein 8,PHF8)对移植瘤生长的影响。方法分别将未感染慢病毒(空白对照组)、感染Nonsilencing-shRNA慢病毒(阴性对照shRNA组)和PHF8 shRNA慢病毒(PHF8 shRNA组)的人食管鳞癌细胞系TE-1接种于裸鼠背部皮下,建立食管鳞癌裸鼠移植瘤模型。定期测量肿瘤体积,绘制肿瘤生长曲线。4周后处死裸鼠,定量PCR及Western blotting法检测肿瘤组织中PHF8的表达。结果PHF8 shRNA组较阴性对照shRNA组、空白对照组的裸鼠致瘤能力明显减弱,PHF8 mRNA和蛋白的表达水平显著降低。结论慢病毒介导的shRNA干扰能有效减少食管鳞癌裸鼠移植瘤中PHF8的表达,而降低PHF8的表达能抑制食管鳞癌移植瘤的生长。
【关键词】PHD锌指蛋白8;慢病毒;食管鳞状细胞癌;裸鼠移植瘤
我国是食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC,以下简称食管鳞癌)的高发国家。目前已知,表观遗传学参与包括食管鳞癌在内的多种肿瘤的发生发展,某些组蛋白去甲基化酶(histone demethylase, KDM)在肿瘤的发病过程中起关键作用。PHD锌指蛋白8(plant homeodomain finger protein 8, PHF8)是近年来新发现的一种组蛋白去甲基化酶,在体内通过对组蛋白的赖氨酸残基进行去甲基化修饰来调节基因的表达[1]。
笔者既往研究[2]以食管鳞癌细胞系为研究对象,通过慢病毒介导的shRNA技术建立了PHF8表达沉默的食管鳞癌稳定细胞系,并且体外研究[3]证实PHF8影响食管鳞癌细胞的增生、凋亡、克隆形成、迁移和侵袭能力。本研究利用上述已建立的食管鳞癌细胞系,进一步探讨PHF8基因对食管鳞癌裸鼠移植瘤生长的影响。
1材料与方法
1.1 材料
人食管鳞癌细胞系TE-1由美国MD Anderson Cancer Center徐晓春教授惠赠。感染慢病毒Non-silencing shRNA和PHF8 shRNA的人食管鳞癌TE-1细胞系由本中心实验室保存。BALB/c 裸小鼠[实验动物许可证号:SYXK(京)2012-0023],SPF 级,鼠龄5周,体质量(19.42±1.28)g,雌性。遵照国家实验动物饲养和使用指南,在实验动物中心无特殊病原菌条件下分笼饲养。RPMI 1640 培养基、胎牛血清、胰蛋白酶均购自美国Gibco公司,RNA提取试剂盒购自美国Qiagen公司,iScript反转录试剂盒购自美国Bio-Rad公司,SYBR Green PCR Master Mix购自美国ABI公司,PHF8抗体购自英国Abcam公司,β-actin抗体购自美国Sigma公司。
1.2 方法
1.2.1细胞培养
各组食管鳞癌细胞TE-1系(PHF8 shRNA实验组,Non-silencing shRNA 阴性对照组和Control空白对照组)[2],用含10%(体积分数)胎牛血清的RPMI 1640培养基,于37 ℃ 含5%(体积分数) CO2培养箱中培养,细胞生长达70%~80%融合时进行传代。
1.2.2实验动物模型的制备及分组
将21只BALB/c 裸小鼠应用随机数字表进行完全随机化,分为3组,每组7只,分别注射PHF8 shRNA实验组、Non-silencing shRNA 阴性对照组和Control空白对照组的TE-1细胞。取对数生长期的各组食管鳞癌细胞,经胰蛋白酶消化后,制备单细胞悬液,用1×PBS 洗涤细胞3 次,计数并用PBS 重悬、调整细胞密度为4×107/mL。用1 mL 注射器抽取瘤细胞悬液接种于裸鼠一侧背部皮下,每个接种部位0.1 mL,含活细胞数4×106。
1.2.3观察指标与测定方法
在裸鼠成瘤实验期间,定期观察裸鼠的精神、饮食、体质量等及有无异常情况。每隔3 d测量裸鼠的体质量、肿瘤结节的长度(L)和宽度(W)。绘制肿瘤生长曲线。肿瘤体积的计算公式为:V=0.5×L×W2。
1.2.4实时荧光定量PCR检测目的基因表达
收集各组裸鼠移植瘤组织并匀浆,应用Qiagen公司的RNA提取试剂盒提取组织总RNA,Bio-Rad公司的iScript反转录试剂盒反转录得到cDNA,随后应用ABI公司的SYBR Green PCR Master Mix试剂盒,在7500 实时荧光定量PCR仪上完成实时荧光定量PCR检测。引物的序列如下:内参照GAPDH:sense:5′-CCACATCGCTCAGACACCAT-3′,antisense:5′-GCGCCCAATACGACCAAAT-3′;目的基因PHF8:sense:5′-GACATGTGCCAGGACTGGTTT-3′,antisense:5′-CAGCAGCCTTCTCCTCTTCAA-3′。
1.2.5Western blotting法检测目的蛋白表达
提取各组移植瘤组织总蛋白后BCA法蛋白定量,40 μg的蛋白样品变性后进行SDS-PAGE蛋白分离,将蛋白转移至PVDF膜,5%(质量分数)牛血清白蛋白室温封闭1 h,一抗4 ℃孵育摇床过夜,TBST洗膜,二抗室温孵育1 h,TBST洗膜,ECL化学发光鉴定。β-actin为内参。
1.3 统计学方法
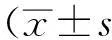
2结果
2.1各组裸鼠的可比性
各组实验动物均在皮下注射后1周左右成瘤,成瘤率100%。至实验结束,动物生长良好,精神、饮食及活动等方面均无异常。各组动物体质量随周数增加而增加,重复测量数据的方差分析结果显示,各组间体质量随时间的变化差异无统计学意义 (F=0.003,P>0.05),具有可比性,详见表1。
2.2各组裸鼠移植瘤体积的比较
各组实验动物的移植瘤的体积随时间增加而增大。重复测量数据方差分析结果显示,不同组间比较差异有统计学意义(F=7.78,P<0.01)。与阴性对照shRNA组和空白对照组比较,PHF8 shRNA实验组的瘤体增长速度慢、体积小(P<0.05),两对照组比较差异无统计学意义(P>0.05)(表2)。进一步绘制肿瘤生长曲线(图1),表明PHF8的表达沉默可使人食管鳞癌裸鼠移植瘤的瘤体生长明显受抑制。
2.3各组裸鼠移植瘤PHF8的表达
应用实时荧光定量PCR和Western blotting方法检测各组移植瘤组织PHF8 mRNA和蛋白的表达水平,可见实验组PHF8的表达量明显低于阴性对照组和空白对照组,两对照组比较差异无统计学意义(图2),这表明在裸鼠移植瘤实验中PHF8的表达沉默持续有效。
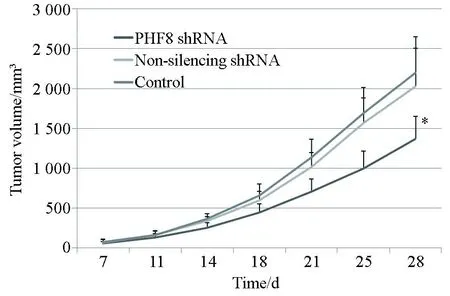
图1 各组裸鼠移植瘤的生长曲线

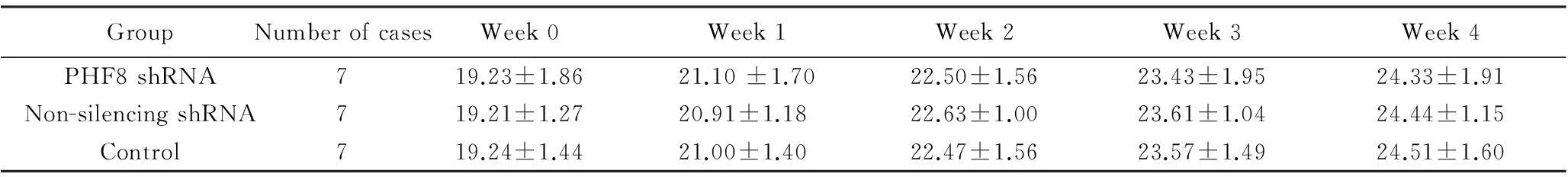
GroupNumberofcasesWeek0Week1Week2Week3Week4PHF8shRNA719.23±1.8621.10±1.7022.50±1.5623.43±1.9524.33±1.91Non-silencingshRNA719.21±1.2720.91±1.1822.63±1.0023.61±1.0424.44±1.15Control719.24±1.4421.00±1.4022.47±1.5623.57±1.4924.51±1.60
PHF8: plant homeodomain finger protein 8.
表2各组实验动物的肿瘤体积
Tab2. Tumor volume of each group

GroupNumberofcasesWeek1Week2Week3Week4PHF8shRNA755.12±23.53251.00±67.04704.56±159.541367.93±281.05Non-silencingshRNA767.70±33.43337.76±55.751013.29±183.792025.99±479.75Control772.70±34.71364.70±61.691134.20±231.842197.86±453.57
The tumor volume of each group was increased as times went on. As compared with non-silencing shRNA group and control group, the tumor growth of PHF8 shRNA group was slow and the tumor volume decreased significantly (P<0.05). However, no significant weight differences were observed in mice between non-silencing shRNA group and control group (P>0.05); PHF8: plant homeodomain finger protein 8.
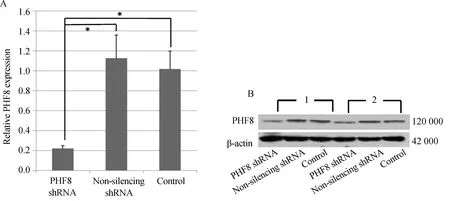
图2 裸鼠移植瘤中PHF8的表达
A: expression levels of PHF8 mRNA determined by quantitative real-time PCR (n=5). B: Western blotting analysis of PHF8 protein levels. β-actin served as the internal reference;1 and 2 are the representative picture of different treat groups;*P<0.05; PHF8: plant homeodomain finger protein 8.
3讨论
近年来,表观遗传学(epigenetics)与肿瘤形成之间的关系越来越受到重视,其研究为肿瘤的发生和发展提供了新的理论基础,并为肿瘤的诊断和治疗提供了新的手段[4]。表观遗传是指没有DNA序列变化的、可遗传的基因表达改变[5]。它有3个特点:(1)可遗传的,即这类改变能够通过有丝分裂或减数分裂,在细胞或个体世代间传递;(2)可逆性的基因表达调控;(3)没有DNA序列变化或者不能用DNA序列的变化解释。异常的表观遗传修饰会使基因错误地表达,引起发育异常、代谢紊乱和疾病,甚至肿瘤的发生,因此表观遗传修饰对于研究个体发育以及肿瘤的发生、诊断和治疗等方面具有重大意义[6]。
当前表观遗传学的研究内容主要集中在3个方面:DNA 甲基化修饰(DNA methylation)、组蛋白共价修饰(covalent histone modification)和非编码RNA(non-coding RNAs)。其中组蛋白修饰是表观遗传调控的重要组成部分,包括甲基化、乙酰化、磷酸化、泛素化、SUMO化和ADP核糖基化等,它们分别由不同的组蛋白修饰酶催化,通过改变染色质的结构以及与其他调控蛋白相互作用,调节真核基因的表达[7]。
组蛋白甲基化(histone methylation)是表观遗传学的研究内容之一。同大多数表观遗传改变一样,它是一个可逆的过程。组蛋白甲基化与组蛋白去甲基化(histone demethylation)分别由组蛋白甲基转移酶(histone methyltransferase)和组蛋白去甲基化酶(histone demethylase)催化[8]。组蛋白去甲基化酶是催化甲基化的组蛋白发生去甲基化的组蛋白修饰酶。自2004年第1个组蛋白赖氨酸去甲基化酶被发现以来,目前已发现30多种,而其中的大部分已经被证实与乳腺癌、前列腺癌、肺癌、结肠癌、白血病、淋巴瘤等多种肿瘤的发生发展有关[9-11]。
PHD锌指蛋白8(PHF8)是近年来新发现的一种组蛋白去甲基化酶。有研究[12-14]显示,PHF8参与调节细胞的增生、凋亡、分化及运动等生物学行为。但是关于PHF8是否参与肿瘤的发生和发展,目前研究仍处于起始阶段。Björkman等[15]的研究表明PHF8在前列腺癌中有过表达,敲除PHF8抑制前列腺癌细胞的增生、迁移和侵袭,这与笔者在食管鳞癌细胞的体外研究[3]结果一致,但关于PHF8功能的体内动物实验目前国内外尚无报道。笔者利用裸鼠移植瘤模型研究PHF8表达沉默对食管鳞癌细胞体内肿瘤生长的影响。将不同处理组的TE-1细胞分别给裸鼠皮下注射,每只裸鼠注射一种细胞。各组实验动物均在皮下注射后1周左右成瘤,成瘤率100%。至实验结束,动物生长良好,精神、饮食及活动等方面均无异常。各组动物体质量随周数增加而增加,各组间体质量差异无统计学意义,具有可比性。随着时间的增加,各组实验动物的移植瘤逐渐增大,与阴性对照组和空白对照组比较,实验组的瘤体增长速度慢、体积小,表明PHF8基因表达沉默抑制食管鳞癌细胞的体内致瘤能力。
本研究结果证实,慢病毒介导的shRNA干扰能够有效、持续地沉默食管鳞癌细胞移植瘤中组蛋白去甲基化酶PHF8的mRNA和蛋白表达。并且,PHF8的表达沉默能够抑制食管鳞癌裸鼠移植瘤的生长,提示PHF8可能参与了食管鳞癌的发病。但肿瘤的病因及发病机制复杂,单一组蛋白的修饰往往不能独立地发挥作用,关于组蛋白去甲基化酶的机制,特别是与其他组蛋白修饰间相互作用的具体机制尚不太清楚,因此,组蛋白去甲基化酶虽然与肿瘤有关,但要从分子水平来阐明两者之间的关系尚需进一步的研究。令人鼓舞的是肿瘤表观遗传治疗的有效性已经得到认可,另一类组蛋白修饰酶——去乙酰化酶已成为临床肿瘤治疗的靶点,调节组蛋白去甲基化酶的活性将成为防治肿瘤的新思路和药物开发的新方向[16-18]。
4参考文献
[1]Feng W, Yonezawa M, Ye J, et al. PHF8 activates transcription of rRNA genes through H3K4 me3 binding and H3K9 me1/2 demethylation[J]. Nat Struct Mol Biol, 2010, 17(4): 445-450.
[2]孙秀静, 原标, 朱圣韬, 等. 沉默PHF8重组慢病毒的制备及其对食管鳞癌细胞增生的影响[J]. 首都医科大学学报, 2014, 35(1): 122-128.
[3]Sun X, Qiu J J, Zhu S, et al. Oncogenic features of PHF8 histone demethylase in esophageal squamous cell carcinoma[J]. PLoS One, 2013, 8(10): e77353.
[4]Taby R, Issa J P. Cancer epigenetics[J]. CA Cancer J Clin, 2010, 60(6): 376-392.
[5]Berger S L, Kouzarides T, Shiekhattar R, et al. An operational definition of epigenetics[J]. Genes Dev, 2009, 23(7): 781-783.
[6]Egger G, Liang G, Aparicio A,et al. Epigenetics in human disease and prospects for epigenetic therapy[J]. Nature, 2004, 429(6990): 457-463.
[7]Strahl B D, Allis C D. The language of covalent histone modifications[J]. Nature, 2000, 403(6765): 41-45.
[8]You J S, Jones P A. Cancer genetics and epigenetics: two sides of the same coin? [J]. Cancer Cell, 2012, 22(1): 9-20.
[9]Agger K, Christensen J, Cloos P A,et al. The emerging functions of histone demethylases[J]. Curr Opin Genet Dev, 2008, 18(2): 159-168.
[10]Rotili D, Mai A. Targeting histone demethylases: a new avenue for the fight against cancer[J]. Genes Cancer, 2011, 2(6): 663-679.
[11]徐龙勇, 陈德桂. 组蛋白去甲基化酶研究进展[J]. 生命科学, 2010, 22(2): 109-114.
[12]Qi H H, Sarkissian M, Hu G Q, et al. Histone H4K20/H3K9 demethylase PHF8 regulates zebrafish brain and craniofacial development[J]. Nature, 2010, 466(7305): 503-507.
[13]Liu W, Tanasa B, Tyurina O V, et al. PHF8 mediates histone H4 lysine 20 demethylation events involved in cell cycle progression[J]. Nature, 2010, 466(7305): 508-512.
[14]Qiu J, Shi G, Jia Y, et al. The X-linked mental retardation gene PHF8 is a histone demethylase involved in neuronal differentiation[J]. Cell Res, 2010, 20(8): 908-918.
[15]Björkman M, Östling P, Härmä V, et al. Systematic knockdown of epigenetic enzymes identifies a novel histone demethylase PHF8 overexpressed in prostate cancer with an impact on cell proliferation, migration and invasion[J]. Oncogene, 2012, 31(29): 3444-3456.
[16]钟武, 李天煜,张磊昌,等. 表观遗传学干预对结直肠癌细胞株p33ING1b基因表达及生物学特性影响[J]. 中华肿瘤防治杂志,2015,22(2):81-85.
[17]肖莉, 万义增,王宝,等. 宫颈上皮内瘤变及鳞癌组织中组蛋白去乙酰化酶1的表达及与HPV16/18感染的关系[J]. 中国医科大学学报,2015,44(5): 464-467.
[18]李宁, 高岭,刘培杰,等. HDAC6表达下调对食管鳞癌细胞周期影响的研究[J]. 中华肿瘤防治杂志,2013,20(5):338-341.
编辑陈瑞芳
Effect ofPHF8 gene on the growth of transplanted tumor of esophageal squamous-cell carcinoma in nude mice
Zhu Shengtao1,2,3, Sun Xiujing2,3,4, Li Peng1,2,3, Guo Qingdong1,2,3, Zhu Shengquan1,2,3, Zhang Shutian1,2,3*
(1.DepartmentofGastroenterology,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China; 2.NationalClinicalResearchCenterforDigestiveDiseases,Beijing100050,China; 3.FacultyofGastroenterology,CapitalMedicalUniversity,Beijing100050,China; 4.DepartmentofGastroenterology,BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China)
【Abstract】ObjectiveTo establish nude mice models with implanted tumor of esophageal squamous-cell carcinoma cells, and to observe the effects of PHF8 gene on the growth of implanted tumor. MethodsNude mice were injected subcutaneously into their right posterior flank with human TE-1 esophageal squamous-cell carcinoma cells (control group), lentivirus mediated Non-silencing shRNA TE-1 cells (Non-silencing shRNA group), or lentivirus mediated PHF8 shRNA TE-1 cells (PHF8 shRNA group), respectively. The size of implanted tumor was measured at regular intervals and the growth curve of tumor was portrayed. Animals were sacrificed at 4 weeks, and the silencing of PHF8 in tumor tissues was confirmed by real-time PCR and Western blotting.ResultsThe tumorigenic effect on nude mice was weaker and lower in PHF8 shRNA group, as compared to those in Non-silencing shRNA group and control group. The expression of PHF8 mRNA and protein in PHF8 shRNA group was significantly decreased. ConclusionLentivirus mediated shRNA effectively inhibited the expression of PHF8 in transplanted tumor of nude mice with human esophageal squamous-cell carcinoma cell lines, and the tumorigenic ability was significantly reduced.
【Key words】PHD finger protein 8; lentivirus; esophageal squamous cell carcinoma; transplanted tumor in nude mice
(收稿日期:2015-12-25)
【中图分类号】R 735.1
[doi:10.3969/j.issn.1006-7795.2016.01.003]
*Corresponding author, E-mail:zhangshutian@ccmu.edu.cn
基金项目:国家自然科学基金(81302160, 81272447),国家消化系统疾病临床医学研究中心基金(2015BAI13B09),北京市医院管理局青苗人才计划(QML20150507)。This study was supported by National Natural Science Foundation of China (81302160, 81272447), National Clinical Research Center for Digestive Diseases (2015BAI13B09), Beijing Municipal Administration of Hospitals’ Youth Programme (QML20150507).
网络出版时间:2016-01-2716∶03网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1603.004.html
· 消化系统重大疾病的全链条研究 ·

