血清饥饿激活表皮生长因子受体诱导胃癌耐药
王俊雄 蔡习强 聂勇战 郝建宇 樊代明*
(1. 第四军医大学西京消化病医院, 西安 710032;2.首都医科大学附属北京友谊医院医疗保健中心, 北京100050;3. 首都医科大学附属北京朝阳医院消化内科,北京 100431;4.国家消化系统疾病临床医学研究中心,北京 100050;5.首都医科大学消化病学系,北京 100050)
血清饥饿激活表皮生长因子受体诱导胃癌耐药
王俊雄1,2,3,4,5蔡习强1聂勇战1郝建宇3,4,5*樊代明1*
(1. 第四军医大学西京消化病医院, 西安 710032;2.首都医科大学附属北京友谊医院医疗保健中心, 北京100050;3. 首都医科大学附属北京朝阳医院消化内科,北京 100431;4.国家消化系统疾病临床医学研究中心,北京 100050;5.首都医科大学消化病学系,北京 100050)
【摘要】目的探讨血清饥饿对表皮生长因子受体(epidermal growth factor receptor,EGFR)高表达胃癌细胞化学药物治疗(以下简称化疗)敏感性的影响及其作用机制。方法将胃癌细胞分为4组:正常对照组、饥饿组、化疗药处理组、饥饿+化疗药处理组。采用噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]方法观察肿瘤细胞的存活率,两两比较验证血清饥饿对化疗药敏感性的影响。采用Western blotting法观察细胞EGFR及其下游靶分子细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK),蛋白激酶B(RAC-alpha serine/threonine-protein kinase, Akt)的磷酸化水平变化;最后进一步借助EGFR单克隆抗体西妥昔单抗抑制EGFR的磷酸化的活性,观察其对胃癌细胞化疗感性的影响。结果与对照组相比,胃癌细胞SGC7901血清饥饿时对多种化疗药物的敏感性下降,血清饥饿可促进EGFR、ERK磷酸化,差异有统计学意义(P<0.05)。EGFR单克隆抗体可部分逆转血清饥饿所导致的化疗药耐药。 结论缺营养饥饿可诱导EGFR高表达胃癌细胞化疗耐药,其诱导机制可能与激活EGFR/ERK信号通路有关。
【关键词】胃癌;血清饥饿;表皮生长因子受体;耐药
大多数晚期肿瘤应用最广泛的治疗策略是化学药物治疗(以下简称化疗),但是并随着药物的使用出现肿瘤耐药,导致仅有部分的肿瘤化疗有效[1]。传统研究[2]认为进行化疗的肿瘤患者应该高营养饮食来抵抗化疗带来的不良反应,近年研究[3]表明短期饥饿可以影响多种肿瘤对化疗药物的敏感性,不同种类的肿瘤化疗药物的敏感性的影响不尽相同。这样针对不同肿瘤患者为其制定个体化的营养方案就可以扩大特定化疗药物对肿瘤的有效性,具有实际的临床意义。胃癌是我国死亡人数最多的恶性肿瘤之一,因此进一步深入研究血清饥饿对胃癌化疗药敏感性的作用,为胃癌患者临床营养支持治疗提供新思路等具有重要意义。
1材料和方法
1.1 材料
人胃癌SGC7901、BGC823、MKN45细胞系(购自中国军事医学科学院),胎牛血清(美国Gibco公司);RPMI-1640 培养基(美国Gibco公司);MTT(美国Sigma公司);表皮生长因子受体(epidermal growth factor receptor,EGFR)、phospho-EGFR、(extracellular regulated protein kinases, ERK)、phospho-ERK、Akt、phospho-Akt抗体(美国Cell Signaling公司);辣根酶过氧化物标记的二抗(美国Santa Cruz 公司);西妥昔单抗(美国Merk公司)。
1.2方法
1.2.1细胞培养及药物处理
人胃癌SGC7901、BGC823、MKN45细胞系培养环境相似,为37 ℃、5% (体积分数)CO2的孵箱。培养液为含10%(体积分数)胎牛血清的RPMI1640,西妥昔单抗浓度为200 μg/ mL。
1.2.2MTT法检测细胞体外药物敏感性
取5×103个细胞,均匀种植于Corning公司的96孔板中,分正常对照组、饥饿组、化疗药处理组、饥饿+化疗药处理组,24 h后将表柔比星(epirubicin,EPI)(0.5 μg/mL)和顺铂(cis-diaminedichloroplatinum,CDDP)(0.8 μg/mL),五氟尿嘧啶[5-fluoro-2,4(1H,3H)pyrimidinedione,5-FU](0.8 μg/mL)等药物或空白对照加入细胞中,每个浓度设置5个复孔。培养48 h后,向96孔板的每个孔小心加入5 mg/mL的预制MTT溶液20 μL,继续孵育4 h。小心吸出96孔板孔内液体,加入150 μL二甲基亚砜,振荡器上震摇10 min,使用酶标仪在490 nm波长处读出各孔的吸光度值。根据所得结果,以对照组的吸光度值为参照,计算与对照组的比值并绘制药物浓度抑制曲线。
1.2.3Western blotting 法分析蛋白表达
不同条件处理胃癌细胞后,弃去培养液,PBS洗2次,把PBS 液吸取干净后,加入蛋白酶抑制剂、磷酸酶抑制剂和细胞裂解液,冰上孵育15 min,用细胞刮将细胞刮下收集到1.5 mL的EP管中,4 ℃,12 000r/min离心10 min,吸取上清至另一EP管。检测蛋白浓度,100 ℃煮沸10 min,冷冻保存备用。各组样品采取总蛋白30 μg,经电泳,转膜,封闭,一抗过夜,次日加入辣根酶过氧化物标记的二抗,室温孵育1 h,加入发光底物,用Bio-Rad成像系统对化学发光信号进行图像采集,采用Quantity One 软件比较样本目的蛋白表达水平高低。
1.2.4荧光共聚焦显微镜检测phospho-EGFR
取处于生长对数期的胃癌细胞SGC7901,于荧光小室中铺细胞,分别正常培养和血清饥饿24 h,细胞孔中分别加入PBS洗3次,每次5 min;加入4%(体积分数)多聚甲醛在室温下固定30 min,吸出多聚甲醛,PBS缓冲液漂洗;1 mL 0.1%(体积分数) Triton 室温下处理5 min;3%(体积分数)胎牛血清封闭液封闭35 min,接着PBS漂洗1次;加入一抗,37 ℃孵育1 h;加入二抗,37 ℃避光孵育2 h;加入DAPI,室温下反应10 min; 荧光共聚焦显微镜下观察,拍照。
1.3统计学方法
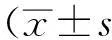
2结果
2.1永生化的胃正常细胞和胃癌细胞系中EGFR的表达情况
在永生化的胃正常细胞GES中EGFR相对低表达,而在胃癌细胞系AGS、MKN45、SGC7901中为相对高表达(图1)。为了验证胃癌细胞系在缺营养状态在对化疗药物敏感性,本研究选择MKN45、SGC7901进行下一步试验。
2.2血清饥饿导致胃癌细胞对化疗药物敏感性下降
在0.5%(体积分数)血清浓度下,胃癌肿瘤细胞可维持基本生长,但生长相对缓慢,所以设置血清浓度0.5%(体积分数)为血清饥饿条件。采用MTT法检测血清饥饿时EGFR高表达的胃癌细胞MKN45和SGC7901对化疗药物的敏感性下降(图2)实验分组分别为:Ctrl组(对照组)、血清饥饿组、化疗药组、血清饥饿+化疗药组。预先铺于96孔板中的MKN45细胞和SGC7901细胞中,每组设5重复,48 h后按MTT法处理,观察肿瘤细胞的存活率,提示血清饥饿时胃癌细胞在相同浓度的化疗药物(5-FU、CDDP、EPI)作用下,细胞存活率较对照组升高,经统计学处理其差异有统计学意义(P<0.01)。
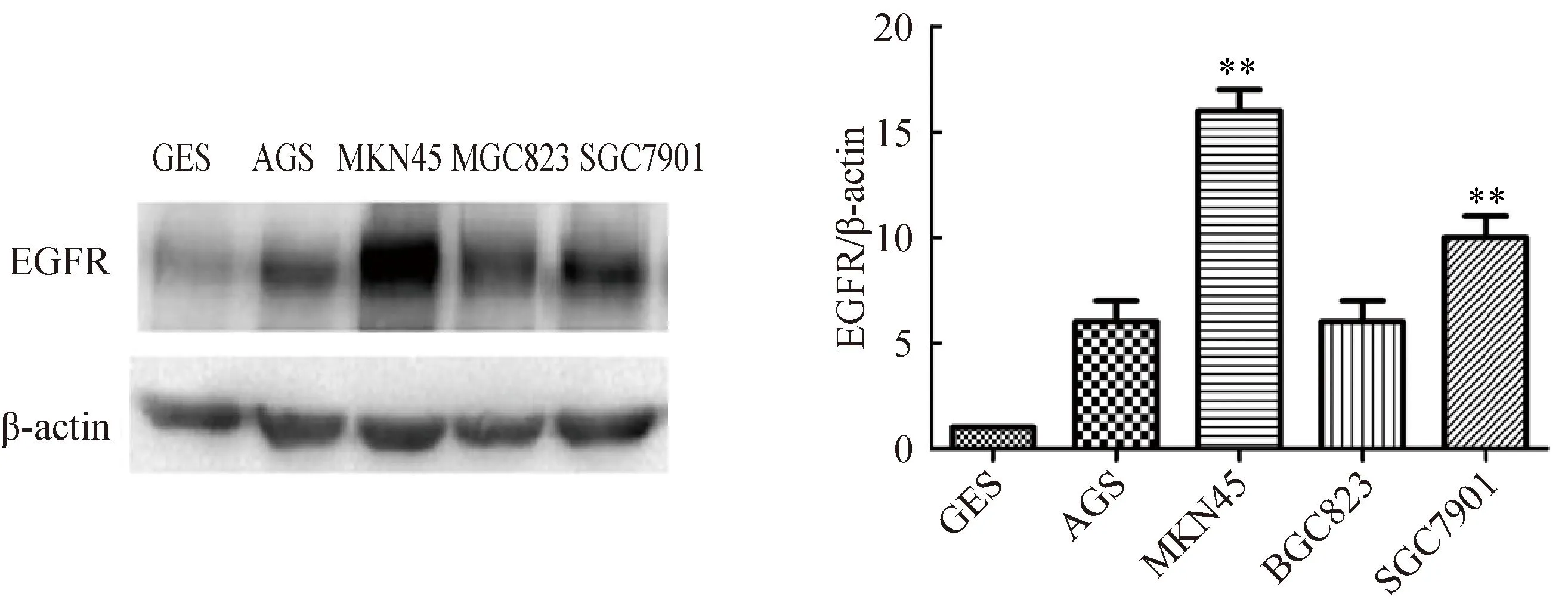
图1 EGFR在胃正常细胞及肿瘤细胞中的表达
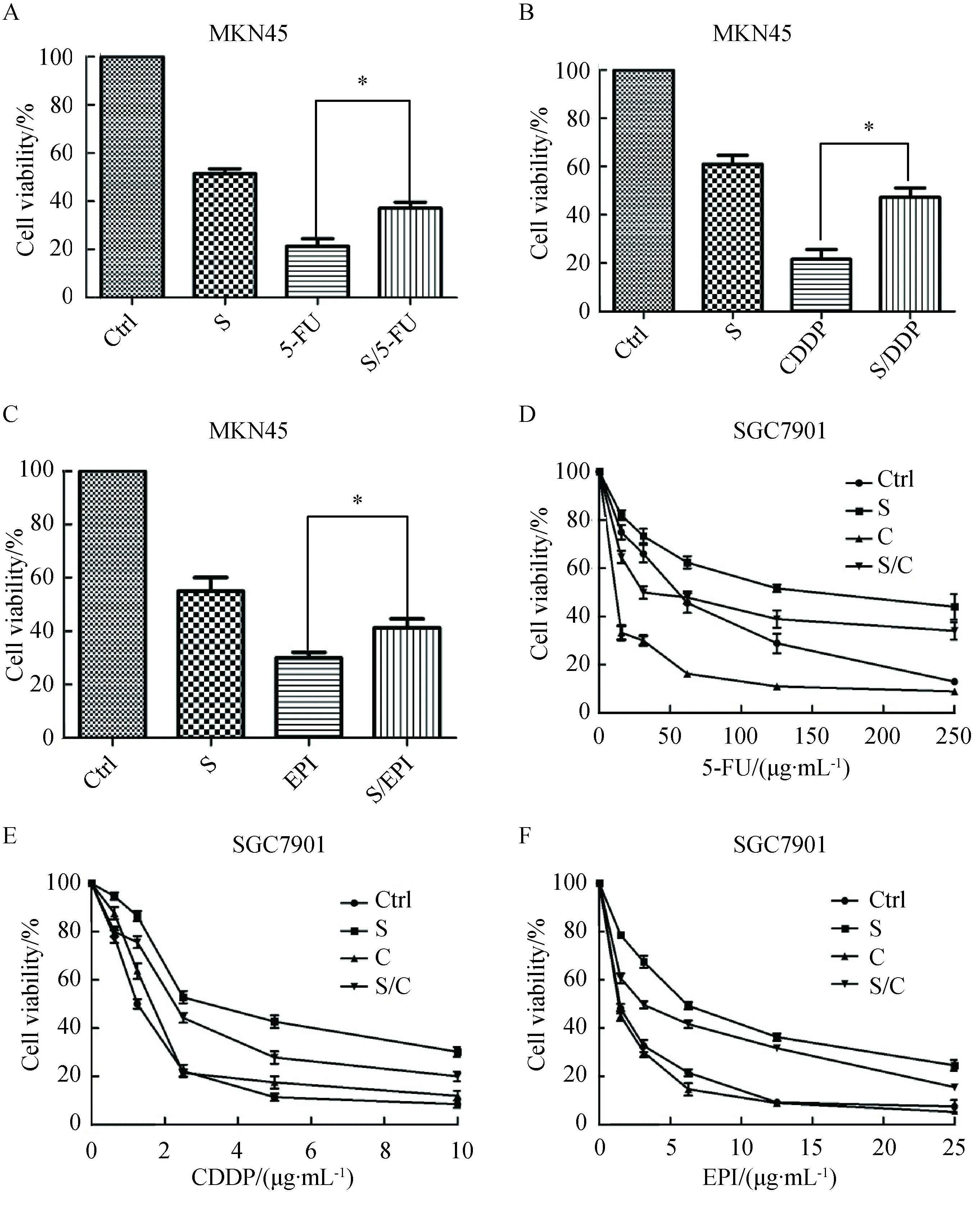
图2 不同条件下胃癌细胞存活率
A:serum starvation reduces the role of 5-FU in MKN45 cells;B:serum starvation reduces the role of CDDP in MKN45 cells;C: serum starvation reduces the role of EPI in MKN45 cells;D:cetuximab could partially reverse 5-FU resistance induced by serum starvation. E:cetuximab could partially reverse CDDP resistance induced by serum starvation. F: cetuximab could partially reverse EPI resistance induced by serum starvation.*P<0. 05; Ctrl: control;S: serum starvation;C: cetuximab;S/C: serum starvation +Cetuximab;EPI:epirubicin; CDDP:cis-diaminedichloroplatinum; 5-FU:5-fluoro-2,4(1H,3H)pyrimidinedione.
2.3血清饥饿激活EGFR/ERK通路
胃癌细胞SGC7901随着血清饥饿时间延长,对EGFR/ERK通路的活化作用越强。在血清饥饿12 h EGFR的磷酸化水平明显升高,同时下游的ERK分子磷酸化也随之升高,但Akt的磷酸化水平明显降低,差异有统计学意义(P<0.05,图3)。同时进行免疫荧光显示,血清饥饿时EGFR的磷酸化水平明显升高(图4)。
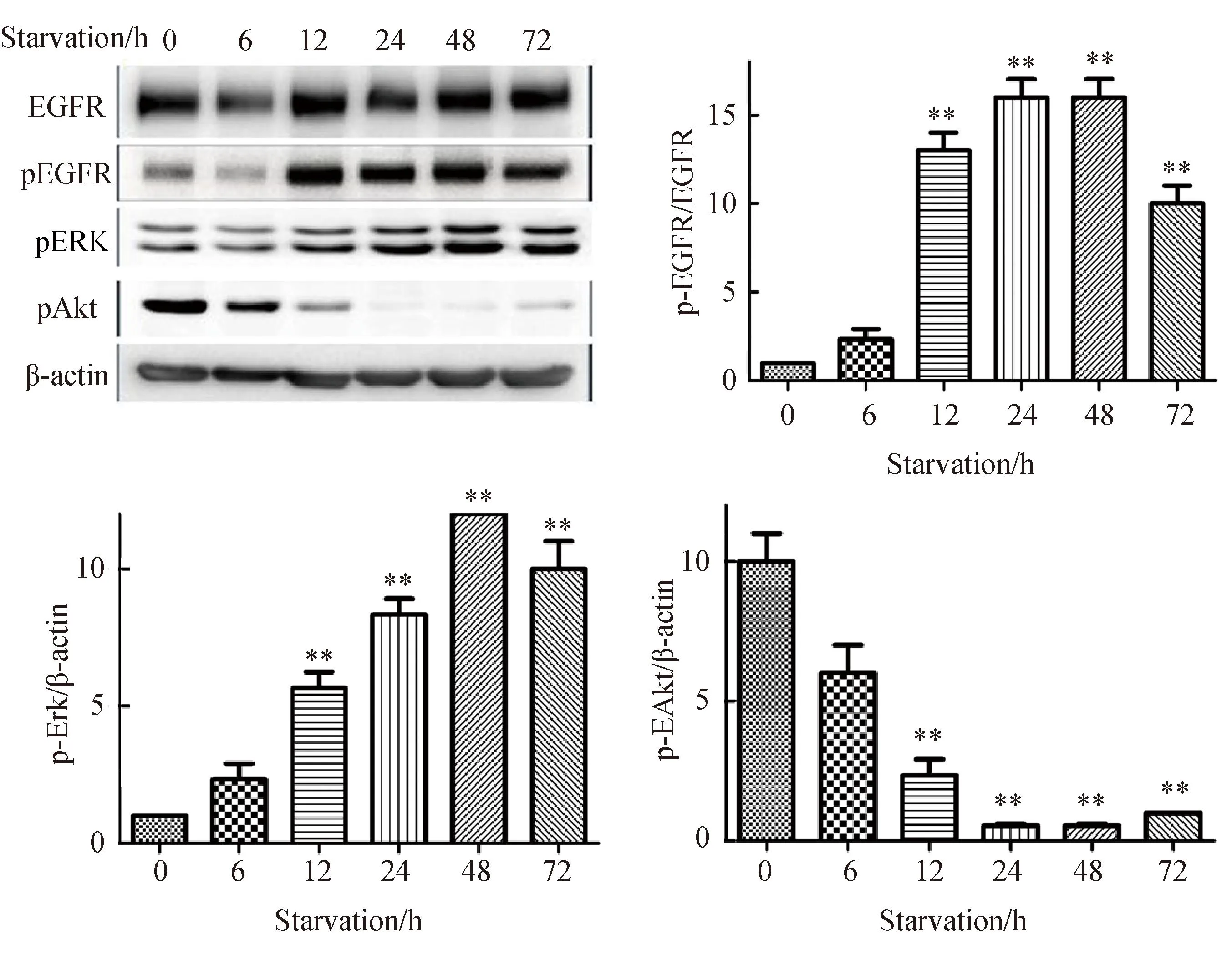
图3 血清饥饿激活EGFR/ERK通路
Expression of EGFR, p-EGFR, p-Akt, p-ERK protein of SGC7901 cells treated with serum starvation time-dependently analyzed by Western blotting,n=6.**P<0. 01vsgroup of 0 h;EGFR:epidermal growth factor receptor;ERK:extracellular regulated protein kinases.
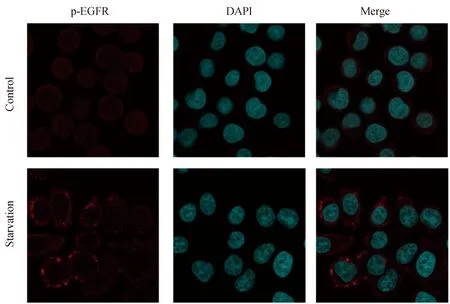
图4 免疫荧光检测血清饥饿时EGFR的激活
2.4EGFR单克隆抗体可部分逆转血清饥饿所致的胃癌细胞化疗耐药
在胃癌细胞SGC7901中,血清饥饿能促进EGFR磷酸化,应用西妥昔单抗能部分抑制EGFR的激活(图5)。同时MTT实验结果显示西妥昔单抗使得化疗药的敏感性有所恢复。实验分组分别为:对照组,血清饥饿组,西妥昔单抗,血清饥饿+西妥昔单抗组。相同浓度的化疗药物,血清饥饿组的胃癌细胞存活率高于对照组,而血清饥饿同时联用西妥昔单抗,能使得化疗药敏感性得到部分恢复(图2D、E、F)。
2.5血清饥饿能拮抗化疗药物对EGFR/ERK通路的抑制
为了进一步明确EGFR/ERK信号通路是否参与了血清饥饿诱导的化疗耐药的过程,本研究实验分组分别为:对照组,血清饥饿组,化疗药组,血清饥饿+化疗药组。Western blotting提示单纯应用化疗药物(EPI,5FU)可以显著抑制EGFR和其下游的ERK的磷酸化,并显著减少(P<0.05,图6)。血清饥饿同时加用化疗药物时可部分恢复EGFR下游的ERK的磷酸化水平。
3讨论
肿瘤化疗药耐药目前成为肿瘤治疗的最大难题之一。近年来大量研究[4-6]显示EGFR异常活化与肿瘤的发生发展、增生与转移、放化疗敏感性、肿瘤耐药性和不良预后显著相关[4]。Yoon等[5]发现胆管上皮

图5 西妥昔单抗抑制血清饥饿诱导的EGFR磷酸化
Expression of EGFR and p-EGFR protein in SGC7901cells treated with serum starvation and Cetuximab analyzed by Western blotting: β-actin was used as a loading control,n=6.**P<0. 01vscontrol;EGFR:epidermal growth factor receptor.
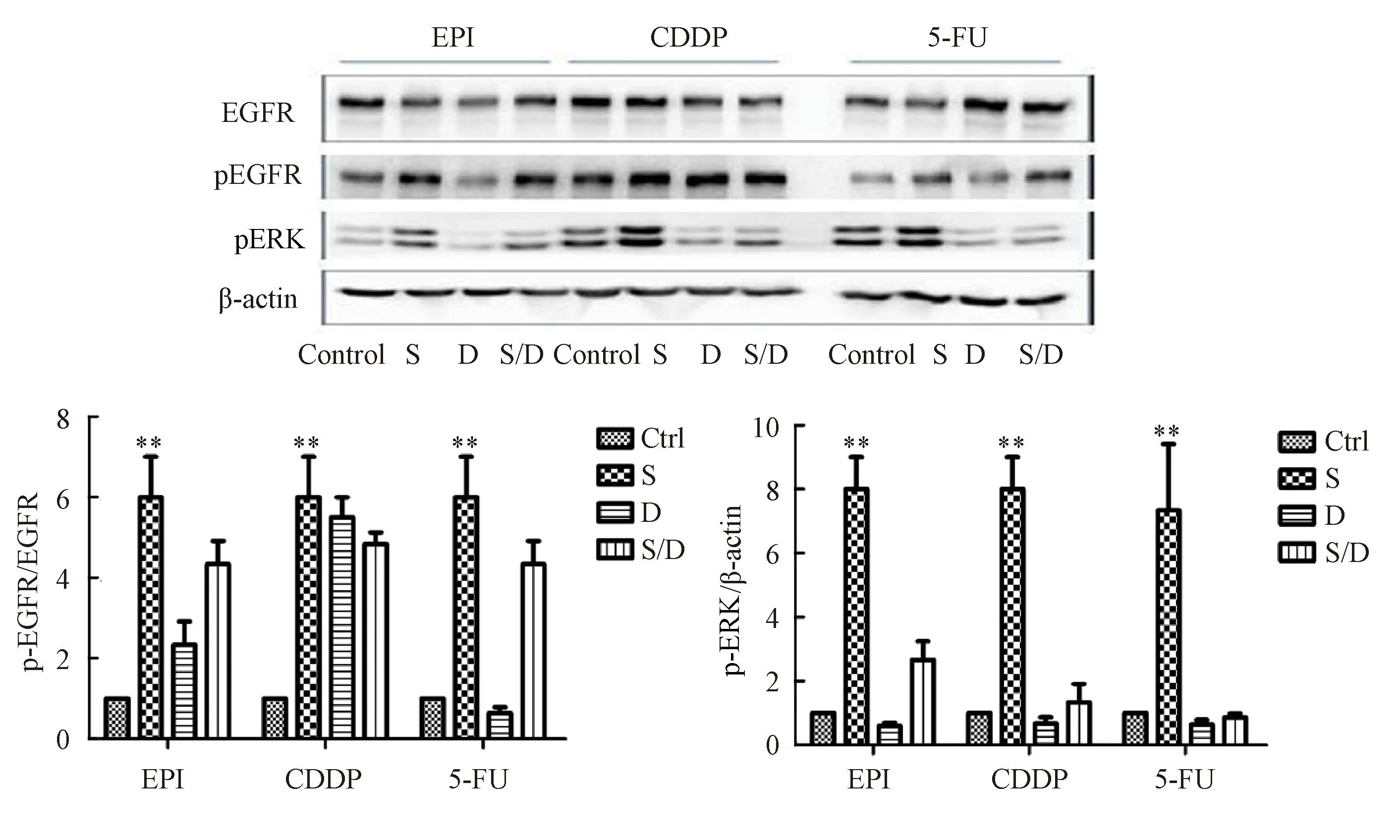
图6 血清饥饿能拮抗化疗药物对EGFR/Erk通路的抑制
n=6.**P<0. 01vscontrol, Ctrl: control;S: serum starvation;D: drug;S/D: serum starvation + drug;EGFR:epidermal growth factor receptor;ERK:extracellular regulated protein kinases; EPI:epirubicin; CDDP: cis-diaminedichloroplatinum; 5-FU5-fluoro-2,4(1H,3H)pyrimidinedione.
细胞癌敏感细胞株中EGFR活性低于耐药细胞株。另一研究[6]发现肝癌多药耐药与表皮因子激活一系列的酪氨酸激酶有关,而且EGFR抑制剂能恢复耐药肝癌细胞的化疗药物敏感性。还有研究[7]报道在多药耐药的乳腺癌中EGFR通过调控细胞周期从而降低化疗药物敏感性。
近期的研究[2]表明在黑素瘤、胶质瘤、乳腺癌细胞中,周期性饥饿可以有效地延缓肿瘤进展并提高化疗药物的有效性。但是另有研究[3]发现缺营养情况下肝癌细胞自噬增加,联用自噬抑制剂后对肝癌细胞化疗药物的敏感性降低。研究[4]表明自噬不但是肝癌细胞在缺营养情况下的生存机制之一,同时也有助于肝癌细胞抵抗化疗的作用。本课题组研究发现高表达EGFR胃癌细胞血清饥饿后,与对照组相比,肿瘤细胞对化疗药物敏感性显著下降。同时发现随着饥饿时间的延长EGFR的磷酸化程度逐渐升高,而肿瘤细胞处于饥饿加EGFR单克隆抗体后化疗敏感性有所恢复。提示EGFR的活化可能参与血清饥饿诱导的胃癌多药耐药。
ERK信号通路是EGFR重要的下游信号传导通路,ERK是MAPK家族成员之一,包括ERK1及ERK2。ERK发挥抑制细胞凋亡,促进细胞增生的作用[8-10]。在特定的癌症中,ERK通路的激活情况可以调节药物泵和抗凋亡的分子如Bcl-2的表达。Bcl-2抗凋亡分子和Mdr-1药物泵蛋白转录表达增加的可能原因是ERK通路下游靶激酶磷酸一些转录因子,这些转录因子结合Mdr-1和Bcl-2和的启动子区,刺激目的分子转录增加[11-13]。Mdr-1和Bcl-2表达的增加使得肿瘤细胞耐药性增强[14-16]。本研究中发现血清饥饿可以促进EGFR磷酸化,同时随着血清饥饿时间的延长下游的ERK的磷酸化水平也明显升高。肿瘤细胞给予化疗药时,与正常对照相比ERK的磷酸化水平相对较低,但血清饥饿的同时给予化疗药物,ERK磷酸化水平处于相对高水平。因此,胃癌细胞正常情况下,EGFR活化处于相对低的状态,而在饥饿状态肿瘤细胞EGFR自身磷酸化,二聚体改变,通过EGFR/ERK大通路诱发化疗药耐药,EGFR单克隆抗体使得化疗药物的敏感性有所恢复。
肿瘤细胞经常处于饥饿或缺氧状态,胃癌细胞血清饥饿有可能是其化疗药耐药的原因之一[17-18]。血清饥饿诱导胃癌细胞化疗耐药的机制可能与激活EGFR信号转导通路有关。以上结果仅是体外实验,还需要通过动物实验进一步证实以上结果。
4参考文献
[1]Chabner B A, Roberts T G Jr. Timeline: chemotherapy and the war on cancer [J].Nat Rev Cancer,2005,5(1):65-72.
[2]Lee C, Raffaghello L, Brandhorst S, et al. Fasting cycles retard growth of tumors and sensitize a range of cancer cell types to chemotherapy[J]. Sci Transl Med,2012,4(124):124-127.
[3]Guo X L, Li D, Hu F, et al. Targeting autophagy potentiates chemotherapy-induced apoptosis and proliferation inhibition in hepatocarcinoma cells[J]. Cancer Lett,2012,320(2):171-179.
[4]Dutta P R, Maity A. Cellular responses to EGFR inhibitor and their relevance to cancer therapy[J]. Cancer Lett, 2007, 254(2):165-177.
[5]Yoon H, Min J K, Lee J W, et al. Acquisition of chemoresistance in intrahepatic cholangiocarcinoma cells by activation of Akt and extracellular signal-regulated kinase (ERK) 1/2[J]. Biochem Biophys Res Commun, 2011, 405(3):333-337.
[6]Hoffmann K, Xiao Z, Franz C, et al. Involvement of the epidermal growth factor receptor in the modulation of multidrug resistance in human hepatocellular carcinoma cells in vitro[J]. Cancer Cell Int, 2011, 11:40.
[7]Chen S J, Luan J, Zhang H S, et al. EGFR-mediated G1/S transition contributes to the multidrug resistance in breast cancer cells[J]. Mol Biol Rep,2012,39(5):5465-5471.
[8]McCubrey J A, Steelman L S, Chappell W H, et al. Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance[J].Biochim Biophys Acta, 2007,1773(8):1263-1284.
[9]Kim S H, Lee S H, Kwak N H, et al. Effect of the activated Raf protein kinase on the human multidrug resistance 1 (MDR1) gene promoter[J]. Cancer Lett,1996,98(2):199-205.
[10]Blagosklonny M V, Schulte T, Nguyen P, et al. Taxol-induced apoptosis and phosphorylation of Bcl-2 protein involves c-Raf-1 and represents a novel c-Raf-1 signal transduction pathway[J]. Cancer Res,1996, 56(8):1851-1854.
[11]Blagosklonny M V. Drug-resistance enables selective killing of resistant leukemia cells: exploiting of drug resistance instead of reversal[J]. Leukemia,1999,13(12):2031-2035.
[12]Weinstein-Oppenheimer C R, Henríquez-Roldán C F, Davis J, et al. Role of the Raf signal transduction cascade in the in vitro resistance to the anticancer drug doxorubicin[J]. Clin Cancer Res,2001,7(9):2892-2907.
[13]Davis J M, Weinstein-Oppenheimer C R, Steelman L S, et al. Raf-1 and Bcl-2 induce distinct and common pathways which contribute to breast cancer drug resistance[J].Clinical Cancer Res,2003,9(3):1161-1170.
[14]Zhao Y Y, Yu L, Liu B L, et al. Downregulation of P-gp, Ras and p-ERK1/2 contributes to the arsenic trioxide-induced reduction in drug resistance towards doxorubicin in gastric cancer cell lines[J]. Mol Med Rep,2015,12(5):7335-7343.
[15]Yadav V, Varshney P, Sultana S, et al. Moxifloxacin and ciprofloxacin induces S-phase arrest and augments apoptotic effects of cisplatin in human pancreatic cancer cells via ERK activation[J]. BMC Cancer,2015,11(15):581.
[16]刘坤, 王海江,孙振强,等. 胃癌组织HER-2和VEGF及EGFR表达临床意义研究[J]. 中华肿瘤防治杂志,2015,22(10):781-785.
[17]袁光波, 郭建新,陈蜜,等. 慢病毒介导的miRNA逆转胃癌细胞耐药性研究[J]. 中华肿瘤防治杂志,2013,20(4):254-258.
[18]王士娜, 王星,王翠芳. 表皮生长因子受体及HER-2/neu蛋白在胃癌中的表达和意义[J]. 中国医科大学学报,2015,44(9):829-832.
编辑慕萌
Serum starvation induces gastric carcinoma chemotherapy resistance through EGFR/ERK pathway
Wang Junxiong1,2,3,4,5,Cai Xiqiang1,Nie Yongzhan1,Hao Jianyu3,4,5*,Fan Daiming1*
(1.XijingHospitalofDigestiveDiseases,XijingHospital,theFourthMilitaryMedicalUniversity,Xi’an710032,China;2MedicalandHealthCenter,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China; 3.DepartmentofGastroenterology,BeijingChaoyangHospital,CapitalMedicalUniversity,Beijing100043,China;4.NationalClinicalResearchCenterforDigestiveDiseases,Beijing100050,China; 5.FacultyofGastroenterology,CapitalMedicalUniversity,Beijing100050,China)
【Abstract】Objective To demonstrate drug resistance induced by serum starvation in gastric cancer and explore the possible mechanism.MethodsThe viability of SGC7901 cells was measured by MTT assay. The inhibition rates and IC50 values were then calculated. The phosphorylation level of EGFR and ERK induced by serum starvation were measured by Western blotting. ResultsSerum starvation could reduce the action of chemotherapeutic drug. EGFR signal activation acted as a protective factor against starvation by regulating downstream genes. Compared with the control group, the phosphorylation levels of EGFR and ERK were significantly increased in serum starvation treatment group (P<0. 05). EGFR monoclonal antibody could partially reverse multiple drug resistance as a result of serum starvation. ConclusionSerum starvation may induce drug resistance in gastric cancer cell and the mechanism may be related to the activation of EGFR/ERK signaling pathway.
【Key words】gastric cancer; serum starvation; epidermal growth factor receptor(EGFR); drug resistance
(收稿日期:2015-12-25)
【中图分类号】R 656.6
[doi:10.3969/j.issn.1006-7795.2016.01.005]
*Corresponding author, E-mail:daimingfan@fmmu.edu.cn, haojianyu@sina.com
基金项目:国家自然科学基金(81120108005, 81172096),国家消化系统疾病临床医学研究中心基金(2015BAI13B09)。This study was supported by National Natural Science Foundation of China (81120108005, 81172096), National Clinical Research Center for Digestive Diseases (2015BAI13B09).
网络出版时间:2016-01-2716∶09网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1609.006.html
· 消化系统重大疾病的全链条研究 ·

