STAT3在sRAGE抑制缺血再灌注导致的心肌细胞凋亡中的作用
郭彩霞 江 雪 曾翔俊 陈步星*
(1.首都医科大学附属北京天坛医院心内科,北京 100050;2.首都医科大学基础医学院病理生理学教研室,北京 100069)
STAT3在sRAGE抑制缺血再灌注导致的心肌细胞凋亡中的作用
郭彩霞1江雪1曾翔俊2陈步星1*
(1.首都医科大学附属北京天坛医院心内科,北京 100050;2.首都医科大学基础医学院病理生理学教研室,北京 100069)
【摘要】目的 建立体内和体外缺血再灌注(ischemia/reperfusion, I/R)模型,观察缺血再灌注心肌细胞凋亡情况及STAT3蛋白表达变化;检测sRAGE对缺血再灌注心肌细胞凋亡及STAT3的蛋白表达的影响。方法复制C57BL/6J小鼠心脏和原代心肌细胞缺血再灌注模型,在sRAGE和(或)STAT3抑制剂AG490的干预下,通过检测TUNEL及caspase-3活性评价心肌细胞凋亡的程度;通过Western blotting检测磷酸化的STAT3(p-STAT3)及总的STAT3(t-STAT3)蛋白的表达。结果体内实验,与Sham组相比,I/R组TUNEL阳性细胞数目和caspase-3活性分别增加了115%和120%,I/R组p-STAT3/STAT3比值降低了50%,sRAGE降低了I/R诱导的心肌细胞凋亡,包括TUNEL阳性细胞数目降低了51%,caspase-3活性降低了36%,此外,sRAGE预处理I/R组的p-STAT3/STAT3比值增加了381%; 体外实验,与Control组相比,I/R组TUNEL阳性细胞数目和caspase-3活性分别增加了380%和77%,I/R组p-STAT3/STAT3比值降低了69%,sRAGE(900 ng/mL) 同样降低了I/R诱导的心肌细胞凋亡,表现为TUNEL阳性细胞数目降低了63%,caspase-3活性降低了33%,此外,sRAGE预处理I/R组的p-STAT3/STAT3比值增加了243%,与I/R+sRAGE组相比较,I/R+sRAGE+AG490组的TUNEL阳性细胞数目升高了126%,caspase-3活性增加了42%,p-STAT3/STAT3比值降低了68%。结论sRAGE可通过激活STAT3抑制缺血再灌注诱导的心肌细胞凋亡。
【关键词】sRAGE;心肌缺血再灌注;凋亡;STAT3
冠状动脉粥样硬化性心脏病(以下简称冠心病)是目前严重威胁人类健康的疾病之一,再灌注治疗是目前最有效的治疗手段,随着冠状动脉介入和搭桥等治疗手段的飞速提高,患者预后明显改善,但会引起致命的缺血再灌注损伤(ischemia/reperfusion,I/R)。心肌I/R 损伤是心肌I/R 后所致的心肌结构改变和功能障碍进一步加重的现象,表现为心肌收缩能力降低、再灌注性心律失常的发生、心肌能量代谢的减弱及心肌结构的破坏等[1-2],严重降低了冠心病的救治及其预后。因此,进行干预挽救缺血心肌的同时,最大限度的减少与预防再灌注导致新的心肌细胞损伤、保护健存心肌是当前需要攻克的重大难关。
目前有一些预防及治疗心肌I/R 损伤的干预措施,如提高心肌氧和能量供应、减轻心脏负担和降低能量消耗等外源性方法;而抑制心肌I/R 损伤的内源性保护机制备受关注,其中包含缺血预处理和药物预处理[3-4],其中,药物预处理的概念,即用药物刺激或模拟机体内源性抗损伤方式,主要是通过影响内源性物质的释放减轻术中及术后的心肌炎性反应、氧化应激等病理损伤而发挥保护作用。
sRAGE 是高级糖基化终末产物受体(receptor for advanced glycation end-products,RAGE)的异构体,二者有共同的配基结合位点。sRAGE具有“诱饵”的作用,即可以结合RAGE的配体,但不会转导细胞信号,从而起到阻断AGEs-RAGE通路而发挥保护作用[5]。RAGE属于免疫球蛋白超家族的细胞表面多配基信号转导受体。RAGE分布广泛,如心肌细胞、内皮细胞、平滑肌细胞、单核巨噬细胞、周细胞、神经元等均可表达。
本课题组前期研究[6]已经发现,在大鼠缺血再灌注模型外周血中sRAGE明显降低。外源性给予sRAGE可减少体外复制的缺氧/复氧模型心肌细胞线粒体通透性转换孔mPTP的开放,使线粒体膜电位去极化程度减轻,提高缺氧/复氧心肌细胞的存活率[6]。本研究选择复制动物心脏和心肌细胞缺血再灌注模型,进一步观察sRAGE对缺血再灌注诱导的心肌细胞凋亡作用的具体机制。
1材料与方法
1.1材料
1.1.1试剂
DeadEndTM TUNEL荧光法检测试剂盒购自美国的Promega公司;DAPI购自美国Sigma公司;caspase-3 活性检测试剂盒购自美国的BioVision公司;蛋白定量BCA试剂盒、组织裂解液及脱脂奶粉均购自北京普利莱基因技术有限公司;sRAGE购自北京爱迪博生物科技有限公司;AG490及Tween-20购自美国Sigma公司;总的和磷酸化的STAT3抗体均购自美国Cell signaling Technology公司;羊抗鼠IgG抗体-辣根过氧化物酶标记购自美国Santa Cruz公司。
1.1.2动物
6~8周的雄性C57BL/6小鼠和新生(24 h以内)的SD大鼠乳鼠均购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2012-0001。
1.1.3仪器及设备
小动物心脏超声仪器Vevo770(Visual Sonics公司,加拿大);小动物麻醉机XGI-8(Caliper公司,美国);CM1950石蜡切片机(Leica 公司,德国);DIAX900匀浆仪(Heidolph公司,德国);Olympus BX51荧光显微镜(奥林巴斯公司,美国);超速低温离心机(Sigma公司,美国);电泳装置、电转移装置及凝胶成像系统(Bio-Rad公司,美国)。
1.2 方法
1.2.1在体小鼠心肌缺血再灌注模型的制备
实验采用23~25g健康雄性C57BL/6小鼠,2%(体积分数)异氟烷吸入麻醉。开胸,胸骨左侧2 mm切开皮肤,钝性分离肌肉见肋骨,在第4肋间隙用眼科剪轻轻向下分离肋间肌,向上伸入血管钳反复夹闭两根肋骨以减少出血。用拉钩拉开胸壁,暴露心脏,在左心耳下缘3~4 mm进针,进针深约1.5 mm,斜向右上方肺动脉圆锥方向出针,针距约3~4 mm,结扎和松开冠状动脉左前降支,采用缺血30 min后再灌注24 h复制缺血/再灌注模型[7]。假手术组采取相同的手术方式,但是不结扎血管。术前12 h及术后12 h分别腹腔注射sRAGE,等体积的0.9%(质量分数)的氯化钠注射液溶解药物,100 μg/只[8]。再灌注24 h后进行心脏超声检测心功能。
实验分组: Sham组:血管置线但不结扎(n=3),术前和术后12 h分别腹腔注射等体积的0.9%(质量分数)的氯化钠注射液;Sham+sRAGE组:术前和术后12 h分别腹腔注射sRAGE,100 μg/只,余处理同Sham组(n=3)。I/R组:结扎左前降支30 min,再灌注24 h,术前和术后12 h分别腹腔注射等体积的0.9%(质量分数)氯化钠注射液(n=3)。I/R+sRAGE组:术前和术后12 h分别腹腔注射sRAGE,100 μg/只,余处理同I/R组(n=3)。
1.2.2原代心肌细胞缺血再灌注模型的制备
正常培养原代心肌细胞72 h后,应用“缺血buffer”(pH 6.3)代替DMEM培养基刺激细胞复制缺血模型[9],缺血buffer 包含以下物质: 118 mmol/L NaCl, 24 mmol/L NaHCO3, 1.0 mmol/L NaH2PO4, 2.5 mmol/L CaCl2·2H2O, 1.2 mmol/L MgCl2, 20 mmol/L 乳酸钠, 16 mmol/L KCl 和 10 mmol/L脱氧葡萄糖。将缺血buffer加入实验组的培养孔,2 mL/孔,然后将细胞放在37 ℃、5%(体积分数) CO2细胞培养箱中孵育,2 h后将缺血buffer换为无血清的DMEM培养基再持续灌注24 h。对于对照组,心肌细胞一直培养在无血清的DMEM培养基中。
实验分组:(1)对照组(Control): DMEM完全培养基培养心肌细胞;(2)Control+sRAGE(Control+sRAGE)组: DMEM完全培养基中加入sRAGE[6],余处理同Control组;(3)Control+AG490(Control+AG490)组:DMEM完全培养基中加入AG490[10],余处理同Control组; (4)缺血再灌注(I/R)组:缺血buffer替代DMEM完全培养基,使心肌细胞缺血2 h,后将缺血buffer更换为DMEM完全培养基,使心肌细胞再灌注24 h;(5)缺血再灌注+sRAGE(I/R+sRAGE)组:缺血前10 min DMEM完全培养基中加入sRAGE(900 nmol/L),余处理同I/R组。(6)缺血再灌注+sRAGE+AG490(I/R+sRAGE+AG490)组:缺血前30 min和10 min DMEM完全培养基中分别加入AG490(5μmol/L)和sRAGE(900 ng/mL),余处理同I/R组。
1.2.3心肌组织及心肌细胞的TUNEL及caspase-3活性检测
石蜡包埋的心脏组织切成4~5 μm厚度,经过脱蜡入水、固定及通透等过程后,离体心肌细胞则经4%(质量分数)甲醛固定后,将样品37 ℃避光孵育在rTdT缓冲液中1 h,清洗、固定,DAPI染核,固定、抗淬灭封片剂封片,荧光显微镜下观察、照相,以凋亡细胞核数占总细胞核数的百分比作为细胞凋亡率[11]。荧光法检测caspase-3的活性,样品在缺血buffer的作用下裂解,14 000 r/min,4 ℃离心10 min,取上清液,样品上清液及荧光底物加入96孔板,0 min测定基础值,37 ℃避光孵育1.5 h后再次读取数值,荧光计的最佳波长为405 nm。同时BCA法测定各组织的蛋白浓度,2次读取的数值之差除以各自的蛋白浓度即为caspase-3活性[12]。
1.2.4组织和细胞STAT3蛋白的表达检测
心肌组织加入RIPA裂解液(20 mg加0.2 mL),同时加入PMSF(1∶100),匀浆器进行匀浆,冰上孵育30 min,4 ℃下12 500 r/min,离心15 min,上清液测蛋白浓度及蛋白定量。经SDS-PAGE电泳后转至PVDF膜,室温下5%(质量分数)脱脂牛奶封闭60 min,3%(质量分数)脱脂牛奶孵育总泛素蛋白一抗(1∶1 000),4 ℃过夜。TBST洗膜后,室温孵育羊抗鼠IgG抗体-辣根过氧化物酶标记二抗60 min,凝胶成像系统成像[13]。
1.3统计学方法
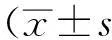
2结果
2.1心肌组织中TUNEL及caspase-3活性的改变
Sham组与Sham+sRAGE组TUNEL阳性心肌细胞极少,两组间细胞凋亡率差异无统计学意义[(4.5±0.4)%vs(2.9±0.3)%,P>0.05)]。与Sham组相比,I/R组细胞凋亡率明显增加了115%[(36.3±1.5)%vs(2.9±0.3)%,P<0.05)]。与I/R组相比,I/R+sRAGE组细胞凋亡率明显降低了51%[(17.8±0.7)%vs(36.3±1.5)%,P<0.05)](图1A、B)。
Sham组与Sham+sRAGE组间caspase-3活性差异无统计学意义[(1.0±0.1)%vs(1.1±0.2)%,P>0.05)]。与Sham组相比,I/R组caspase-3活性明显升高了120%[(2.2±0.5)%vs(1.0±0.1)%,P<0.05)]。与I/R组相比,I/R+sRAGE组caspase-3活性明显从(2.2±0.5)%降低至(1.4±0.2)% (P<0.05) (图1C)。
2.2组织STAT3的蛋白表达
与Sham组相比较,I/R组p-STAT3/STAT3比值降低了50% (0.17±0.11vs0.35±0.03,P<0.05),差异有统计学意义;与I/R组相比较,sRAGE预处理I/R组的p-STAT3/STAT3比值增加了381% (0.84±0.16vs0.17±0.11,P<0.05),差异有统计学意义。另外,与Sham组相比较,sRAGE预处理Sham组的p-STAT3/STAT3升高了85% (0.64±0.13vs0.35±0.03,P<0.05) (图2)。
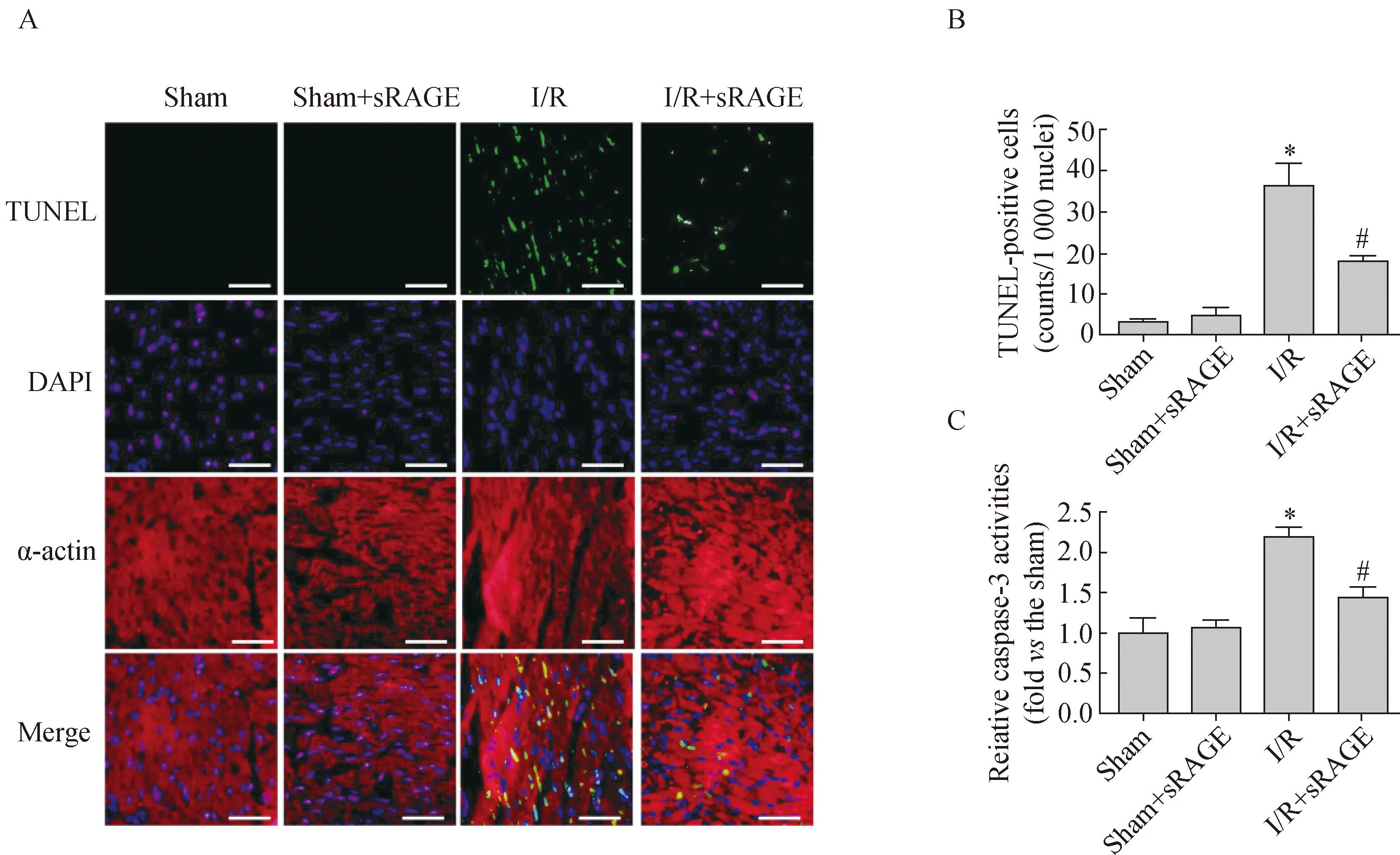
图1 小鼠心肌细胞凋亡检测
A:representative photomicrographs of TUNEL-stained myocardium sections from wild-type (WT) exposed to sham operation or ischemia-reperfusion (I/R). TUNEL-positive nuclei (green), myoglobin (red), and DAPI (blue); Scale bar: 50 μm. B:quantitative analysis of apoptosis;n=3-4 per group. C:myocardial cell apoptosis was determined by caspase-3 activity assay in sham, sham+ sRAGE and experimental mice 24 h after I/R injury from different groups; Values are expressed as means±SE.*P<0.05vssham group,#P<0.05vsI/R group; sRAGE:soluble receptor for advanced glycation end products; I/R:ischemia/reperfusion.
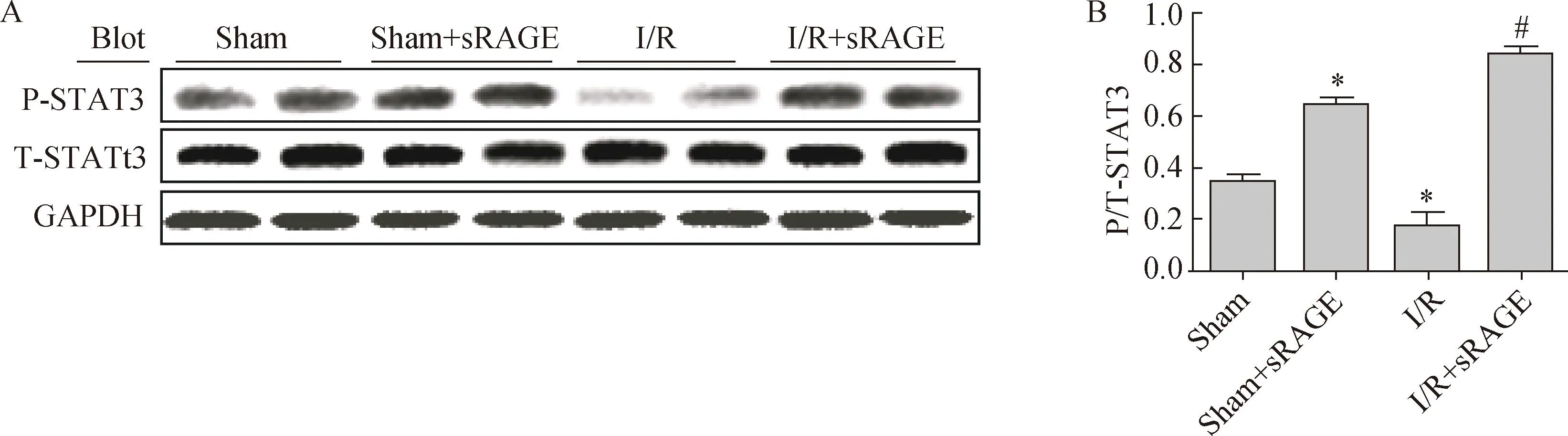
图2 小鼠心肌凋亡相关蛋白表达
A:Western blotting analysis for p-STAT3 and t-STAT3. B:quantitative analysis of p-STAT3 to t-STAT3.n=3-4 per group. Values are expressed as means±SE.*P<0.05vssham group,#P<0.05vsI/R group; sRAGE:soluble receptor for advanced glycation end products; I/R:ischemia/reperfusion.
2.3 原代心肌细胞中TUNEL及caspase-3活性的改变
Control组与Control+sRAGE组间细胞凋亡率差异无统计学意义[(1.1±0.2)%vs(1.0±0.1)%,P>0.05)],Control组与Control+AG490组间细胞凋亡率差异无统计学意义[(1.1±0.3)%vs(1.0±0.1)%,P>0.05)];与Control组相比,I/R组细胞凋亡率明显增加[(3.8±0.9)%vs(1.0±0.1)%,P<0.05)];与I/R组相比,I/R+sRAGE组细胞凋亡率明显降低[(1.4±0.6)%vs(3.8±0.9)%,P<0.05)];与I/R+sRAGE组相比较,I/R+sRAGE+AG490组细胞凋亡率明显升高[(3.2±0.7)%vs(1.4±0.6)%,P<0.05)](图3A、B)。
Control组与Control+sRAGE组间caspase-3活性差异无统计学意义[(0.9±0.1)%vs(1.0±0.1)%,P>0.05)];Control组与Control+AG490组间caspase-3活性差异无统计学意义[(1.0±0.3)%vs(1.0±0.1)%,P>0.05)];与Control组相比,I/R组caspase-3活性明显升高了77%[(1.8±0.5)%vs(1.0±0.1)%,P<0.05)];与I/R组相比,I/R+sRAGE组caspase-3活性明显从(1.8±0.5)%降低至(1.2±0.4)% (P<0.05);与I/R+sRAGE组相比,I/R+sRAGE+AG490组caspase-3活性从(1.2±0.4)%升高至(1.7±0.3)% (P<0.05) (图3C)。
2.4原代心肌细胞中STAT3的蛋白表达
与Control组相比较,I/R组p-STAT3/STAT3比值降低了69% (0.18±0.09vs0.60±0.05,P<0.05),差异有统计学意义;与I/R组相比较,sRAGE预处理I/R组的p-STAT3/STAT3比值增加了243% (0.63±0.14vs0.18±0.09,P<0.05),差异有统计学意义;与I/R+sRAGE组相比较,I/R+sRAGE+AG490组p-STAT3/STAT3比值降低了68% (0.20±0.11vs0.63±0.14,P<0.05)。另外,与Control组相比较,sRAGE预处理Sham组的p-STAT3/STAT3升高了20% (0.72±0.14vs0.60±0.05,P<0.05);与Control组相比较,Control+AG490组 p-STAT3/STAT3比值降低了34% (0.40±0.10vs0.60±0.05,P<0.05) (图4)。
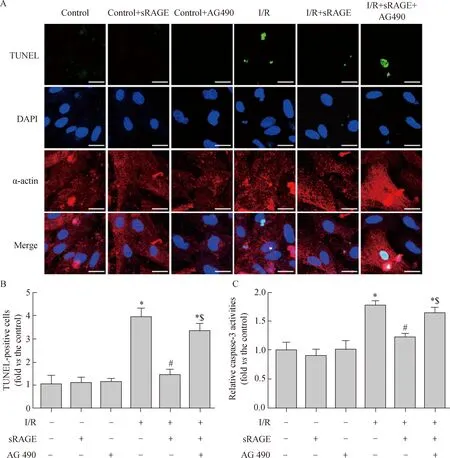
图3 体外心肌细胞凋亡检测
A:Representative photomicrographs of TUNEL-stained cardiomyocytes from different groups. TUNEL-positive nuclei (green), myoglobin (red), and DAPI (blue). Scale bar,100 μm.B:Quantitative analysis of TUNEL-positive cells was shown for different groups.C: quantitative analysis of caspase-3 activity was shown for different groups. Values were expressed as means±SE for three independent experiments.*P<0.05vscontrol group,#P<0.05vsI/R group,$P<0.05vsI/R+sRAGE group; sRAGE: soluble receptor for advanced glycation end products; I/R:ischemia/reperfusion.
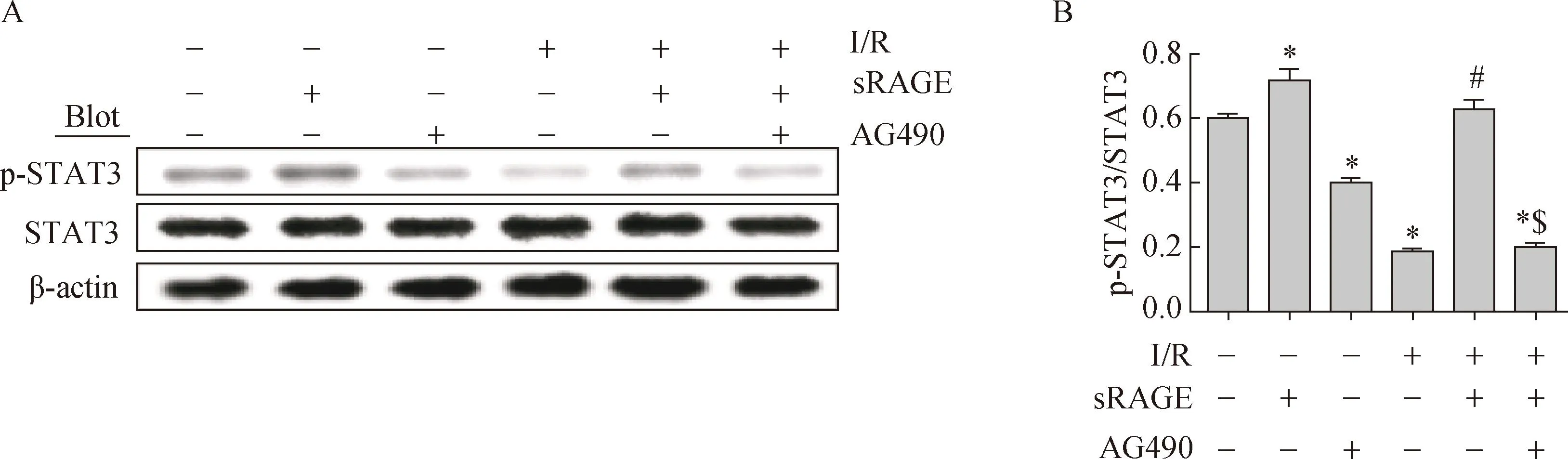
图4 体外心肌凋亡相关蛋白表达水平
A:Western blotting analysis for p-STAT3 and t-STAT3. B:quantitative analysis of p-STAT3 to t-STAT3. Values were expressed as means±SE for three independent experiments.*P<0.05vscontrol group,#P<0.05vsI/R group,$P<0.05vsI/R+sRAGE group; sRAGE: soluble receptor for advanced glycation end products; I/R:ischemia/reperfusion; STAT3: signal transducers and activators of transcriptions 3.
3讨论
冠心病患者给予再灌注治疗后可发生再灌注心肌损伤,目前关于缺血再灌注损伤的确切机制尚未明确,因此,寻找临床有效干预以降低缺血再灌注损伤仍然是重要的挑战[14-17]。内源性物质的作用备受关注,其中研究广泛的内源性物质之一就是sRAGE,关于其在心肌缺血再灌注损伤中的研究也逐渐增多,Bucciarelli 等[18]证实sRAGE 可抑制心肌I/R 时乳酸脱氢酶(lactate dehydrogenase, LDH)的释放及改善I/R 导致的心功能降低,此后,Aleshin 等[19]表明sRAGE 可减缓小鼠心肌I/R 炎性反应、减少梗死面积、抑制细胞色素C 的释放及信号转导子和转录激活子3(signal transducers and activators of transcriptions 3,STAT3)活性的降低。国内学者[12]利用猪心肌I/R 模型证实sRAGE可通过抑制转化生长因子β1(transforming growth factor β1,TGF-β1)的表达而抑制I/R后心肌重构,这些研究均表明,sRAGE具有心脏保护作用,究其保护机制,本课题组前期研究[6]表明,sRAGE的心肌保护作用主要是通过抑制I/R诱导的心肌细胞凋亡实现的。
心肌细胞在I/R 过程中主要有凋亡和坏死两种死亡方式。细胞凋亡是心肌I/R损伤的主要途径。凋亡主要由长时间持续缺血或再灌注阶段诱发,贯穿于再灌注早期的起始阶段、中性粒细胞浸润的中间阶段及数月之后的延迟阶段,介导I/R 后心肌梗死范围扩大、心室重塑及心力衰竭等I/R 损伤的发生。缺血后再灌早期,再灌损伤抢救激酶(reperfusion injury salvage kinase,RISK)通路激活,包括PI3K/Akt和Erk1/2 MAPK等,而JAK/STAT可通过PI3K/Akt启动RISK通路的激活。因此,STAT在细胞信号转导中发挥着至关重要的作用,主要通过将细胞表面的信号转导至细胞核中,从而调节应激反应基因的表达。Aleshin等[19]证实RAGE-/-和sRAGE处理的小鼠I/R心肌组织中STAT3磷酸化水平明显增强,同时明显减轻RAGE介导的心肌损伤,提示sRAGE可通过激活STAT3发挥作用。本研究结果显示,I/R可明显降低STAT3的磷酸化水平,增加TUNEL阳性细胞数目及caspase-3活性,而sRAGE预处理后可明显抑制I/R导致的STAT3的磷酸化水平的降低及心肌细胞的增加,STAT3抑制剂AG490可减弱上述的sRAGE抗凋亡作用。
sRAGE能够激活STAT3,而sRAGE本身无跨膜段,因此提示sRAGE可能通过激活其他细胞因子进而调节STAT3的活性而发挥保护作用,具体机制尚需进一步验证。
4参考文献
[1]Qian W, Xiong X, Fang Z, et al. Protective effect of tetramethylpyrazine on myocardial ischemia-reperfusion injury[J]. Evid Based Complement Alternat Med, 2014, 2014:107501.
[2]Badalzadeh R, Yousefi B, Majidinia M, et al. Anti-arrhythmic effect of diosgenin in reperfusion-induced myocardial injury in a rat model: activation of nitric oxide system and mitochondrial KATP channel[J]. J Physiol Sci, 2014, 64(6):393-400.
[3]Vinten-Johansen J, Shi W. The science and clinical translation of remote postconditioning[J]. J Cardiovasc Med (Hagerstown), 2013, 14(3):206-213.
[4]Szentmiklosi A J, Cseppento A, Harmati G, et al. Novel trends in the treatment of cardiovascular disorders: site-and event-selective adenosinergic drugs[J].Curr Med Chem, 2011, 18(8):1164-1187.
[5]Yan S F, Ramasamy R, Schmidt A M. Soluble RAGE: therapy and biomarker in unraveling the RAGE axis in chronic disease and aging[J].Biochem Pharmacol, 2010, 79(10):1379-1386.
[6]Guo C, Zeng X, Song J, et al. A soluble receptor for advanced glycation end-products inhibits hypoxia/reoxygenation-induced apoptosis in rat cardiomyocytes via the mitochondrial pathway[J]. Int J Mol Sci, 2012, 13(9):11923-11940.
[7]Pan Z, Sun X, Ren J, et al. miR-1 exacerbates cardiac ischemia-reperfusion injury in mouse models[J].PLoS One, 2012, 7(11):e50515.
[8]Shang L, Ananthakrishnan R, Li Q, et al. RAGE modulates hypoxia/reoxygenation injury in adult murine cardiomyocytes via JNK and GSK-3beta signaling pathways[J]. PLoS One,2010, 5(4):e10092.
[9]Das A, Xi L, Kukreja R C. Phosphodiesterase-5 inhibitor sildenafil preconditions adult cardiac myocytes against necrosis and apoptosis. Essential role of nitric oxide signaling[J]. J Biol Chem, 2005, 280(13):12944-12955.
[10]Smith C C, Dixon R A, Wynne A M, et al. Leptin-induced cardioprotection involves JAK/STAT signaling that may be linked to the mitochondrial permeability transition pore[J]. Am J Physiol Heart Circ Physiol,2010, 299(4):H1265-1270.
[11]Yin T, Hou R, Liu S, et al. Nitrative inactivation of thioredoxin-1 increases vulnerability of diabetic hearts to ischemia/reperfusion injury[J]. J Mol Cell Cardiol, 2010, 49(3):354-361.
[12]Wang K, Zhang J, Liu J, et al. Variations in the protein level of Omi/HtrA2 in the heart of aged rats may contribute to the increased susceptibility of cardiomyocytes to ischemia/reperfusion injury and cell death: Omi/HtrA2 and aged heart injury[J]. Age (Dordr),2013,35(3):733-746.
[13]Yang K, Zhang T P, Tian C, et al. Carboxyl terminus of heat shock protein 70-interacting protein inhibits angiotensin II-induced cardiac remodeling[J]. Am J Hypertens,2012, 25(9):994-1001.
[14]Eltzschig H K, Eckle T. Ischemia and reperfusion—from mechanism to translation[J]. Nat Med,2011, 17(11):1391-1401.
[15]熊瑞媛, 田炜,杨方. 细胞凋亡途径在心肌缺血/再灌注损伤中的研究进展[J]. 中国煤炭工业医学杂志, 2015,18(3):512-515.
[16]唐丽敏, 贺永贵,张义东,等. 心肌缺血/再灌注损伤发生机制及其保护研究进展[J]. 中国煤炭工业医学杂志,2013,16(1):159-161.
[17]王梦然, 张健,梁艳红,等. 缺血后处理对老年大鼠心肌缺血再灌注损伤的保护作用[J]. 首都医科大学学报,2015,36(1):132-136.
[18]Bucciarelli L G, Kaneko M, Ananthakrishnan R, et al. Receptor for advanced-glycation end products: key modulator of myocardial ischemic injury[J]. Circulation,2006,113(9):1226-1234.
[19]Aleshin A, Ananthakrishnan R, Li Q, et al. RAGE modulates myocardial injury consequent to LAD infarction via impact on JNK and STAT signaling in a murine model[J]. Am J Physiol Heart Circ Physiol,2008, 294(4):H1823-1832.
编辑陈瑞芳
Effect of STAT3 in soluble receptor for advanced glycation end-products inhibiting myocardial apoptosis induced by ischemia/reperfusion
Guo Caixia1, Jiang Xue1,Zeng Xiangjun2, Chen Buxing1*
(1.DepartmentofCardiology,BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China;2.DepartmentofPathophysiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China)
【Abstract】ObjectiveTo test the effect of sRAGE on myocardial apoptosis and STAT3 protein expression with or without STAT3 inhibitor AG490 following ischemia/reperfusion in vivo and in vitro. MethodsC57BL/6J mice undergone left anterior descending coronary artery ligation were used as in vivo model and neonatal rat cardiomyocyte subjected to ischemic buffer as an in vitro model. Apoptosis was detected by TUNEL staining and caspase-3 activity. Expression of STAT3/p-STAT3 protein were detected by Western blotting analysis in the presence and absence of the JAK2 inhibitor AG 490. ResultsIn vivo, compared with sham group, the number of TUNEL positive cells and caspase-3 activity were increased by 115% and 120%, and the ratio of p-STAT3/STAT3 was reduced by 50%; sRAGE (100 μg/day) reduced the TUNEL-positive myocytes by 51%, and activity of caspase-3 by 36%, increased the ratio of p-STAT3/STAT3 by 381% followed by I/R. In vitro, compared with control group, the number of TUNEL positive cells and caspase-3 activity increased by 380% and 77%, and the ratio of p-STAT3/STAT3 was reduced by 69%, sRAGE (900 ng/mL) reduced the TUNEL-positive myocytes by 63%, and caspase-3 activity by 33%, increased the ratio of p-STAT3/STAT3 by 243% followed by I/R. The effect of sRAGE reduction on TUNEL-positive myocytes and caspase-3 activity, raise of the ratio of p-STAT3/STAT3 were attenuated by STAT3 inhibitor AG490. ConclusionThese results suggest that sRAGE protects cardiomyocytes from apoptosis induced by I/R in vitro and in vivo by activating STAT3.
【Key words】sRAGE; myocardial ischemia/reperfusion; apoptosis; STAT3
(收稿日期:2015-12-10)
【中图分类号】R 541.4
[doi:10.3969/j.issn.1006-7795.2016.01.009]
*Corresponding author, E-mail:chbux@126.com
基金项目:国家自然科学基金(81570321, 81370313),北京市科技新星计划(2010B050),北京市卫生系统高层次卫生技术人才培养计划(2013-3-046)资助项目。This study was supported by National Natural Science Foundation of China(81570321, 81370313),Beijing NOVA Program(2010B050), Beijing Health System High Level Health Technical Personnel Training Plan(2013-3-046)
网络出版时间:2016-01-2718∶00网络出版地址:http://www.cnki.net/kcms/detail/11.3662.R.20160127.1800.026.html
· 心脑血管疾病临床与基础研究 ·

