FGF-2与BMP-2在颅缝细胞成骨分化中的相互作用
姜陶然 曹德君
原发性颅缝早闭是较常见的先天性颅面畸形,系因一条或多条颅缝过早闭合所引起,即骨缝过早骨化,提前失去增殖扩大的能力,从而导致各种颅面部畸形及智力障碍。成纤维生长因子受体突变(FGFRs)可导致多种颅缝早闭综合征,如Apert综合征及Crouzon综合征等。骨形成蛋白下游的转录因子MSX2发生突变时也可导致Boston型颅缝早闭。研究发现,FGFs/FGFRs信号通道与BMPs信号通道在调控骨髓间充质干细胞成骨分化时,可发生相互作用。但在颅缝细胞成骨分化过程中,FGFs/FGFRs与BMPs的相互作用及其机制仍不明确。为探讨这一问题,我们设计了本实验。
1 材料和方法
1.1 主要试剂及仪器
低糖 DMEM(Hyclone,美国),胎牛血清(Biowest,法国),Ⅳ型胶原蛋白酶(SERVA,德国),茜素红、青链霉素原液、L-谷氨酰胺、胰蛋白酶-EDTA、抗坏血酸、β-甘油磷酸钠、地塞米松(Gibco,美国),Recombinant Rat FGF-2、Recombinant Human BMP-2、Recombinant Human Noggin(PEPROTECH,美国),Trizol液(Invitrogen,美国),碱性磷酸酶染色试剂盒(上海虹桥乐翔医用试剂技术有限公司),M-MLV反转录酶及相关试剂(Promega,美国),SYBR Premix Ex TagⅡ试剂盒(Takara,日本)。紫外分光光度计(MAPADA,UV-3200)。
1.2 方法
1.2.1 大鼠颅缝细胞培养
取1~3天的新生SD大鼠,乙醇浸泡消毒,无菌条件下切取颅盖骨,剥离硬脑膜和骨膜,取颅骨矢状缝及冠状缝处1.5 mm组织,尽量剪碎,放入4 mLⅣ型胶原蛋白酶内,37℃,3 h;离心弃上清液。10 mL完全培养液 (低糖DMEM+10%FBS+1%青链霉素原液+292 mg/L L-谷氨酰胺)重悬细胞,无菌转移至培养皿中,37℃、5%CO2及饱和湿度下培养。每3天换液一次,1周后0.25%胰蛋白酶消化,1×104cells/cm2细胞密度接种于6孔板及24孔板。实验用第一代细胞。
1.2.2 FGF-2对颅缝细胞BMP-2表达的影响
第一代细胞80%融合后,将培养液换为成骨诱导培养液(完全培养液+10-8mol/L地塞米松+50 μg/mL抗坏血酸+10 mmol/L β-甘油磷酸钠),并添加不同浓度 FGF-2 (1 ng/mL,10 ng/mL,16 ng/mL,20 ng/mL,50 ng/mL,100 ng/mL,150 ng/mL 和 200 ng/mL);对照组仅添加成骨诱导培养液。诱导24 h后,收集细胞,提取RNA,逆转录荧光定量PCR检测BMP-2的表达量。
在成骨诱导培养液中添加10 ng/mL FGF-2,分别于诱导后的不同时段(12 h,24 h,36 h,48 h,3 d,5 d,7 d)收集细胞,提取RNA,定量PCR检测BMP-2的表达量。
1.2.3 成骨诱导分化
第一代细胞80%融合后,将培养液换为成骨诱导培养液。细胞分4组,分别添加①10 ng/mL FGF-2;②10 ng/mL FGF-2与100 ng/mL BMP-2;③10 ng/mL FGF-2 与 1 ug/ml Noggin;④10 ng/mL FGF-2、100 ng/mL BMP-2与1 μg/mL Noggin。 每3天换液,培养24 h或48 h,收集细胞,提取RNA,定量PCR检测成骨标志物COL-1、OC、BSP。培养7 d后,固定细胞,行ALP染色及茜素红矿化染色。
1.2.4 ALP染色
用无磷酸钙的PBS冲洗细胞3次后,多聚甲醛室温固定30 sec,流水冲洗,晾干;根据试剂盒使用说明书配置工作液;在培养板中添加工作液,37℃恒温箱中孵育45 min;流水冲洗5 min,晾干,镜下观察。
1.2.5 茜素红矿化染色
用无磷酸钙的PBS冲洗细胞3次后,4%多聚甲醛室温固定10 min,流水冲洗。在培养板中添加10%茜素红溶液,37℃恒温箱中孵育30 min,流水冲洗,晾干,镜下观察。
1.2.6 RNA提取及荧光定量PCR
Trizol进行mRNA的提取,实验操作参照Invitrogen Trizol使用说明,用紫外分光光度计检测核酸浓度及纯度。RNA逆转录形成cDNA模板,使用MMLV反转录酶及相关试剂合成。qPCR定量分析,在冰上按说明书配制10 μL反应体系,每种引物扩增反应都设定阴性对照(表1)。在Stepone plus仪器上进行Real Time PCR反应,每个反应重复3次,实验结束后用 2-ΔΔCT法分析统计结果。

表1 引物序列Table 1 Primer sequence
2 结果
2.1 FGF-2对颅缝细胞BMP-2表达的影响
结果显示,BMP-2的表达随FGF-2浓度增加而增高,FGF-2浓度达到50 ng/mL后,BMP-2表达进入平台期 (图1A);随着FGF-2作用时间延长,BMP-2表达量也随之有明显增加(图1B)。
2.2 FGF-2与BMP-2对颅缝细胞成骨分化的影响
结果显示,FGF-2与BMP-2共同作用抑制COL-1的表达,促进OC和BSP的表达。诱导培养7 d后,ALP染色及茜素红矿化染色均高于对照组(单纯成骨诱导培养液)(图2)。
2.3 BMP-2被阻断后对颅缝细胞成骨分化的影响
结果显示,内源性BMP-2被阻断后,晚期成骨标志物OC和BSP表达量均明显下降,ALP染色、茜素红矿化染色均减弱;外源性BMP-2被阻断后,晚期成骨标志物OC和BSP表达量均显著降低,ALP染色、茜素红矿化染色也明显减弱(图3)。
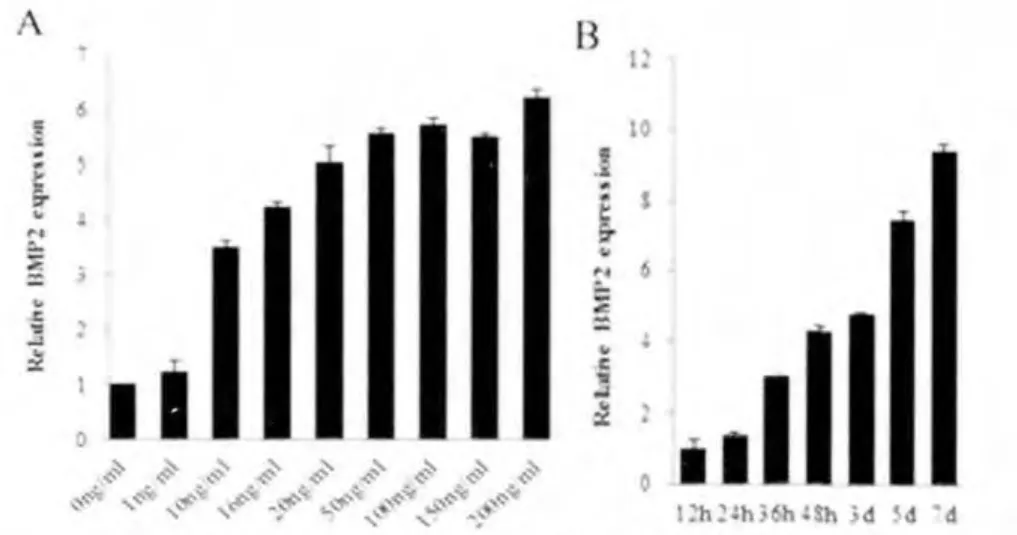
图1 FGF-2对颅缝细胞BMP-2表达的影响Fig.1 BMP-2 expression in cranial suture cells after FGF-2 induction

图2 FGF-2与BMP-2共同作用对颅缝细胞成骨分化的影响Fig.2 The effect of co-treatment of FGF-2 and BMP-2 on the osteoblastic differentiation of cranial suture cells
3 讨论
原发性颅缝早闭,即颅骨骨缝过早融合,是颅颌面较为常见的畸形,发病率为1/2 500[1]。由于颅缝过早闭合,颅腔提前失去增殖扩大的能力,常可导致严重的并发症,如颅内高压、继发性的视力和听力损害、气道堵塞及智力低下等,并因外貌异常导致心理疾病[2]。颅缝早闭患者需接受多次复杂的开颅手术,但因气管发育异常,易出现术后并发症[3]。因此在了解疾病发病机制的基础上,研究出新型的非手术治疗方法具有重要的意义。

图3 Noggin阻断BMPs信号通道对颅缝细胞晚期成骨分化的影响Fig.3 The effect of Noggin on the later-stage osteoblastic differentiation of cranial suture cells
骨骼发育分为膜内成骨及软骨内成骨两种形式。颅骨作为扁状骨,是由膜内成骨发育而来,即间充质细胞不经软骨形成过程,而直接分化为成骨细胞。在这一过程中,有多种细胞信号参与调控。研究发现,发生在FGFRs的基因突变,可导致FGFs信号通道不依赖配体的组成性激活,从而加速间充质细胞/成骨细胞的分化,最终导致颅缝过早闭合;发生在BMPs下游的转录因子MSX2发生突变时可导致Boston型颅缝早闭[4-5]。这些研究表明,FGFs/FGFRs与BMPs信号通道均参与调控颅缝闭合,发生异常时均可导致颅缝早闭。研究发现,FGFs/FGFRs与BMPs信号通道在骨形成过程中相互作用[6-7]。但两者是否在调控颅缝闭合的过程中相互作用并不明确。本实验发现,FGF-2可促进BMP-2在颅缝细胞中的表达,但BMP-2不能促进FGF-2在颅缝细胞中的表达 (前期实验结果)。同时发现,FGF-2对BMP-2的促进作用具有浓度依赖性及时间依赖性。该结果和Choi等[8]的研究结果一致,但Biver等[9]的认为,FGF-2 可完全阻断 BMP-2、BMP-4、BMPR-1A及BMPR-1B在人间充质干细胞成骨分化过程中的表达上调。这一矛盾结果可能是由于不同的细胞类型及不同的培养条件所造成的。BMP-2在颅骨形成不同阶段中都具有重要作用,包括启动前体成骨细胞向成熟成骨细胞的分化以及促进成骨细胞的矿化[10-13]。研究表明,BMP-2异常调节与颅缝闭合及原发性颅缝早闭有关。人为给予高浓度BMP-2的动物模型及BMPR-1组成性激活突变的动物模型均出现了颅缝过早闭合[14-15]。因此,我们认为,高表达的BMP-2可增强BMPs信号通道,从而加速颅缝细胞成骨分化,最终导致颅缝过早闭合。FGF-2可促进BMP-2在颅缝细胞中的表达,可能是FGFRs组成性激活突变导致颅缝早闭的机制之一。
为了进一步探讨FGF-2与BMP-2在颅缝细胞成骨分化中的相互作用,我们在颅缝细胞培养体系中同时添加了10 ng/mL FGF-2与100 ng/mL BMP-2,并观察颅缝细胞成骨分化的情况。我们通过消化未闭合的冠状缝及矢状缝旁3 mm骨块以获得颅缝原代细胞,对组织块的消化使得我们获得的原代细胞并不会是单一的细胞,原代细胞中掺杂着靠近颅缝、相对不成熟的颅缝细胞及离颅缝较远、相对成熟的颅缝细胞[9]。在消化前,我们将覆盖在骨块上的骨膜及硬脑膜去除,消除硬脑膜分泌的各种生长因子对实验结果的干扰[16]。结果显示,FGF-2与BMP-2共同作用,抑制了早期成骨标志物COL-1在颅缝细胞中的表达,却促进了晚期成骨标志物OC和BSP的表达。同时,颅缝细胞的ALP染色及茜素红矿化染色均较对照组增强。该结果说明,双因子共同作用可促进颅缝细胞晚期成骨分化。研究表明,FGFs/FGFRs通常通过蛋白激酶C(PKC)途径及细胞外调节蛋白激酶-促分裂素原活化蛋白激酶链 (ERKMAPK)途径促进成骨分化[17]。本实验发现,BMP-2是FGF-2信号通道的下游因子,FGF-2与BMP-2共同作用可促进颅缝细胞晚期成骨分化。所以,我们推测,FGF-2信号通道还可通过BMP-2途径促进成骨分化。我们通过添加BMPRs竞争性抑制剂Noggin阻断内源性及外源性BMP-2信号通道。结果显示,添加Noggin后,单因子FGF-2及FGF-2+BMP-2促进颅缝细胞晚期成骨分化的作用均减弱,说明FGF-2促进颅缝细胞成骨分化也可通过BMP-2途径。综上所述,本实验说明,FGF-2与BMP-2在调控颅缝细胞成骨分化中具有轴向作用,即FGF-2上调BMP-2在颅缝细胞中的表达,增强的BMP-2信号通道加强了FGF-2促进颅缝细胞晚期成骨分化的作用。
颅缝早闭作为常见的先天性颅颌面畸形,可导致多种并发症,故对其发病机制的研究具有重要意义。本实验初步阐明了FGFs/FGFRs信号通道与BMPs信号通道在颅缝早闭发病过程中的相互作用,对颅缝早闭的具体发病机制有了进一步的了解。
[1]Wilkie AO.Epidemiology and genetics of craniosynostosis[J].Am J Med Genet,2000,90(1):82-84.
[2]Dwivedi PP,Grose RH,Filmus J,et al.Regulation of bone morphogenetic protein signalling and cranial osteogenesis by Gpc1 and Gpc3[J].Bone,2013,55(2):367-376.
[3]Sinkueakunkit A,Chowchuen B,Kantanabat C,et al.Outcome of anesthetic management for children with craniofacial deformities[J].Pediatr Int,2013,55(3):360-365.
[4]Muenke M,Gripp KW,McDonald-McGinn DM,et al.A unique point mutation in the fibroblast growth factor receptor 3 gene(FGFR3)defines a new craniosynostosis syndrome[J].Am J Hum Genet,1997,60(3):555-564.
[5]Wilkie AO.Craniosynostosis:genes and mechanisms[J].Hum Mol Genet,1997,6(10):1647-1656.
[6]Fakhry A,Ratisoontorn C,Vedhachalam C,et al.Effects of FGF-2/-9 in calvarial bone cell cultures:differentiation stagedependent mitogenic effect,inverse regulation of BMP-2 and noggin,and enhancement of osteogenic potential[J].Bone,2005,36(2):254-266.
[7]Nakamura Y,Tensho K,Nakaya H,et al.Low dose fibroblast growth factor-2(FGF-2)enhances bone morphogenetic protein-2(BMP-2)-induced ectopic bone formation in mice[J].Bone,2005,36(3):399-407.
[8]Choi KY,Kim HJ,Lee MH,et al.Runx2 regulates FGF2-induced Bmp2 expression during cranial bone development[J].Dev Dyn,2005,233(1):115-121.
[9]Biver E,Soubrier AS,Thouverey C,et al.Fibroblast growth factor 2 inhibits up-regulation of bone morphogenic proteins and their receptors during osteoblastic differentiation of human mesenchymal stem cells[J].Biochem Biophys Res Commun,2012,427(4):737-742.
[10]Chen D,Harris MA,Rossini G,et al.Bone morphogenetic protein 2(BMP-2)enhances BMP-3,BMP-4,and bone cell differentiation marker gene expression during the induction of mineralized bone matrix formation in cultures of fetal rat calvarial osteoblasts[J].Calcif Tissue Int,1997,60(3):283-290.
[11]Hay E,Hott M,Graulet AM,et al.Effects of bone morphogenetic protein-2 on human neonatal calvaria cell differentiation[J].J Cell Biochem,1999,72(1):81-93.
[12]Marie PJ,Debiais F,Hay E.Regulation of human cranial osteoblast phenotype by FGF-2,FGFR-2 and BMP-2 signaling[J].Histol Histopathol,2002,17(3):877-885.
[13]Ornitz DM,Marie PJ.FGF signaling pathways in endochondral and intramembranous bone development and human genetic disease[J].Genes Dev,2002,16(12):1446-1465.
[14]Kinsella CR Jr,Cray JJ,Durham EL,et al.Recombinant human bone morphogenetic protein-2-induced craniosynostosis and growth restriction in the immature skeleton[J].Plast Reconstr Surg,2011,127(3):1173-1181.
[15]Komatsu Y,Yu PB,Kamiya N,et al.Augmentation of Smaddependent BMP signaling in neural crest cells causes craniosynostosis in mice[J].J Bone Miner Res,2013,28(6):1422-1433.
[16]Opperman LA,Passarelli RW,Morgan EP,et al.Cranial sutures require tissue interactions with dura mater to resist osseous obliteration in vitro[J].J Bone Miner Res,1995,10(12):1978-1987.
[17]Park J,Park OJ,Yoon WJ,et al.Functional characterization of a novel FGFR2 mutation,E731K,in craniosynostosis[J].J Cell Biochem,2012,113(2):457-464.

