骨缝牵引成骨动物模型的建立及应用
李东 黄晓翔 Sean Shih-Yao Liu 徐海淞 曹德君 柴岗 韦敏
缝牵引成骨是从口腔正畸技术发展起来的,近年来逐渐应用于颅颌面外科[1-3],为面部骨骼发育不全的治疗提供了新的选择。骨缝牵引成骨是指应用外力作用于生长中的骨缝,诱导骨缝及其周边骨骼改建,使新骨形成、骨骼位置改变的生物过程。目前有关缝牵引成骨技术的一些基础理论和临床治疗问题还有待不断研究和探讨,骨缝牵引成骨较长的疗程以及新骨生成、矿化不良所引起的各种并发症是影响该技术在临床推广应用的主要障碍。
为了进一步研究骨缝牵引成骨的机制及促进骨缝牵引成骨效率的方法,我们希望能建立一种既能简单有效地牵开骨缝,又可调节牵引力及牵引方式,且有较高成功率的骨缝牵引动物模型。镍钛合金弹簧能提供均匀持久的弹性牵引力[4],结合新型的即刻牵引微型牵引种植钉(Miniscrew implants,MSI)作为支抗[5-6],或许能有效牵开骨缝且能控制和调节牵引力;而新西兰白兔的颅骨矢状缝常被作为颅骨缝实验的首选。
本实验目的是建立兔颅骨矢状缝牵引成骨的动物模型,并验证该模型的可操作性及可靠性,探索局部应用rhBMP-2对牵引成骨的作用,为后续颅缝牵引成骨的相关机制研究提供良好的动物模型。
1 材料及方法
1.1 实验动物
新西兰大白兔14只,11周龄,上海交通大学医学院附属第九人民医院实验动物中心提供。
1.2 牵引器
自行设计,50 g镍钛合金牵开弹簧(Sentalloy GAC,Bohemia,美国),微型牵引种植钉支抗(Daegu,韩国), 直径 0.7 mm钛丝 (99.9%钛,A Johnson Matthey Company,美国)。
1.3 实验方法
1.3.1 实验动物及分组
将14只兔随机分为实验组(牵引+rhBMP-2,n=7)和对照组(单纯牵引,n=7)。两组分别以50 g力镍钛合金弹簧持续等张牵引29 d;实验组动物在颅骨矢状缝局部应用rhBMP-2。
1.3.2 牵引模型的建立及基本操作
以氯胺酮75 mg/Kg肌肉注射麻醉动物,手术区域备皮,无菌操作。以MSI作支抗植入颅骨固定(图1A),并分离骨膜,将可吸收海绵(Absorbable collagen sponge,ACS)剪成 6 mm×8 mm×2 mm 大小,浸于浓度为0.1 mg/mL的rhBMP-2溶液中,随后将浸有rhBMP-2的可吸收海绵置于实验组骨膜下 (图1C)。两MSI之间置入50 g力镍钛合金牵开弹簧(图1D、E)。在MSI前方3~4 mm处,分别钉入2个钛钉(图1F)作为骨影像学标记。对照组动物仅行牵引操作,骨膜下未放置rhBMP-2(图1B)。通过记录各阶段X线片上金属物影像变化,比较骨缝牵开距离及牵引种植钉偏移情况。在手术当天(0 d)及术后第5、11、17、23及29 d记录和调节牵引力,并使弹簧始终保持在有效牵引力范围。
1.3.3 数据采集和记录
第 0、5、11、17、23 及 29 d 记录动物体质量,拍摄X线平片及Micro-CT。第7、27天注射四环素(13.6 mg/lb/im),第 17 天注射钙黄绿素(10 mg/Kg/im)。前期研究表明,荧光骨标记过的动物在牵引成骨后,新生骨结合有荧光骨标记,因此可以通过荧光显微镜观察不同时期矢状缝间骨骼的改建情况。
1.3.4 组织标本的制备
牵引第29天,取有效标本区,包括:矢状缝,临近的颅骨,微型牵引种植钉及钛骨标记区域。并立即用70%乙醇固定7 d。标本以甲基丙烯酸甲酯固定后制作成约60 μm的颅缝冠状面切片,于荧光显微镜下观察。
1.3.5 数据的测量与分析
使用Viewbox 3.1软件,由单人随机测量全部X线平片,包括微型牵引种植钉间距MSIr及钛骨标间距MSIm,每张照片测量3次取均值。通过X线平片测量MSIr、MSIm结果,以评估颅缝牵开情况及牵引种植钉位移情况。
组织切片用Nikon 80i荧光显微镜观察四环素标记(绿色)及钙黄绿素标记(红色),并用Photometrics Coolsnap K4高清摄像头及MetaMorph 6.3软件捕捉影像。
1.3.6 统计学分析
采用SPSS 13.0软件进行统计学分析,实验动物体重、骨缝牵开距离的比较分别采用t检验及方差分析,所得数据以s表示,P<0.05认为差异有统计学意义。
2 结果
2.1 大体观察
实验前后动物平均增重1 093~1 218 g,各组间体重增加差异无统计学意义(P>0.05),说明牵引治疗对兔生长无明显影响,实验兔耐受治疗。对照组有2只动物出现MSI脱落,这些动物测量的数据统计截止至MSI脱落前一天。而实验组未见牵引钉脱落。本次实验MSI牵引系统成功率为86%(12/14)。
2.2 X线平片及Micro-CT
牵引结束后行头颅X线平片测量,并对动物头颅进行Micro-CT扫描以评价牵引效果。
X线平片测量钛骨标记间距变化显示,牵引周期 29 d 后,对照组颅缝平均牵开(1.28±0.13)mm,实验组平均牵开(1.04±0.12)mm,两组间差异有统计学意义(P<0.05)(图 2A、图 4A)。
X线平片测量牵引种植钉间距MSIr变化显示,实验后对照组平均牵开(2.35±0.17)mm,实验组平均牵开(1.87±0.12)mm,差异有统计学意义(P<0.05)(图 2B、图 4B)。
相同牵引力及牵引时间,实验组牵引后颅缝间隙较小,说明牵引过程中伴随有新骨的形成。Micro-CT图示可明确显示牵引情况(图3)。
2.3 组织学观察
实验组各荧光免疫标记线重叠或间隔狭小 (图5A),说明在牵引过程中伴随着较多的快速成骨。荧光显微镜下观察发现,单纯牵引组各时间点荧光标记线清晰(图5B),说明第7~17天及第 17~27天均有一定量的新骨沿骨缝边缘向骨缝间隙生长。

图1 兔矢状缝牵引模型Fig.1 The rabbit model of sagittal suture traction
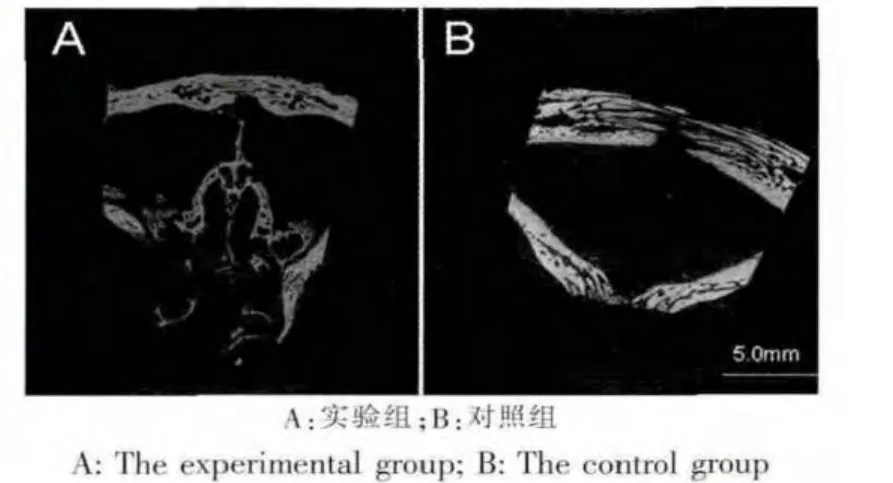
图2 牵引结束后头影X线片Fig.2 X-ray after ditraction
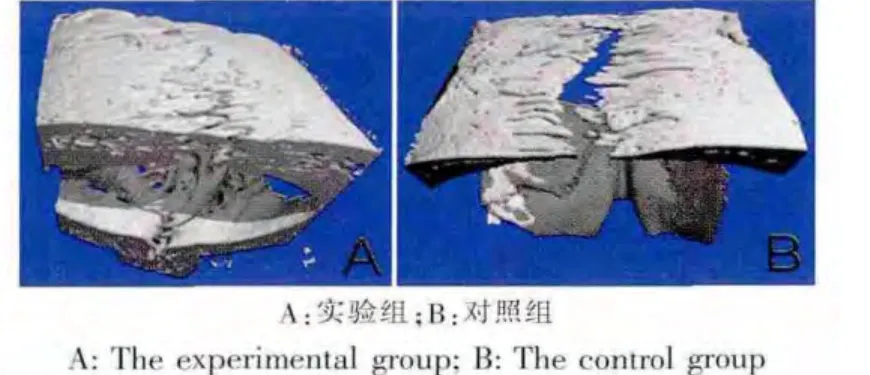
图3 Micro-CT显示牵引效果Fig.3 The effect of distraction

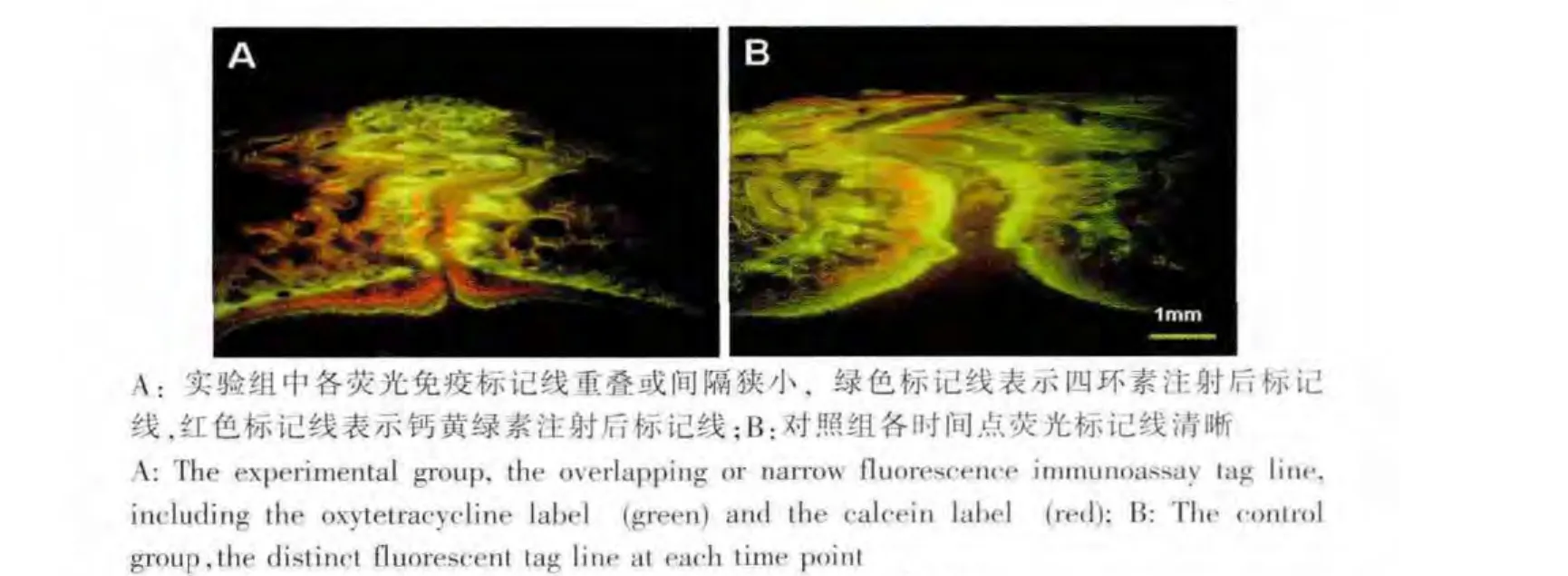
图5 矢状缝冠切面荧光标记影像Fig.5 Fluorescent labeled sections of sagittal suture
3 讨论
上世纪60年代以来,随着上颌骨前移或后退牵引矫正牙颌面畸形的兴起,相继报道了腭中缝、上颌骨周围骨缝及颅骨矢状缝对张力作用的反应[7-10]。1997年,Carls等[11-12]报道了通过骨缝牵引成骨延长了6只成年狗的硬腭,验证了颅面部骨缝牵引成骨的可行性;1999年,Tung等[13]通过牵引兔颅缝成骨实验,验证了缝牵引成骨的可行性。柳春明等[14]在狗模型上,经手术形成硬腭的裂隙,用镍钛记忆合金缝牵引器牵张腭骨外侧缝,使裂隙两侧腭骨向中线移动关闭裂隙成功,说明缝牵引技术可以诱导犬腭骨外侧缝的骨再生,修复硬腭的缺损。以上动物模型虽然能进行缝牵引成骨的相关研究,但是狗、羊等大型动物模型不易大量饲养,牵引器的设计及制造也相对复杂,实验成本较高,缺乏大样本实验的可行性。
本实验中,我们成功创建了以微型牵引种植钉MSI为支抗的兔颅骨矢状缝牵引系统。经验证,该颅缝牵引模型操作简单,牵引方式可控,经济实用。本实验所有牵引装置均耐受治疗全过程,无锈蚀、弯曲及断裂现象。在器械外露端,皮肤与器械紧密贴合,封闭性良好,软组织均一期愈合,未见感染发生。本实验中所用的11周龄新西兰白兔为青壮年期[15],可见只要骨缝未闭合,仍可通过牵引应力对骨缝进行改建,达到矫正颅面部骨骼畸形的目的。
本实验中,我们应用了微型牵引种植钉MSI作为即刻牵引支抗,虽然螺纹长度只有3 mm,但是成功率达到了86%,和以往文献报道的术后种植钉即刻牵引成功率接近[16-18]。文献报道显示,大多的种植钉牵引失败多在前1~2周[19-22],这可能是由于首次种植后,种植钉与颅骨结合稳定度不够造成的。我们总结了各牵引钉脱落的可能原因,认为第一对微型牵引种植钉脱落可能是因操作不当及螺钉磨损导致,种植钉螺纹的损伤极易导致种植牵引的失败[22];另一对微型牵引种植钉在第18天脱落,未见明显感染迹象,可能是由于种植后牵引种植钉周围骨质愈合不好加上牵引中轻微的移动,导致脱落。而实验组则未见牵引种植钉的脱落,考虑主要与其在牵引过程中的快速成骨有关。本实验中3 mm微型牵引种植钉较常用的种植牵引支抗要短,我们较高的成功率说明,对于种植钉的稳定性,其直径的大小较之长度更为重要[23]。
研究发现,机械应力刺激作用于颅面部骨缝,影响其中的成骨细胞的增殖分化和基质合成,使骨缝的宽度增加,骨缝边缘新骨沉积[24-25]。在外牵引力的作用下,骨缝的组织与形态发生明显的变化:骨缝变宽;骨缝组织中的细胞发生分化、增殖,新骨不断形成。骨缝组织为适应外牵引力而发生了一系列的骨缝组织结构的改建,从而形成了新的骨缝组织形态。本实验中,牵引后对照组骨缝标本头影平片及Micro-CT精细三维重建均可见矢状缝牵开距离较大,可见明显骨缝间隙,有一定量的新骨沿应力方向排列。说明牵引成骨模型成功建立,并且牵引过程中伴随新骨形成。
BMP参与骨骼的生长、发育及创伤修复,rhBMP-2的临床应用基于其生物学活性。Wang等[26]最早发现利用大鼠的脱钙骨基质作为载体,rhBMP-2可以诱导骨形成。研究显示,rhBMP-2诱导新骨形成的同时,可与原来存在的骨成功结合,这显示了rhBMP-2临床应用的可能性。近年来,相关研究关注于BMP在牵张成骨过程中的作用[27-28]。为了探讨rhBMP-2是否能加速牵引成骨,本实验我们在单纯牵引的基础上,局部应用rhBMP2进一步观察其对颅缝的改建作用。
通过测量牵引种植钉及钛骨标在牵引前后的位移,我们发现实验组骨缝在0~5 d牵开趋势与对照组相似,但5~29 d骨缝牵开率较对照组明显下降。各组骨缝牵开数据经方差分析显示,对照组与实验组矢状缝牵开距离之差异有统计学意义 (P<0.05)。我们认为,在牵引早期由于周围组织的弹性阻力及成骨量较少,所以牵引距离增加较快;而在5 d后,周围组织的弹性阻力及临近骨组织的阻力作用开始显现,所以牵引距离的增加速度开始下降,尤其是实验组,局部应用rhBMP-2导致局部快速成骨,使得牵引阻力进一步增加,最终导致其牵开距离明显小于对照组。经组织学切片观察骨缝冠切面显示,对照组骨缝间隙明显,各时间段荧光标记线清晰显示,说明在各时间段均有一定量的新骨生成,但新骨生成量不及牵开的速度。而在实验组,荧光标记线多数重叠或狭窄,骨缝可见有较多的骨质形成。说明在牵引过程中,伴有快速成骨,局部应用rhBMP-2能明显促进牵引成骨的速度。因此,局部应用适当浓度的rhBMP-2可提高缝牵引成骨效率,缩短牵引治疗周期,并有可能减少术后复发。
两组牵引结束后,MSI的牵开距离稍大于钛骨标之间的距离,但差别均小于2 mm,我们认为这种距离差异主要与周围软组织的弹性阻力,以及邻近骨组织的阻力有关。这说明,在牵引阻力明显增加后,MSI在牵引力作用下相对骨面产生了微小位移。文献报道指出,即刻种植牵引可使种植钉偏移达2 mm以上[29],本实验持续牵引位移在可接受范围内。
4 总结
本实验采用自行研制的微型种植钉弹力牵引系统,成功地建立了兔矢状缝弹力牵引成骨模型,该模型证实矢状缝牵引成骨效果可靠,具有可行性、可靠性、可重复性、价格便宜、成功率较高的特点。在骨缝牵引过程中,局部应用rhBMP-2可提高缝牵引成骨效率,缩短牵引治疗周期,减少术后复发。
[1]Liu C,Hou M,Liang L,et al.Sutural distraction osteogenesis(SDO)versusosteotomy distraction osteogenesis(ODO)for midfacial advancement:a new technique and primary clinical report[J].J Craniofac Surg,2005,16(4):537-548.
[2]柳春明,黄旭明,侯敏,等.经缝牵引成骨早期矫正儿童面中份发育不全[J].中华整形外科杂志,2005,21(2):90-93.
[3]Brosh T,Vardimon AD,Ergatudes C,et al.Rapid palatal expansion.Part 3:strains developed during active and retention phases[J].Am J Orthod Dentofacial Orthop,1998,114(2):123-133.
[4]Ascherman JA,Marin VP,Rogers L,et al.Palatal distraction in a canine cleft palate mode[J].Plast Reconstr Surg,2000,105(5):1687-1694.
[5]Melsen B.Mini-implants:Where are we[J]?J Clin Orthod,2005,39(9):539-547.
[6]Kyung HM,Park HS,Bae SM,et al.Development of orthodontic micro-implants for intraoral anchorage[J].J Clin Orthod,2003,37(6):321-328.
[7]Brin I,Hirshfeld Z,Shanfeld JL,et al.Rapid palatal expansion in cats:effect of age on sutural cyclic nucleotides[J].Am J Orthod,1981,79(2):162-175.
[8]Storey E.Tissue response to the movement of bones[J].Am J Orthod,1973,64(3):229-247.
[9]Kambara T.Dentofacial changes produced by extraoral forward force in the macacairus[J].Am J Orthod,1977,71(3):249-277.
[10]Miyawaki S,Forbes DP.The morphologic and biochemical effects of tensile force application to the interparietal suture of the Sprague-Dawley rat[J].Am J Orthod Dentofacial Orthop,1987,92(2):123-133.
[11]Carls FR,Jackson IT,Topf JS.Distraction osteogenesis for lengthening of the hard palate:Part I.A possible new treatment concept for velopharyngeal incompetence.Experimental study in dogs[J].Plast Reconstr Surg,1997,100(7):1635-1647.
[12]Carls F,Sahiipbach P,Sailer H,et al.Distraction osteogenesis for lengthening of the hard palate:Part II.Histological study of the hard and soft palate after distract ion[J].Plast Reconstr Surg,1997,100(7):1648-1654.
[13]Tung TH,Robertson BR,Winograd JM,et al.Successful distraction osteogenesis across a growing cranial suture without an osteotomy[J].Plast Reconstr Surg,1999,103(2):362-370.
[14]Liu C,Song R,Song Y.Sutural expansion osteogenesis for management of the bony-tissue defect in cleft palate repair:experimental studies in dogs[J].Plast Reconstr Surg,2000,105(6):2012-2025.
[15]Masoud I,Shapiro F,Kent R,et al.A longitudinal study of the growth of the New Zealand white rabbit:cumulative and biweekly incremental growth rates for body length,body weight,femoral length,and tibial length[J].J Orthop Res,1986,4(2):221-231.
[16]Melsen B,Costa A.Immediate loading of implants used for orthodontic anchorage[J].Clin Orthod Res,2000,3(1):23-28.
[17]Owens SE,Buschang PH,Cope JB,et al.Experimental evaluation of tooth movement in the beagle dog with the mini-screw implant for orthodontic anchorage[J].Am J Orthod Dentofacial Orthop,2007,132(5):639-646.
[18]Carrillo R,Rossouw PE,Franco PF,et al.Intrusion of multiradicular teeth and related root resorption with mini-screw implant anchorage:a radiographic evaluation[J].Am J Orthod Dentofacial Orthop,2007,132(5):647-655.
[19]Schatkzer J,Sanderson R,Murnaghan JP.The holding power of orthopedic screws in vivo[J].Clin Orthop Relat Res,1975(108):115-126.
[20]Ikumi N,Tsutsumi S.Assessment of correlation between computerized tomography values of the bone and cutting torque values at implant placement[J].Int J Oral Maxillofac Implants,2005,20(2):253-260.
[21]Collinge CA,Stern S,Cordes S,et al.Mechanical properties of small fragment screws[J].Clin Orthop Relat Res,2000(373):277-284.
[22]Carano A,Lonardo P,Velo S,et al.Mechanical properties of three different commercially available miniscrews for skeletal anchorage[J].Prog Orthod,2005,6(1):82-97.
[23]Miyawaki S,Koyama I,Inoue M,et al.Factors associated with the stability of titanium screws placed in the posterior region for orthodontic anchorage[J].Am J Orthod Dentofac Orthop,2003,124(4):373-378.
[24]Alaqeel SM,Hinton RJ,Opperman LA.Cellular response to force,Cellular response to force application at craniofacial sutures[J].Orthod Craniofac Res,2006,9(3):111-122.
[25]Henderson JH,Longaker MT,Carter DR.Sutural bone deposition rate and strain magnitude during cranial development[J].Bone,2004,34(2):271-280.
[26]Wang EA,Rosen V,D'Alessandor JS,et al.Reocmbinant human bone morphogenetic protein induces bone formation[J].Proc Natl Acad Sci U S A,1990,87(6):2220-2224.
[27]Rauch F,Lauzier D,Croteau S,et al.Temporal and spatial expression of bone morphogenetic protein-2,-4,and-7 during distraction osteogenesis in rabbits[J].Bone,2000,27(3):453-459.
[28]Sato M,Ochi T,Nakase T,et al.Mechanical tension-stress induces expression of bone morphogenetic protein(BMP)-2 and BMP-4,but not BMP-6,BMP-7,and GDF-5 mRNA,during distraction osteogenesis[J].J Bone Miner Res,1999,14(7):1084-1095.
[29]Liou EJ,Pai BC,Lin JC.Do miniscrews remain stationary under orthodontic forces[J]?Am J Orthod Dentofac Orthop,2004,126(1):42-47.

