徐淮山羊Oct4启动子功能的初步分析
韦光辉, 李东, 左其生, 张亚妮, 朱睿, 张蕾, 刘志永, 邱峰龙, 李碧春
扬州大学动物科学与技术学院, 江苏省动物遗传繁育与分子设计重点实验室, 扬州 225009
Oct4(Octamer-binding transcription factor 4)即八聚体结合转录因子, 又称为 POU5F1, 属于 POU家族的一个同源结构域转录因子[1~3]。Oct4是第一个被发现只在多能细胞中表达的转录因子, 对于调控胚胎干细胞的自我更新、维持其未分化状态起着关键性作用。因此, Oct4经常被用来作为鉴定多能细胞的标记物[4~7]。
研究表明, 转录因子Oct4的精确表达对维持胚胎干细胞多能性具有关键调控作用, 表达量过高或过低均会影响胚胎干细胞的自我更新状态[8]。同时,Oct4基因与胚胎干细胞(ES)分化密切相关。Niwa等[9,10]研究表明, 通过调控 ES细胞中Oct4基因的表达水平导致ES细胞向不同方向分化。当Oct4正常表达水平上调50%时, ES细胞分化为原始内胚层和中胚层, 而当Oct4正常表达水平下调50%时, ES细胞会向滋养层方向分化。只有Oct4维持正常表达水平时, ES细胞才能够保持其未分化状态和多能性。此外, Oct4还通过与Sox、FoxD3等转录因子结合,共同调控下游靶基因的表达, 从而维持胚胎干细胞的自我更新状态。另一方面, 在多能细胞中, Oct4也能激活一系列有助于维持细胞多能性的基因表达[11,12]。
Oct4基因的表达水平对多能干细胞的维持和向不同方向分化起着重要作用。启动子区域决定基因起始时间、控制基因表达的程度, 是基因转录调控最重要的结构。因此, 研究Oct4基因启动子对于阐明其基因表达调控是必不可少的。de Silva等[13]利用曲古抑菌素诱导CD4+T细胞,提高了SAMHD1基因的表达量。Teng等[14]添加丙戊酸后增强了小鼠Oct4基因启动子的活性。Oct4是一种转录调控基因, 目前关于羊Oct4基因启动子的功能研究报道较少。本研究采用双荧光素酶报告基因载体对徐淮山羊Oct4基因启动子进行分析, 通过瞬时转染山羊胎儿成纤维细胞(gEF)、非洲绿猴 SV40转化的肾细胞(COS7)和P19(小鼠畸胎瘤细胞)细胞系, 检测双荧光报告基因活性, 确定了徐淮山羊Oct4基因启动子的核心调控区域, 同时探讨了TSA和VPA对Oct4基因启动子活性的调控作用, 为进一步揭示山羊Oct4基因的转录调控机制提供了理论基础。
1 材料和方法
1.1 材料
徐淮山羊来自江苏丹阳珥陵山羊交易市场,PGL3-Basic、pRL-SV40、pEGFP-N1和感受态 DH5α为本实验室保存。
1.2 方法
1.2.1 徐淮山羊Oct4基因启动子克隆
参照GenBank数据库已公布的山羊Oct4基因序列, 采用 Primer5.0设计一对特异性引物 PGL3-Oct4P1(表 1), 以提取的徐淮山羊血液基因组 DNA为模板进行PCR扩增反应。扩增条件:95℃ 4 min;98℃ 10 s, 60℃ 18 s, 72℃ 90 s, 共 30个循环; 72℃延伸 6 min。PCR产物末端加A后进行琼脂糖凝胶电泳, PCR产物连接pMD19-T载体。经转化、酶切鉴定后命名为 pMD19-Oct4P1, 由上海英俊生物工程有限公司测序。
1.2.2 Oct4基因启动子各缺失片段的克隆
参照Oct4基因启动子区域以及潜在的转录因子结合位点预测的结果, 固定下游引物不变, 变化上游引物, 设计了6对不同长度片段的启动子引物(引物序列见表1)。以pMD19-Oct4P1为模板进行各片段的扩增, 分别与 pMD19-T载体连接, 构建包含Oct4基因启动子不同片段的克隆载体。构建后由上海英俊生物工程有限公司测序。

表1 用于扩增Oct4基因不同缺失片段的引物
1.2.3 双荧光素酶表达载体PGL3-Oct4P的构建
用限制性内切酶KpnⅠ和XhoⅠ(Thermo公司)分别对包含Oct4基因不同启动子片段的克隆载体pMD19-Oct4P(P1~P7)进行双酶切, 同时用KpnⅠ和XhoⅠ双酶切 PGL3.0-Basic载体, 经酶切得到的Oct4不同长度片段分别与双酶切后的PGL3.0-Basic载体进行连接, 构建7个包含不同长度的Oct4基因启动子的荧光素酶表达载体, 分别命名为PGL3-Oct4P1、PGL3-Oct4P2、PGL3-Oct4P3、PGL3-Oct4P4、PGL3- Oct4P5、PGL3-Oct4P6 和PGL3-Oct4P7。载体构建示意图见图1。

图1 含有Oct4启动子不同长度片段的双荧光素酶报告载体PGL3-Oct4P构建示意图
1.2.4 pEGFP-N1/1546载体的构建
分别用限制性内切酶AseⅠ和XhoⅠ对pEGFP-N1和N1/p1546的PCR产物进行双酶切, 酶切产物回收后进行连接、转化。经 PCR、酶切、测序鉴定正确后命名为pEGFP-N1/1546。
1.2.5 细胞瞬时转染
转染前一天将细胞接种于24孔板, 细胞密度为1×105细胞/孔, 待细胞汇合度培养至 80%~90%时进行质粒转染, 重组质粒 PGL3-Oct4P (P1~P7)、pRL-SV40以30:1的比例共转染gEF、P19和COS7细胞。同时共转染空载体PGL3-Basic和pRL-SV40作为空白对照组; 另外, 用重组质粒 pEGFP-N1/1546转染gEF细胞, 同时转染质粒pEGFP-N1, 作为阳性对照。具体参照LipofectamineTM2000产品操作步骤说明书。
1.2.6 TSA和VPA对Oct4长片段启动子活性的诱导
采用终浓度为 1 µmol/L的 TSA和终浓度为 4 mmol/L的 VPA(均购自 SIGMA公司)对转染了重组质粒 PGL3-Oct4P2的细胞进行诱导, 以无任何添加的重组质粒PGL3-Oct4P2转染组为对照组。36 h后进行双荧光素酶报告基因检测。
1.2.7 Oct4启动子缺失片段活性分析和GFP的检测
采用 Dual-Luciferase®Reporter assay System(Promega公司)检测系统测定报告基因的表达水平。具体操作参照Promega双荧光报告检测试剂盒说明书。分别记录萤火虫荧光值和海肾荧光值的 3次读取结果。荧光素酶相对活性的数值为 3次重复实验结果的“平均值±标准差”。pEGFP-N1/1546载体转染COS7细胞后在荧光显微镜下检测绿色荧光。
2 结果与分析
2.1 Oct4基因启动子各片段的克隆
以扩增得到的1966 bp的Oct4基因启动子片段为模板, 用Oct4基因启动子不同长度片段的上、下游引物分别进行PCR扩增。1.5%的琼脂糖凝胶电泳结果显示:扩增出的条带为 1966 bp、1546 bp、976 bp、645 bp、465 bp、268 bp 和 126 bp, 与预期条带大小一致(图2)。

图2 Oct4基因启动子不同片段扩增产物电泳图
2.2 双荧光素酶表达载体PGL3-Oct4P和pEGFPN1/1546载体的酶切鉴定
包含Oct4启动子不同片段的重组双荧光素酶表达载体 PGL3-Oct4P分别采用限制性内切酶KpnⅠ和XhoI进行双酶切验证。经2%浓度的琼脂糖凝胶电泳检测, 结果显示:各泳道均出现两条带, 且条带大小与预期结果一致, 表明所构建的载体正确(图3)。pEGFP-N1载体中的CMV启动子替换为Oct4基因的启动子片段 P2, 利用AseⅠ和XhoⅠ进行双酶切,琼脂糖凝胶电泳检测结果出现两条近似4300 bp和1546 bp的条带, 分别与去除启动子 CMV后的pEGFP-N1和P1546片段大小一致(图4)。
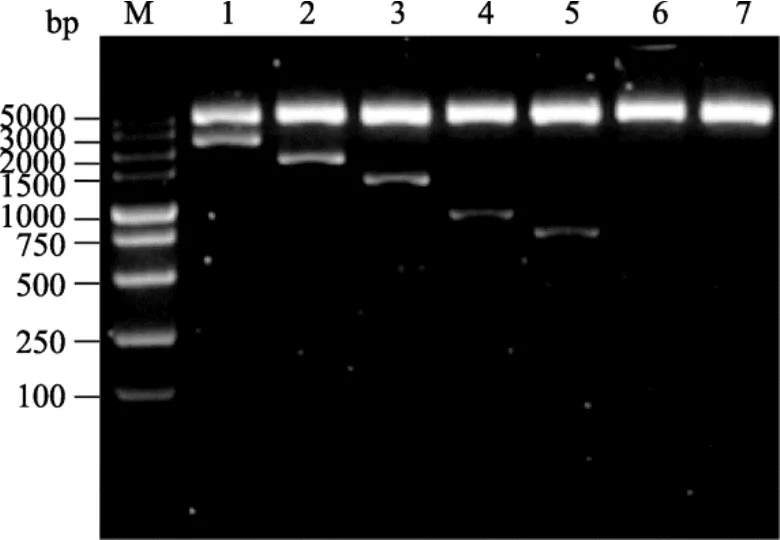
图3 双荧光素酶表达载体PGL3-Oct4P酶切鉴定
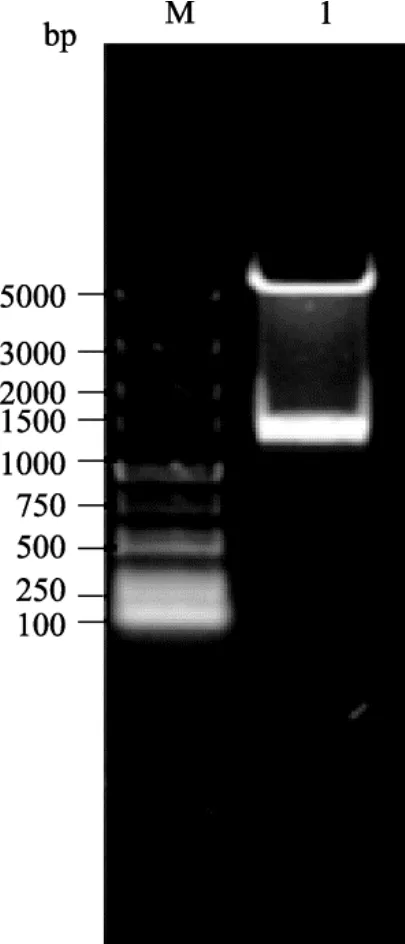
图4 载体pEGFP-N1/1546双酶切鉴定
2.3 Oct4基因启动子活性分析
7个重组质粒 PGL3-Oct4P(P1~P7)分别与 pRLSV40共转染gEF、P19和COS7细胞, 同时设置对照组, 共转染空载体PGL3-Basic和pRL-SV40。
双荧光报告基因检测结果表明,Oct4基因启动子不同片段在 3种细胞中表现出不同程度的启动子活性(图 5), 并且Oct4启动子相同片段在不同细胞中的活性也不同。在3种细胞中, P2(–1516~+30 bp)启动子活性最高, P7(–96~+30 bp)活性最低。–238~–96 bp 区域启动子活性下降明显, –96~+30 bp区域基本无启动子活性, 表明启动子基本活性区域为–238~+30 bp; 在–1516~–946 bp、–615~–96 bp 区域, 启动子活性随片段长度增加而升高, 表明这些区域存在正调控元件, 而在–1936~–1516 bp、–946~–615bp区域启动子活性随着片段长度增加而下降, 表明这些区域存在负调控元件。
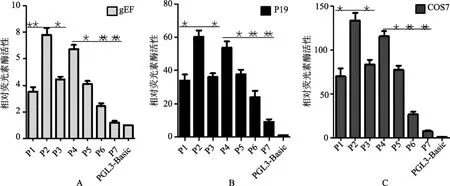
图5 Oct4启动子的活性检测
2.4 TSA和VPA对Oct4基因启动子活性的诱导
经过对PGL3-Oct4P2质粒不同浓度诱导的筛选,终浓度为 1µmol/L的 TSA和终浓度为 4mmol/L的VPA对Oct4基因启动子活性诱导效率最高。诱导后的双荧光素酶报告基因检测结果显示:与对照组相比, 在 gEF、P19和 COS7细胞中, 单独添加 VPA,Oct4启动子活性分别相应提高了 2.5倍、3倍和 4倍; 单独添加 TSA,Oct4启动子活性分别相应提高了8.4倍、11.2倍和12倍; 而联合添加VPA和TSA,Oct4启动子活性分别相应提高了10.1倍、12.2倍和13.5 倍(图 6)。
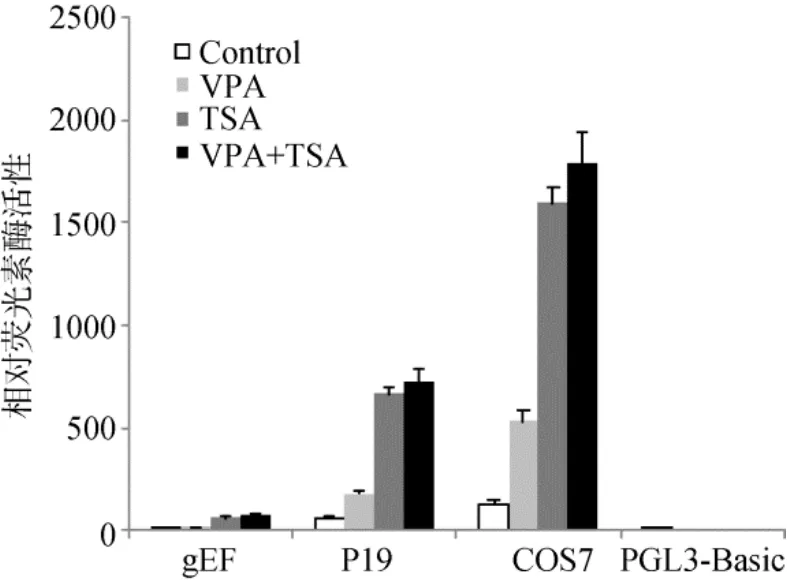
图6 TSA和VPA对Oct4启动子活性的诱导
2.5 Oct4长片段启动子活性的定性分析
双荧光素酶报告基因检测结果证明Oct4基因启动子具有启动子活性, 为验证其长片段是否具有启动子活性, 选取启动子Oct4启动子长片段P2(–1516~+30 bp)片段替换 pEGFP-N1 载体中的CMV启动子, 替换后转染gEF细胞。同时转染阳性对照 pEGFP-N1。荧光结果分析表明, 转染pEGFP-N1/1546的gEF细胞有GFP表达, 但弱于阳性对照质粒 pEGFP-N1(图 7), 该结果进一步验证了Oct4启动子长片段能够启动GFP的转录, 具有启动子活性。
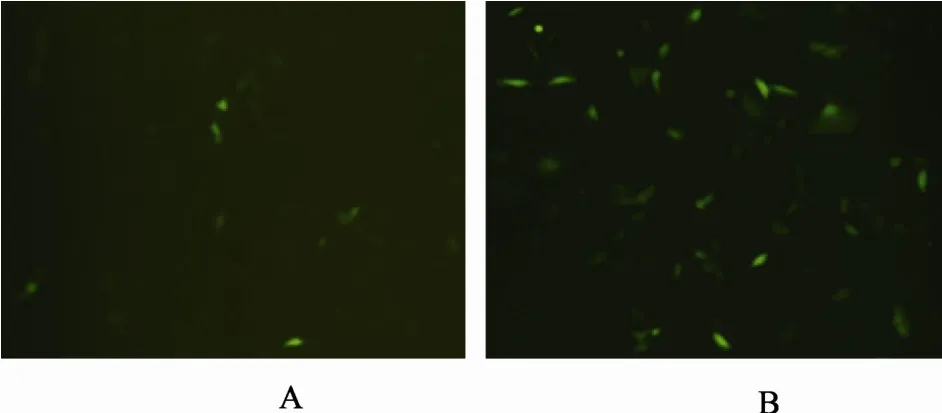
图 7 Oct4基因启动子长片段启动子活性的荧光检测(100×)
3 讨 论
启动子是调控基因转录水平的最基本结构, 通过研究启动子的结构和功能可以更好地了解基因的表达模式[15,16]。Oct4属于POU转录因子家族, 对于维持胚胎干细胞的自我更新及其全能性具有重要作用, 同时也是参与体外诱导多功能干细胞的关键基因[17]。本研究针对山羊Oct4基因启动子的功能进行了初步探讨, 对于进一步揭示Oct4基因的转录调控机制具有重要意义。
本文采用目前研究基因调控的常用方法——5′端逐步缺失突变技术[18,19], 研究Oct4启动子转录调控机制。根据Oct4启动子序列, 构建了包含7个不同长度启动子片段的萤光素酶报告基因表达载体,同时设置含有海肾荧光报告基因的PGL3-SV40载体作为内参, 分别转染gEF、COS7和P19细胞。双荧光报告基因检测结果表明:在同一种细胞中, 启动子活性随着启动子片段大小的不同而不同; 而在不同细胞中, 片段相同的Oct4基因启动子的活性强度存在差异。在以上转染的 3种细胞中, 相同大小片段的启动子在 COS7细胞中测得活性最高, 其次是P19细胞, 最后是 gEF细胞。分析原因可能是不同种属细胞间存在的差异。COS7是经SV40病毒基因转化的细胞系, 能组成型地表达SV40 T抗原, 使得任何复制启始位置带有 SV40的转染质粒能够以很高的拷贝数进行复制[20], 常用于病毒和转染研究以及对细胞基因转录的研究中。P19是小鼠畸胎瘤细胞, 是一种多能性细胞, 而 Oct4基因在多能细胞中表达量丰富, 是鉴定多能细胞的标记物。gEF是山羊胎儿成纤维细胞, 转染效率低。Oct4基因启动子活性的整体趋势在以上 3种细胞中所检测结果是一致的。
为验证其长片段是否具有启动子活性, 将pEGFP-N1载体中的CMV启动子替换为Oct4启动子的 P2(–1516~+30 bp)长片段, 替换后的重组质粒pEGFP-N1/1546转染gEF细胞。荧光结果分析表明,转染的gEF细胞有GFP表达, 但弱于阳性对照质粒pEGFP-N1, 该结果进一步验证了Oct4启动子长片段能够启动GFP的转录, 具有启动子活性。
在本研究中, 与 P6(–238~+30 bp)区域相比较,P7(–96~+30 bp)区域的转录活性下降十分明显, 几乎无转录活性, 这表明–238~–96 bp之间存在重要的正调控元件, 同时也说明–238~+30 bp区域是Oct4基因启动子的基本活性区域。生物信息学分析预测显示:羊Oct4基因不含典型的 TATA框, 在–238~+30 bp区域存在 CCAAT box特征序列以及SP1、ADR1和MZF1等转录因子。已有研究证实, 一个基因的启动子区域中缺少 TATA框, 转录因子SP1能够参与该基因的转录起始[21~25]。由于SP1转录因子结合位点序列相对保守, 因此推测 SP1在缺乏 TATA 盒的羊Oct4基因启动子中可能发挥了重要的作用, 确保Oct4启动子的基本转录活性。
Cotterman等[26]研究证实, 可以通过改变基因富集区域和已知基因远距离区域的组蛋白乙酰化来调节整个基因组的染色质结构。本研究为进一步验证Oct4基因的表达是否存在组蛋白修饰, 采用组蛋白去乙酰化酶抑制剂TSA、VPA来诱导Oct4启动子活性。本研究参考DETSA最佳诱导浓度以及Teng摸索的VPA最适浓度, 对TSA和VPA最佳浓度进行了筛选, 结果表明终浓度为1 μmmol/L的TSA和4 mmol/L的VPA对Oct4启动子诱导效率最高。通过对gEF、P19和COS7细胞的诱导检测,Oct4启动子活性均有不同程度的提高, 表明Oct4基因存在组蛋白乙酰化修饰作用。
本研究成功构建了包含Oct4基因5′侧翼区一系列不同片段的重组报告基因载体PGL3-Oct4P。利用双荧光素酶报告系统分析了各片段的启动子活性,确定了Oct4基因启动子的核心区域及正负调控区域。研究结果表明:Oct4基因启动子活性与启动子片段大小并没有呈现绝对正相关, 启动子活性没有随着序列长度的增加而升高, 启动子活性最高的片段是P2 (–1516~+30 bp), 不是最长序列片段 P1(–1936~+30 bp)。片段 P2的启动子活性比 P3(–946~+30 bp)高, 从片段 P7(–96~+30 bp)到片段 P4(–615~+30 bp),启动子活性逐步升高, 表明–1516~–946 bp区域、–615~–96 bp区域存在正调控元件, 但具体是哪些元件起增强作用还需要进一步研究。在–1936~–1516 bp、–946~–615 bp区域存在抑制启动子活性的元件, 具体是哪些元件同样也需要进一步的研究验证。
[1]Takeda J, Seino S, Bell GI. Human Oct3 gene family:cDNA sequences, alternative splicing, gene organization,chromosomal location, and expression at low levels in adult tissues.Nucleic Acids Res, 1992, 20(17): 4613–4620.
[2]Shi GL, Jin Y. Role of Oct4 in maintaining and regaining stem cell pluripotency.Stem Cell Res Ther, 2010, 1(5): 39.
[3]Kellner S, Kikyo N. Transcriptional regulation of the Oct4 gene, a master gene for pluripotency.Histol Histopathol,2010, 25(3): 405–412.
[4]Boyer LA, Lee TI, Cole MF, Johnstone SE, Levine SS,Zucker JP, Guenther MG, Kumar RM, Murray HL, Jenner RG, Gifford DK, Melton DA, Jaenisch R, Young RA. Core transcriptional regulatory circuitry in human embryonic stem cells.Cell, 2005, 122(6): 947–956.
[5]Zaehres H, Lensch MW, Daheron L, Stewart SA, Itskovitz-Eldor J, Daley GQ. High-efficiency RNA interference in human embryonic stem cells.Stem Cells, 2005, 23(3):299–305.
[6]Looijenga LH, Stoop H, de Leeuw HP, de Gouveia Brazao CA, Gillis AJ, van Roozendaal KE, van Zoelen EJ, Weber RF, Wolffenbuttel KP, van Dekken H, Honecker F, Bokemeyer C, Perlman EJ, Schneider DT, Kononen J, Sauter G, Oosterhuis JW. POU5F1(OCT3/4) identifies cells with pluripotent potential in human germ cell tumors.Cancer Res, 2003, 63(9): 2244–2250.
[7]Wang X, Zhao Y, Xiao Z, Chen B, Wei Z, Wang B, Zhang J, Han J, Gao Y, Li L, Zhao H, Zhao W, Lin H, Dai J. Alternative translation ofOCT4by an internal ribosome entry site and its novel function in stress response.Stem Cells, 2009, 27(6): 1265–1275.
[8]Niwa H, Miyazaki J, Smith AG. Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells.Nat Genet, 2000, 24(4): 372–376.
[9]Niwa H. Molecular mechanism to maintain stem cell renewal of ES cells.Cell StructFunct, 2001, 26(3): 137–148.
[10]Ovitt CE, Schöler HR. The molecular biology of Oct-4 in the early mouse embryo.Mol Hum Reprod, 1998, 4(11):1021–1031.
[11]Yuan H, CorbiN, Basilico C, Dailey L. Developmental-specific activity of the FGF-4 enhancer requires the synergistic action of Sox2 and Oct-3.Genes Dev, 1995,9(21): 2635–2645.
[12]Luo WR, Li SY, Peng BL, Ye YF, Deng XB, Yao KT. Embryonic stem cells markers SOX2, OCT4 and Nanog expression and their correlations with epithelial-mesenchyal transition in nasopharyngeal carcinoma.PLoS ONE, 2013,8(2): e56324.
[13]de Silva S, Hoy H, Hake TS, Wong HK, Porcu P, Wu L.Promoter methylation regulates SAMHD1 gene expression in human CD4+T cell.J Biol Chem, 2013, 288(13):9284–9292.
[14]Teng HF, Kuo YL, Loo MR, Li CL, Chu TW, Suo H, Liu HS, Lin KH, Chen SL. Valproic acid enhances Oct4 promoter activity in myogenic cell.J Cell Biochem, 2010,110(4): 995–1004.
[15]Nechaev S, Adelman K. Promoter-proximal Pol II: when stalling speeds things up.Cell Cycle, 2008, 7(11):1539–1544.
[16]Juven-Gershon T, Hsu JY, Theisen JW, Kadonaga JT. The RNA polymeraseⅡcore promoter-the gateway to transcription.CurrOpin Cell Biol, 2008, 20(3): 253–259.
[17]秦彤, 苗向阳. iPS细胞研究的新进展及应用. 遗传,2010, 32(12): 1205–1214.
[18]王洪梅, 张利博, 侯明海, 王长法, 王玲玲, 孙涛, 何洪彬, 仲跻峰. 牛 Nramp1基因启动子的克隆及其活性分析. 中国农业科学, 2011, 44(5): 1022–1028.
[19]王秋华, 曹允考, 李树峰, 佟慧丽, 兴孝友, 李光鹏, 严云勤. 牛 MyoG基因启动子的克隆及功能的初步分析.畜牧兽医学报, 2012, 43(1): 37–43.
[20]Gluzman Y. SV40-Transformed simian cells support the replication of early SV40 mutants.Cell, 1981, 23(1):175–182.
[21]Zheng J, Ather JL, Sonstegard TS, Kerr DE. Characterization of the infection-responsive bovine lactoferrin promoter.Gene, 2005, 353(1): 107–117.
[22]Deaton AM, Bird A. CpG islands and the regulation of transcription.Genes Dev, 2011, 25(10): 1010–1022.
[23]Richer E, Campion CG, Dabbas B, White JH, Cellier MF.Transcription factors Sp1 and C/EBP regulate NRAMP1 gene expression.FEBS J, 2008, 275(20): 5074–5089.
[24]Pugh BF, Tjlan R. Mechanism of transcriptional activation by Sp1: evidence for coactivators.Cell, 1990, 61(7):1187–1197.
[25]Zou S, Gu Z, Ni P, Liu X, Wang J, Fan Q. SP1 plays a pivotal role for basal activity of TIGAR promoter in liver cancer cell lines.Mol Cell Biochem, 2012, 359(1–2):17–23.
[26]Cotterman R, Jin VX, Krig SR, Lemen JM, Wey A, Farnham PJ, Knoepfler PS. N-Myc regulates a widespread euchromatic program in the human genome partially independent of its role as a classical transcription factor.Cancer Res, 2008, 68(23): 9654–9662.

