蛋白质可逆磷酸化对花粉管生长的调控作用
索金伟,戴绍军
东北林业大学盐碱地生物资源环境研究中心,东北油田盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040
花粉在柱头上萌发后,通过极性生长的花粉管将精细胞运送到胚珠,与卵细胞结合完成受精作用。花粉管极性生长受多种信号与代谢过程的调控,包括Rop GTPase信号途径、磷脂酰肌醇信号通路、花粉管尖端 Ca2+信号、肌动蛋白动态变化、囊泡运输以及细胞壁重塑等[1],蛋白质可逆磷酸化在这些调控过程中具有重要作用。蛋白激酶或磷酸酶分别将蛋白质丝氨酸、苏氨酸、酪氨酸残基磷酸化或去磷酸化,从而激活或失活该蛋白质的功能。科研人员已经利用分子生物学与遗传学手段揭示了上述过程中多种蛋白质的功能受到蛋白质可逆磷酸化作用的调节(表1),并利用磷酸化蛋白质组学研究策略鉴定到了779种花粉管生长相关的磷酸化蛋白质,它们主要参与信号转导、离子平衡、细胞骨架动态、囊泡运输、细胞壁重塑、核酸和糖代谢、转录,以及蛋白质合成与降解等调控过程[2~4]。本文综述了花粉管极性生长过程中通过蛋白质磷酸化/去磷酸化调节的信号与代谢过程(图1:A~F),为进一步理解蛋白质可逆磷酸化对花粉管生长的调控机制提供了信息。
1 Rop GTPase信号途径中蛋白质可逆磷酸化
Rop (Rho-related GTPase from plants)是 Rho 亚家族(包括:Cdc42、Rac、Rho、Rop)的成员之一,为植物中所特有的小G蛋白。Rop含有4个鸟苷酸结合区和1个效应器分子结合区。Rop 与GTP结合呈“活化状态”,当 GTP去磷酸化成为 GDP时,Rop失去GTPase活性。这一可逆磷酸化过程受鸟苷酸交换因子(Guanine nucleotide exchange factor,GEF)、鸟苷酸解离抑制因子(Guanine nucleotide dissociation inhibitor, GDI)和 GTPase活化蛋白(GTPase activating protein, GAP)的调节。Rop GTPase信号途径对花粉管极性生长的调控受蛋白质可逆磷酸化调节。蛋白激酶与磷酸酶介导的可逆磷酸化作用通过改变GEF、GAP和GDI的活性来调节Rop的活性;同时,蛋白激酶还参与Rop下游途径的调节,从而调控花粉管的极性生长(图1 A)。
1.1 蛋白质可逆磷酸化调节Rop活性
定位于花粉管尖端质膜的Rop的活性受GEF正调控。GEF催化 Rop GDPase上的 GDP解离并与GTP结合形成有活性的 Rop GTPase。Rop GTPase通过质膜流动侧向扩散,在生长的花粉管尖端形成Rop GTPase帽。研究发现,拟南芥(Arabidopsis thaliana(L.) Heynh)花粉中表达的RhoGEF1、RopGEF8和 RopGEF9能够激活定位于花粉管尖端质膜上的Rop[5,6]。被激活的Rop GTPase受GAP和GDI的负调控,从而失去活性,保持有活性Rop和无活性Rop之间的动态平衡[7]。其中,GAP催化 GTP水解成GDP,抑制Rop的活性。然而,GAP本身没有明显的膜定位结构域,可能通过接头/辅助蛋白与细胞壁组分或与膜脂质相连,从而定位在质膜上[8]。执行完功能的GAP与质膜的分离受磷酸化作用调控。在Ca2+存在的条件下,磷酸化的GAP与14-3-3蛋白结合后从质膜上解离下来,重新定位在细胞质中[9]。利用定点突变的方法,预测到烟草(Nicotiana tabacumL.)GAP的 S158为可能的磷酸化位点[9]。失活的 Rop与GDI结合,从花粉管尖端质膜上解离下来形成Rop-GDP-GDI复合体,储存在胞质中,阻止GDP/GTP的交换[7,10]。Yoon等[9]推测,GDI可能会被定位在花粉管尖端质膜上的 Ca2+依赖的蛋白激酶(Ca2+-dependent protein kinase 1, CDPK1)磷酸化,导致Rop-GDP-GDI复合体解体,释放Rop并使之重新回到质膜处,开始Rop激活/失活的新一轮循环(图1A)。
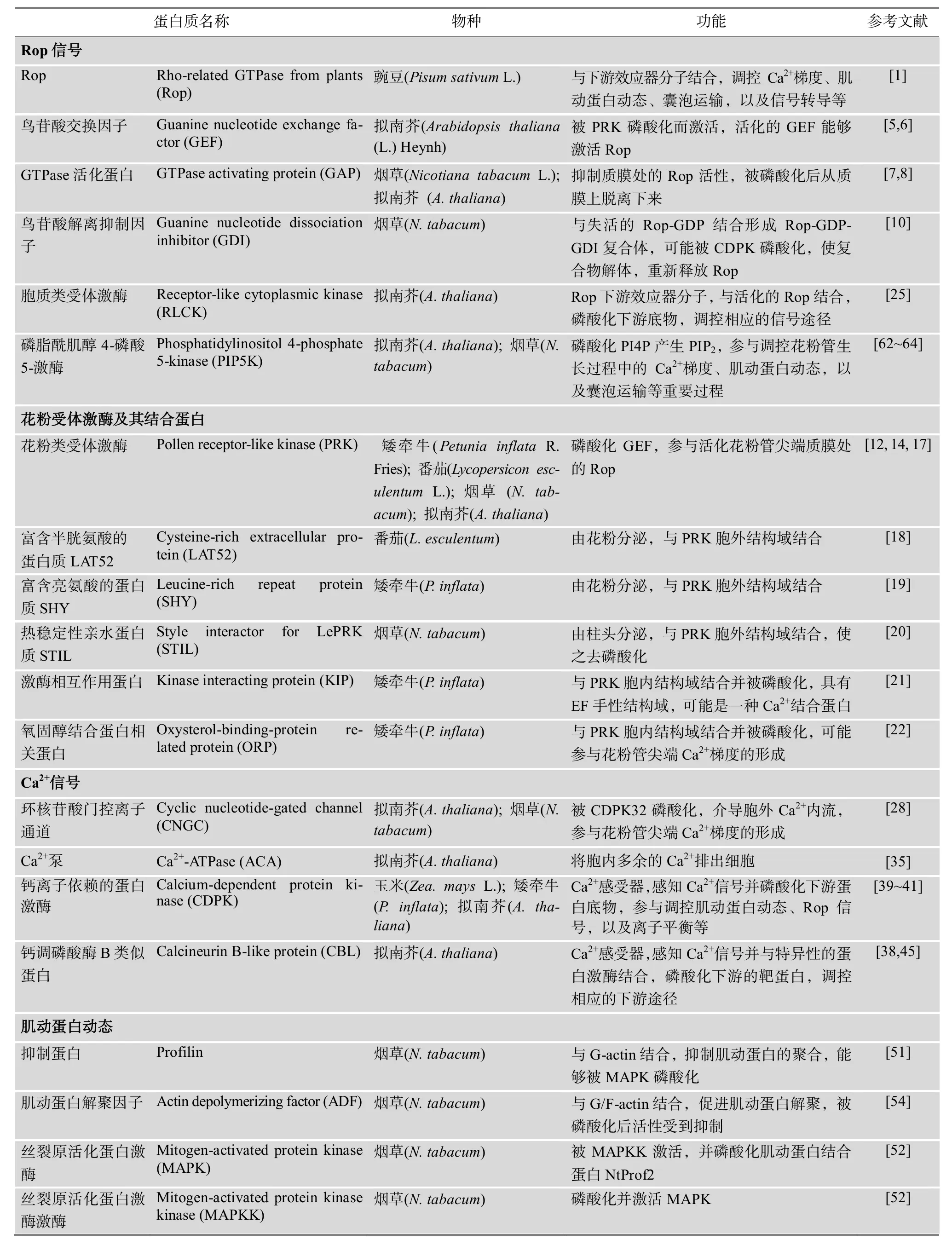
表1 与花粉管生长相关的磷酸化蛋白质
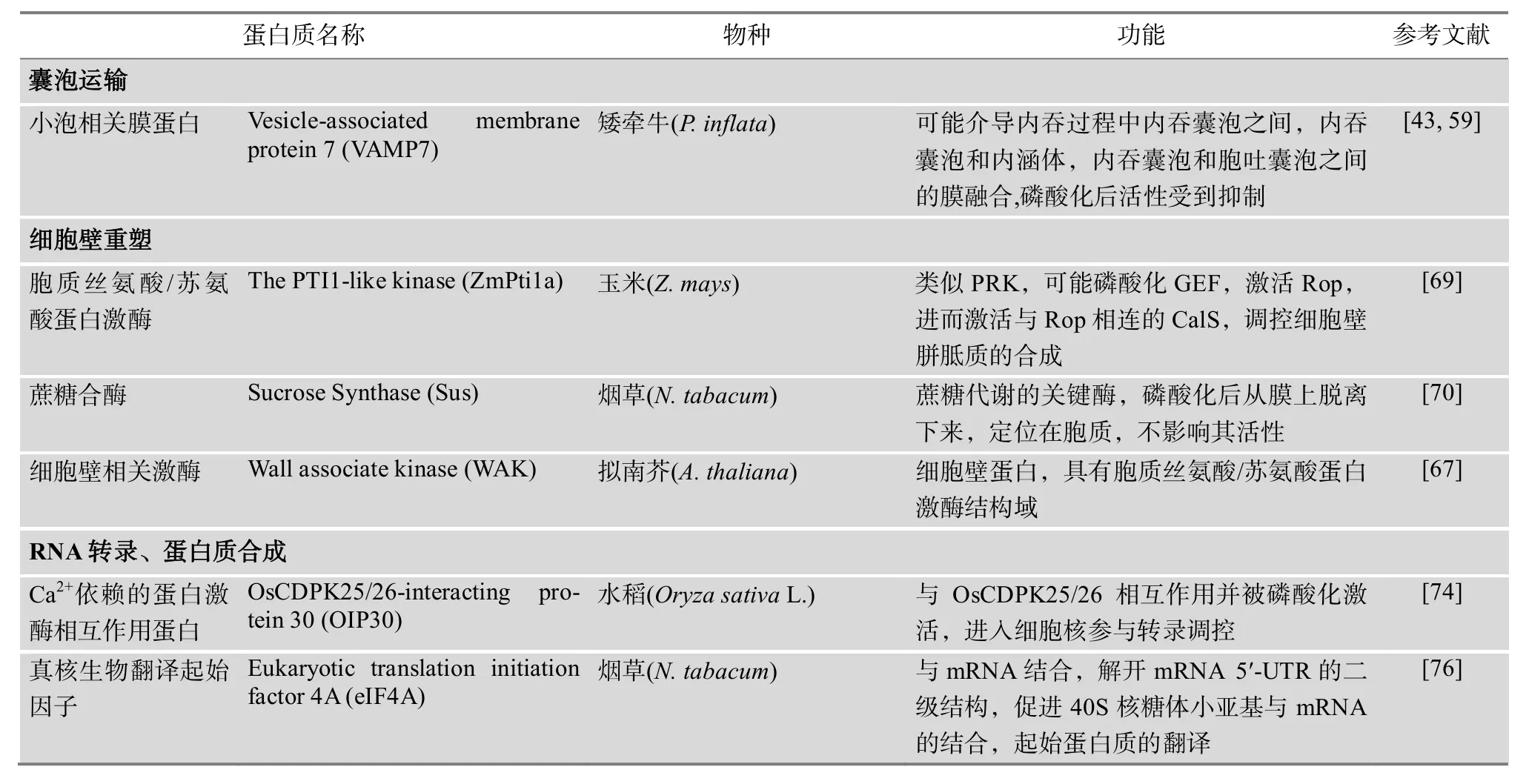
续表
GEF的活性受其 C-端可逆磷酸化作用的调节。植物 GEF都含有一个高度保守的 PRONE (Plantspecific Rop nucleotide exchanger)催化结构域和可变的N-/C-端区域,PRONE参与GDP从Rop-GDP上解离,而N-/C-端则用于调控GEF自身的活性[11]。GEF的 C-端磷酸化受花粉类受体激酶(Pollen receptor-like kinases, PRKs)的调节。研究发现,拟南芥 AtPRK2和 AtPRK2a以及番茄(Lycopersicon esculentumL.)LePRK2都能够与GEF的C-端相互作用并使之磷酸化,解除C-端对 GEF活性的抑制作用[12~14](图 1A)。对AtRopGEF12的定点突变表明,AtPRK2a的作用位点可能是S510[12];而AtPRK2对RopGEF1的磷酸化作用位点可能是C-端的S460和S480[14]。
多数花粉 PRKs都由胞外受体结构域、跨膜区和胞内激酶结构域组成。胞外受体结构域是一段富含亮氨酸的重复序列,能够与胞外配体结合,将胞外信号转导到胞内,并通过胞内激酶结构域自身磷酸化或磷酸化相应的靶蛋白,调控花粉管极性生长(图1 A)。另外,近膜区(Juxtamembrane, JM)和羧基端(Carboxy-terminal, CT)的非催化结构域可能参与受体激酶活性的调节。定点突变 LePRK2近膜区假定磷酸化结构域I上的S277/279/282,以及结构域II上的 S304/307和 T308,结果表明,结构域 I的磷酸化会降低激酶的磷酸化活性,抑制花粉管生长;而结构域II的磷酸化则能够增强激酶的磷酸化活性,促进花粉管生长。这两种结构域磷酸化状态之间存在动态平衡,共同调控花粉管的极性生长[15]。同样,AtPRK2的JM和CT非催化结构域对其与GEF的相互作用至关重要。若全长AtPRK2过表达,则突变体植株的花粉管生长异常(长度变短且尖端膨大变形),而 JM和 CT分别被删除或者两者同时被删除的AtPRK2过表达植株花粉管生长形态基本正常[16]。此外,JM和CT还能够参与调控PRK的质膜定位。荧光标记定位研究发现,野生型拟南芥植株中AtPRK2均匀分布在质膜上,在JM被删除或者JM和CT同时被删除的AtPRK2突变体中,AtPRK2在质膜上呈斑点状定位,或者错误定位到花粉管中运动的囊泡膜上[16]。
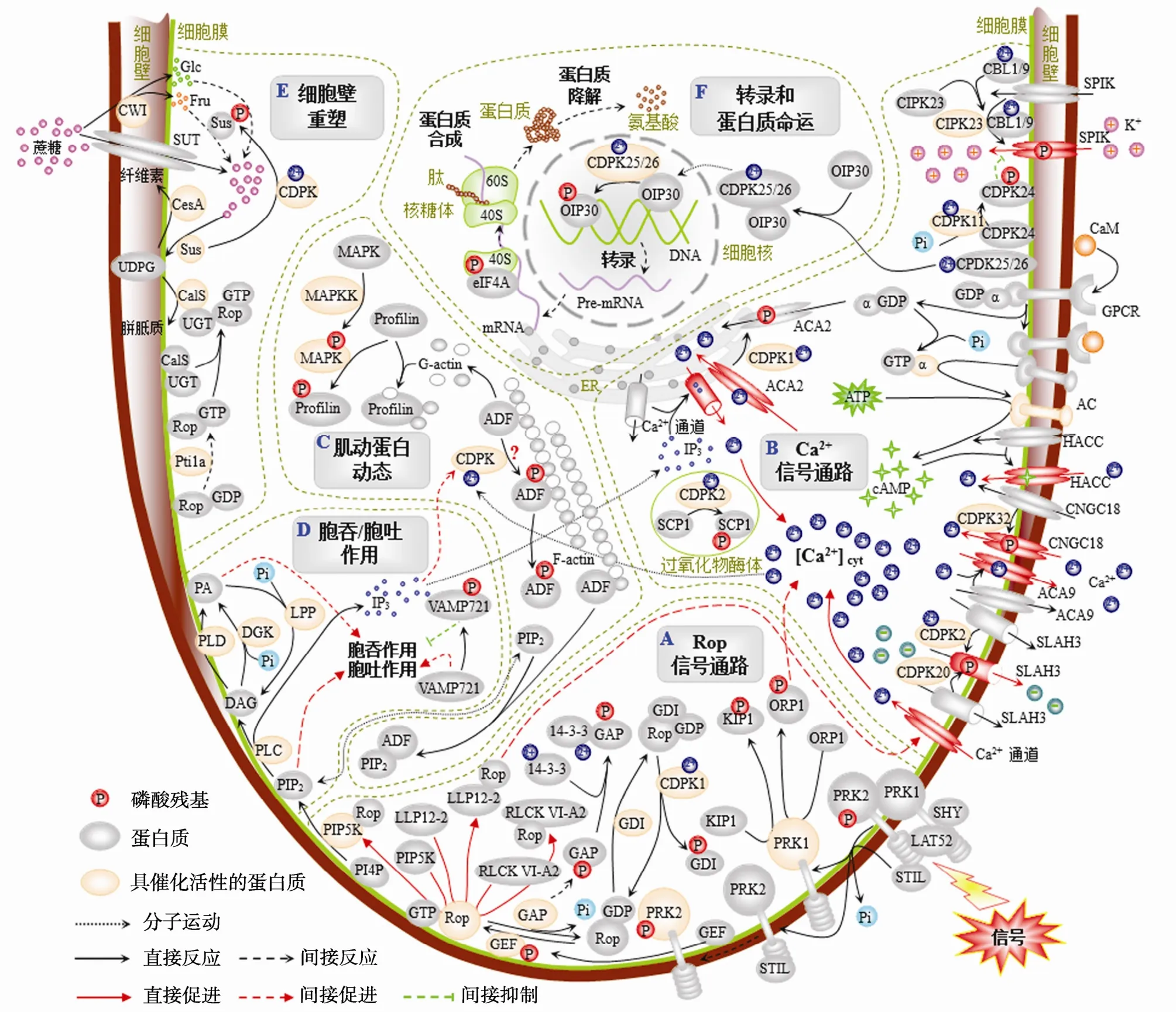
图1 花粉管极性生长过程中蛋白质可逆磷酸化参与的信号与代谢途径
目前,人们已经鉴定到多种 PRKs编码基因,如:拟南芥中的AtPRK2和AtPRK2a,矮牵牛(Petunia inflataR. Fries)中的PiPRK1,番茄中的LePRK1、LePRK2和LePRK3,以及玉米(Zea maysL.)中的ZmPRK1等[12,14,17]。在花粉水合前或水合过程中,LePRK1与处于磷酸化状态的 LePRK2结合形成复合体,定位于花粉管尖端的质膜处,并通过其胞外受体结构域与胞外配体(如 LAT52或 SHY)结合(图1A)。LAT52是富含半胱氨酸的蛋白质,SHY是富含亮氨酸重复序列(LRR)的蛋白质,二者都可以与LePRK2胞外结构域结合形成复合体[18,19]。花粉萌发后,LAT52与柱头提取物中的蛋白质 STIL竞争性地与 LePRK2结合,使 LePRK2去磷酸化,导致LePRKs-LAT52/SHY-STIL复合体解体释放出LePRKs单体[20]。从复合体中释放的LePRK2可能通过自身磷酸化作用被激活,同时其胞质激酶结构域能够磷酸化胞内的靶蛋白,并调控相应的下游途径,控制花粉管的生长。例如,AtPRK2a磷酸化胞内的GEF,参与花粉管尖端 Rop的活化[12]。此外,PiPRK1的两种胞内靶蛋白为激酶相互作用蛋白(Kinase interacting protein, PiKIP1)和氧化型胆固醇结合蛋白相关蛋白(Oxysterol-binding-protein related protein,PiORP1)[21,22](图 1A)。PiKIP1定位在花粉或花粉管胞质中,具有EF手性结构,可能是一种Ca2+结合蛋白。PiKIP1与 PiPRK1的胞质激酶结构域相互作用并被磷酸化。PiPRK1的K462位点对其发挥激酶活性十分重要。将K462突变成R462后,其与PiKIP1的结合和磷酸化能力都减弱。目前,这种受磷酸化调控的PiKIP1在花粉或花粉管中的具体功能还未见报道[21]。PiORP1在花粉管质膜上呈点状分布,与质膜上的PiPRK1相互作用并被磷酸化。PiORP1能够与质膜上的磷脂酰肌醇-4,5-二磷酸结合(Phosphatidylinositol 4,5-bisphosphate, PIP2),后者可参与磷脂酰肌醇信号通路介导的内质网Ca2+释放。因此,PiORP1很有可能通过磷酸化作用参与调控花粉管尖端 Ca2+梯度的形成,但具体的生理功能还有待研究[22]。
1.2 Rop GTPase下游效应器分子受磷酸化调节
受磷酸化调控的Rop通过其下游效应器分子调控花粉管极性生长(图1A)。目前,花粉中Rop下游效应器分子主要有以下3类:包含CRIB结构域的Rop相互作用蛋白(Rop-interactive CRIB motif-containing proteins, RICs)、胞质类受体激酶(Receptor-like cytoplasmic kinases, RLCK)和Rop相互作用蛋白(Rop interactive partner 1, RIP1/ICR1)[23~25]。这 3 类蛋白质分别能够调控花粉管生长过程中的肌动蛋白动态、囊泡运输、Ca2+梯度,以及信号转导等过程。目前只发现RICs和RLCK参与的途径受到蛋白质可逆磷酸化作用的调控。百合(Lilium longiflorumL.)花粉表达的LLP12-2是一种RIC蛋白,定位在花粉管尖端靠近质膜区域的胞质中,与活化形式的Rop结合后,能够激活花粉管尖端质膜处的Ca2+通道,促进Ca2+内流,参与调控花粉管尖端Ca2+梯度的形成(图1A)。LLP12-2过表达会导致花粉管尖端Ca2+浓度过高,从而抑制花粉管的生长。外源添加丝氨酸/苏氨酸蛋白激酶抑制剂能够缓解LLP12-2过表达对花粉管生长的抑制作用,这表明蛋白激酶可能通过调节 Ca2+信号参与此抑制过程。因为 Ca2+依赖的蛋白激酶、钙调磷酸酶,以及与其相互作用的蛋白激酶等,既可作为Ca2+的感受器,又能够参与调控Ca2+信号的下游途径。抑制这两种蛋白激酶的活性,则可防止过多Ca2+信号的传递,并减缓LLP12-2过表达对花粉管生长的抑制[26]。此外,与大多数受体激酶不同,RLCK仅具有羧基端的激酶结构域,没有明显的信号感知和跨膜结构域。研究发现,拟南芥 RLCK(AtRLCK VI-A2)能够与Rop GTPase结合并被激活,参与信号转导过程。然而,目前尚未发现受 AtRLCK VI-A2磷酸化调节的底物[25]。
2 蛋白质可逆磷酸化参与 Ca2+梯度形成以及Ca2+信号的调节
2.1 花粉管尖端 Ca2+梯度形成受蛋白质磷酸化作用调控
Ca2+作为细胞内重要的第二信使分子,在花粉管尖端形成一定的浓度梯度。Ca2+梯度主要通过质膜 Ca2+通道介导的胞外 Ca2+流入以及胞内贮存的Ca2+释放形成。胞外 Ca2+流入是胞内 Ca2+梯度的主要来源。在花粉管尖端质膜定位的 Ca2+通道中,超极化激活钙离子通道(Hyperpolarization-activated Ca2+channel, HACC)[27]和环核苷酸门控离子通道(Cyclic nucleotide-gated channel, CNGC)[28]的活性受蛋白质磷酸化调节(图 1 B)。HACC在钙调蛋白(Calmodulin, CaM)引发的cAMP信号通路的调节下被激活。在此通路中,胞外基质中的CaM可能通过与胞外具有 CaM 结合位点的 G蛋白偶联受体(G protein-coupled receptors, GPCRs)结合,并激活胞内的G蛋白。G蛋白α亚基与去磷酸化的GDP结合呈非活化状态,而与GDP磷酸化产生的GTP结合时被激活,被激活的 G蛋白 α亚基与腺苷酸环化酶(Adenylate cyclase, AC)结合并使之活化,将ATP去磷酸化转换为 cAMP,第二信使 cAMP能够与质膜处的Ca2+通道HACC结合,使之激活,介导胞内Ca2+梯度的形成[29](图 1B)。此外,花粉管质膜上的CNGCs也能够介导胞外 Ca2+的流入。植物 CNGCs是一类非选择性的阳离子通道,由保守的跨膜结构域、C-端环核苷酸结合结构域以及钙调蛋白结合结构域3部分组成[30]。花粉表达的CNGC18定位在花粉管后高尔基体囊泡和尖端质膜处,并且 CNGC18在质膜上的定位受Rop信号调控[28]。在花粉管生长过程中,CNGC18能够与CDPK32结合并被磷酸化。磷酸化激活CNGC18的通道蛋白活性,促使Ca2+内流,提升胞质Ca2+浓度[31](图1B)。
质膜离子通道介导的花粉管尖端 Ca2+浓度的增加能够激活胞内 Ca2+敏感的磷脂酰肌醇特异性磷脂酶C(Phospholipase C, PLC)的活性,从而引发磷脂酰肌醇信号通路介导的内质网Ca2+释放[32](图1:A、B和 D)。在此过程中,磷脂酰肌醇-4-磷酸-5激酶(Phosphatidylinositol-4-phosphate 5-kinase, PIP5K)与质膜处活化的Rop结合并被激活,被激活的PIP5K磷酸化质膜处的磷脂酰肌醇-4-磷酸(Phosphatidylinositol-4-phosphate, PI4P)产生 PIP2[33]。PIP2在活化的 PLC作用下,被水解产生磷脂酰肌醇-1,4,5-三磷酸(Inositol -1,4,5-trisphosphate, IP3),IP3是一种水溶性分子,通过细胞溶质扩散,结合并打开内质网膜上 IP3敏感的 Ca2+通道,引起 Ca2+释放,提升胞质Ca2+浓度[34]。
维持胞内适当的 Ca2+浓度对花粉管生长十分必要。植物Ca2+泵(Ca2+-ATPase,ACA)通过ATP去磷酸化水解产生ADP提供能量来介导胞内Ca2+的外排。Type-IIB型Ca2+泵——ACA9,定位于拟南芥花粉管质膜[35](图1B);另一种Type-IIA型内质网膜定位的Ca2+泵——ACA2,也被发现在花中表达(虽然尚未被定位于花粉管)。二者都可以与 Ca2+或 CaM 结合并被激活,将胞质中多余的 Ca2+排出细胞或泵回到内质网中,从而维持胞内适宜的Ca2+浓度[35,36]。ACA2的S45被CDPK1磷酸化后,将不能够与CaM结合,从而抑制 Ca2+泵的活性,维持花粉管尖端适宜的Ca2+浓度[37]。
2.2 Ca2+信号途径受蛋白激酶调节
花粉管尖端的Ca2+信号由Ca2+感受器感知,并转导引发下游系列反应,调控花粉管极性生长[38]。Ca2+感受器包括钙调蛋白(Calmodulin, CaM)、钙调蛋白类似蛋白(CaM-like, CML)、CDPK及钙调磷酸酶B类似蛋白(Calcineurin B-like protein, CBL)等。其中,CDPK、CBL及CBL相互作用蛋白激酶(CBL-interacting protein kinases, CIPKs)通过蛋白质磷酸化作用参与Ca2+信号的调节(图1 B)。CDPK包含一个CaM类似结构域和一个激酶结构域,结合Ca2+后被激活,被激活的CDPK通过其激酶结构域磷酸化下游靶蛋白,参与调控花粉管生长过程中肌动蛋白动态、Rop信号以及离子平衡等。例如,玉米中的ZmCDPK可能通过磷酸化相应的肌动蛋白结合蛋白,调控花粉管中肌动蛋白细胞骨架的动态变化[39](图1C)。定位在矮牵牛花粉管尖端质膜的PiCDPK1,可能磷酸化GDI,使之激活并参与 Rop信号调节[10]。同样,拟南芥 AtCDPK17和 AtCDPK34也定位在质膜,与PiCDPK1高度同源,可能同样通过磷酸化作用参与Rop活性的调节[40](图1A)。此外,CDPK还能够通过磷酸化作用调控花粉管质膜离子通道蛋白的活性,从而维持花粉管内的离子平衡。研究发现,AtCDPK11和AtCDPK24能够调节花粉管质膜上内向整流 K+通道(Shaker pollen inward K+channel,SPIK)的活性。AtCDPK11和AtCDPK24以复合体形式存在于花粉管质膜上,AtCDPK11与 Ca2+结合后被激活,并磷酸化AtCDPK24,磷酸化的AtCDPK24可能直接或间接作用于质膜上的 SPIK并负调控其K+通道活性,阻止花粉管胞外K+的内流,维持胞内适宜的 K+浓度[41](图 1B)。与之相似,花粉表达的AtCDPK2和AtCDPK20定位在花粉管尖端质膜,当花粉管尖端Ca2+浓度较高时,二者与Ca2+结合并被激活,被激活的 AtCDPK2和 AtCDPK20都能够磷酸化定位在花粉管尖端质膜上的阴离子(Cl-/NO3-)通道(Slow anion channel-associated, SLAH3),介导阴离子(Cl-或NO3-)外流,维持花粉管顶端生长所需的离子梯度[42](图1B)。另外,PiCDPK2定位于过氧化物酶体,能够与小 CDPK相互作用蛋白(Small CDPK- interacting protein1, PiSCP1)结合并使其S16和 S92磷酸化(图 1B),同时过表达 PiCDPK2和PiSCP1会抑制花粉管的生长,但其具体作用机制还不清楚[43,44]。
CBL作为Ca2+信号的感受器,与CIPKs相互作用形成复合体。感知 Ca2+信号后,CIPKs能够磷酸化下游靶蛋白,调控相应的下游途径[38]。目前,花粉中已鉴定到的 CBLs包括 AtCBL1、AtCBL9、AtCBL2以及AtCBL3等。其中,AtCBL1和AtCBL9参与调控花粉管内的离子平衡,尤其是调控K+平衡。研究发现,CBL1和CBL9平均分布在花粉管质膜处,在花粉管尖端 Ca2+浓度较高的区域被局部激活。被激活的 CBL1和 CBL9能够促进花粉萌发和花粉管生长过程中K+的吸收[45](图1B)。在拟南芥幼苗和根尖中,当胞内 K+浓度较低时,CBL1/9与胞质中的CIPK23结合使之锚定到质膜上,质膜定位的CIPK23能够磷酸化 shaker家族 K+通道 AKT1,磷酸化的AKT1激活其转运蛋白活性,促进K+的吸收[46]。并且,AKT1同源的shaker家族K+通道SPIK在花粉或花粉管中表达,若SPIK被破坏,突变体植株中K+的内向流动受到严重影响,并且花粉管的生长也受到抑制[47]。由此推测,花粉表达的 CBL1/9同样是通过磷酸化作用调控花粉管中SPIK的活性,进而调控花粉管生长过程中胞内K+的平衡(图1B)。此外,通过绿色荧光蛋白标记发现,AtCBL2和AtCBL3在花粉管中的定位随着花粉管的生长会呈现动态变化,但尚未发现与其相互作用的蛋白激酶CIPK[38]。
3 蛋白质磷酸化对肌动蛋白动态的调控
肌动蛋白细胞骨架可为花粉管胞质环流、细胞器运动以及囊泡运输提供分子轨道,对花粉管极性生长至关重要。肌动蛋白束的组装和去组装受到多种肌动蛋白结合蛋白的调节[48]。外源添加蛋白磷酸酶抑制剂会导致百合花粉管肌动蛋白细胞骨架分布异常,使花粉管生长失去极性[49,50],这表明肌动蛋白结合蛋白的活性可能受到磷酸化调节,从而调控肌动蛋白细胞骨架的动态变化。参与肌动蛋白解聚的 Profilin和肌动蛋白解聚因子/丝切蛋白(Actin depolymerizing factor/cofilin, ADF/cofilin) 家族中ADF的活性受磷酸化作用调控(图 1 C)。植物中多数 Profilin都含有一个丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)磷酸化结构域和一个 MAPK相互作用结构域(MAP kinase interaction motif, KIM)。对烟草 Profilin(NtProf2)的研究发现,当花粉水合后,烟草花粉表达的MAPKK(NtMEK2)能够磷酸化 MAPK(P45Ntf4和SIPK),被激活的P45Ntf4和SIPK能够磷酸化NtProf2的T114(图1 C)。然而,NtProf2的磷酸化对肌动蛋白细胞骨架动态的调节机制还有待研究[51,52]。ADF/cofilin的主要功能是通过水解ATP提供能量,促进肌动蛋白解聚。ADF/cofilin既能够与球状肌动蛋白(G-actin)结合,又能够与纤维状肌动蛋白(F-actin)结合,促使ADP-G-actin从肌动蛋白丝上解聚下来,加速肌动蛋白动态变化[53]。花粉表达的NtADF1以磷酸化和非磷酸化两种形式存在,S6磷酸化会抑制NtADF1的活性。如果将NtADF1的S6突变为没有磷酸化能力的 A6,NtADF1(S6A)的活性增加,然而将 S6突变成模拟磷酸化的 D6,NtADF1(S6D)活性受到抑制,不能与G/F-actin结合[54](图 1C)。NtADF1磷酸化与非磷酸化之间的动态平衡受Rop GTPase调控。过表达NtRac1会削弱NtADF1与肌动蛋白的结合能力,导致烟草花粉管的生长失去极性,花粉管尖端膨胀并且肌动蛋白细胞骨架分布异常,但不影响 NtADF1(S6A)与肌动蛋白的结合能力。过表达NtADF1(S6A)能够抵消NtRac1过表达产生的花粉管去极化生长的表型,但NtADF1(S6D)过表达无法抵消NtRac1过表达的表型[54]。Rop GTPase对ADF活性的调控可能通过膜磷脂PI4P和PIP2完成。Rop GTPase激活PIP5K的蛋白激酶活性,PIP5K磷酸化PI4P产生PIP2。PIP2被质膜处的PLC水解产生IP3,IP3诱导花粉管尖端Ca2+梯度的形成,并可能通过下游CDPK调控ADF磷酸化与非磷酸化状态的动态平衡(图 1C)。研究表明,非花粉表达的ZmADF3的S6被CDPK磷酸化,但花粉中ADF磷酸化是否受CDPK调控,以及CDPK是否直接磷酸化ADF,或者CDPK通过磷酸化其他蛋白质来间接磷酸化ADF,都有待进一步研究[55]。另外,PIP2也能跟肌动蛋白竞争性地与ADF结合,当ADF与PIP2结合后,则不能与肌动蛋白结合,进而影响肌动蛋白的动态平衡[56]。此外,Rop下游效应器分子RIC4很有可能通过调节某种激酶使ADF磷酸化,从而抑制肌动蛋白解聚。若过表达RIC4与荧光标记的ADF,ADF则不再与肌动蛋白相互作用,荧光信号大部分在胞质中被检测到。但RIC4下游的激酶以及具体的磷酸化机制还有待验证[57]。
4 蛋白质磷酸化对囊泡运输的调节
在极性生长的花粉管中,分泌囊泡在倒喷泉式的胞质环流驱动下,沿着花粉管两侧运输到尖端呈倒锥型密集分布,通过极性胞吐作用为花粉管细胞膜与细胞壁的生长提供原料[58],而胞吞作用可以介导多余膜组分与细胞壁材料等的回收再利用,还能够吸收营养成分以及柱头分泌的信号分子,实现胞内外物质和信号的交流[58]。极性的胞吞/胞吐作用是在时空上相互关联的周期性调控过程。在此过程中,蛋白质可逆磷酸化参与调节胞吞/胞吐相关蛋白质的活性,还能够调控质膜的磷脂代谢(图1 D)。
花粉中已鉴定到了多种胞吞/胞吐相关蛋白质。其中,VAMP721和VAMP726是矮牵牛花粉表达的两种小泡相关膜蛋白(Vesicle-associated membrane protein 7, VAMP7),属于 SNARE(Soluble N-ethylmaleimide-sensitive factor attachment protein receptor)蛋白家族。研究表明,PiVAMP721和 PiVAMP726定位在花粉管顶端的运输囊泡,介导内吞过程中内吞囊泡之间,内吞囊泡和内涵体,内吞囊泡和胞吐囊泡之间的膜融合[43,59]。PiVAMP721的活性受磷酸化作用的负调控(图 1D)。位于 PiVAMP721的 N-端结构域上的S42可能是一个潜在的磷酸化位点,将S42突变为没有磷酸化能力的A42后,PiVAMP721的膜融合能力显著增强,突变体的花粉管长度较短。而将 S42突变为模拟磷酸化的 E42后,PiVAMP721的膜融合能力明显降低,突变体的花粉管长度也显著增长[43]。
极性胞吞/胞吐作用受多种因素调节,包括花粉管中肌动蛋白动态、Ca2+梯度、Rop GTPase以及磷脂酰肌醇等[60,61]。其中,蛋白质可逆磷酸化作用可以通过调节质膜上PIP2及其代谢产物磷脂酸(Phosphatidic acid, PA)的代谢过程,参与调控花粉管生长过程中的极性胞吞/胞吐作用(图1D)。研究发现,PIP2不仅能够参与花粉管尖端的胞吐作用,还能够参与调控网格蛋白介导的胞吞过程。若过表达定位于花粉管尖端质膜的AtPIP5K4、AtPIP5K5和NtPIP5K6,都会导致花粉管质膜产生过多的 PIP2,造成胞吐作用过度发生,使得花粉管尖端果胶沉积过多,细胞壁增厚。过多的PIP2还会导致内吞作用过度发生,造成花粉管尖端质膜大量内陷且严重变形[62~64]。此外,PIP2还能够被体内的 PLC水解产生二酰甘油(Diacylglycerol,DAG),DAG可被二酰甘油激酶(Diacylglycerol kinases, DGKs)磷酸化产生 PA,同时磷脂酶 D(Phospholipase D, PLD)也能够直接水解DAG产生PA。PA在脂质磷酸磷酸酶(Lipid phosphate phosphatases, LPPs)的作用下,去磷酸化重新生成DAG(图1D)。在烟草花粉管中,PA能够参与分泌囊泡与质膜的融合过程。如果抑制PLD的水解酶和DGK的激酶活性,会阻碍PA的合成,减少烟草花粉管中分泌囊泡与质膜的融合、破坏尖端果胶的沉积并抑制花粉管的生长,而抑制LPP的磷酸酶活性,会导致PA积累,促进胞吐作用并有利于花粉管生长[65]。
5 蛋白质磷酸化调控花粉管细胞壁重塑
花粉管顶端生长依赖于细胞壁材料及其前体物质向尖端运输,细胞壁重塑是花粉管极性生长的前提[66]。多数植物花粉管细胞壁外层由机械强度较高的果胶层组成,内层主要由胼胝质沉积而成;此外,花粉管细胞壁还包含少量纤维素和半纤维素,根据物种的不同,二者或者与果胶层相连,或者与胼胝质层相连,或者形成介于果胶层和胼胝质层之间独立的第三层[67,68]。花粉中已鉴定到多种细胞壁重塑相关的蛋白质,这些蛋白质主要参与果胶合成与修饰、纤维素与胼胝质合成、蔗糖合成等过程。其中,细胞壁相关激酶(Wall associate kinase, WAK)是一种细胞壁蛋白质,利用跨膜结构域与细胞壁果胶层共价相联。在花粉管生长过程中,可能通过胞质激酶结构域磷酸化下游底物参与调控相应的信号转导过程[67]。此外,蛋白质磷酸化/去磷酸化也能够调节胞质丝氨酸/苏氨酸蛋白激酶(The PTI1-like kinase, ZmPti1a)和蔗糖合酶(Sucrose synthase, Sus)在花粉管中的功能以及分布模式,参与花粉管细胞壁重塑[69,70](图1 E)。
花粉管细胞壁胼胝质的合成主要受胼胝质合酶(Callose synthase, CalS)催化,研究发现,植物中CalS与UDP-葡萄糖转移酶(UDP-glucose transferase,UGT)结合并形成复合体,受PRK2激活的Rop-GTPase通过与UGT结合,进而激活CalS[71]。ZmPti1a编码一种胞质丝氨酸/苏氨酸蛋白激酶,与PRK相似,既能够发生自身磷酸化,又可作为其他蛋白激酶的底物(图1E)。在花粉萌发过程中,ZmPti1a特异性定位于花粉或花粉管质膜胼胝质沉积处,Herrmann等[69]推测ZmPti1a能够利用其胞质激酶结构域调控CalS的活性,参与花粉管细胞壁胼胝质合成。
Sus是蔗糖代谢的关键酶之一,催化二磷酸尿苷(Uridine diphosphate, UDP)和蔗糖生成果糖和UDP-葡萄糖(UDP-glucose, UDPG)的可逆反应。植物中Sus以磷酸化和非磷酸化两种形式存在,并且定位不同。非磷酸化的 Sus与膜相连,磷酸化会降低 Sus表面疏水性,使其从膜上脱离下来游离到胞质中[72](图 1E)。花粉管生长过程中,外界蔗糖被细胞壁蔗糖酶(Cell wall invertase, CWI)水解成葡萄糖和果糖,或者被质膜上的蔗糖转运蛋白(Sucrose transporter,SUT)直接转运到花粉管内。葡萄糖和果糖在胞质非磷酸化状态的 Sus作用下重新合成蔗糖,游离的蔗糖又会被与膜相连的磷酸化形式的 Sus裂解产生UDP-葡萄糖,UDP-葡萄糖则可作为胼胝质和纤维素合成的前体物质,参与花粉管细胞壁的构建[70](图1E)。玉米叶片蛋白质组学研究发现,Sus的 S15被CDPK磷酸化[73]。但花粉中调控 Sus磷酸化的激酶以及潜在磷酸化位点的鉴定都还有待进一步研究。
6 蛋白质磷酸化对基因表达与蛋白质命运的调节
有研究认为花粉管生长所需的蛋白质来源于成熟花粉中贮存的mRNA[74],但也有研究认为成熟花粉中贮存的mRNA不足以满足不断生长的花粉管的需求,需要新合成mRNA[75]。在花粉中已经鉴定到了参与转录调控的多种转录因子和 Ca2+依赖的蛋白激酶相互作用蛋白(OsCPDK25/26-interacting protein 30, OIP30)。其中,水稻(Oryza sativaL.)花粉中表达的 OIP30是一种受 OsCDPK25/26磷酸化调节的DNA解旋酶,定位于细胞质,而OsCDPK25/26既具有膜定位相关的豆蔻酰化信号又具有核定位信号。在花粉管生长过程中,定位在膜上的OsCDPK25/26感知Ca2+信号后被激活,与OIP30结合并从膜上水解下来,携带OIP30进入细胞核。OsCDPK25/26将其磷酸基团转移给OIP30使其磷酸化,激活OIP30的解旋酶和ATPase活性,参与转录调控[74](图1 F)。
此外,在花粉中也鉴定到了参与蛋白质合成和降解相关的蛋白质。其中,真核生物翻译起始因子4A(Eukaryotic translation initiation factor 4A, eIF4A)属于 RNA解旋酶 DEAD-box 家族,是翻译起始因子复合体eIF4F(包括eIF4A、eIF4E、以及eIF4G)的一个亚基,能够与起始因子eIF4B或eIF4H相互作用,后两者能够增强eIF4A的解旋酶活性。在蛋白质翻译起始阶段,eIF4A利用ATP水解提供能量,解开mRNA 5′-UTR的二级结构,促进40S核糖体小亚基与 mRNA结合,启动蛋白质翻译过程(图 1F)。eIF4A8是花粉中特异性表达的eIF4A的一个亚型,在花粉萌发过程中,eIF4A8的苏氨酸残基被磷酸化[76],然而磷酸化对eIF4A8的活性及功能的调节还不清楚。
7 结语与展望
花粉管极性生长是植物有性生殖的重要环节,可逆磷酸化作用作为生物体内最为普遍和重要的蛋白质翻译后修饰方式之一,对花粉管极性生长的调节受到人们越来越广泛的关注。人们已经利用分子生物学与遗传学手段研究并发现了花粉管生长过程中多种受磷酸化调节的蛋白质,并对潜在的磷酸化位点进行了验证,明确了花粉管生长过程中磷酸化作用对蛋白质活性、功能与分布模式的调节,为认识花粉管极性生长的分子机制提供了新的信息。
花粉管的极性生长受多种信号和代谢过程共同调控,包括Rop GTPase信号途径、磷脂酰肌醇信号通路、Ca2+信号、肌动蛋白动态变化、囊泡运输、细胞壁重塑等,每个过程都极为复杂,并且各个过程之间也存在着时空上的相互联系。目前已经发现的磷酸化相关蛋白质还远不能清晰地解释花粉管极性生长的复杂调控网络。磷酸化蛋白质组学作为高通量的蛋白质翻译后修饰的研究手段,为深入分析花粉蛋白质磷酸化提供了重要信息。今后,进一步利用磷酸化蛋白质组学、分子生物学及遗传学等技术策略深入分析花粉管极性生长过程中蛋白质的磷酸化状态及其相关的调控机制,将为揭示花粉管极性生长的分子机制提供新的证据。
[1]Qin Y, Yang ZB. Rapid tip growth: insights from pollen tubes.Semin Cell Dev Biol, 2011, 22(8): 816–824.
[2]Chen YM, Liu P, Hoehenwarter W, Lin JX. Proteomic and phosphoproteomic analysis ofPicea wilsoniipollen development under nutrient limitation.J Proteome Res, 2012,11(8): 4180–4190.
[3]Fíla J, Matros A, Radau S, Zahedi RP, Čapková V, Mock HP, Honys D. Revealing phosphoproteins playing role in tobacco pollen activatedin vitro.Proteomics, 2012,12(21): 3229–3250.
[4]Mayank P, Grossman J, Wuest S, Boisson-Dernier A, Roschitzki B, Nanni P, Nühse T, Grossniklaus U. Characterization of the phosphoproteome of matureArabidopsispollen.Plant J, 2012, 72(1): 89–101.
[5]Gu Y, Li SD, Lord EM, Yang ZB. Members of a novel class ofArabidopsisRho guanine nucleotide exchange factors control Rho GTPase-dependent polar growth.Plant Cell, 2006, 18(2): 366–381.
[6]Li ZX, Liu D. ROPGEF1 and ROPGEF4 are functional regulators of ROP11 GTPase in ABA-mediated stomatal closure inArabidopsis.FEBS Lett, 2012, 586(9): 1253–1258.
[7]Hwang JU, Wu G, Yan A, Lee YJ, Grierson CS, Yang ZB.Pollen-tube tip growth requires a balance of lateral propagation and global inhibition of Rho-family GTPase activity.J Cell Sci, 2010, 123(3): 340–350.
[8]Klahre U, Kost B. Tobacco RhoGTPase ACTIVATING PROTEIN1 spatially restricts signaling of RAC/Rop to the apex of pollen tubes.Plant Cell, 2006, 18(11): 3033–3046.
[9]Yoon GM, Dowd PE, Gilroy S, McCubbin AG. Calcium-dependent protein kinase isoforms inPetuniahave distinct functions in pollen tube growth, including regulating polarity.Plant Cell, 2006, 18(4): 867–878.
[10]Klahre U, Becker C, Schmitt AC, Kost B. Nt-RhoGDI2 regulates Rac/Rop signaling and polar cell growth in tobacco pollen tubes.Plant J, 2006, 46(6): 1018–1031.
[11]Berken A., Thomas C, Wittinghofer A. A new family of RhoGEFs activates the Rop molecular switch in plants.Nature, 2005, 436(7054): 1176–1180.
[12]Zhang Y, McCormick S. A distinct mechanism regulating a pollen-specific guanine nucleotide exchange factor for the small GTPase Rop inArabidopsis thaliana.Proc Natl Acad Sci USA, 2007, 104(47): 18830–18835.
[13]Zhang D, Wengier D, Shuai B, Gui CP, Muschietti J,McCormick S, Tang WH. The pollen receptor kinase LePRK2 mediates growth-promoting signals and positively regulates pollen germination and tube growth.Plant Physiol, 2008, 148(3): 1368–1379.
[14]Chang F, Gu Y, Ma H, Yang ZB. AtPRK2 promotes ROP1 activation via RopGEFs in the control of polarized pollen tube growth.Mol Plant, 2013, 6(4): 1187–1201.
[15]Salem T, Mazzella A, Barberini ML, Wengier D, Motillo V, Parisi G, Muschietti J. Mutations in two putative phosphorylation motifs in the tomato pollen receptor kinase LePRK2 show antagonistic effects on pollen tube length.J Biol Chem, 2011, 286(6): 4882–4891.
[16]Zhao XY, Wang Q, Li S, Ge FR, Zhou LZ, McCormick S,Zhang Y. The juxtamembrane and carboxy-terminal domains ofArabidopsisPRK2 are critical for ROP-induced growth in pollen tubes.J Exp Bot, 2013, 64(18): 5599–5610.
[17]Mu JH, Lee HS, Kao TH. Characterization of a pollen-expressed receptor-like kinase gene ofPetunia inflataand the activity of its encoded kinase.Plant Cell, 1994,6(5): 709–721.
[18]Tang W, Ezcurra I, Muschietti J, McCormick S. A cysteine-rich extracellular protein, LAT52, interacts with the extracellular domain of the pollen receptor kinase LePRK2.Plant Cell, 2002, 14(9): 2277–2287.
[19]Guyon V, Tang WH, Monti MM, Raiola A, Lorenzo GD,McCormick S, Taylor LP. Antisense phenotypes reveal a role for SHY, a pollen-specific Leucine-rich repeat protein,in pollen tube growth.Plant J, 2004, 39(4): 643–654.
[20]Wengier DL, Mazzella MA, Salem TM, McCormick S,Muschietti JP. STIL, a peculiar molecule from styles, specifically dephosphorylates the pollen receptor kinase LePRK2 and stimulates pollen tube growthin vitro.BMC Plant Biol, 2010, 10(1): 33.
[21]Skirpan AL, McCubbin AG, Ishimizu T, Wang X, Hu Y,Dowd PE, Ma H, Kao TH. Isolation and characterization of kinase interacting protein 1, a pollen protein that interacts with the kinase domain of PRK1, a receptor-like kinase ofpetunia.Plant Physiol, 2001, 126(4): 1480–1492.
[22]Skirpan AL, Dowd PE, Sijacic P, Jaworski CJ, Gilroy S,Kao TH. Identification and characterization of PiORP1, aPetuniaoxysterol-binding-protein related protein involved in receptor-kinase mediated signaling in pollen, and analysis of the ORP gene family inArabidopsis.Plant Mol Biol, 2006, 61(4–5): 553–565.
[23]Wu G, Gu Y, Li SD, Yang ZB. A genome-wide analysis ofArabidopsisRop-interactive CRIB motif-containing proteins that act as Rop GTPase targets.Plant Cell, 2001,13(12): 2841–2856.
[24]Li S, Gu Y, Yan A, Lord E, Yang ZB. RIP1 (ROP Interactive Partner 1)/ICR1 marks pollen germination sites and may act in the ROP1 pathway in the control of polarized pollen growth.Mol Plant, 2008, 1(6): 1021–1035.
[25]Jurca ME. Characterization of ROP GTPase-activatedArabidopsisreceptor-like cytoplasmic kinases (RLCK class VI_A). Hungary: Hungarian Academy of Sciences,2011.
[26]Hsu, SW, Wang CS. Lily Cdc42/Rac-interactive binding motif-containing protein, a Rop target, involves calcium influx and phosphoproteins during pollen germination and tube growth.Plant Signal Behav, 2010, 5(11): 1460–1463.
[27]Qu HY, Shang ZL, Zhang SL, Liu LM, Wu JY. Identification of hyperpolarization-activated calcium channels in apical pollen tubes ofPyrus pyrifolia.New Phytol, 2007,174(3): 524–536.
[28]Chang F, Yan A, Zhao LN, Wu WH, Yang ZB. A putative calcium-permeable cyclic nucleotide-gated channel, CNGC18,regulates polarized pollen tube growth.J Integr Plant Biol,2007, 49(8): 1261–1270.
[29]Wu YS, Xu XD, Li SJ, Liu T, Ma LG, Shang ZG. Heterotrimeric G-protein participation inArabidopsispollen germination through modulation of a plasma membrane hyperpolarization-activated Ca2+-permeable channel.New Phytol, 2007, 176(3): 550–559.
[30]Kaupp UB, Seifert R. Cyclic nucleotide-gated ion channels.PhysiolRev, 2002, 82(3): 769–824.
[31]Zhou LM, Lan WZ, Jiang YQ, Fang W, Luan S. A Calcium-dependent protein kinase interacts with and activates a calcium channel to regulate pollen tube growth.Mol Plant, 2013, 7(2): 369–376.
[32]Franklin-Tong VE, Drobak BK, Allan AC, Watkins P,Trewavas AJ. Growth of pollen tubes ofPapaver rhoeasis regulated by a slow-moving calcium wave propagated by inositol 1, 4, 5-trisphosphate.PlantCell, 1996, 8(8): 1305–1321.
[33]Kost B, Lemichez E, Spielhofer P, Hong Y, Tolias K,Carpenter C, Chua NH. Rac homologues and compartmentalized phosphatidylinositol 4, 5-bisphosphate act in a common pathway to regulate polar pollen tube growth.J Cell Biol, 1999, 145(2): 317–330.
[34]Monteiro D, Liu Q, Lisboa S, Scherer GE, Quader H,Malhó R. Phosphoinositides and phosphatidic acid regulate pollen tube growth and reorientation through modulation of [Ca2+]cand membrane secretion.J Exp Bot, 2005,56(416): 1665–1674.
[35]Schiøtt M, Romanowsky SM, Bækgaard L, Jakobsen MK,Palmgren MG, Harper JF. A plant plasma membrane Ca2+pump is required for normal pollen tube growth and fertilization.Proc Natl Acad Sci USA, 2004, 101(25): 9502–9507.
[36]Harper JF, Hong B, Hwang I, Guo HQ, Stoddard R, Huang JF, Palmgren MG, Sze H. A novel calmodulin-regulated Ca2+-ATPase (ACA2) fromArabidopsiswith an N-terminal autoinhibitory domain.J Biol Chem, 1998, 273(2):1099–1106.
[37]Hwang I, Sze H, Harper JF. A calcium-dependent protein kinase can inhibit a calmodulin-stimulated Ca2+pump(ACA2) located in the endoplasmic reticulum ofArabidopsis.Proc Natl Acad Sci USA, 2000, 97(11): 6224–6229.
[38]Zhou LM, Fu Y, Yang ZB. A genome-wide functional characterization ofArabidopsisregulatory calcium sensors in pollen tubes.J Integr Plant Biol, 2009, 51(8): 751–761.
[39]Estruch JJ, Kadwell S, Merlin E, Crossland L. Cloning and characterization of a maize pollen-specific calcium-dependent calmodulin-independent protein kinase.Proc Natl Acad Sci USA, 1994, 91(19): 8837–8841.
[40]Myers C, Romanowsky SM, Barron YD, Garg S, Azuse CL, Curran A, Davis RM, Hatton J, Harmon AC, Harper JF. Calcium-dependent protein kinases regulate polarized tip growth in pollen tubes.Plant J, 2009, 59(4): 528–539.
[41]Zhao LN, Shen LK, Zhang WZ, Zhang W, Wang Y, Wu WH. Ca2+-dependent protein kinase11 and 24 modulate the activity of the inward rectifying K+channels inArabidopsispollen tubes.Plant Cell, 2013, 25(2): 649–661.
[42]Gutermuth T, Lassig R, Portes MT, Maierhofer T, Romeis T, Borst JW, Hedrich R, Feijó JA, Konrad KR. Pollen tube growth regulation by free anions depends on the interaction between the anion channel SLAH3 and calcium-dependent protein kinases CPK2 and CPK20.Plant Cell, 2013,25(11): 4525–4543.
[43]Guo F. Investigation into the functions of the pollen specific genes PiVAMP721 and PiSCP1 in pollen tube growth.Washington: Washington State University, 2008.
[44]Guo F, Yoon GM, McCubbin AG. PiSCP1 and PiCDPK2 Localize to peroxisomes and are involved in pollen tube growth inPetunia Inflata.Plants, 2013, 2(1): 72–86.
[45]Mähs A, Steinhorst L, Han JP, Shen LK, Wang Y, Kudla J.The Calcineurin B-like Ca2+sensors CBL1 and CBL9 function in pollen germination and pollen tube growth inArabidopsis.Mol Plant, 2013, 6(4): 1149–1162.
[46]Xu J, Li HD, Chen LQ, Wang Y, Liu LL, He L, Wu WH.A protein kinase, interacting with two calcineurin B-like proteins, regulates K+transporter AKT1 inArabidopsis.Cell, 2006, 125(7): 1347–1360.
[47]Mouline K, Véry AA, Gaymard F, Boucherez J, Pilot G,Devic M, Bouchez D, Thibaud JB, Sentenac H. Pollen tube development and competitive ability are impaired by disruption of a Shaker K+channel inArabidopsis.Genes Dev, 2002, 16(3): 339–350.
[48]Ren HY, Xiang Y. The function of actin-binding proteins in pollen tube growth.Protoplasma, 2007, 230(3–4): 171–182.
[49]Foissner I, Grolig F, Obermeyer G. Reversible protein phosphorylation regulates the dynamic organization of the pollen tube cytoskeleton: effects of calyculin A and okadaic acid.Protoplasma, 2002, 220(1–2): 1–15.
[50]Zi HJ, Xiang Y, Li M, Wang T, Ren HY. Reversible protein tyrosine phosphorylation affects pollen germination and pollen tube growth via the actin cytoskeleton.Protoplasma, 2007, 230(3–4): 183–191.
[51]Limmongkon A, Giuliani C, Valenta R, Mittermann I,Heberle-Bors E, Wilson C. MAP kinase phosphorylation of plant profilin.Biochem Bioph Res Commun, 2004, 324(1):382–386.
[52]Voronin V, Aionesei T, Limmongkon A, Barinova I, Touraev A, Laurière C, Coronado MJ, Testillano PS, Risueño MC, Heberle-Bors E, Wilson C. The MAP kinase kinase NtMEK2 is involved in tobacco pollen germination.FEBS Lett, 2004, 560(1): 86–90.
[53]Carlier MF, Laurent V, Santolini J, Melki R, Didry D, Xia GX, Hong Y, Chua NH, Pantaloni D. Actin depolymerizing factor (ADF/cofilin) enhances the rate of filament turnover: implication in actin-based motility.J Cell Biol,1997, 136(6): 1307–1322.
[54]Chen CY, Cheung AY, Wu HM. Actin-depolymerizing factor mediates Rac/Rop GTPase–regulated pollen tube growth.Plant Cell, 2003, 15(1): 237–249.
[55]Allwood EG, Smertenko AP, Hussey PJ. Phosphorylation of plant actin-depolymerising factor by calmodulin-like domain protein kinase.FEBS Lett, 2001, 499(1–2): 97–100.
[56]Ischebeck T, Stenzel I, Hempel F, Jin X, Mosblech A,Heilmann I. Phosphatidylinositol-4, 5-bisphosphate influences Nt-Rac5-mediated cell expansion in pollen tubes ofNicotiana tabacum.Plant J, 2011, 65(3): 453–468.
[57]Chudnovskiy A. Analysis of an Actin Binding Guanine Exchange Factor, GEF8, and Actin depolymerizing factor inArabidopsis Thaliana. America: University of Massachusetts Amherst, 2010.
[58]Derksen J, Rutten T, Lichtscheidl IK, de Win AHN, Pierson ES, Rongen G. Quantitative analysis of the distribution of organelles in tobacco pollen tubes: implications for exocytosis and endocytosis.Protoplasma, 1995, 188(3–4):267–276.
[59]Guo F, McCubbin AG. The pollen-specific R-SNARE/longin PiVAMP726 mediates fusion of endo-and exocytic compartments in pollen tube tip growth.J Exp Bot, 2012,63(8): 3083–3095.
[60]Zhang Y, McCormick S. The regulation of vesicle trafficking by small GTPases and phospholipids during pollen tube growth.Sex Plant Reprod, 2010, 23(2): 87–93.
[61]Zhang Y, He J, Lee D, McCormick S. Interdependence of endomembrane trafficking and actin dynamics during polarized growth ofArabidopsispollen tubes.Plant Physiol,2010, 152(4): 2200–2210.
[62]Ischebeck T, Stenzel I, Heilmann I. Type B phosphatidylinositol-4-phosphate 5-kinases mediateArabidopsisandNicotiana tabacumpollen tube growth by regulating apical pectin secretion.Plant Cell, 2008, 20(12): 3312–3330.
[63]Sousa E, Kost B, Malhó R.Arabidopsisphosphatidylinositol-4-monophosphate 5-kinase 4 regulates pollen tube growth and polarity by modulating membrane recycling.Plant Cell, 2008, 20(11): 3050–3064.
[64]Zhao Y, Yan A, Feijó JA, Furutani M, Takenawa T,Hwang I, Fu Y, Yang Z. Phosphoinositides regulate clathrin-dependent endocytosis at the tip of pollen tubes inArabidopsisand tobacco.Plant Cell, 2010, 22(12): 4031–4044.
[65]Pleskot R, Pejchar P, Bezvoda R, Lichtscheidl IK, Wolters-Arts M, Marc J, Žárský V, Potocký M. Turnover of phosphatidic acid through distinct signaling pathways affects multiple aspects of pollen tube growth in tobacco.Front Plant Sci, 2012, 3: 54.
[66]Mollet JC, Leroux C, Dardelle F, Lehner A. Cell wall composition, biosynthesis and remodeling during pollen tube growth.Plants, 2013, 2(1): 107–147.
[67]Geitmann A, Steer MW. The Architecture and Properties of the Pollen Tube Cell Wall. In: Malhó R, ed. The Pollen Tube: a Cellular and Molecular Perspective. Berlin:Springer, 2006, 3: 177–200.
[68]Krichevsky A, Kozlovsky SV, Tian GW, Chen MH,Zaltsman A, Citovsky V. How pollen tubes grow.Dev Biol,2007, 303(2): 405–420.
[69]Herrmann MM, Pinto S, Kluth J, Wienand U, Lorbiecke R.The PTI1-like kinase ZmPti1a from maize (Zea maysL.)co-localizes with callose at the plasma membrane of pollen and facilitates a competitive advantage to the male gametophyte.BMC Plant Biol, 2006, 6: 22.
[70]Persia D, Cai G, Del Casino C, Faleri C, Willemse MTM,Cresti M. Sucrose synthase is associated with the cell wall of tobacco pollen tubes.Plant Physiol, 2008, 147(4):1603–1618.
[71]Verma DPS, Hong ZL. Plant callose synthase complexes.Plant Mol Biol, 2001, 47(6): 693–701.
[72]Winter H, Huber JL, Huber SC. Membrane association of sucrose synthase changes during the graviresponse and possible control by protein phosphorylation.FEBS Lett,1997, 420(2–3): 151–155.
[73]Hardin SC, Winter H, Huber SC. Phosphorylation of the amino terminus of maize sucrose synthase in relation to membrane association and enzyme activity.Plant Physiol,2004, 134(4): 1427–1438.
[74]Wang CW, Chen WC, Lin LJ, Lee CT, Tseng TH, Leu WM.OIP30, a RuvB-like DNA helicase 2, is a potential substrate for the pollen-predominant OsCPK25/26 in rice.Plant Cell Physiol, 2011, 52(9): 1641–1656.
[75]Zhou JJ, Liang Y, Niu QK, Chen LQ, Zhang XQ, Ye D.TheArabidopsisgeneral transcription factor TFIIB1 (At-TFIIB1) is required for pollen tube growth and endosperm development.J Exp Bot, 2013, 64(8): 2205–2218.
[76]op den Camp RGL, Kuhlemeier C. Phosphorylation of tobacco eukaryotic translation initiation factor 4A upon pollen tube germination.Nucleic Acids Res, 1998, 26(9):2058–2062.

