钙结合蛋白对花粉生长发育调控研究进展
于晓俊,曹绍玉,董玉梅,毕保良,张应华,许俊强
(云南农业大学 云南省滇台特色农业产业化工程研究中心,昆明 650201)
钙结合蛋白对花粉生长发育调控研究进展
于晓俊,曹绍玉,董玉梅,毕保良,张应华,许俊强*
(云南农业大学 云南省滇台特色农业产业化工程研究中心,昆明 650201)
植物钙结合蛋白存在于花粉管中,通过直接或间接结合Ca2+,定位膜结构,形成Ca2+信号通道,发生信号转导,对花粉发育及花粉管的生长起到调控作用。目前已明确以钙调蛋白(CAM)、钙依赖型蛋白激酶(CDPK)、类钙调蛋白(CML)、类钙调素B类蛋白(CBL)和激酶蛋白(CIPK)为主的植物钙结合蛋白在调控花粉发育及花粉管生长方面的重要作用。该文主要对近年来国内外已经明确的各类钙结合蛋白家族以及家族成员间不同的作用机理的研究进展进行综述,并举例阐述了钙结合蛋白家族中各类成员对花粉管特定的作用方式及调控作用,最后对今后相关领域的研究前景进行了展望。
钙结合蛋白;花粉萌发;花粉管伸长
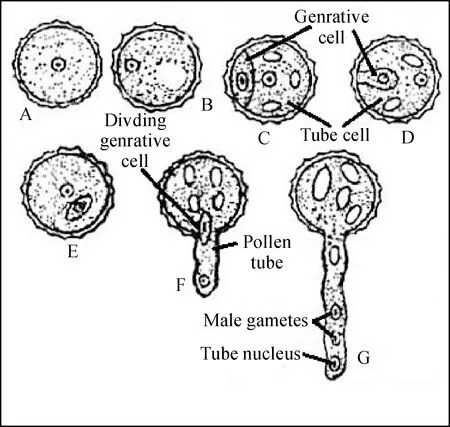
A.生殖细胞;B.正在分裂的生殖细胞;C、D.正在变化的生殖细胞和花粉管;E.显示还未分裂的生殖细胞;F.显示生殖细胞随伸长的花粉管运动;G.显示由生殖细胞分裂成的2个精子随花粉管伸长向胚囊方向运动图1 花粉萌发与雄配子发育(A~G)[2]A.Generative cell; B.The division of generative cell;C, D. The changing generative cell and pollen tube; E.Represent for non dividing generative cell; F.Represent for the motion of generative cell with the elongation of pollen tube; G.Represent for two germ cell split by generative cell move into the embryo sac with the elongation for pollen tubeFig.1 Germination of pollen grain and development of male gametes(A-G)[2]
植物正常生长发育与花粉受基因正确调控、表达生长功能相关。花粉发育前期仅含营养细胞、生殖细胞或经其分裂成的2个精子,其中精子结合卵细胞,形成受精卵,发育形成胚;另外精子结合两极核细胞,形成受精极核,发育成胚乳。而花粉发育主要在传粉后落至柱头,受柱头分泌黏液刺激,使萌发花粉粒内壁突出,内壁经花粉外壁萌发孔向外延伸细管,形成动态伸长的花粉管,花粉管从柱头经花柱向子房方向延伸,待长至一定长度,原先花粉粒内含物质运动至花粉管顶端,直达胚珠,花粉管最终到达胚囊位置,携带两精子及其它内含物至胚囊,同卵细胞受精(图1)。已知钙离子作为调控花粉管生长的第二信使,可直接或间接结合钙调蛋白,发挥钙结合功能,改变花粉管Ca2+浓度梯度。研究表明,钙离子浓度梯度经调控高尔基体小泡定向分泌、运转与融合,促使合成花粉管壁及质膜相关物质不断运输至花粉管顶端,形成新管壁及质膜,最终导致花粉管顶端极性生长[1]。但各类型钙结合蛋白作用钙离子方式不同,因此,钙结合蛋白相关类型与花粉发育具紧密联系。
Ca2+作用于植物生长及对环境的适应性,受刺激的Ca2+信号在特定时空内表现为二价游离钙离子。高浓度Ca2+分布于水合花粉萌发孔周围,形成浓度梯度。花粉管生长受其顶端的限制,其生长速率可能与管顶端Ca2+的浓度呈正相关。而Ca2+可能参与调控花粉管极性生长,调控花粉管尖端细胞内Ca2+浓度可能高度影响花粉管极性生长与伸长。
钙结合蛋白用于解码植物钙信号,在植物体内形成复杂的信号网络,接收并处理信息,调控花粉萌发及花粉管伸长[3]。国内外学者越来越重视花粉管钙离子信号作用植物相关位点的研究。目前已知钙结合蛋白主要包含五大类钙感受器,即钙依赖型蛋白激酶(Ca2+-dependent kinases protein,CDPK)、钙调蛋白(calmodulin,CAM)、类钙调蛋白(calmodulin-like protein,CML)、类钙调素B类蛋白(calcineurin B-like protein,CBL)和激酶蛋白(CBL-interacting protein kinases,CIPK),以及未知的一类蛋白质。本文通过介绍花粉管中存在的不同钙结合蛋白家族、代表性家族成员及相关作用机理,并从钙结合蛋白对花粉管发育所起各类功能等方面详细阐述,希望为相关研究者提供参考借鉴。
1 钙依赖型蛋白激酶(CDPK)
CDPK作为Ca2+的感受器,对植物调控自身代谢及对外界环境的适应性发挥重要作用,其中胞内游离钙离子是促进花粉萌发和花粉管生长过程中必不可少的要素[4]。CDPK具1个N-末端结构域和其他3个相对保守结构域[激酶结构域,自抑制结构域和C-末端类钙调结构域(4个钙结合蛋白EF手型结构)],在钙调蛋白家族中,仅CDPK具蛋白激酶活性,与Ca2+结合以诱导自身构象改变发挥其功能。
目前,已鉴定出拟南芥基因组花粉基因共34类AtCDPKs,其中有5类CDPK在花粉管中高度表达,分别是CDPK14、CDPK16、CDPK17、CDPK32和CDPK34;有12类CDPK与花粉管表达高度关联[5];经CDPK N端标记的GFP(绿色荧光蛋白)对CDPK基因功能无明显作用。研究表明,CDPK14和CDPK34诱导花粉管去极化生长(图2);CDPK32诱导花粉管过表达的作用最为明显,其花粉管顶端形成球状体积[6],而CDPK14仅轻度抑制花粉管伸长,CDPK17的过表达对花粉管伸长甚至无影响。同时,因CDPK17和CDPK34为Ca2+信号传导提供固定支撑模式,以提高花粉管尖端生长速率,从而使CDPK17和CDPK34在成熟花粉管中优先表达[7]。另外,CDPK11和CDPK24作为Ca2+下游的响应因子,对内向K+通道AKT6具调控作用,双方作为激酶级联的局部结构,在质膜上相互作用,发生信号传导,最终起到调控花粉管生长的功能[8]。
已知矮牵牛中有2种CDPKs(PiCDPK1和PiCD-PK2)在花粉管中高度表达。其中,PiCDPK1主要调控花粉管生长极性,PiCDPK2则参与花粉管伸长调节。过表达的PiCDPK1和PiCDPK2均可使花粉管生长极发生突变,使花粉管生长长度缩短,并生成球状尖端。瞬时表达和超表达的PiCDPK1会扰乱花粉管的生长极,可能与管尖膨胀诱导Ca2+浓度上升有关,结果表明PiCDPK1可能参与调节Ca2+动态平衡。而PiCDPK2的表达未改变花粉管的生长极性、萌发率及生长形态,但抑制花粉管伸长生长[9],表明CDPK1和CDPK2对花粉管生长具不同作用。另外,分析表明PiCDPK1与拟南芥CDPK17最为接近,二者具78%一致性,PiCDPK1也与在玉米花粉表达的CDPK具77% 一致性[10]。PiCDPK1主要经酰化介导发生质膜定位,激发激酶活性,而PiCDPK2位于未知内膜结构,内膜定位会多次重复发生,酰化作用还会再次介导部分定位发生。已知拟南芥植物生长发育演变过程中,调控花粉管伸长生长的氨基酸序列会随CDPK17和CDPK24广泛分离产生差异性[11],表明CDPK在植物生长过程中起到不同功能。其他物质结构,如经三磷酸依赖性肌醇释放的Ca2+有利于Ca2+浓度梯度形成[4];研究表明,PiCDPK1活性定位花粉肌动蛋白[12],细胞内微丝骨架与活性氧(reactive oxygen species, ROS)信号分子发生相互作用,均对花粉管尖端生长起到重要作用[13],肌动蛋白失去细胞质流将受到抑制,使花粉管停止生长[14]。玉米花粉中特定CDPK的表达不利于花粉管生长,但加入激酶抑制剂及钙拮抗剂时则相反[10]。对花粉管尖端中心部位Ca2+浓度梯度分析表明Ca2+浓度梯度与浓度上升部位激酶活性上升相关[15]。
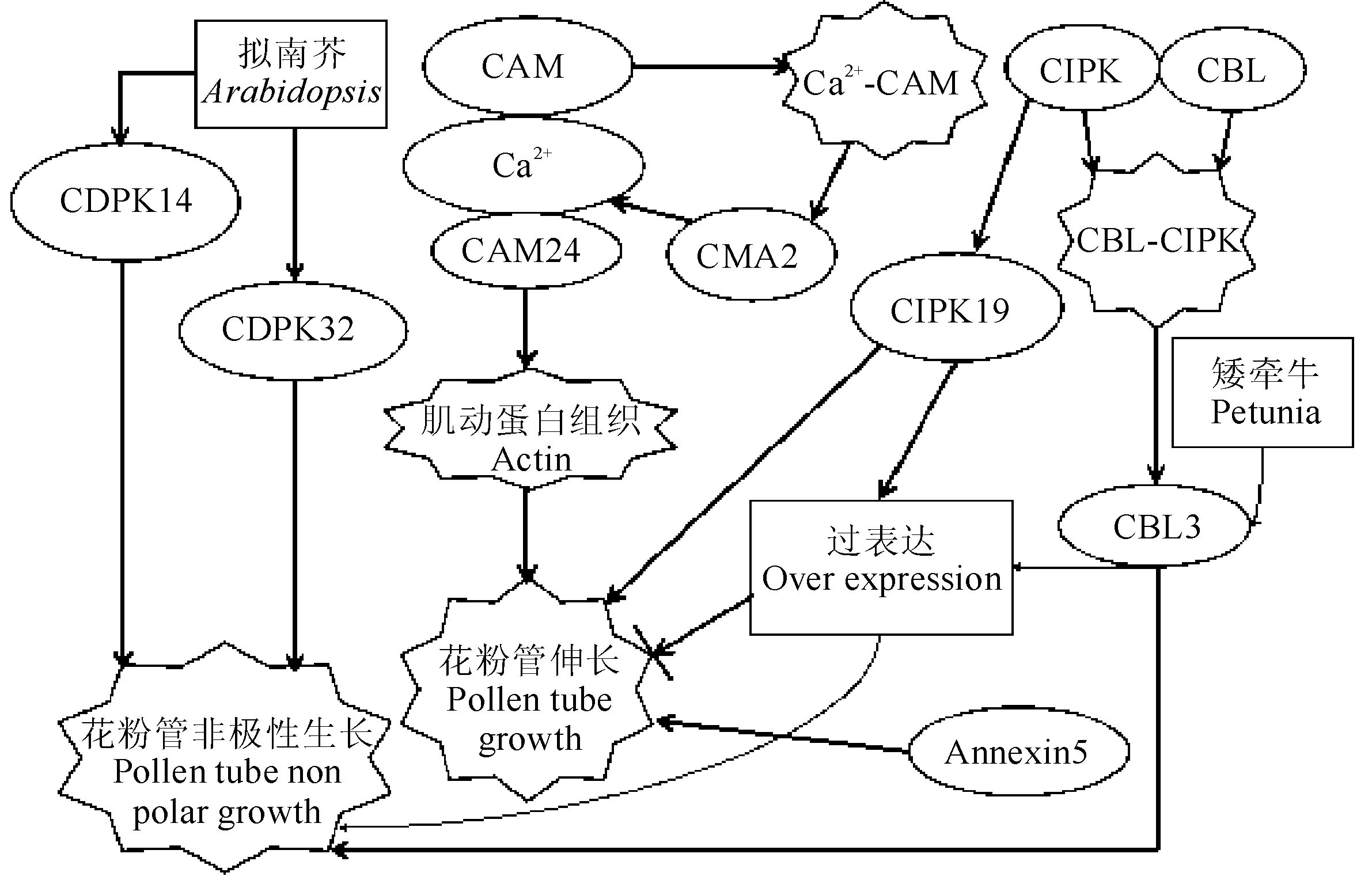
图2 钙结合蛋白分类及作用类型Fig.2 Classification and function types of calcium binding proteins
2 钙调蛋白(CAM)
CAM是普遍存在真核生物中,属于具调控花粉萌发及花粉管生长作用的一类钙结合蛋白,位于花粉萌发孔和水合花粉萌发泡附近细胞质及花粉管胞浆中的CAM,形成与管尖端处相似Ca2+浓度[16]。CAM家族自身不具激酶活性,仅通过与Ca2+相互作用,以形成Ca2+-CaM复合体,作用下游靶点,从而改变蛋白构象。CAM的三维结构类似哑铃状,具单个由3个钙结合蛋白EF手型结构组成的Ca2+结构域[17]。基因组数据显示,拟南芥家族共7类成员编码4类钙调蛋白亚基(CaMl/4;CaM2/3,5;CaM6;CaM7)[18],其间仅相差5个氨基酸。
利用显微注射技术,将CAM均匀注射到花粉管细胞质中[19],花粉管尖端处CAM仍具较高活性,因为CAM活性依赖于结合钙离子,而低浓度CAM抑制活性物质分泌,并改变花粉管生长极[20]。由于朱顶红花粉管细胞外源性CAM含量上升可促进花粉管的伸长,外源性CAM与拮抗剂W7-agarose及EGTA相互作用,则能增大花粉管伸长速率[21]。
研究显示,至少有90类具单个脱氧核糖核酸结合结构域的蛋白质与CAM间相互关联[22],这类蛋白质主要来自BZIP、WRKY和 MYB转录因子家族[23],CAM与转录激活因子(CAMTA)结合,促使所有含有这类转录因子的蛋白质与CAM结合[24]。CAMTA在植物各种生理活动中发挥各类功能,如传导激素信号[25]、维持碳氮代谢Ca2+运输过程动态平衡[26]及响应盐和干旱胁迫信号等,这类钙调蛋白可抵消其他钙结合蛋白作用,如自我抑制型Ca2+泵(Auto in-hibted Calcium ATPase,ACA2)的Ca2+-ATP酶活性受CPK1磷酸化N-末端结构域抑制作用,反会促进ACA2同CAM结合[27]。CAM与Ca2+相互作用条件下,几类质膜的结合与激酶胞浆受体的活性增强[28]。CAM是最为保守的一类真核蛋白,经CAM扩展的蛋白质家族,由数量各异Ca2+同钙结合蛋白EF手型结构结构域结合其他结构域组成[29]。其中CAM2对植物生殖生长发挥重要作用,通常CAM2决定花粉管伸长方向,并在花粉管生长过程中以改变Ca2+浓度为信号转导通路,发挥感应Ca2+的功能,而CAM2和CAM7均可促进花粉管生长(图2)。
3 类钙调蛋白(CML)
CML是近年来发现仅存于植物体内的一类钙结合蛋白。其自身无法直接激发酶活性,仅通过与钙依赖性蛋白间互作改变下游靶点,发挥钙调功能。CML家族又属于编码蛋白一类蛋白质家族,具钙结合蛋白EF手型结构,与CAM具16%氨基酸序列同源性[18]。拟南芥中50类CMLs均属于编码蛋白,这类CML包含大量功能性钙结合蛋白EF手型结构[30]。许多CML虽属胞质蛋白,但部分经脂质修饰的CML与膜发生作用[30]。对拟南芥AFFYMETRK ATH1基因芯片数据分析显示,检测中的48类CMLs基因,有19类在花粉管中表达,9类优势表达,部分基因转录时期水平含量会明显升高。其中,CML39在花粉萌发期间表达上调;11类基因(CML2、CML3、CML14、CML15、CML16、CML20、CML21、CML24、CML39、CML42、CML49)在花粉管生长期间表达上调。需注意的是,部分基因(CML6、CML13、 CML25、CML28)均在花粉萌发及花粉管生长期间高度表达[31]。
CML25的相关研究表明,作为CML蛋白家族中一类具Ca2+结合活性成员,CML25普遍存在于成熟花粉粒及生长的花粉管中,CML25蛋白主要针对细胞质发生介导作用。其中,CML25中断供给使花粉管Ca2+浓度上升,CML25是通过Ca2+介导调控K+内流,以促进花粉萌发及花粉管伸长的一类重要钙结合蛋白[32],故CML25功能性发挥,可能与管的肿胀尖端处Ca2+浓度改变相关。另有研究显示,拟南芥CML24与Ca2+经CML24肌动蛋白组织介导发生相互作用,进而影响花粉萌发及花粉管伸长(图2)[33];而CML21仅在过表达时显著抑制花粉管伸长,但轻度拓宽花粉管,花粉管长度与野生型相比缩短近18%[34],但其它类型基因过表达个体与野生型花粉管间极性生长并无明显差异[35];对自交不亲和甘蓝材料F1花粉萌发前后总蛋白双向电泳结果的质谱分析,得到花粉萌发及花粉管伸长相关的重要钙结合蛋白CML49,并构建35S与LAT52启动子下反义CML49的表达载体,结果显示,反义转基因植株花粉萌发率显著低于对照水平,花粉管长度也明显缩短。此外,CML49在不同器官的表达分析说明该基因在不同器官均发生表达,花粉萌发前CML49基因表达量为萌发后的2.73倍,CML49在拟南芥生长发育各阶段均存在表达,但表达量水平较低[18]。因花粉管存在大量不同类型钙结合蛋白的表达,难以用传统遗传途径研究CML对花粉管的作用机制,只能通过间接掌握CML与其他蛋白间相互作用机制,进一步深入研究CML对花粉萌发尤其是花粉管伸长方面的作用。
虽然目前国内外对CML与花粉萌发及花粉管伸长作用关系的研究有部分进展,但仍处于起步阶段,许多新型基因功能和机制还有待进一步研究和发现[34]。
4 类钙调素B类蛋白(CBL)
CBL是一类最新发现的的钙结合蛋白,具典型Ca2+结构域,属于传递型感受器。CBL需同CIPK相互作用传递信号,以发挥自身活性,其中CIPK是植物体内特有的具丝氨酸/苏氨酸结构域的蛋白激酶[36],其络合物CBL-CIPK钙感受器具双分子,于CBL的N-末端定位亚细胞[37],以便各类CBL-CIPK络合物建立解码Ca2+的信号网,增强对细胞内外Ca2+信号感知能力[38]。此外,类SNF1蛋白激酶已知是CBL的靶蛋白[39],参与植物体内各类细胞代谢过程,包括调节离子动态平衡及植物应激反应等。这类钙结合蛋白的过表达,会抑制花粉管伸长,诱导花粉管去极化生长。此外,CBL蛋白还在稳定植物体内钙离子含量、花粉管尖端生长钙依赖性及花粉管振荡生长平衡性方面发挥重要作用[40]。
已知拟南芥中具10类CBLs,经微阵列数据分析10类CBLs,显示4类CBLs(CBL1、CBL2,CBL3和CBL9)在成熟花粉、水合花粉和花粉管中表达[41]。CBL1与CBL9均在烟草花粉管中正常表达,但二者过表达不利于花粉管生长及形态发育;有数据分析表明,成功诱导这类表型需CBL1于质膜高效定位,同时要求Ca2+独立与CBL1第4位点钙结合蛋白EF手型结构结构域成功结合。此外,CBL1和CBL9对花粉管生长调控受质膜上K+浓度适中调节[42],当外界K+浓度上升时,于拟南芥花粉管中过表达的CBL1和CBL9能增强花粉管伸长敏感性;而K+浓度降低时,花粉管长度变短,当外部K+浓度上升,CBL1和CBL9稳定过表达均显著降低花粉萌发率,并改变花粉管形态。CBL1和CBL9过表达诱导烟草粉管长度变短,造成其顶端膨大。这些研究结果表明,适度调节质膜CBL1和CBL9累积水平是花粉正常萌发、花粉管极性生长的关键。除此以外,CBL1和CBL9也可调节花粉中各类离子间动态平衡。对烟草花粉管中CBL2和CBL3研究表明,二者氨基酸序列具92%一致性,均在花粉管细胞3个不同发育阶段对亚细胞动态定位,这表明CBL2和CBL3可能参与调控烟草花粉管早期再生长及去极化生长。CBL3过表达影响花粉管去极化生长,以抑制花粉管尖端伸长,拓宽花粉管管壁(图2);相似部位的CBL2仅抑制花粉管伸长,但未显著拓宽花粉管管壁[34]。由此可见,过表达的CBL1、CBL2、CBL3和CBL9均抑制花粉管伸长,除CBL2未显著拓宽花粉管尖端外,CBL1、CBL3和CBL9均诱导花粉管尖端膨胀,其中的CBL1与CBL9主要经改变花粉管外K+浓度对花粉管顶端发挥作用。
5 激酶蛋白(CIPK)
CIPK是与CBL互作的特定激酶,同样依赖与CBL互作激发活性,发挥钙调功能。CIPK家族成员主要在一定浓度水平的Ca2+下,介导各成员间保守区域C端非激酶结构域同CBL相互作用[36],以形成CBL-CIPK双分子传感器,从而发生信号传导。
CIPK与CBL发生相互作用,以参与调控花粉管细胞活动。其中,过表达的CIPK12诱导拟南芥花粉管尖端去极化生长,因为CBL2和CBL3与CIPK12发生共识表达,诱导CIPK12磷酸化依赖性增强,从而膨胀液泡并中断花粉管极性生长[43]。
有研究表明,与CIPK12高度相似的CIPK19,对拟南芥花粉管生长同样具明显调控作用,CIPK19于花粉管中特异性表达,但过表达会诱发花粉管去极化生长,表明CIPK12与CIPK19存在功能冗余。花粉管外与管内CIPK19表达,均阻碍花粉管正常极性生长;缺失CIPK19导致雄性花粉不育,但CIPK19过表达诱发花粉管去极化生长(图2)。此外,经Lat52启动子启动全长CIPK编码序列与N-末端GFP相融合表达,利用基因枪法,瞬时表达烟草花粉管的融合结构,结果表明CIPK19-GFP过表达会高度诱发花粉管去极化生长。
CIPK19与CIPK12均可高度诱发花粉管去极化生长,大大降低花粉管伸长率,其间可能存在功能冗余。不同之处在于,CIPK12主要借助与CBL2或CBL3相互作用,以增强磷酸化依赖性,从而膨胀液泡,最终对拟南芥花粉管伸长起到抑制作用;CIPK19则主要借由介导Ca2+流,调控花粉管生长极性,CIPK含量过高或过低,均诱导花粉管尖端去极生长[44]。OsCIPK25和OsCIPK26与玉米晚穗期表达的玉米CDPK基因高度相似,其中由反义机制产生抑制作用诱导花粉管的生长[45]。
6 其他类型的钙结合蛋白
除上述主要钙结合蛋白家族,还涉及其他调控花粉管生长的钙结合蛋白,膜联蛋白是可调控质膜、磷脂、肌动蛋白结合Ca2+调控花粉管生长的一类钙结合蛋白,其作用机理在于结合Ca2+质膜形成Ca2+信号通道,以进行膜性生物学活动,如信号传导,从而发挥钙调功能,调控花粉管生长发育[46]。
花粉管尖端高浓度膜联蛋白(annexin)与高浓度Ca2+共存,同Ca2+结合花粉管突触小泡、膜联蛋白以及发挥钙结合功能具直接联系[47]。已知经各类植物体中分离的膜联蛋白,对肌动细胞骨架、MEM—膜,Ca2+中具连接功能,这些结构用于促进花粉管伸长。此外,annexin5调控花粉管伸长,并在成熟花粉管中特定表达,用以诱导花粉管生长(图2);而花粉管发育二阶段,annexin5仅对花粉管起保护作用,花粉管停止进一步生长时,由于annexin5功能水平下调,使花粉管最终退化变形[48]。对拟南芥8个家族膜联蛋白氨基酸序列进行比较,结果表明,膜联蛋白在花粉管发育初期表达量较高,并可能参与调控花粉管极性生长。此外,膜联蛋白表达量在参与的极性伸长部位如根毛、花粉管等也会上调[49]。另有研究表明,BoAnnexin2于花粉萌发后期表达下调,经免疫定位试验发现,膜联蛋白聚集于玉米花粉管[50],Annexin D2、Annexin D6和Annexin D7在拟南芥花器官中均发生表达[51]。
7 小结与展望
经上述对钙结合蛋白分类阐述,以及各类钙结合蛋白对花粉管作用方式差异性的综合阐述,结合已有研究成果表明,仅CDPK一类钙结合蛋白自身具蛋白激酶活性,可直接与Ca2+结合诱导自身构象改变,发挥调控功能;而CAM、CML自身均不具酶活性功能,需经间接作用,激发自身酶活性,两者差异在于CAM经同Ca2+相互作用以调控花粉管,而CML仅通过钙依赖性蛋白间相互作用,来改变下游靶点,发挥钙调功能;CBL发挥激酶活性方式更具特异性,仅通过与特异性互作激酶CIPK相互作用,传递信号来发挥自身酶活性,CIPK作为CBL靶蛋白,对花粉管调控同样需与CBL结合,以生成CIPK-CBL络合物的方式,发挥钙调功能。此外,各大类钙结合蛋白下不同家族成员对花粉管伸长与极性调控的作用效果也不同,可能具促进、抑制或无明显作用。
近年来,研究人员对植物钙结合蛋白家族类型、作用机理以及对花粉管的调控效应等方面展开了一定程度的研究,越来越多的证据显示钙结合蛋白家族大多数成员对花粉管的生长发育起到重要调控作用,但还存在许多未知钙结合蛋白家族成员有待发现,钙结合蛋白相关作用机理、定位底物也有待进一步深掘,如钙结合蛋白定位质膜、细胞质是否一定与钙结合蛋白种类相关,EF手型蛋白的数量及结构类型与钙结合蛋白发挥功能性之间具哪些规律可寻,钙结合蛋白发挥钙调功能与花粉管中其他内含物质间的关联是否有进一步研究的空间等。今后,扩大对花粉管相关钙结合蛋白种类及作用机理多样性进一步深掘成为钙结合蛋白作用花粉管领域的主要研究方向。相信随着相关理论研究不断深入,钙结合蛋白对花粉管伸长作用这一研究内容会更加清晰,钙结合蛋白对花粉管伸长调控作用研究水平会更加进步与完善。
[1] STEER M, STEER J. Pollen tube tip growth[J].NewPhytologist, 1989, 111(3): 323-358.
[2] TRISHA. Sexual Reproduction in Angiosperm Plants(Steps)[EB/OL]. 2013. http://www.biologydiscussion.com/ angiosperm/ sexual-reproduction-in-angiosperm-plants-steps/ 6506.htm.
[3] BREW J, KNACK B. The essential role of calcium ion in pollen germination and pollen tube growth[J].AmericanJournalofBotany, 1963,859-865.
[4] MALHO R, READ N, TREWAVAS A. Calcium channel activity during pollen tube growth and reorientation[J].ThePlantCell, 1995, 7(8): 1 173-1 184.
[5] HARPER J, BRETON G, HARMON A. Decoding Ca2+signals through plant protein kinases[J].Annu.Rev.PlantBiol., 2004 55: 263-288.
[6] YOON G, DOWD P, GILROY S,etal. Calcium-dependent protein kinase isoforms in Petunia have distinct functions in pollen tube growth, including regulating polarity[J].ThePlantCell, 2006, 18(4): 867-878.
[7] PODELL S, GRIBSKOV M. Predicting N-terminalmyristoylationsites in plant proteins[J].BmcGenomics, 2004, 5(1): 1.
[8] ZHAO L, SHEN L, ZHANG W. Ca2+-dependent proteinkinase11 and 24 modulate the activity of the inward rectifying K+channels inArabidopsispollen tubes[J].ThePlantCell, 2013, 25(2): 649-661.
[9] YOON G, DOWD P, GILROY S. Calcium-dependent protein kinase isoforms in Petunia have distinct functions in pollen tube growth, including regulating polarity[J].ThePlantCell, 2006, 18(4): 867-878.
[10] ESTRUCH J, KADWELL S, MERLIN E. Cloning and characterization of a maize pollen-specific calcium-dependent calmodulin independent protein kinase[J].ProceedingsoftheNationalAcademyofSciences, 1994, 91(19): 8 837-8 841.
[11] HRABAK E. Calcium-dependent protein kinases and their relatives[J].AdvancesinBotanicalResearch, 2000,32: 185-223.
[12] EVANS C, HARMON A,etal. Calcium-dependent protein kinase is localized with F-actin in plant cells[J].CellMotilityandtheCytoskeleton, 1989, 12(1): 12-22.
[13] HEPLER P, VIDALI L, CHEUNG A. Polarized cell growth in higher plants[J].AnnualReviewofCellandDevelopmentalBiology, 2001, 17(1): 159-187.
[14] VIDALI L, MCKENNA S, HEPLER P. Actin polymerization is essential for pollen tube growth[J].MolecularBiologyoftheCell, 2001, 12(8): 2 534-2 545.
[15] MOUTINHO A, TREWAVAS A, MALHR. Relocation of a Ca2+-dependent protein kinase activity during pollen tube reorientation[J].ThePlantCell, 1998, 10(9): 1 499-1 509.
[16] MCCUBBIN A, RITCHIE S, SWANSON S. The calcium-dependent protein kinaseHvCDPK1 mediates the gibberellic acid response of the barley aleurone through regulation of vacuolar function[J].ThePlantJournal, 2004, 39(2): 206-218.
[17] PATIL S, TAKEZAWA D, POOVAIAH B. Chimeric plant calcium/calmodulin dependent protein kinase gene with a neural visinin like calcium-binding domain[J].ProceedingsoftheNationalAcademyofSciences, 1995, 92(11): 4 897-4 901.
[18] MCCORMACK E, TSAI Y, BRAAM J. Handling calcium signaling:ArabidopsisCaMsandCMLs[J].TrendsinPlantScience, 2005, 10(8): 383-389.
[19] MOUTINHO A, LOVE J, TREWAVAS A. Distribution of calmodulin protein andmRNAin growing pollen tubes[J].SexualPlantReproduction, 1998, 11(3): 131-139.
[20] RATO C, MONTEIRO D, HEPLER P. Calmodulin activity andcAMPsignalling modulate growth and apical secretion in pollen tubes[J].ThePlantJournal, 2004, 38(6): 887-897.
[21] MA L, SUN D. The effects of extracellular calmodulin on initiation ofhippeastrumrutilumpollen germination and tube growth[J].Planta, 1997, 202(3): 336-340.
[22] REDDY A, ALI G, CELESNIK H. Coping with stresses: roles of calcium and calcium/calmodulin regulated gene expression[J].ThePlantCell, 2011, 23(6): 2 010-2 032.
[23] DU L, ALI G, SIMONS K. Ca2+/calmodulin regulates salicylic acid mediated plant immunity[J].Nature, 2009, 457(7 233): 1 154-1 158.
[24] GALON Y, FINKLER A, FROMM H. Calcium-regulated transcription in plants[J].MolecularPlant, 2010, 3(4): 653-669.
[25] GALON Y, ALONI R, NACHMIAS D. calmodulin binding transcription activator 1 mediatesauxinsignaling and responds to stresses inArabidopsis[J].Planta, 2010, 232(1): 165-178.
[26] FRANZ S, EHLERT B, LIESE A. Calcium-dependent protein kinaseCPK21 functions inabioticstress response inArabidopsisthaliana[J].MolecularPlant, 2011, 4(1): 83-96.
[27] HARPER J, HONG B, HWANG I. A novel calmodulin regulated Ca2+-ATPASE (ACA2) fromArabidopsiswith anN-terminalautoinhibitorydomain[J].JournalofBiologicalChemistry, 1998, 273(2): 1 099-1 106.
[28] YANG T, CHAUDHURI S, YANG L. A calcium/calmodulin regulated member of the receptor-like kinase family confers cold tolerance in plants[J].JournalofBiologicalChemistry, 2010, 285(10): 7 119-7 126.
[29] SNEDDEN W, FROMM H. CALMODULIN CALMODULIN related proteins and plant responses to the environment[J].TrendsinPlantScience, 1998, 3(8): 299-304.
[30] YANG T, POOVAIAH B W.ARABIDOPSISchloroplast CHAPERONIN 10 is a CALMODULIN binding protein[J].BiochemicalandBiophysicalResearchCommunications, 2000, 275(2): 601-607.
[31] WANG Y, ZHANG W Z, SONG L F. TRANSCRIPTOME analyses show changes in gene expression to accompany pollen germination and tube growth in Arabidopsis[J].Plantphysiology,2008, 148(3): 1 201-1 211.
[32] WANG S S, DIAO W Z, YANG X.arabidopsisthalianaCML25 mediates the Ca2+regulation of K+transmembrane trafficking during pollen germination and tube elongation.[J].Plant,Cell&Environment,2015, 38(11): 2 372-2 386.
[33] YANG X, WANG S S, WANG M. Calmodulin like proteinCML24 regulates pollen tube growth by modulating the actin cytoskeleton and controlling the cytosolic Ca concentration[J].PlantMolecularBiology,2014, 3(86): 225-236.
[34] ZHOU L, FU Y, YANG Z. A genome-wide functional characterization of Arabidopsis regulatory Calcium sensors in pollen Tubes[J].JournalofIntegrativePlantBiology,2009, 51(8): 751-761.
[35] 许俊强. 甘蓝花粉管钙感受蛋白编码基因CML49的克隆及功能鉴定研究[D].重庆:西南大学, 2014.
[36] LUAN S, KUDLA J, RODRIGUEZ M. CALMODULINS and calcineurin B-like proteins calcium sensors for specific signal response coupling in plants[J].ThePlantCell, 2002, 14(suppl 1): S389-S400.
[38] HASHIMOTO K, KUDLA J. Calcium decoding mechanisms in plants[J].Biochimie, 2011, 93(12): 2 054-2 059.
[39] HALFTER U, ISHITANI M, ZHU J K. TheArabidopsisSOS2 protein kinase physically interacts with and is activated by the calcium-binding proteinSOS3[J].ProceedingsoftheNationalAcademyofSciences, 2000, 97(7): 3 735-3 740.
[40] DRERUP M, SCHLÜCKING K, HASHIMOTO K. The calcineurin B-like calcium sensorsCBL1 andCBL9 together with their interacting protein kinaseCIPK26 regulate thearabidopsisnadph oxidase rbohf[J].MolecularPlant, 2013, 6(2): 559-569.
[41] WANG H J, WAN A R, JAUH G Y. An actin binding protein, LlLIM1, mediates calcium and hydrogen regulation of actin dynamics in pollen tubes[J].Plantphysiology,2008, 147(4): 1 619-1 636.
[43] HEILMANN I, KUDLA J. VacuolarCBL-CIPK12 Ca2+-sensor-kinase complexes are required for polarized pollen tube growth[J].CurrentBiology, 2015,25: 1-8.
[44] ZHOU L, LAN W, CHEN B. A calcium sensor-regulated protein kinase, calcineurin b-like protein-interacting protein kinase19, is required for pollen tube growth and polarity.[J].PlantPhysiology,2015, 167(4): 1 351-1 360.
[45] DAS R, PANDEY G. expressional analysis and role of calcium regulated kinases in abiotic stress signaling[J].CurrentGenomics, 2010, 11(1): 2-13.
[46] HOFMANN A, PROUST J, DOROWSKI A. Annexin 24 from Capsicum annuum X-ray structure and biochemical characterization[J].JournalofBiologicalChemistry, 2000, 275(11): 8 072-8 082.
[47] FRANKLIN-TONG V. Signaling and the modulation of pollen tube growth[J].ThePlantCell, 1999, 11(4): 727-738.
[48] ZHU J, YUAN S, GUO W. Annexin5 is essential for pollen development inArabidopsis[J].MolecularPlant,2014, 7(4): 751-754.
[49] 黄逸群,左开井. 膜联蛋白的功能与调控研究进展[J].生物技术进展,2012, 2(3): 157-164.
HUANG Y Q, ZUO K J .Advances in function and regulation of annexin[J].CurrentBiotechnology, 2012,2(3):157-164.
[50] 孙梓健,许俊强,宋 明,等. 结球甘蓝花粉膜联蛋白基因的克隆及其表达分析[J].园艺学报,2012, 39(8): 1 567-1 574.
SUN Z J, XU J Q, SONG M,etal. Molecular cloning and expression analysis of annexin gene from cabbage[J].ActaHorticulturaeSinica, 2012,39(8):1 567-1 574.
[51] CANTERO A, BARTHAKUR S, BUSHART T. Expression profiling of theArabidopsisannexin gene family during germination, de-etiolation and abiotic stress[J].PlantPhysiologyandBiochemistry, 2006, 44(1): 13-24.
(编辑:裴阿卫)
Research Progress of Calcium Binding Proteins in Pollen Growth and Development
YU Xiaojun, CAO Shaoyu, DONG Yumei, BI Baoliang, ZHANG Yinghua, XU Junqiang*
(Dian-Tai Engineering Research Center for Characteristic Agriculture Industrialization of Yunnan Province, Yunnan Agricultural University, Kunming 650201, China)
The plant calcium binding protein was found in pollen tube, which combines with Ca2+directly or indirectly, orientates in membrane structure and forms Ca2+signal channel. After activation of signal transmission, it will regulate pollen development and pollen tube growth. The calcium binding proteins CAM(calmodulin),CDPK(Ca2+-dependent kinases protein),CML(calmodulin-like protein),CBL(calcineurin B-like protein)and CIPK(CBL-interacting protein kinases) are recognized as key roles in the regulation of pollen development and pollen tube growth. In this review, the recent research of mechanism in different protein families and whose members between the various types of calcium binding are summarized. It also presented the effect on pollen tube specific mode of action and regulation with some examples from the calcium binding protein family members for varioustypes. In addiction, the forecast is discussed in the review about the future research in related fields.
calcium binding protein;pollen germination;pollen tube elongation
1000-4025(2016)10-2121-07
10.7606/j.issn.1000-4025.2016.10.2121
2016-07-13;修改稿收到日期:2016-09-11
国家自然科学基金(31560560,30972012);云南省应用基础研究计划(2015FD019)
于晓俊(1992-),男,在读硕士研究生,主要从事蔬菜遗传育种研究。E-mial:1564810854@qq.com
*通信作者:许俊强,讲师,主要从事蔬菜分子生物学研究。E-mail:xujunqiang101@163.com
Q945.6; Q257
A

