多聚唾液酸(PSA)及其修饰的神经粘附分子(PSA-NCAM)对肿瘤及细胞信号通路的影响
王欣,关锋
1. 江南大学,糖化学与生物技术教育部重点实验室,无锡214122;
2. 江南大学生物工程学院,无锡 214122
神经粘附分子(Neural cell adhesion molecule,NCAM)是一种大量存在于细胞膜上的跨膜糖蛋白,含有5个IgG样结构域和两个FN3样结构域(图1A),通过同源(NCAM-NCAM)或者异源结合机制增强细胞-细胞间的粘附作用,并可以促进突触的生成与发生,改变突触功效,有利于神经系统的形态塑造等[1]。NCAM包括NCAM-120、NCAM-140和NCAM-180 3种亚型,分子量分别为120kDa、140kDa、180kDa。其中,NCAM-120是GPI锚定蛋白;NCAM-140和NCAM-180是两种跨膜蛋白(图1A)。NCAM-140和NCAM-180主要在胚胎早期发育中起作用,引导神经元的迁移,在胚胎分化过程中,可以检测到NCAM-120的表达上调[2]。NCAM的第3、4、5个IgG样结构域上共有 6个 N-糖基化位点[3],NCAM基因经转录后修饰在第5个IgG样结构域的第5和第 6个糖链末端修饰大量的多聚唾液酸(Polysialic acid, PSA),形成多聚唾液酸化的NCAM,即PSANCAM[4](图 1:A,B)。
唾液酸(Sialic acid, Sia)是一种九碳糖,结构超过了 50种,其核心结构主要为酮基-脱氧壬酮糖酸(Kdn)、Neu、N-乙酰神经氨酸(Neu5Ac或 NANA)和 N-羟乙酰神经氨酸(Neu5Gc或 NANG)(图2)。这些单体组成的线性碳水化合物即为 PSA,其链长聚合度(Degree of polymerization, DP)可达 2~400不等[5](图1B)。带有大量负电荷的PSA可以降低NCAM的粘附作用,同时提高细胞的运动能力。一方面,PSA通过控制NCAM的粘附能力在神经系统的形成与重建过程中起着重要的作用[6,7];另一方面,PSA因其空间排列以及聚合度的不同导致其载体-糖脂或糖蛋白的结构差异,一定程度上决定了该糖脂或糖蛋白的功能发挥[8,9]。PSA-NCAM对细胞粘附能力、迁移能力、侵袭能力的作用报道较多,但PSA对NCAM的修饰作用进而影响细胞下游信号通路的作用仍具有潜在研究价值[10]。

图1 NCAM亚型及PSA-NCAM结构示意图
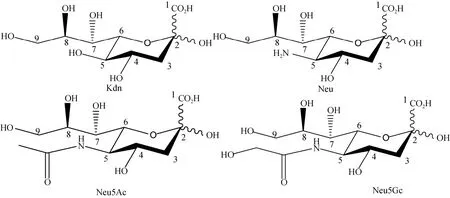
图2 唾液酸的核心结构
1 PSA对糖蛋白的修饰及与细胞因子的结合
PSA对糖蛋白的修饰作用以及与小分子的结合作用会对细胞内信号通路的维持产生影响。
1.1 PSA对大分子糖蛋白的修饰
脊椎动物中有6种糖蛋白可以发生多聚唾液酸化修饰,分别是鱼卵多唾液酸蛋白[11]、NCAM[12]、大鼠脑部钠离子通道蛋白[12]、人乳 CD36[13]以及人淋巴细胞神经纤毛蛋白-2[14],其中NCAM被认为是研究PSA的模式蛋白。PSA-NCAM富含于各种胚胎组织中,但在绝大多数成熟组织中NCAM缺乏PSA修饰。PSA在胚胎和成人脑中的功能尚不完全清楚。人的血小板可以表达无唾液酸修饰的糖蛋白CD36,而人和鼠的乳汁中表达多聚唾液酸化的CD36,说明多聚唾液酸对新生儿的发育和营养至关重要[13]。
1.2 PSA与细胞因子结合
Ono等[15]推测PSA可以通过与神经因子形成特殊的复合物而调节神经营养因子、神经递质(Neurotransmitters)、细胞因子和生长因子等的活动。PSA不仅具有抑制黏附的作用(图3A),Ono等还通过“two-complex”模型提出了PSA可能存在的一种新功能,即PSA具有保留与释放两种性能(图3B):首先,PSA能够结合例如脑源性神经营养因子(Brain-derived neurotrophic factor, BDNF)、成纤维母细胞生长因子2(Fibroblast growth factor 2, FGF2)和神经递质等神经活性分子;其次,PSA维持了这种复合物存在所需要的独特微环境。同时,PSA也具备调节释放这些分子的功能,但PSA与这几种分子的互作形式不尽相同:BDNF与PSA形成复合物后可由 PSA释放 BDNF而直接迁移至高亲和力的受体,转移至哪个受体取决于这两个分子之间的亲和力大小;FGF2与PSA-NCAM形成复合物后,FGF2要通过其他中间体,并不能直接迁移(间接迁移)至FGFR。在上述过程中PSA均参与了信号通路的调节。
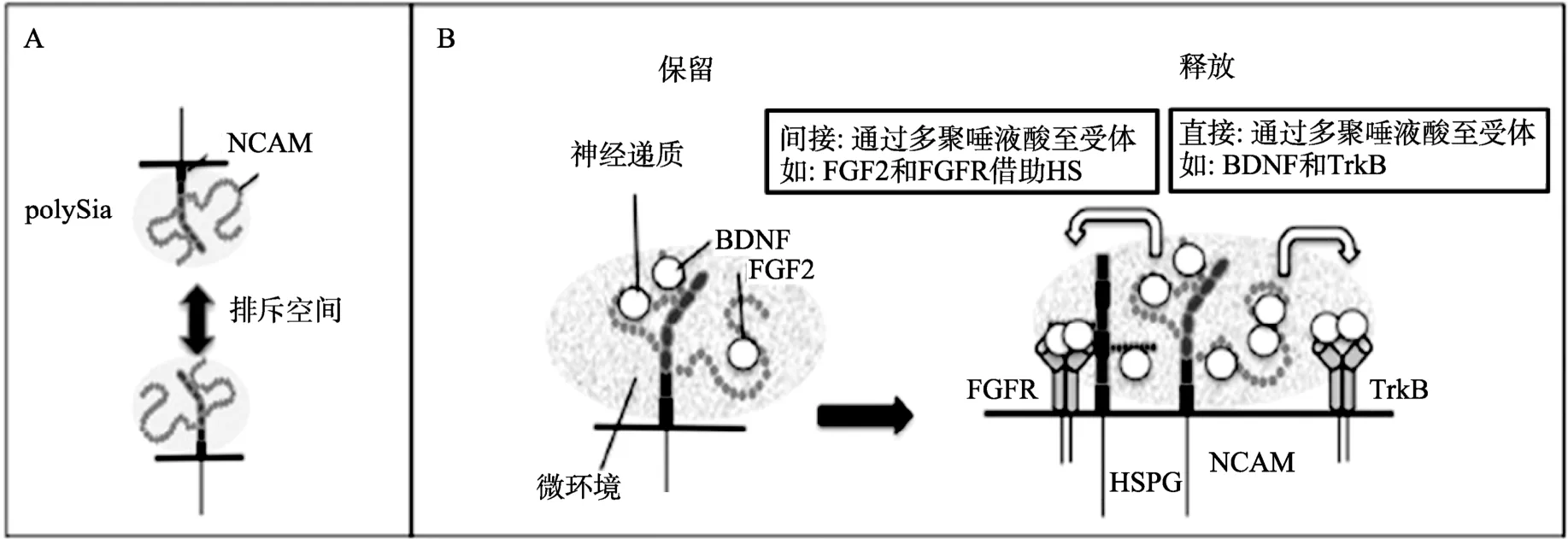
图 3 PSA新功能的可能机制(参考文献[15]并修改)
2 肿瘤细胞中存在PSA再表达的现象
近期研究发现,多种肿瘤细胞表面表达多聚唾液酸化的糖链[16],表明PSA与肿瘤细胞的粘附性、迁移性和侵袭性等密切相关[17]。在小细胞肺癌(Small cell lung cancer)、胶质瘤(Glioma)、甲状腺上皮细胞肿瘤(Thyroid epithelial tumors)、卵巢粒细胞瘤(Ovarian granulosa)、胰腺癌(Pancreatic cancer)、肾母细胞瘤(Wilms’ tumor)和成神经母细胞瘤(Neuroblastoma)等多种恶性肿瘤的病例中,可以检测到NCAM的表达,除了小细胞肺癌无明确报道外,其他几种恶性肿瘤均伴有PSA-NCAM的表达[6,18~23]。此外,在胰腺癌病例中,正常的胰腺组织和癌症组织中都有NCAM的表达,而PSA-NCAM只表达于恶性胰腺癌中,在胰岛中并没有被发现[23],说明PSA-NCAM与一些恶性肿瘤的发展密切相关。Schreiber等[24]对12例人胰腺癌肿瘤细胞样品进行分析,发现PSA-NCAM与上皮细胞粘附分子E-cadherin的结合抑制了E-cadherin介导的细胞粘附,揭示PSANCAM可以直接影响E-cadherin的功能。
3 PSA及NCAM增强细胞的迁移与侵袭能力易化肿瘤细胞的扩散
细胞外基质(Extracellular matrix, ECM)构成复杂的网架结构,支持并连接组织,调节组织的发生和细胞的生理活动。细胞的迁移能力依赖于细胞对细胞外基质的粘附作用,Li等[25]验证了PSA在这一过程中所发挥的作用。该研究小组以表达NCAM而不表达PSA的小鼠胚胎成纤维细胞NIH-3T3为研究对象,发现转染STX基因可以实现NIH-3T3细胞中NCAM 3种亚型的多聚唾液酸化;与对照组相比,PSA降低NCAM与细胞基质间的相互作用,与肝素(Heparin)粘附能力增强而与纤连蛋白(Fibronectin, FN)粘附能力减弱,同时增强了NIH-3T3细胞的迁移以及侵袭能力。此外,当唾液粘蛋白表面大量表达PSA后,易化了细胞从原发肿瘤的脱落,从而转移形成新的病灶[26,27]。研究发现,PSA可以引起肿瘤细胞的扩散,NCAM也有类似引起肿瘤细胞扩散的作用。Colombo等[28]发现正常的卵巢细胞并不表达NCAM,而卵巢癌细胞却随着病程的加剧高表达NCAM,由此可见,NCAM可以刺激卵巢癌细胞的迁移与侵袭。
4 PSA与NCAM介导的细胞信号应答
4.1 NCAM或PSA-NCAM通过FGFR信号通路调节细胞增殖与粘附能力
FGFR属于一类新的受体激酶家族,能与FGF和HS形成三元复合物,也可以与NCAM直接结合而引发一系列的信号传导途径,参与胚胎发育、血管形成、伤口愈合等一系列生理过程的调节[29]。研究表明,NCAM、PSA-NCAM、PSA分别参与FGFR信号通路以调节细胞的增殖与粘附[24,25,30,31]。
4.1.1 NCAM介导的FGFR信号通路
NCAM可以依赖FGFR家族方式激活神经突生长,并伴随着各种级联信号的激活。如酪氨酸激酶 p59fyn(Tyrosine kinase p59fyn)、黏着斑激酶(Focal adhesion kinase,FAK)、磷脂酶(Phospholipase C)途径(PLC-γ pathway)、Ras-丝裂原蛋白活化激酶(Ras-mitogen-activated protein kinase)途径(p42/44 MAPK pathway)的激活等[32~34]。研究证实,NCAM主要通过调节β1-integrin介导的细胞基质粘着力来参与肿瘤的病变与淋巴结转移[32,35],而NCAM与FGFR结合不但可以影响FGF介导的信号通路,还对细胞增殖粘附能力起作用[36]。
4.1.2 PSA-NCAM介导的FGFR信号通路
虽然诸多文献报道了NCAM通过FGFR信号通路调节细胞生长和增殖的作用,但PSA-NCAM在这一过程中的可能作用仍缺少进一步的证据。Ono等[15]在分别过表达 STX和 PST的 NIH-3T3细胞中,发现FGF2介导的细胞生长受到抑制。该研究小组通过非变性凝胶电泳、凝胶过滤层析和SPR(Surface plasmon resonance)技术验证了FGF2可以与PSA结合,条件是PSA最小聚合度为17。与FGF2形成复合物的HS相比,PSA可以和FGF2形成更大、更复杂的FGF2低聚物,并同时与FGF受体相结合。以上结果说明,PSA- NCAM与FGF2的结合方式异于HS,它能直接与FGF2结合而参与FGF2-FGF受体信号通路的调节。在研究PSA与FGFR的作用时,该研究小组发现PSA不能与FGFR结合,说明PSA对FGF- FGFR信号通路的影响主要通过调节 FGF2分子在细胞内的浓度水平来实现。
4.1.3 PSA介导的FGFR信号通路
研究发现,PSA也可以通过非依赖于NCAM的信号通路介导细胞粘附的调节。Li等[25]阐述了由 PSA介导的细胞粘附机制,发现转染 STX的NIH-3T3细胞中FGFR、FAK、ERK1/2的磷酸化水平显著提高;而p59fyn的磷酸化水平因ECM中成分而异:肝素可以增强 p59fyn的磷酸化水平,FN(Fibronectin)反之,而 VN(Vitronectin)对 p59fyn的磷酸化水平无影响。PSA介导的细胞迁移增加的现象可能是由于FGFR、FAK、ERK1/2的活化而引起,而PSA介导的细胞粘附可能与p59fyn的活化有关。
4.2 NCAM 在上皮间质转化过程中通过非依赖于FGFR的信号通路调节细胞粘附
上皮间质转化(Epithelial-mesenchymal transition,EMT)过程被认为是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程。该过程中,细胞极性丧失,上皮细胞表型丢失,而获得了间质细胞的表型[30,37,38]。
Lehembre等[31]研究了EMT过程中NCAM对下游信号通路的影响。EMT发生前,E-cadherin在细胞表面的表达量较高,此时只有少量的NCAM与FGFR和PLCγ形成复合物,FGFR发送NCAM依赖性的信号,激活Raf-激酶PKCβII,持续保持MAPK 的活性以及增强细胞的粘附(图 4b)。当EMT发生后,E-cadherin发生功能性缺失,NCAM的表达量增加,同时一部分NCAM的表达重新定位于脂筏中,此时p59Fyn大量聚集并与NCAM结合,p59Fyn被磷酸化和激活,它的效应物FAK导致形成稳定的 β1-integrin介导的黏着斑,致使细胞延展性和转移性的增强(图4c)。与NCAM介导的 FGFR的信号通路比较,由 FGF介导的非NCAM依赖性的 FGFR信号通路则是通过 FGFs激活PLCγ/PKCα和Ras/Raf/MAPK信号途径积累FGFR,最终提高细胞的粘附和增殖能力(图4a)。因此,EMT过程影响了 NCAM介导的信号转导特性,这种信号通路转变的认识将有利于人们进一步认识肿瘤恶变过程的分子机制。
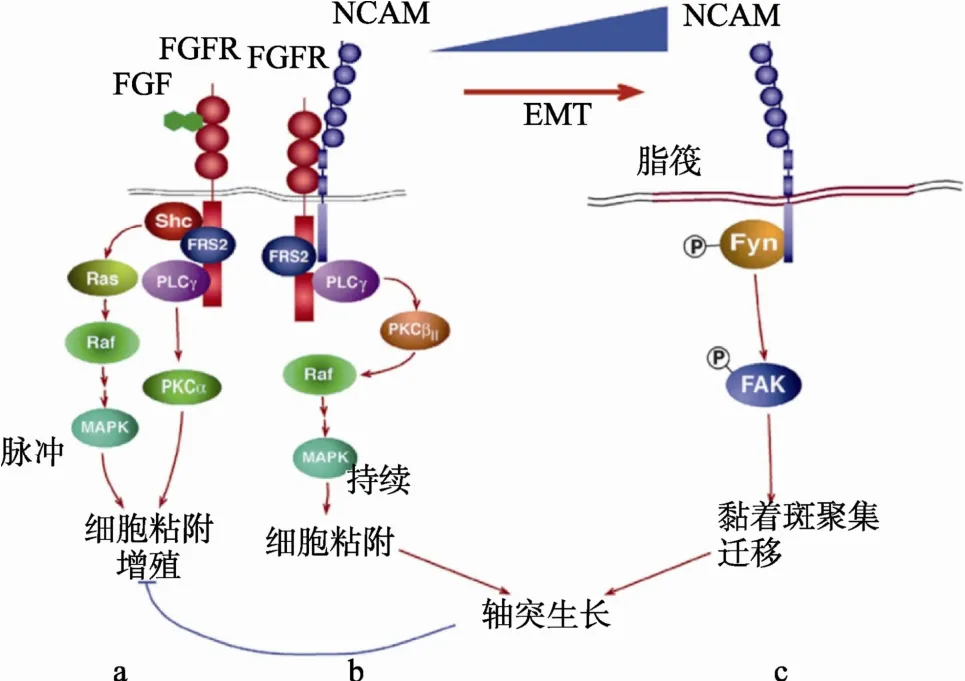
图4 基于NCAM亚细胞定位改变的分子机制(参考文献[31]并修改)
4.3 PSA与小分子配体结合调节细胞信号通路影响细胞迁移与粘附能力
在PSA介导的细胞应答中,与PSA结合的配体较少,包括 BDNF[39]、组蛋白 H1(Histone H1)[40]、FGF2[15]等。Theis等[41]证明富含丙氨酸的豆蔻酰化蛋白激酶C的作用底物(Myristoylated Alanine-rich C Kinase Substrate, MARCKS)也能作为配体直接与PSA相结合。MARCKS是蛋白激酶C(Protein Kinase C, PKC)的特异性底物蛋白,介导神经元表面信号与肌动蛋白的运动。在明确细胞信号转导过程中,底物蛋白磷酸化是各种信使系统作用的最后通路,在PKC的作用下,MARCKS发生磷酸化反应,参与跨膜信息传递与脑组织的发育,还在细胞转移、粘附、分泌,以及细胞的内摄、外放和吞噬中起作用。同时,PSA还有捕获儿茶酚胺神经递质的功能,包括多巴胺,可以通过多巴胺受体调节Akt信号通路[42]。
5 唾液酸转移酶STX与PST的检测可能成为临床诊断的重要手段
研究表明,两种多聚唾液酸转移酶(Polysialyltransferases)—ST8SiaII(STX)和 ST8SiaIV(PST)催化NCAM多聚唾液酸链的形成[43]。STX和PST在蛋白水平上有59%的同源性[44],二者可以在NCAM的第五和第六个糖基化位点上独立合成 PSA,或者协同作用合成更长的 PSA链,其特性比较见表 1。PST基因与STX基因是独立调控的,预示这两种酶有着不同的生物学作用。但是,每一个唾液酸转移酶在恶性肿瘤发展中的生物学作用尚未见报道。
Tanaka等[6]研究了 24例非小细胞肺癌(Nonsmall cell lung cancer, NSCLC)病例,发现表达PSA的 NSCLC病例中,STX基因在 I期肿瘤中的表达(4.2%)明显低于IV期肿瘤(85.7%),说明STX基因在肿瘤组织中的表达与肿瘤的发展进程密切相关。在NSCLC肿瘤组织中,只有肿瘤发展至后期STX基因才表达,然而PST基因在所有病例和正常肺部组织中都有表达,说明STX基因在NSCLC肿瘤病变过程中起重要作用。因此,STX基因可能是肺癌治疗的一个新目标,对临床标记具有重要的意义。另外,PST的mRNA水平表达的显著变化也在胰腺癌病例中得到证实:所有NCAM表达阳性的胰腺癌肿瘤细胞都表达STX和PST两种基因[24]。PSA的表达与癌症分级相关,PSA表达阳性的癌症中病患的5年存活率较低。针对不同癌症中STX和PST基因的表达差异,监控病情发展以及开展预前预后的工作已经应用到临床检测中。在神经母细胞瘤和横纹肌肉瘤病人的血清检查中,如果 PSA含量过高,则预示着有癌转移与恶变的倾向,而STX转录水平的检测已经成为断定病患是否患有转移性神经母细胞瘤疾病的标志[45]。

表1 STX与PST的特性比较
6 展 望
PSA及PSA-NCAM的研究,不仅对人们了解癌症发生与发展提供导向作用,更对临床工作提供更多的借鉴和指导。PSA还与多种人类重大疾病相关,例如老年痴呆症(Alzheimer’s Disease)、抑郁症、帕金森综合征和癫痫症等。老年痴呆症的标志为神经递质系统失调与突触丢失,可能存在某些特殊的神经化学类物质导致神经元退化以及突触重塑缺陷,研究发现NCAM影响脑源性神经营养因子BDNF的浓度水平,进而影响老年痴呆症的发生[46]。鉴于PSA与人类多种疾病的发生紧密相关,对 PSA以及PSA-NCAM的研究,尤其是PSA影响细胞多种下游信号通路的研究将成为热点。PSA通过FGFR信号通路增强细胞增殖能力,但也有报道指出PSA干扰了FGFR介导的细胞增殖现象[15]。因此,PSA的繁杂空间构象以及不同链长的存在形式影响了其载体糖蛋白功能,使PSA在不同的细胞中行使了不同的作用。PSA不同作用的发挥很可能存在其他信号通路的影响,有待深入研究探讨。
[1]Gascon E, Vutskits L, Kiss JZ. The role of PSA-NCAM in adult neurogenesis. Adv Exp Med Biol, 2010, 663: 127–136.
[2]Polo-Parada L, Bose CM, Plattner F, Landmesser LT.Distinct roles of different neural cell adhesion molecule(NCAM) isoforms in synaptic maturation revealed by analysis of NCAM 180 kDa isoform-deficient mice. J Neurosci, 2004, 24(8): 1852–1864.
[3]Liedtke S, Geyer H, Wuhrer M, Geyer R, Frank G, Gerardy-Schahn R, Zahringer U, Schachner M. Characterization of N-glycans from mouse brain neural cell adhesion molecule. Glycobiology, 2001, 11(5): 373–384.
[4]Bruses JL, Rutishauser U. Roles, regulation, and mechanism of polysialic acid function during neural development.Biochimie, 2001, 83(7): 635–643.
[5]Nakata D, TroyII FA. Degree of polymerization (DP) of polysialic acid (polySia) on neural cell adhesion molecules (N-CAMS): development and application of a new strategy to accurately determine the DP of polySia chains on N-CAMS. J Biol Chem, 2005, 280(46): 38305–38316.
[6]Tanaka F, Otake Y, Nakagawa T, Kawano Y, Miyahara R,Li M, Yanagihara K, Nakayama J, Fujimoto I, Ikenaka K,Wada H. Expression of polysialic acid and STX, a human polysialyltransferase, is correlated with tumor progression in non-small cell lung cancer. Cancer Res, 2000, 60(11):3072–3080.
[7]Sato C, Kitajima K. Disialic, oligosialic and polysialic acids:distribution, functions and related disease. J Biochem,2013, 154(2): 115–136.
[8]Wickramasinghe S, Medrano JF. Primer on genes encoding enzymes in sialic acid metabolism in mammals. Biochimie,2011, 93(10): 1641–1646.
[9]Nie H, Li Y, Sun XL. Recent advances in sialic acidfocused glycomics. J Proteomics, 2012, 75(11): 3098–3112.
[10]Falconer RA, Errington RJ, Shnyder SD, Smith PJ, Patterson LH. Polysialyltransferase: a new target in metastatic cancer. Curr Cancer Drug Targets, 2012, 12(8): 925–939.
[11]Inoue S, Iwasaki M. Isolation of a novel glycoprotein from the eggs of rainbow trout: occurrence of disialosyl groups on all carbohydrate chains. Biochem Biophys Res Commun,1978, 83(3): 1018–1023.
[12]Finne J. Occurrence of unique polysialosyl carbohydrate units in glycoproteins of developing brain. J Biol Chem,1982, 257(20): 11966–11970.
[13]Yabe U, Sato C, Matsuda T, Kitajima K. Polysialic acid in human milk - CD36 is a new member of mammalian polysialic acid-containing glycoprotein. J Biol Chem, 2003,278(16): 13875–13880.
[14]Curreli S, Arany Z, Gerardy-Schahn R, Mann D, Stamatos NM. Polysialylated neuropilin-2 is expressed on the surface of human dendritic cells and modulates dendritic cell-T lymphocyte interactions. J Biol Chem, 2007, 282(42):30346–30356.
[15]Ono S, Hane M, Kitajima K, Sato C. Novel regulation of fibroblast growth factor 2 (FGF2)-mediated cell growth by polysialic acid. J Biol Chem, 2012, 287(6): 3710–3722.
[16]Cheray M, Petit D, Forestier L, Karayan-Tapon L, Maftah A, Jauberteau MO, Battu S, Gallet FP, Lalloue F. Glycosylation-related gene expression is linked to differentiation status in glioblastomas undifferentiated cells.Cancer Lett, 2011, 312(1): 24–32.
[17]Jun L, Yuanshu W, Yanying X, Zhongfa X, Jian Y, Fengling W, Xianjun Q, Kokudo N, Wei T, Weixia Z, Shuxiang C. Altered mRNA expressions of sialyltransferases in human gastric cancer tissues. Med Oncol, 2012, 29(1):84–90.
[18]Aletsee-Ufrecht MC, Langley K, Rotsch M, Havemann K,Gratzl M. NCAM: a surface marker for human small cell lung cancer cells. FEBS Lett, 1990, 267(2): 295–300.
[19]Amoureux MC, Coulibaly B, Chinot O, Loundou A, Metellus P, Rougon G, Figarella-Branger D. Polysialic acid neural cell adhesion molecule (PSA-NCAM) is an adverse prognosis factor in glioblastoma, and regulates olig2 expression in glioma cell lines. BMC Cancer, 2010, 10: 91.
[20]Satoh F, Umemura S, Yasuda M, Osamura RY. Neuroendocrine marker expression in thyroid epithelial tumors.Endocr Pathol, 2001, 12(3): 291–300.
[21]Sentani K, Oue N, Noguchi T, Sakamoto N, Matsusaki K,Yasui W. Immunostaining of gastric cancer with neuroendocrine differentiation: Reg IV-positive neuroendocrine cells are associated with gastrin, serotonin, pancreatic polypeptide and somatostatin. Pathol Int, 2010, 60(4):291–297.
[22]Valentiner U, Muhlenhoff M, Lehmann U, Hildebrandt H,Schumacher U. Expression of the neural cell adhesion molecule and polysialic acid in human neuroblastoma cell lines. Int J Oncol, 2011, 39(2): 417–424.
[23]Kameda K, Shimada H, Ishikawa T, Takimoto A, Momiyama N, Hasegawa S, Misuta K, Nakano A, Nagashima Y,Ichikawa Y. Expression of highly polysialylated neural cell adhesion molecule in pancreatic cancer neural invasive lesion. Cancer Lett, 1999, 137(2): 201–207.
[24]Schreiber SC, Giehl K, Kastilan C, Hasel C, Muhlenhoff M, Adler G, Wedlich D, Menke A. Polysialylated NCAM represses E-cadherin-mediated cell-cell adhesion in pancreatic tumor cells. Gastroenterology, 2008, 134(5): 1555–1566.
[25]Li J, Dai G, Cheng YB, Qi X, Geng MY. Polysialylation promotes neural cell adhesion molecule-mediated cell migration in a fibroblast growth factor receptor-dependent manner, but independent of adhesion capability. Glycobiology, 2011, 21(8): 1010–1018.
[26]Evangelou A, Letarte M, Marks A, Brown TJ. Androgen modulation of adhesion and antiadhesion molecules in PC-3 prostate cancer cells expressing androgen receptor.Endocrinology, 2002, 143(10): 3897–3904.
[27]Ozaki H, Matsuzaki H, Ando H, Kaji H, Nakanishi H,Ikehara Y, Narimatsu H. Enhancement of metastatic ability by ectopic expression of ST6GalNAcI on a gastric cancer cell line in a mouse model. Clin Exp Metastasis,2012, 29(3): 229–238.
[28]Colombo N, Cavallaro U. The interplay between NCAM and FGFR signalling underlies ovarian cancer progression.Ecancermedicalscience, 2011, 5: 226.
[29]Jacobsen J, Kiselyov V, Bock E, Berezin V. A peptide motif from the second fibronectin module of the neural cell adhesion molecule, NCAM, NLIKQDDGGSPIRHY, is a binding site for the FGF receptor. Neurochem Res, 2008,33(12): 2532–2539.
[30]Granit RZ, Slyper M, Ben-Porath I. Axes of differentiation in breast cancer: untangling stemness, lineage identity, and the epithelial to mesenchymal transition. Wiley Interdisciplinary Reviews: Systems Biology and Medicine, 2014,6(1): 93–106.
[31]Lehembre F, Yilmaz M, Wicki A, Schomber T, Strittmatter K, Ziegler D, Kren A, Went P, Derksen PW, Berns A,Jonkers J, Christofori G. NCAM-induced focal adhesion assembly: a functional switch upon loss of E-cadherin.Embo J, 2008, 27(19): 2603–2615.
[32]Cavallaro U, Niedermeyer J, Fuxa M, Christofori G.N-CAM modulates tumour-cell adhesion to matrix by inducing FGF-receptor signalling. Nat Cell Biol, 2001, 3(7):650–657.
[33]Beggs HE, Baragona SC, Hemperly JJ, Maness PF. NCAM140 interacts with the focal adhesion kinase p125fak and the SRC-related tyrosine kinase p59fyn. J Biol Chem,1997, 272(13): 8310–8319.
[34] Niethammer P, Delling M, Sytnyk V, Dityatev A, Fukami K, Schachner M. Cosignaling of NCAM via lipid rafts and the FGF receptor is required for neuritogenesis. J Cell Biol,2002, 157(3): 521–532.
[35]Christofori G. Changing neighbours, changing behaviour:cell adhesion molecule-mediated signalling during tumour progression. Embo J, 2003, 22(10): 2318–2323.
[36]Kiselyov VV, Soroka V, Berezin V, Bock E.Structural biology of NCAM homophilic binding and activation of FGFR. J Neurochem, 2005, 94(5):1169–1179.
[37]Balanis N, Wendt MK, Schiemann BJ, Wang Z, Schiemann WP, Carlin CR. Epithelial to mesenchymal transition promotes breast cancer progression via a fibronectin-dependent STAT3 signaling pathway. J Biol Chem, 2013,288(25): 17954–17967.
[38]Qu C, Zhang WJ, Zheng GP, Zhang ZJ, Yin J, He ZM.Metformin reverses multidrug resistance and epithelial–mesenchymal transition (EMT) via activating AMP-activated protein kinase (AMPK) in human breast cancer cells. Mol Cell Biochem, 2014, 386(1–2): 63–71.
[39]Kanato Y, Kitajima K, Sato C. Direct binding of polysialic acid to a brain-derived neurotrophic factor depends on the degree of polymerization. Glycobiology, 2008, 18(12):1044–1053.
[40]Mishra B, von der Ohe M, Schulze C, Bian S, Makhina T,Loers G, Kleene R, Schachner M. Functional role of the interaction between polysialic acid and extracellular histone H1. J Neurosci, 2010, 30(37): 12400–12413.
[41]Theis T, Mishra B, von der Ohe M, Loers G, Prondzynski M, Pless O, Blackshear PJ, Schachner M, Kleene R.Functional role of the interaction between polysialic acid and myristoylated alanine-rich C kinase substrate at the plasma membrane. J Biol Chem, 2013, 288(9): 6726– 6742.
[42]Isomura R, Kitajima K, Sato C. Structural and functional impairments of polysialic acid by a mutated polysialyltransferase found in schizophrenia. J Biol Chem,2011, 286(24): 21535–21545.
[43]Angata K, Fukuda M. Polysialyltransferases: major players in polysialic acid synthesis on the neural cell adhesion molecule. Biochimie, 2003, 85(1–2): 195–206.
[44]Kurosawa N, Yoshida Y, Kojima N, Tsuji S. Polysialic acid synthase (ST8Sia II/STX) mRNA expression in the developing mouse central nervous system. J Neurochem,1997, 69(2): 494–503.
[45]Cheung IY, Vickers A, Cheung NK. Sialyltransferase STX(ST8SiaII): a novel molecular marker of metastatic neuroblastoma. Int J Cancer, 2006, 119(1): 152–156.
[46]Aisa B, Gil-Bea FJ, Solas M, García-Alloza M, Chen CP,Lai MK, Francis PT, Ramírez MJ. Altered NCAM expression associated with the cholinergic system in Alzheimer's disease. J Alzheimers Dis, 2010, 20(2): 659–668.

