基于报告基因检测的PXR、FXR和LXRα激动剂高通量筛选模型的建立
庄嘉琅,曾 行,钟国平,金 晶,苟晓丽,毕惠嫦,黄 民
(中山大学药学院药物代谢与药动学实验室,广东 广州 510006)
基于报告基因检测的PXR、FXR和LXRα激动剂高通量筛选模型的建立
庄嘉琅,曾行,钟国平,金晶,苟晓丽,毕惠嫦,黄民
(中山大学药学院药物代谢与药动学实验室,广东 广州510006)
黄民(1963-),男,博士,教授,博士生导师,研究方向: 临床药理学与药物基因组学,E-mail: huangmin@mail.sysu.edu.cn
摘要:目的 建立基于报告基因法的高通量筛选细胞模型,用来发现PXR、FXR和LXRα受体激动剂。方法利用Real-time定量PCR方法比较HEK293、HepG2和LS174T细胞中内源性核受体PXR、FXR和LXRα的表达量,将pSG5-hPXR和pGL3-XREM-CYP3A4、pEGFP-N3-hFXR和EcRE-TK-Luc、 pCMX-FLAG-hLXRα和pGL3-XREM-CYP3A4等质粒分别共转染到工具细胞中,优化共转染比例,并考察阳性药与萤光素酶报告基因表达强度的量效关系、模型特异性和稳定性。结果① 根据Real-time定量PCR结果,模型选用低表达PXR、FXR和LXRα的HEK293细胞作为工具细胞;② 根据不同共转染比例对报告基因活性的结果,PXR、FXR和LXRα报告基因药物筛选模型的报告基因和过表达质粒比例,最终分别选择1 ∶1、2 ∶1和2 ∶1;③ 模型中,报告基因活性均与相应阳性药物(PXR/Rif、FXR/CDCA和LXRα/T0901317)呈剂量依赖性增长;④ 仅PXR激动剂Rif、FXR激动剂CDCA和LXRα激动剂T0901317可分别明显增加相应筛选模型的报告基因活性,分别重复5次试验后,计算得Z′值分别为0.58、0.66和0.63。结论该研究建立的PXR、FXR和LXRα激动剂高通量筛选模型,具有良好的特异性和稳定性,适用于对PXR、FXR和LXRα受体激动剂的筛选,进而开发以核受体作为药物靶点的药物。
关键词:核受体;报告基因;高通量筛选;PXR;FXR;LXRα
核受体(nuclear receptors,NRs)为脂溶性配体依赖转录因子,现已明确核受体可根据配体分子的浓度调节靶基因的转录过程,在个体发育中参与多种生理功能的调节,如形态发育、细胞增殖分化、机体稳态维持、高级神经功能控制以及决定细胞命运等重要生命现象中发挥作用[1]。人类核受体家族包含48个成员,例如PXR、FXR、LXR、PPAR、VDR、RXR等。近年来,核受体家族在代谢性疾病领域受到广泛的关注,已有研究证明,它们与糖尿病、脂肪肝等疾病的发生发展密切相关,也被称为代谢性核受体。
目前,针对核受体包括PXR、LXR和FXR的药物筛选手段[2-4]包括:基于细胞的转录激活检测法、基于溶液的生物物理化学分析和基于计算机辅助的虚拟筛选等。相对而言,前者因基于生理状态更为有效。高通量筛选技术已成为目前药物筛选领域研究的重要课题[5],针对靶标的药物研发过程可以分为靶标的确立,先导化合物的发现,新药的研发,其中高通量筛选技术是先导化合物发现的关键,在药物研发过程中起重要作用,由于其具有快速、微量、高效、经济的特点,这一技术必将在未来的药物研究中发挥越来越重要的作用。而基于细胞的转录激活检测的报告基因筛选模型为高通量寻找新药提供了可能[6-8],通过将目的基因与双报告基因共转染入细胞中进行表达,配体结合到相应的受体,激活下游信号通路,报告基因响应这种信号的变化,使荧光素酶表达量发生变化。通过检测细胞中双报告基因荧光素酶的表达,来评估配体的功能和进行备选药物的高通量筛选。
因此,我们通过将PXR、FXR和LXRα的过表达质粒、相应的报告基因质粒以及内参质粒pRL-TK瞬时共转染工具细胞,利用高通量筛选平台检测各种化合物作用后萤光素酶的荧光值来研究化合物对PXR、FXR和LXRα转录活性的调控作用。
1材料与方法
1.1材料
1.1.1细胞和试剂HEK293人胚肾细胞、HepG2人肝癌细胞和LS174T人结肠癌细胞购自中国科学院上海生命科学研究院细胞资源中心,由本实验室保存;质粒pEGFP-N3-hFXR由本实验室构建,质粒pCMX-FLAG-hLXRα和EcRE-TK-Luc由美国匹兹堡大学谢文教授惠赠,质粒pSG5-hPXR由美国德克萨斯州大学Steven Kliewer教授惠赠,质粒pGL3-XREM-CYP3A4由美国堪萨斯大学Lawrence教授惠赠,质粒pRL-TK和Dual-Luciferase Reporter Assay System 购自美国Promega公司;利福平(rifampicin,RIF)、鹅去氧胆酸 (chenodeoxycholic acid,CDCA)、T0901317、CITCO、罗格列酮 (rogiglitazone,Rog)、DMSO(dimethyl sulfoxide) 均购自Sigma公司,培养基DMEM、培养基RPMI 1640、胎牛血清和胰酶购自美国Hyclone公司; LipofectamineTM2000和OPTI-MEM培养基购自美国Invitrogen公司。
1.1.2主要仪器SW-CJ-2FD型超净化工作台,苏州苏净集团安泰公司; BB16型二氧化碳培养箱,美国HERAEUS公司; XSZ-D2型显微镜,重庆光学仪器厂;2.0 light cycler 定量PCR仪,罗氏公司;M1000全波长多功能酶标仪,瑞士TECAN公司。
1.2方法
1.2.1细胞接种取对数生长期的HEK293人胚肾细胞、HepG2人肝癌细胞和LS174T人结肠癌细胞,以每孔5×104个细胞接种于96孔板中,每组做3个复孔,至细胞在96孔板中覆盖率达到80%~85%时即可进行转染。
1.2.2质粒转染按照脂质体LipofectamineTM2000试剂说明书,采用瞬时转染法分别将下列质粒与作为内参的pRL-TK质粒共转染进不同细胞:(1) pSG5-hPXR和pGL3-XREM-CYP3A4,(2) pEGFP-N3-hFXR和EcRE-TK-Luc,(3) pCMX-FLAG-hLXRα和pGL3-XREM-CYP3A4。
1.2.3药物处理细胞转染6 h后,更换含有药物的培养基,设空白对照组、阳性药物组和待测药物组。药物干预24 h后进行双萤光素酶报告基因检测。
1.2.4双荧光报告基因的检测药物作用24 h后,去除培养孔中的培养基,PBS溶液洗涤细胞1次,小心去除PBS溶液,每个培养孔中加入20 μL 1×PLB溶液,室温下震荡20 min。每孔再加入20 μL LARII溶液,检测萤火虫萤光素酶活性;再加入20 μL Stop & Glo®Reagent,启动海肾萤光素酶反应,检测海肾萤光素酶活性。
1.2.5结果分析每孔的萤光素酶活性值用海肾萤光素酶的活性进行校正,故最后每样品孔校正酶活性为:萤火虫萤光素酶活性值/海肾萤光素酶的活性值。相对荧光素酶活性=实验组荧光素酶活性/溶媒组荧光素酶活性。

1.2.6实时荧光定量PCR按TRIzol(Invitrogen)说明书步骤提取不同细胞株的总RNA,参照TaKaRa公司RT-PCR试剂盒说明书将总RNA逆转录成cDNA后进行荧光定量PCR检测。使用的引物序列如下Tab 1所示。
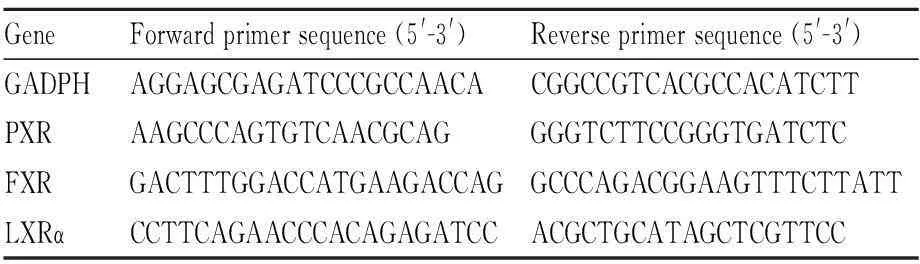
Tab 1 Primer sequences for RT-qPCR
按以下设置参数进行:94℃×1 min→95℃×30 s,59℃×30 s,72℃×30 s(45个循环)→95℃×10 s→65℃×45 s→40℃×60 s。选择GADPH为内参,通过检测目的基因相对于内参基因的表达变化来定量。采用GAPDH为内参照,以空白组为对照。2-ΔΔCt方法来分析数据:ΔCt=Ct目的基因-Ct内参,ΔΔCt =ΔCt样品-ΔCt对照。计算2-ΔΔCt的数值即为实验组目的基因相对于对照组的表达量的变化倍数。
1.2.7模型特异性和稳定性考察分别使用Rog和CITCO等经典核受体激动剂来刺激细胞,并与相应阳性对照组进行对比;选择国际公认的统计学参数Z′因子以确认筛选模型是否符合高通量筛选的要求,采用Z′因子分析法来进行评估,其计算公式为:
其中μC+:阳性对照组的平均值,μC-:阴性对照组的平均值;σC+:阳性对照组的标准偏差,σC-:阴性对照组的标准偏差。
2结果
2.1细胞株的选择为了消除内源性核受体对后续报告基因检测的影响,我们用RT-qPCR法检测了HEK293、HepG2和LS174T各细胞株中PXR、FXR和LXRα基因mRNA水平的表达,结果如Fig 1所示,HepG2细胞中PXR和FXR基因表达与其他两株细胞相比相对较高,LS174T和HepG2细胞中LXRα基因表达明显比HEk293细胞高,最后我们发现在HEK293细胞中PXR、FXR和LXRα基因表达水平都相对较低。结合HEK293细胞具有转染效率高,培养传代容易等优点,我们选用其作为核受体报告基因的药物高通量筛选模型的转染靶细胞。

Fig 1The mRNA expression of PXR, FXR and

**,## and △△P<0.01vsPXR, FXR and LXRα mRNA for HEK293.
2.2共转染质粒比例的优化在过表达质粒、报告基因质粒和内参质粒pRL-TK共转染HEK293细胞的实验中,为得到最佳的诱导效应,在总质粒量为200ng和pRL-TK为3ng不变的情况下,我们比较了报告基因质粒和过表达质粒的比例为10 ∶1、2 ∶1、1 ∶1、1 ∶2、1 ∶10几种情况下阳性药物(10 μmol·L-1Rif、10 μmol·L-1CDCA和10 μmol·L-1T0901317)对核受体的激动作用。根据Tab 2所示,本研究对于PXR、FXR和LXRα报告基因药物筛选模型的报告基因和过表达质粒比例最终分别选择1 ∶1、2 ∶1和2 ∶1。
Tab 2Effects of different plasmid ratios on fold of induction
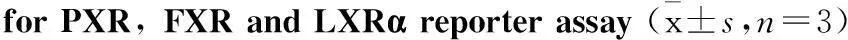
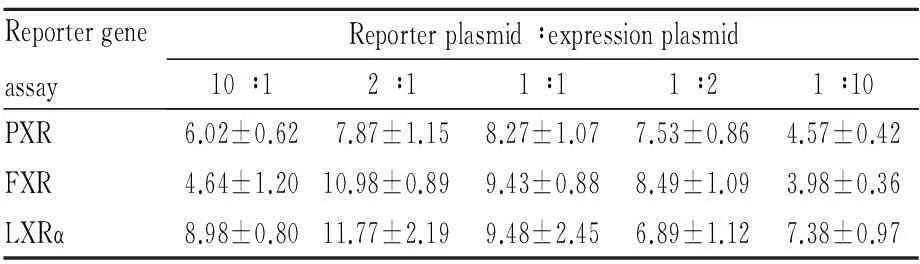
ReportergeneassayReporterplasmid∶expressionplasmid10∶12∶11∶11∶21∶10PXR6.02±0.627.87±1.158.27±1.077.53±0.864.57±0.42FXR4.64±1.2010.98±0.899.43±0.888.49±1.093.98±0.36LXRα8.98±0.8011.77±2.199.48±2.456.89±1.127.38±0.97
2.3阳性药与萤光素酶报告基因表达强度的量效关系根据所得到的最佳转染条件进行转染后给予相应阳性药,药物刺激24 h后检测双萤光素酶活性,结果如Fig 2所示,相对荧光素酶活性均与阳性药物呈剂量依赖性增长,其中,50 μmol·L-1RIf的诱导倍数可达到8左右,100 μmol·L-1CDCA时最高可达到30左右,5和10 μmol·L-1T0901317时最高可达到18以上。
2.4模型特异性和稳定性考察采用PXR激动剂Rif、FXR激动剂CDCA、LXRα激动剂T0901317、PPARγ激动剂Rog和组成型雄甾烷CAR受体激动剂CITCO对这3种核受体药物筛选模型的特异性进行考察。使用不同浓度的受试药物处理转染后的HEK293细胞,24 h后检测相对萤光素酶活性。结果如Fig 3所示,只有PXR阳性激动剂Rif、FXR阳性激动剂CDCA和LXRα阳性激动剂T0901317可对相对荧光素酶活性产生良好诱导,其他核受体激动剂都不能对PXR、FXR和LXRα产生激动作用。值得注意的是,由于T0901317为LXRα和PXR双激动剂,因此T0901317在PXR报告基因药物筛选模型中也能产生明显的萤光素酶活性。
按已确定的转染条件分别瞬转入PXR、FXR和LXRα的过表达质粒和报告基因质粒以及内参质粒pRL-TK的HEK293细胞给予相应阳性药,药物刺激24 h后检测双萤光素酶活性,根据方法“1.2.7”计算出PXR、FXR和LXRα药物高通量筛选模型的Z′因子,结果如Tab 3所示。结果表明,PXR、FXR和LXRα药物筛选模型的Z'因子均高于0.5;一般认为Z′因子值大于0.5时,说明该高通量筛选方法为比较理想的实验方法,可以接受,故这些模型的稳定性良好,可用于高通量筛选。

*P<0.05,**P<0.01vscontrol.


*P<0.05,**P<0.01vscontrol.

Tab 3 Z′ factor of 96-well plates for PXR, FXR and
3讨论
近年有研究认为[10],PXR和LXRα存在交叉协同作用,由于PXR和LXRα配体结合域的蛋白结构组成具有50%的同源性,因此部分外源物(如T0901317)可同时激活这两种受体,PXR与LXRα均能够与CYP3A基因中dNR1和eNR3A4元件相结合是PXR- CYP3A和LXRα-CYP3A途径相互交叉的结构基础。据此本研究以XREM作为报告基因的靶序列,建立了PXR和LXRα的药物高通量筛选模型。而另一方面,蜕皮激素响应元件 ecdysone response element(EcRE)[11]能被FXR的DNA结合域(DBD)所结合并启动下游基因的转录,故本研究选用FXR的内源报告基因EcRE和有本实验室构建的含FXR全长序列的pEGFP-N3-hFXR质粒共转染HEK293细胞,建立了FXR的药物高通量筛选模型。
目前,在细胞水平上基于核受体为治疗靶点进行药物筛选和评价的手段中,双萤光素酶报告基因检测法是现在开展高通量药物筛选研究用得最多的方法,该方法在传统的单萤光素酶报告基因检测法的基础上,加入了海肾萤光素酶报告基因作为内参对照,将实验报告基因的活力与内对照报告基因的活力作归一化,可消除实验中不同测试间所固有的变化,提高了检测的准确度和灵敏度,操作简便,符合高通量药物筛选的特点。同时,本研究选用内源性PXR、FXR和LXRα低表达的HEK293细胞作为高通量药物筛选模型的细胞载体,在加入不同浓度的Rif、CDCA或T0901317处理24 h后,发现PXR、FXR或LXRα的萤光素酶活性均明显升高,并呈现浓度依赖性上升。而另一方面,其他核受体激动剂如PPARγ激动剂Rog或CAR激动剂CITCO对细胞萤光素酶活性均无明显影响,该结果说明PXR、FXR和LXRα高通量药物筛选模型具有一定的特异性。进一步采用国际上公认的Z′因子对PXR、FXR和LXRα高通量药物筛选模型的稳定性进行评价,实验结果显示PXR、FXR和LXRα高通量药物筛选模型的Z′因子均大于0.5(分别为0.58、0.66和0.63),显示这3种高通量药物筛选模型具有良好的稳定性。
细胞核受体是许多疾病重要的药物靶点[12],当前,以核受体为靶点已经成为抗肿瘤和代谢性疾病药物研究的新热点。PXR作为人体内“最主要的异物感感受器”,是 CYP3A4 基因转录的关键调控因子,对异源物(食物、药物和其他成分)的代谢中起到了关键作用,PXR可以通过促进药物代谢酶和药物转运蛋白的表达来应对药物及其他外来化学物质,进而影响它们的生物转化率,并将其清除出体外。本实验室前期研究结果[13-14]发现多种中药单体在建立于HepG2或Huh7细胞的PXR-CYP3A4 报告基因检测体系中,均能经过PXR受体通路诱导CYP3A4 荧光素酶的表达,这为研究中药代谢与中药-化学药相互作用和中药配伍毒性提供了新的思路和方法,因此本研究中的PXR高通量药物筛选模型也是本实验室前期对PXR报告基因检测体系研究的发展。
随着对核受体研究的深入,脂质、葡萄糖代谢已经与Ⅱ型糖尿病、肥胖和动脉粥样硬化这类疾病联系起来,在疾病的治疗和发展中发挥着重要的作用。FXR和LXRα作为体内重要的代谢调节因子,前者的激活能够维持胆汁酸在肝脏和小肠中的正常循环和稳态,同时能够调节糖类、脂类和胆固醇的水平,成为治疗代谢疾病(如胆汁阻塞、胆结石、非酒精性脂肪肝、动脉粥样硬化和糖尿病等)出色的药物靶分子;而后者作为一种体内胆固醇感受器,可控制脂肪和胆固醇的合成、吸收、转运及分解,调控机体的脂肪和胆固醇平衡,同时由于其具有的抗炎作用,使得LXRα的激动剂有望成为非他汀类的治疗高胆固醇、肥胖症和动脉粥样硬化的极具潜力的新药靶点。LXRα的激动剂成为治疗人体中由于胆固醇代谢、脂代谢和糖代谢的平衡紊乱而导致的包括糖尿病、高血脂、高胆固醇、高血压、动脉粥样硬化、冠心病、肥胖症和代谢综合症等多种疾病的治疗药物。因此,筛选以FXR和LXRα为靶标的药物具有重要的应用价值。目前世界各大制药公司和研发机构都在积极进行FXR和LXRα激动剂药物的研发,并有诸多化合物进行了专利申请。
本研究建立的以检测PXR、FXR和LXRα靶基因表达的双萤光素酶报告基因筛选模型,是一种快捷有效的高通量筛选工具,可进一步筛选具有PXR、FXR或LXRα激动剂活性的化学合成物、天然药物或食物成分。
参考文献:
[1]Beato M, Herrlich P, Schutz G. Steroid hormone receptors: many actors in search of a plot[J].Cell, 1995, 83(6): 851-7.
[2]Glickman J F, Wu X, Mercuri R, et al. A comparison of ALPHAScreen, TR-FRET, and TRF as assay methods for FXR nuclear receptors[J].JBiomolScreen, 2002, 7(1): 3-10.
[3]Raucy J L, Lasker J M. Cell-based systems to assess nuclear receptor activation and their use in drug development[J].DrugMetabRev, 2013, 45(1): 101-9.
[4]Jin L, Feng X, Rong H, et al. The antiparasitic drug ivermectin is a novel FXR ligand that regulates metabolism[J].NatCommun, 2013, 4.
[5]李韶菁, 杜冠华.细胞水平的高通量药物筛选技术研究进展[J].中国药学杂志, 2008, 43(2): 84-7.
[5]Li S Q, Du G H. The research progress in advances on the High-throughput Screening of drugsinvitro[J].ChinPharmJ, 2008, 43 (2): 84-7.
[6]孙颖, 蔡海燕, 沈敬山, 等.5-羟色胺1A受体激动剂高通量筛选模型的建立[J].中国药理学通报, 2012, 28(5): 731-6.
[6]Sun Y, Cai H Y, Shen J S, et al.A method for tracheal intubation of mice under direct vision through head wearing kind magnifying glass[J].ChinPharmacolBull, 2012, 28 (5): 731-6.
[7]戴清源, 陈祥贵, 杨潇, 罗静.STAT5b靶控报告基因检测胰岛素受体激酶活性细胞模型的建立[J].中国药理学通报, 2009, 25(2): 267-9.
[7]Dai Q Y, Chen X G, Yang X, Luo J.Establishment of cell model for determining activity of insulin receptor kinase by STAT5b responsive reporter gene[J].ChinPharmacolBull, 2009, 25(2): 267-9.
[8]邵帅, 马增春, 洪倩,等.基于Nrf2-ARE通路的抗辐射有效活性成分筛选研究[J].中国药理学通报, 2012, 28 (1): 29-33.
[8]Shao S, Ma Z C, Hong Q, et al.Screening antioxidants to protect radiation via Nrf2-ARE reporter gene[J].ChinPharmacolBull, 2012, 28 (1): 29-33.
[9]McKenna N J, O′Malley B W. Combinatorial control of gene expression by nuclear receptors and coregulators[J].Cell, 2002, 108(4): 465-74.
[10]Watanabe K, Sakurai K, Tsuchiya Y, et al. Dual roles of nuclear receptor liver X receptor α (LXRα) in the CYP3A4 expression in human hepatocytes as a positive and negative regulator[J].BiochemPharmacol, 2013, 86(3): 428-36.
[11]Forman B M, Goode E, Chen J, et al. Identification of a nuclear receptor that is activated by farnesol metabolites[J].Cell, 1995, 81(5): 687-93.
[12]Olefsky J M. Nuclear receptor minireview series[J].JBiolChem, 2001, 276(40): 36863-4.
[13]Liu Y, Mo S, Bi H, et al. Regulation of human pregnane X receptor and its target gene cytochrome P450 3A4 by Chinese herbal compounds and a molecular docking study[J].Xenobiotica, 2011, 41(4): 259-80.
[14]邓蓉蓉, 毕惠嫦, 金晶, 等.白藜芦醇通过拮抗hPXR对P-gp的影响[J].中国药理学通报, 2013, 29 (4): 501-2.
[14]Deng R R, Bi H C, Jin J, et al.Effect of resveratrol onexpressionandactivityof P-gp through human pregnane X receptor pathway[J].ChinPharmacolBull, 2013, 29 (4): 501-2.
网络出版时间:2015-1-9 13:37网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.02.028.html
◇实验方法学◇
Establishment of cell models for PXR, FXR and LXRα agonists
high-throughput screening based on reporter gene assay
ZHUANG Jia-lang,ZENG Hang,ZHONG Guo-ping,JIN Jing,Gou Xiao-li,BI Hui-chang, HUANG Min
(LaboratoryofDrugMetabolismandPharmacokinetics,SchoolofPharmaceuticalSciences,
SunYat-SenUniversity,Guangzhou510006,China)
Abstract:AimTo develop an in vitro high throughput drug screening system based on reporter gene assay for identification of novel compounds with PXR, FXR and LXRα agonist activity. MethodsThe expressions of exogenous PXR, FXR and LXRα gene in HEK293, HepG2 and LS174T cells were examined by Real-Time quantity PCR. pSG5-hPXR and pGL3-XREM-CYP3A4, pEGFP-N3-hFXR and EcRE-TK-Luc, pCMX-FLAG-hLXRα and pGL3-XREM-CYP3A4 were cotransfected into cells and the optimal ratio of three plasmids was determined. The dose-response relationship between the positive drug and the fold induction was determined. The specificity of the model was examined, and the repeatability was also determined by Z′ value. Results① The PXR,FXR and LXRα mRNA expression in HEK293 cell is low among three different cells. ② reporter gene vector and expression plasmid ratio of 1 ∶1, 2 ∶1 and 2 ∶1 were proved to be suitable for highest relative luciferase activity for PXR, FXR or LXRα agonist screening model. ③ The relative luciferase activity was induced by Rif, CDCA or T0901317 in a dose-dependent manner. ④ Only Rif, CDCA or T0901317 could significantly increase the relative luciferase activity in PXR,FXR or LXRα agonist screening model, no effect of other nuclear receptors agonist was observed, and the values of Z′-factor for PXR, FXR and LXRα agonist screening model were 0.58, 0.66 and 0.63,respectively. ConclusionAn in vitro PXR, FXR and LXRα agonist high-throughput screening models are developed with acceptable specificity and repeatability, and the models can be used to screen PXR, FXR and LXRα agonist.
Key words:nuclear receptor;reporter gene;high-throughput screening;PXR;FXR;LXRα
作者简介:庄嘉琅(1990-),男,硕士生,研究方向: 临床药理学与药物基因组学,E-mail:zhjial2@mail2.sysu.edu.cn;
基金项目:广东省新药设计与评价重点实验室开放基金(No 2011 A060901014-009)
收稿日期:2014-10-10,修回日期:2014-11-05
文献标志码:中国图书分类号:R392.11;R394.2;R394.3;R965.1
doi:10.3969/j.issn.1001-1978.2015.02.028

