褪黑素减轻博来霉素诱发小鼠肺纤维化早期的内质网应激反应
曹林峰,赵 卉,秦厚应,张 程,徐德祥
(1.安徽医科大学第二附属医院呼吸内科,安徽 合肥 230601;2.安徽医科大学卫生毒理学系,安徽 合肥 230032)
褪黑素减轻博来霉素诱发小鼠肺纤维化早期的内质网应激反应
曹林峰1,赵卉1,秦厚应1,张程2,徐德祥2
(1.安徽医科大学第二附属医院呼吸内科,安徽 合肥230601;2.安徽医科大学卫生毒理学系,安徽 合肥230032)
中国图书分类号:R-332;R329.24;R563.13;R977.1
摘要:目的探讨褪黑素(MT)是否能减轻由博来霉素(BLM)诱发小鼠肺纤维化早期的内质网应激反应。方法将成年健康♂ ICR小鼠随机分为对照组、MT组、BLM组和MT+BLM组。MT组小鼠给予生理盐水前30 min经腹腔注射MT(10 mg·kg-1),并在给予生理盐水后按每24 h一次经腹腔注射MT(10 mg·kg-1),BLM组小鼠经气管插管单次给予BLM(5 mg·kg-1),MT+BLM组小鼠在给予BLM(5 mg·kg-1)前30min经腹腔注射给予MT(10 mg·kg-1),并在给予BLM后按每24 h一次经腹腔注射给予MT(10 mg·kg-1),对照组小鼠经气管插管给予等容积的生理盐水。各组分别在BLM处理后不同时间点(24、72 h)剖杀小鼠并取材,肺组织进行病理切片,HE染色法观察肺部炎性细胞浸润情况,Western blot检测内质网(ER)应激相关蛋白(GRP78、p-eIF2α和p-IRE1α)的表达水平,免疫组化检测ER应激相关蛋白(GRP78、p-IRE1α、ATF6α和p-PERK)的分布。结果成功构建了小鼠肺纤维化急性炎症模型;在BLM处理后,肺重、肺重比和肺炎性细胞浸润明显增加,并呈明显时间-效应关系;MT可明显降低BLM引起的肺重和肺重比增加,减轻肺部炎性细胞浸润;Western blot显示,MT处理后明显对抗BLM引起的ER应激敏感蛋白GRP78蛋白的上调,抑制BLM引起的UPR通路相关蛋白eIF2α和IRE1α磷酸化;免疫组化结果显示,MT可降低BLM诱导的ER应激相关蛋白GRP78、p-IRE1α、ATF6α和p-PERK的表达。结论MT可减轻BLM诱发的小鼠肺纤维化早期ER应激反应。
关键词:褪黑素;博来霉素;炎症;肺纤维化;内质网应激;GRP78蛋白
特发性肺纤维化是一种致命性的肺部疾病,其进展缓慢、预后差。诊断后平均生存期为3年,目前临床上药物治疗效果不佳,其发病机制仍不明确[1]。目前,对于肺纤维化的研究主要集中于采用博来霉素(bleomycin,BLM)诱导的小鼠肺纤维化模型[2],通过对该模型的研究发现其发病机制可能与氧化应激[3]、炎症反应、上皮间质转化(epithelial-to-mesenchymal transition,EMT)[4-5]等有关。最近的研究证实,内质网应激(endoplasmic reticulum stress,ER stress)也参与肺纤维化的发生发展过程[6,7]。
褪黑素(melatonin,MT)是脊椎动物松果体产生和释放的一种神经激素,MT通过抗氧化及抗炎作用对BLM诱导的小鼠慢性肺纤维化起保护作用[8]。最近的研究表明,MT对BLM诱导的小鼠慢性肺纤维化的保护可能通过抑制ER stress反应起作用[9]。另一方面,肺纤维化的形成需经历炎症期、纤维化形成期、纤维化进展期等阶段[10],其中,早期炎症对慢性纤维化的形成起关键作用。而ER 是维持细胞生存和正常功能所必需的一种重要细胞器,在受到外界化学等刺激后可以通过ER stress引起炎症反应[7],但在BLM诱发小鼠肺纤维化早期,MT是否影响ER stress反应尚不清楚。本研究在BLM诱导小鼠肺纤维化早期炎症的基础上,进一步探讨了MT对BLM诱导小鼠肺纤维化早期的保护作用是否影响ER stress反应。
1材料与方法
1.1主要试剂 MT购于美国Sigma化学试剂公司(批号:SLBC7539V);BLM购于日本化药株式会社(批号:430312);GRP78(批号:3177S)、p-PERK(批号:3719S)、p-eIF2α(批号:9721S)抗体购自美国Cell Signal公司;ATF6α(批号:A2811)抗体购自美国Santa Cruz公司;β-actin(批号:BM0627)抗体购自武汉博士德生物工程有限公司;p-IRE1α(批号:16927)和ECL发光液购自美国Thermo Scientifis公司(批号:LB141873);SP免疫组化试剂盒购自北京中杉金桥生物公司(批号:13152); DAB购自Sigma公司;无水乙醇(纯度>99.7%)购于上海振企化学试剂有限公司;其他试剂均购自Sigma公司。
1.2实验动物♂ ICR小鼠,6~8周龄,(30±2) g,清洁级,购自安徽医科大学实验动物中心。实验前适应性喂养1周(自由进食标准饲料、水,维持12 h光照和12 h黑暗的昼夜节律,温度20℃~25℃,相对湿度(50±5)%。
1.3动物分组和处理36只♂ ICR成年健康小鼠随机分为对照组(Control组)、MT组各6只,BLM组和MT+BLM组各12只。BLM组小鼠采用腹腔给予10%水合氯醛麻醉(3 ml·kg-1),约10 min后小鼠完全麻醉,予以微量注射器行气管插管滴注单次给予BLM(5 mg·kg-1),立即将小鼠直立沿顺时针及逆时针各旋转1 min,使药物均匀分布;Control组小鼠经气管插管给予等容积的生理盐水;MT+BLM组小鼠在给予BLM(5 mg·kg-1)前30 min和给予BLM后按每24 h一次经腹腔注射给予MT(10 mg·kg-1),MT组小鼠在给予生理盐水前30 min和给予生理盐水后按每24 h一次经腹腔注射MT(10 mg·kg-1)。分别在BLM处理后不同时间点(24、72 h)剖杀小鼠并取材,称量肺脏重量,取部分肺脏组织放入4%多聚甲醛溶液固定,其余肺脏组织放入-80 ℃冰箱中保存。
1.4HE染色肺脏组织经4%多聚甲醛溶液固定后,石蜡包埋,切片,常规石蜡切片,酒精梯度脱蜡至水化,苏木精染色3 min,流水冲洗10 min,伊红染色2 min,流水冲去浮色,梯度酒精脱水,二甲苯透明,中性树胶封片。同时,每张病理切片分别进行病理评分,定义0为正常肺组织,1、2、3、4和5分别表示炎性细胞浸润的范围百分比分别为10%、10%~30%、30%~80%和80%以上。
1.5Western blot取一定量的肺脏组织,加入组织裂解液制备成20%的组织匀浆液,离心、取上清、定量、蛋白变性。总蛋白样品经SDS-PAGE电泳后转移到PVDF膜,5%脱脂牛奶溶液封闭后,分别用GRP78、p-eIF2α或p-IRE1α等一抗室温孵育3 h,DPBST浸洗液浸洗3次(每次10 min),用DPBS洗一次(10 min),用对应的IgG二抗(羊抗鼠或羊抗兔)孵育2 h,DPBST浸洗液浸洗3次(每次10 min),用DPBS洗一次(10 min),再用ECL发光液孵育5 min,于自动成像仪曝光摄片。运用Carestream Molecular Imaging (MI) Software图像分析软件测定各蛋白条带的灰度值。
1.6免疫组织化学染色肺脏组织的常规石蜡切片经酒精梯度脱蜡至水化,于切片上滴加0.3%过氧化氢,室温下10 min,PBS冲洗3次,每次5 min,柠檬酸钠缓冲液微波中高火修复抗原2次,每次5 min,用5%的羊血清来封闭非特异性蛋白,37℃恒温30 min;分别用GRP78、p-IRE1α、ATF6α或p-PERK一抗孵育,37℃恒温30 min,再置4℃冰箱过夜;相应二抗孵育,37℃恒温30 min;再进行SP反应,DAB显色,经复染、脱水、透明、封片。在光学显微镜(×100)观察各内质网应激蛋白分布情况。

2结果
2.1MT对BLM所致小鼠肺纤维化早期肺损伤的生理指标影响 与Control组相比,小鼠给予BLM处理后24 h与72 h的肺重和肺重比明显增加(Tab 1,P<0.05),而72 h较24 h肺重增加更为明显。与单纯BLM处理后24 h相比,MT+BLM处理后24 h的肺重及肺重比有所减低,差异没有统计学意义。与BLM处理后72 h相比,MT+BLM处理后72 h肺重及肺重比有所降低(Tab 1,P<0.05),差异有统计学意义。
2.2MT对BLM所致小鼠肺纤维化早期肺损伤的病理影响肺组织HE染色显示,给予BLM处理24 h与72 h后,肺泡内出现明显炎性细胞浸润,但肺间质及肺泡壁未见明显破坏(Fig 1A)。与Control组相比,BLM处理72 h和24 h后,HE染色肺病理评分有明显提高(P<0.05),并且72 h炎性细胞浸润及病理评分都较24 h更为明显(Fig 1B)。如Fig 1A所示,与单纯BLM处理后24 h相比,MT+BLM处理后24 h的小鼠肺炎性细胞浸润有所减轻,并且MT+BLM处理后72 h比BLM处理后72 h减轻明显。如Fig 1B所示,与BLM处理后72 h相比,MT+BLM处理后72 h的HE染色病理评分明显降低(P<0.05)。
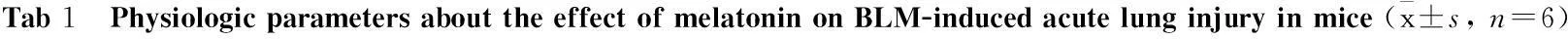

GroupControlMTBLM24h72hMT+BLM24h72hLungweight/g0.189±0.0070.186±0.0110.214±0.011*0.230±0.007*0.205±0.0100.209±0.014#Lungweightratio/%0.598±0.0130.598±0.0200.704±0.027*0.755±0.038*0.654±0.9400.662±0.045#
*P<0.05vscontrol group;#P<0.05vsBLM 72 h.

±s, n=6)
1:Control; 2:MT; 3:BLM 24 h; 4: MT+BLM 24 h; 5:BLM 72 h; 6:MT+BLM 72 h
*P<0.05vscontrol group;#P<0.05vsBLM in each group.
2.3Western blot检测MT对BLM所致小鼠肺纤维化早期的ER stress相关蛋白的影响给予BLM 72 h后小鼠肺组织中GRP78的表达较Control组明显升高(Fig 2A,P<0.05),并且eIF2α和IRE1α磷酸化水平在BLM处理72 h后较Control组明显增加。而与单纯BLM处理后72 h比较,MT+BLM处理后72 h小鼠肺组织中GRP78的表达明显降低(Fig 2,P<0.05)。同样,与BLM处理后72 h相比,MT+BLM处理后72 h小鼠肺组织中IRE1α和eIF2α的磷酸化水平明显降低(Fig 2,P<0.05)。
2.4免疫组化检测MT对BLM所致小鼠肺纤维化早期的ER stress相关蛋白的影响如Fig 3所示,与Control组比较,BLM处理后小鼠肺组织GRP78、p-IRE1α、ATF6α和p-PERK的免疫组化结果中DAB显色阳性的细胞明显增加。与单纯BLM处理后72 h比较,MT+BLM处理后72 h小鼠肺组织GRP78、p-IRE1α、ATF6α和p-PERK的免疫组化结果中DAB显色阳性的细胞明显减少。
3讨论
BLM诱发的小鼠肺纤维化模型经历炎性期、纤维化形成期、纤维化进展期。本研究以炎性期为研究基础,发现在肺纤维化炎症期,小鼠肺重及肺重比明显升高,同时肺组织HE染色可见炎性细胞浸润,而肺间质及肺泡壁未见明显破坏,同时病理评分结果与HE染色结果一致,炎性损伤呈时间-效应关系。另一方面,我们的研究结果显示,与BLM组的小鼠相比,给予MT干预的小鼠肺组织中炎性细胞的浸润明显减少,且病理评分也明显降低,这与Kim等[11]报道的MT对肺纤维化保护机制与抗炎作用有关相一致。这些结果都表明炎症在BLM诱发的小鼠肺纤维化的形成过程中起着重要的作用。


A: GRP78 in the lungs was detected by immunoblots; B: p-eIF2α in the lungs was detected using immunoblots; C: p-IRE1α in the lungs was detected by immunoblots.*P<0.05vscontrol group;#P<0.05vsBLM 72 h group.

Fig 3 Effects of melatonin on BLM-induced ER stress determined by immunohistochemistry at 72 h (×100)
最近的研究表明,ER stress 反应在炎症发生过程中起重要作用[7,12]。内质网(endoplasmic reticulum,ER)是真核生物的一个细胞器,它在蛋白质的折叠、脂类合成、糖原的合成和储存以及钙的代谢等方面起决定性的作用[13]。各种生理和病理刺激,如化学损伤、DNA损伤,缺氧、氧化应激和营养缺乏,都会干扰ER的功能,继而导致错误折叠或未折叠的蛋白质在ER腔内大量堆积,从而导致ER stress。ER stress激活未折叠蛋白反应(unfolded protein response,UPR),UPR分别通过激活蛋白激酶R样内质网激酶(PERK)、肌醇蛋白酶1(IRE1)和活化转录因子6(ATF6)三条通路减少蛋白的合成、加快正常蛋白的折叠以及异常蛋白的降解,若UPR失代偿则产生细胞损伤[14]。ER stress可以通过激活ATF6、PERK和IRE1三条通路引起炎症反应、EMT及异常修复机制而引起肺纤维化[13-14]。为进一步明确MT保护机制是否涉及ER stress,我们使用Western blot及免疫组化检测BLM处理后72 h ER stress相关蛋白表达情况。ER分子伴侣GRP78与ER stress的UPR的三个跨膜蛋白ATF6、PERK和IRE1相结合,维持细胞稳态,当受到外界刺激时,该蛋白与跨膜蛋白解离,激活UPR三条通路,在UPR反应后其本身表达可被上调,是ER stress的敏感蛋白。本研究结果发现,当给予BLM处理后GRP78表达升高,而给予MT处理后明显降低了BLM对GRP78的上调作用。跨膜蛋白PERK在ER stress反应时通过磷酸化方式激活,使下游eIF2α磷酸化,继而激活核因子κB(NK-κB)引起炎症反应,我们通过检测p-PERK发现,MT可以明显抑制BLM诱导的PERK磷酸化水平与分布范围。IRE1α可通过磷酸化激活c-Jun氨基末端激酶(JNK)信号通路引起炎症反应,我们的研究也发现,给予MT后可明显抑制BLM诱导的IRE1α磷酸化水平与分布范围。ATF6激活后可通过p38引起炎症反应,我们观察了ATF6分布情况,结果发现给予MT后,ATF6α分布较单纯BLM分布减少。我们的以上研究结果表明,在BLM所致小鼠肺纤维化早期MT明显抑制了ER stress反应的三条通路[13]。
ER stress 激活UPR通路后可分别通过三条通路,引起炎症反应[5], ER stress也可引起氧化应激,同时氧化应激和炎症反应又能进一步加重ER stress[15]。文献报道[16]MT对肺纤维化形成的保护机制可能与其有抗氧化应激及抗炎症作用都有关。本研究发现,MT对BLM所致的小鼠早期损伤的保护作用可能与抑制ER stress有关,但MT是直接通过影响ER stress相关蛋白,还是通过影响氧化应激或炎症反应继而间接影响ER stress相关蛋白,抑或通过ER stress、炎症反应及氧化应激三种机制共同起保护作用,在本研究中并没有完全阐明,有待进一步研究。因此,根据本研究结果可得出的结论是MT能减轻BLM引起小鼠肺纤维化早期的损伤并抑制ER stress。总之,本研究阐明了MT对肺纤维化早期炎症期的保护作用及其部分机制,为应用于临床治疗提供了新的证据。
参考文献:
[1]Zolak J S, de Andrade J. A idiopathic pulmonary fibrosis [J].ImmunolAllergyClinNorthAm, 2012, 32(4): 473-85.
[2]Limjunyawong N, Mitzner W, Horton M R. A mouse model of chronic idiopathic pulmonary fibrosis [J].PhysiolRep, 2014, 2(2): e249.
[3]钟长军, 李琳, 李俊, 等. 氧化应激在特发性肺纤维化中的作用及其机制研究进展[J]. 中国药理学通报, 2012,28(2): 169-72.
[3]Zhong C J, Li L, Li J, et al. The role and mechanisms of oxidative stress in idiopathic pulmonary fibrosis[J].ChinPharmacolBull, 2012,28(2): 169-72.
[4]高建, 刘干, 李俊. 肺成纤维细胞在肺纤维化进程中的作用[J]. 中国药理学通报, 2010,26(9): 1125-8.
[4]Gao J, Liu G, Li J. The role of fibroblast in pulmonary fibrosis[J].ChinPharmacolBull, 2010,26(9): 1125-8.
[5]Rydell-Tormanen K, Andreasson K, Hesselstrand R, et al. Extracellular matrix alterations and acute inflammation; developing in parallel during early induction of pulmonary fibrosis [J].LabInvest, 2012, 92(6): 917-25.
[6]Baek H A, Kim D S, Park H S, et al. Involvement of endoplasmic reticulum stress in myofibroblastic differentiation of lung fibroblasts [J].AmJRespirCellMolBiol, 2012, 46(6): 731-9
[7]Hotamisligil G S. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease [J].Cell, 2010, 140(6): 900-17.
[8]Arslan S O, Zerin M, Vural H, et al. The effect of melatonin on bleomycin-induced pulmonary fibrosis in rats [J].JPinealRes, 2002, 32(1): 21-5.
[9]Zhao H, Wu Q Q, Cao L F, et al. Melatonin inhibits endoplasmic reticulum stress and epithelial-mesenchymal transition during bleomycin-induced pulmonary fibrosis in mice [J].PLoSOne, 2014, 9(5): e97266.
[10]Moeller A, Ask K, Warburton D, et al. The bleomycin animal model: a useful tool to investigate treatment options for idiopathic pulmonary fibrosis[J].IntJBiochemCellBiol, 2008, 40(3): 362-82.
[11]Kim G D, Lee S E, Kim T H, et al. Melatonin suppresses acrolein-induced IL-8 production in human pulmonary fibroblasts [J].JPinealRes, 2012, 52(3): 356-64.
[12]Wang J Q, Chen X, Zhang C, et al. Phenylbutyric acid protects against carbon tetrachloride-induced hepatic fibrogenesis in mice [J].ToxicolApplPharmacol, 2013, 266(2): 307-16.
[13]Tanjore H, Lawson W E, Blackwell T S. Endoplasmic reticulum stress as a pro-fibrotic stimulus [J].BiochimBiophysActa, 2013, 1832(7): 940-7.
[14]Tanjore H, Blackwell T S, Lawson W E. Emerging evidence for endoplasmic reticulum stress in the pathogenesis of idiopathic pulmonary fibrosis [J].AmJPhysiolLungCellMolPhysiol, 2012, 302(8): L721-9.
[15]Cao S S, Kaufman R J. Endoplasmic reticulum stress and oxidative stress in cell fate decision and human disease[J].AntioxidRedoxSignal, 2014, 21(3): 396-413.
[16]Wu W S, Chou M T, Chao C M, et al. Melatonin reduces acute lung inflammation, edema, and hemorrhage in heatstroke rats [J].ActaPharmacolSin, 2012, 33(6): 775-82.
网络出版时间:2015-1-9 13:37网络出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.02.016.html
Melatonin alleviates endoplasmic reticulum stress at an early stage
during bleomycin-induced lung fibrosis in mice
CAO Lin-feng1, ZHAO Hui1, QIN Hou-ying1, ZHANG Cheng2, XU De-xiang2
(1.DeptofRespiratory,theSecondAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230601,China;
2.DeptofToxicology,AnhuiMedicalUniversity,Hefei230032,China)
Abstract:AimTo investigate whether melatonin (MT) can alleviate endoplasmic reticulum(ER) stress at an early stage of bleomycin(BLM)-induced lung fibrosis in mice. MethodsAdult healthy male ICR mice were divided randomly into control group, MT group, BLM group and MT+BLM group. In MT group, mice had saline treatment 30 minutes after having the intraperitoneal injection of MT (10 mg·kg-1) and had been intraperitoneally injected with MT once in the following every 24 hours. In BLM group, mice were intratracheally injected with a single dose of BLM (5 mg·kg-1). In MT+BLM group, mice had been intraperitoneally injected with BLM 30 minutes after having MT and had been injected with MT once in the following every 24 hours. In control group, mice received the same level of saline treatment in the same manner. All mice were dissected for collecting the tissue of lungs at different time points (24h, 72h) after BLM treatment. Inflammatory cell infiltration of lungs was determined by HE staining. The level of ER stress related proteins (GRP78, p-eIF2α, p-IRE1α) in lungs was determined using Western blot. The distribution of ER stress related proteins (GRP78, p-IRE1α, ATF6α, p-PERK) in lungs was detected by immunohistochemistry. ResultsThe model of BLM-induced acute inflammation of lung fibrosis in mice had been successfully constructed. After BLM treatment, lung weight, lung weight ratio and inflammatory cell infiltra tion were significantly increased with a significant correlation between time and effectiveness. After MT treatment, lung weight, lung weight ratio and inflammatory cell infiltration were significantly reduced. The results of Western blot showed that MT pretreatment not only prevented the increase of BLM-induced GRP78 protein significantly, but also restrained the phosphorylation of eIF2α and IRE1α in mouse lungs. Immunohistochemistry also showed that MT pretreatment reduced the expression of GRP78, p-IRE1α, ATF6α and p-PERK. ConclusionMT alleviates ER stress effectively at an early stage of BLM-induced lung fibrosis in mice.
Key words:melatonin; bleomycin; inflammation; lung fibrosis; ER stress; GRP78 protein
通讯作者赵卉(1967-),男,副教授,主任医师,硕士生导师,研究方向:肺纤维化,,Tel:0551-63869557, E-mail:zhaohuichenxi@126.com
作者简介:曹林峰(1988-),男,硕士生,研究方向:肺纤维化,E-mail:88341446@qq.com;
基金项目:国家自然科学基金资助项目 (No 30973544)
收稿日期:2014-10-23,修回日期:2014-11-21
文献标志码:A
文章编号:1001-1978(2015)02-0227-06
doi:10.3969/j.issn.1001-1978.2015.02.016

