PCR-焦磷酸测序检测金黄色葡萄球菌研究
许龙岩 袁慕云 唐 勤 邹志飞 相大鹏
(1.广东出入境检验检疫局 广东广州 510623;2.南方医科大学)
1 前言
金黄色葡萄球菌(Staphylococcus aureus)是引起医院感染和细菌性食物中毒的一种主要病原菌,该菌可分泌20多种毒性蛋白质[1,2],日本的调查结果表明,平均32.5%的食品存在金黄色葡萄球菌的污染[3,4,]。随着分子生物学的发展,已有用普通 PCR或荧光 PCR 检测金黄色葡萄球菌的报道[5,6,7],虽然这些方法可达到快速、高通量的目的,但却无法获得分子诊断的黄金标准-DNA碱基序列,因此有假阳性的可能。焦磷酸测序(pyrosequencing)技术是近年来发展的一项实时地进行短片段DNA测序技术,该技术在DNA序列分析时不需要电泳和荧光标记,直接测定测序引物后面的碱基序列,通过提供可靠的序列信息来确认PCR产物,同时由于主要分析PCR产物双链中的一条链的序列,避免了由于DNA链的二级结构造成的人工假象,使测序结果更加准确[8],目前应用于基因表达[9]、病毒检测[10]、SNP 分析[11]、耐药基因检测[12]、真菌鉴定[13]、DNA甲基化分析[14]等多个领域。
本研究根据金黄色葡萄球菌凝固酶基因保守序列设计扩增引物和测序引物,建立了结合PCR-焦磷酸测序从DNA碱基序列水平上检测金黄色葡萄球菌的方法,并评价了方法的特异性、与传统检测方法的符合性,以期实际应用于食品中金黄色葡萄球菌的检测。
2 材料和方法
2.1 材料
2.1.1 菌株来源
金黄色葡萄球菌共20株,其中标准菌株1株,不同食品中的分离株19株,菌株信息见表1。阴性对照菌株8株,分别为单增李斯特菌ATCC19115、阪崎肠杆菌 ATCC29544、藤黄微球菌CMCC28001、痢疾志贺氏菌NICPBP51252、小肠结肠炎耶尔森氏菌CMCC52221、肺炎克雷伯氏菌CMCC46102、粪链球菌ATCC2921、大肠杆菌ATCC25922。上述菌株来自中国普通微生物菌种保藏管理中心、中国药品生物制品鉴定所和广东出入境检验检疫局技术中心,所有菌株均经VITEK 2和API试剂条进行了确证。

表1 金黄色葡萄球菌菌株信息
2.1.2 主要仪器和试剂
焦磷酸测序PyroMark lD系统:瑞典Biotage公司;7900PCR扩增仪:美国PE公司;全自动核酸纯化系统12GC:日本 PSS公司;PCR用 Buffer、dNTP、琼脂糖、PCR分子量标记(50-500bp)Taq酶,购自宝生物工程(大连)有限公司;链亲和素标记磁珠:GE.Healthcare公司;焦磷酸测序用酶、dNTP、结合缓冲液、退火缓冲液、变性缓冲液、洗涤缓冲液等购自QIAGEN上海办事处;7.5%氯化钠肉汤:北京陆桥有限公司。
2.2 方法
2.2.1 引物设计
根据GenBank公布的金黄色葡萄球菌凝固酶基因序列中的保守区域,用PyroMark Assay Design软件设计引物和测序引物,上游引物5'-AGCCATTAGTTAAAATTCCACAGG -3',下游引物 5'-TTTAGATGAGCTACCTTCAAGACC -3',测序引物5'-CTTTAAGCGATAATTATACT -3',下游引物 5'端标记生物素,扩增片段大小为215bp,委托宝生物工程(大连)有限公司合成。
2.2.2 模板制备
所有菌株均用7.5%氯化钠肉汤36℃培养18-24h,取1mL菌悬液移入离心管,12000 r/min离心5min去上清,用1mL去离子水漂浮沉淀,12000 r/min离心3min去上清,重复2次,最后加200μL去离子水在核酸提取仪上提取DNA,用于PCR扩增。
2.2.3 PCR扩增体系及电泳参数
扩增体系 50μL:PCR Mix Buffer25μL,Taq 酶5μL,MgCl21μL,10μmol/L 上、下游引物各 2μL,模板1μL,去离子水14μL。循环参数为预变性95℃5min;95℃15s,65℃ 30s,72℃ 30s,45 个循环;72℃12min,4℃保存。PCR产物一部分在2%琼脂糖凝胶上电泳,另一部分用于焦磷酸测序。
2.2.4 单链模板制备及焦磷酸测序
将15μL PCR产物转移至96孔PCR板中,加入2μL磁珠,20μL结合缓冲液和 43μL纯水,常温震荡混20min;打开真空泵,将真空预装工具 prep tool在高纯水中清洗30 s,将prep tool移到96孔PCR板中,抓取其中的磁珠,待磁珠基本抓取完毕后将携带有磁珠的prep tool放入70%乙醇中5 s,再分别在变性缓冲液和洗涤缓冲液中各清洗20-30s,prep tool放在装有退火预混液 PSQ 96板(预先加入43μL退火缓冲液和2μL测序引物)的上方,关掉真空泵,轻轻摇动释放磁珠,将PSQ 96板在80℃放置5min,自然冷却至室温后进行焦磷酸测序反应。测序程序采用SQA模式,按ATCG的碱基排列顺序,依次循环加入15次,根据软件给出的剂量在试剂仓中加入底物混合物、酶混合物和4种脱氧核糖核苷酸,将PSQ96孔板和试剂仓放入PyroMark lD系统中进行焦磷酸测序。测序峰及相应的DNA碱基序列由仪器SQA软件自动分析产生。
2.2.5 焦磷酸测序结果判断
检测的DNA碱基序列与测序引物后的DNA碱基序列比对判断结果,即检测的前29个DNA碱基序列为 CAACCGACGACACCGAACCCTATTTTAGA,则判断为金黄色葡萄球菌。
2.2.6 模拟样品检测
用均质带分别秤取25g猪肉、对虾,每份样品中加入225mL 7.5%氯化钠肉汤缓冲蛋白胨水,分别加入1mL用已调好浓度的102cfu/mL金黄色葡萄球菌CMCC26003菌悬液,用拍击式均质器拍打2 min,36℃ 培养18-20h,然后取一部分按上述步骤提取DNA进行焦磷酸检测,另一部分按GB4789.10-2010《食品微生物学检验 金黄色葡萄球菌检验》继续进行检测。
3 结果与分析
3.1 PCR 扩增结果
凝固酶基因PCR扩增结果,20株金黄色葡萄球菌均扩增出215bp大小的DNA片段(图1),而单增李斯特氏菌、阪崎肠杆、藤黄微球菌、痢疾志贺氏菌、小肠结肠炎耶尔森氏菌、肺炎克雷伯氏菌、粪链球菌、大肠杆菌等对照菌株未见扩增条带(图2),表明设计的扩增引物具有较好的特异性,能特异性地扩增金黄色葡萄球菌。

图1 金黄色葡萄球菌凝固酶基因PCR扩增电泳图

图2 金黄色葡萄球菌特异性试验PCR扩增电泳图
3.2 焦磷酸测序结果
20株金黄色葡萄球菌焦磷酸测序结果,根据模版浓度等条件的不同,测出38-44bp长短不等的DNA碱基序列(表2,图3-图4,其他测序结果图略),而单增李斯特菌等8株对照株未测出DNA碱基序列。测序所得20株金黄色葡萄球菌DNA碱基序列,分别与测序引物后的 DNA序列比对,发现100%匹配的DNA碱基数为29-44bp,所有有效测序结果均超过29个碱基(表2),表明测序引物的特异性较好,并且可用CAACC GACGACACCG AACCCTATTT TAGA的DNA碱基序列特异性地检测金黄色葡萄球菌。

表2 金黄色葡萄球菌焦磷酸测序检测结果

(续表)
3.3 模拟样品焦磷酸测序检测结果
添加金黄色葡萄球菌CMCC26003菌悬液的猪肉、对虾模拟样品,分别检测出与预期相符的DNA碱基序列,即CAACC GACGACACCG AACCCTATTT TAGA(图略)。按照 GB4789.10-2010《食品微生物学检验金黄色葡萄球菌检验》检测的模拟样品,均分离鉴定出金黄色葡萄球菌,结果与本研究建立的焦磷酸测序方法一致。
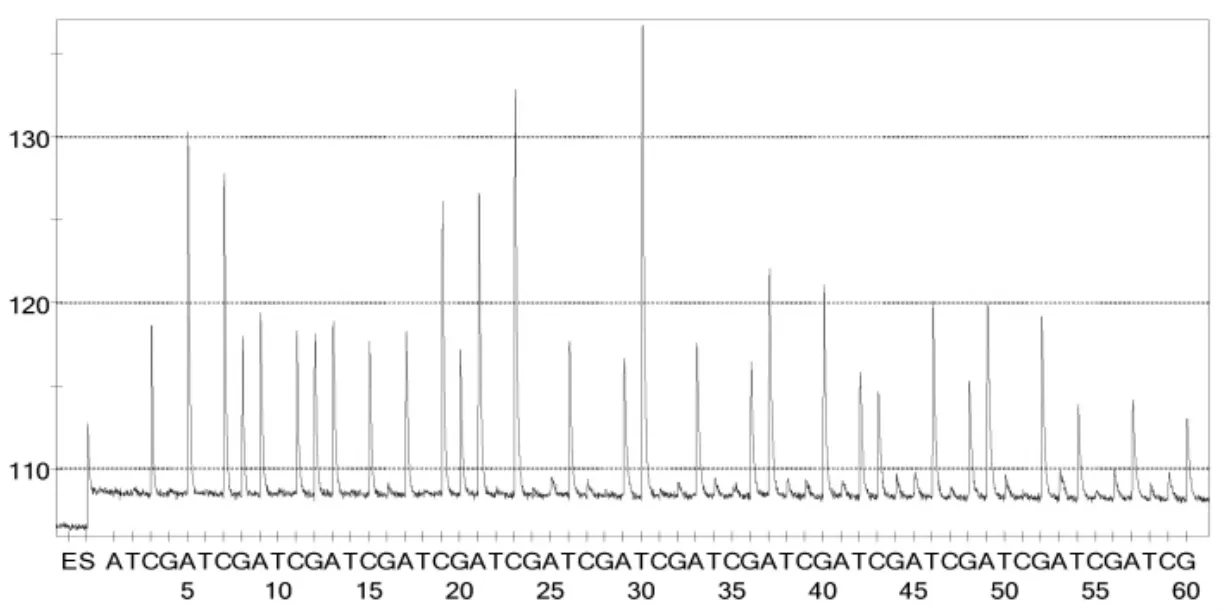
图3 BJ CMCC26003焦磷酸测序结果图
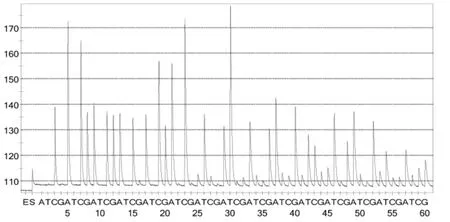
图4 JP1焦磷酸测序结果图
4 讨论
致病性较强的金黄色葡萄球菌可产生凝固酶,使血浆中纤维蛋白原转变成纤维蛋白,附着于细菌表面成块,凝块包绕细菌使其免遭抗生素、抗体、吞噬等多种因素的作用。葡萄球菌有2种凝固酶,一种是分泌至菌体外的蛋白质称为游离凝固酶,此酶与血浆中的凝固酶反应因子协同作用于纤维蛋白原,使血浆凝固,故可用试管法检出;另一种结合于菌体表面并不释放,称为结合凝固酶或凝聚因子,它可直接作用于纤维蛋白原,可用玻片法检出。凝固酶因子试验和血浆凝固酶试验是两个不相关试验,两者不能相互替代,也不可相互印证。金黄色葡萄球菌既可产生凝固酶,亦可产生凝集因子,而血浆凝固酶试验是鉴定金黄色葡萄球菌致病性的关键。我国国家标准GB4789.10-2010《食品微生物学检验金黄色葡萄球菌检验》,也将血浆凝固酶试验作为鉴定金黄色葡萄球菌的指标[15,16,17]。
本研究根据血浆凝固酶基因DNA碱基序列中的保守区域,分别设计扩增引物和测序引物,建立了PCR-焦磷酸测序从DNA碱基序列水平上检测金黄色葡萄球菌的方法,先对目标片段进行PCR扩增,保证扩增片段的特异性,再用扩增产物制备单链模板,在测序引物的引导下进行焦磷酸测序,检测的DNA碱基序列与测序引物后的序列比对,前29个碱基序列100%匹配作为阳性结果,即序列为CAACC GACGACACCG AACCCTATTT TAGA,则判断为金黄色葡萄球菌。PCR扩增试验结果,扩增引物具有较好的特异性,20株金黄色葡萄球菌均扩增出215bp大小的DNA片段,而单增李斯特氏菌等其他对照菌株未扩增出DNA条带。焦磷酸测序结果,20株金黄色葡萄球菌DNA碱基序列与测序引物后的碱基序列比对,100%匹配的碱基数分别为29-44bp,均超过需检测的29个DNA碱基序列,而其他单增李斯特氏菌等对照菌株未测出DNA碱基序列。模拟样品检测结果,焦磷酸测序结果与传统检测方法一致,但在检测周期上传统方法需要培养、划线分离、凝固酶试验等,需要2-3d,而焦磷酸测序方法增菌18-24h、核酸提取、PCR扩增和焦磷酸测序3h,整个试验21-27h完成,简便快捷,而且可通DNA碱基序列的水平上检测金黄色葡萄球菌,避免了单纯PCR扩增检测易污染造成的假阳性结果,准确性高,具有较好的应用前景。
[1]王小红,谢笔钧,史贤明.金黄色葡萄球菌致病因子检测的PCR 方法[J].食品与机械,2004,20(3):48 -50.
[2]Martin M Dinges,Paul M Orwin,Patrick M Schlievert.Exotoxins of Staphylococcus aureus[J].Clinical microbiology reviews,2000,13(1):16 -34.
[3]陈靖,陈叶.用酶联免疫吸附法(ELISA)检测金黄色葡萄球菌肠毒素[J].中国食用菌,1999,18(5):39 -40.
[4]ATANASSOVA V,MEINDL A,RING.Prevalence of Staphylococcus aureus and st aphylococcal enterotoxins in raw pork and uncooked smoked ham-a comparison of classical culturing detect ion and RFLP-PCR[J].Int J FoodMicrobiol,2001,68:105 -113.
[5]田静,计融,杨军,等.PCR方法快速检测食品中的金黄色葡萄球菌[J].卫生研究,2007,36(2):183 -186.
[6]姜延龙,张宇,田波,等.PCR技术检测金黄色葡萄球菌进展[J].食品科学,2006,27(5):265 -269.
[7]周海东,范学工,黄勋,等.实时荧光PCR检测耐甲氧西林金黄色葡萄球菌的研究[J].中国感染控制杂志,2008,7(3):162-166.
[8]陈之遥,周国华.焦磷酸测序技术的研究进展[J].现代生物医学进展,2008,8(8):1573 -1598.
[9]Zhang xiao-dan,WU Hai- Ping,Chen Zhi- Yao,at al.Differential Gene Expression Analysis by Combining Sequence-Tagged Reverse-Transcription Polymerase Chain Reaction with Pyrosequencing[J].Chin J Anal Chem,2009,37(8):1107-1112.
[10]Wang Wei-Peng,Wu Hai- Ping,Zhou Guo- Hua.Detection of Avian Influenza A Virus Using Pyrosequencing[J].Chin J Anal Chem,2008,36(6):775-780.
[11]Bender K,Nehlich C,Harrison C,et al.A multiplex SNP typing approach for the DNA pyrosequencing technology[J].International Congress Series,2006,1288:73 -75.
[12]Jin Rong Zhao,Yu Jie Bai,Qing Hua Zhang,et al.Pyrosequencing-based approach for rapid detection of rifampin-resistant Mycobacterium tuberculosis[J].Diagnostic Microbiology and Infectious Disease,2005,51:135-137.
[13]Baback Gharizadeh,Michael Akhras,Nader Nourizad,et al.Methodological improvements of pyrosequencing technology[J].Journal of Biotechnology,2006,124:504-511.
[14]Uhlmann K,Brinckmann A,Toliat,M R,et al.Evaluation of a potential epigenetic biomarker by quantitative methyl-single nucleotide polymorphism analysis[J].Electrophoresis,2002,23:4072-4079.
[15]高霞,李卓成,徐小平.金黄色葡萄球菌凝固酶检测方法的比较评估[J].中国感染控制杂志,2005,4(3):257 -258.
[16]Sanders C C,Barry A L,Washington J A,et al.Detection of ex -tended spectrum-beta-lactamase-producing members of the family Enterobacteriaceaewith Vitek ESBL test[J].J Clin Microbiol,1996,34:2997 -3001.
[17]Lawrence C,Cosseron M,Mimoz O,et al.Use of the coagulase gene typingmethodfordetectionofcarriersofmethicillin-resistant Staphylococcus aureus[J].Journal of Antimicrobial Chemotherapy,1996,37:687 -696.

