缓冲液种类对土壤酸性磷酸酶活性的影响
唐晓倩,耿玉清,陈艳鑫,郜少敏,杨雨果
(北京林业大学林学院,北京 100083)
土壤磷酸酶可水解有机磷的磷酸酯或磷酸酐,在土壤有机磷矿化过程中发挥重要作用。提高磷酸酶活性是提高土壤磷有效性的一种生物途径[1]。因此,及时准确地测定和了解土壤磷酸酶活性的高低,对土壤磷素的管理具有重要意义。由于分离技术的限制,目前直接从土壤中提取酶尚有一定的难度。因此,对土壤磷酸酶活性的测定,主要是在土壤中添加一定数量对硝基苯磷酸二钠基质,在一定pH值的缓冲液和温度等环境条件下进行培养,最终通过测定酶促反应后生成物的量来计算酶的活性[2]。
酶促反应是在一定环境条件下进行的。其中pH值与酶结构的稳定性以及酶对底物的亲和力密切相关[3],对土壤酶活性的测定结果有显著影响[4]。由于pH值对酶活性的显著作用,为减少培养过程中因pH值浮动而造成的影响,通常采用一定的缓冲液来实现较稳定的培养环境,而不同缓冲液影响下酶活性高低也有所不同。不适宜的pH值可能给酶促反应生成物的测定造成困难[5]。
由于pH值对磷酸酶活性的影响非常显著,通常根据pH值将土壤磷酸酶分为酸性磷酸酶(EC 3.1.3.2)和碱性磷酸酶(EC 3.1.3.1)[5]。目前国内外学者测定酸性磷酸酶活性的方法不一。就酶促反应的环境条件而言,国外学者主要采用pH值为5的醋酸盐缓冲液[6-8],也有学者认为pH值为6.5的MUB缓冲液是测定土壤酸性磷酸酶活性最适宜的培养条件[2,9-10]。此外,有学者建议依据土壤本身pH值的大小,选择合适种类的缓冲液,测定土壤酸性磷酸酶活性[11-12]。因此,虽然土壤酸性磷酸酶的测定是比较简单的过程,但不同研究者所选择的培养条件是多元化的。如何针对具体的土壤选择适宜的pH值及缓冲液种类,还缺乏系统的研究。这在一定程度上给土壤磷酸酶的测定方法造成了选择上的困难。因此,本研究选用不同pH值的土壤,研究不同缓冲液及pH值对土壤酸性磷酸酶活性的影响,为选择适宜的测定酸性磷酸酶活性的培养条件提供依据。
1 材料与方法
1.1 供试土壤
本研究选择6种土壤。土壤pH值用梅特勒—托利多酸度计(FE20K)测定。土壤有机碳采用高温外热重铬酸钾氧化-容量法测定。土壤全氮测定采用凯氏消煮法,定氮仪蒸馏。碱解扩散法测土壤碱解氮。土壤有效磷采用碳酸氢钠法测定。土壤速效钾采用乙酸铵提取,用火焰光度计测定[13]。土壤采样地点和常规指标分析结果见表1。
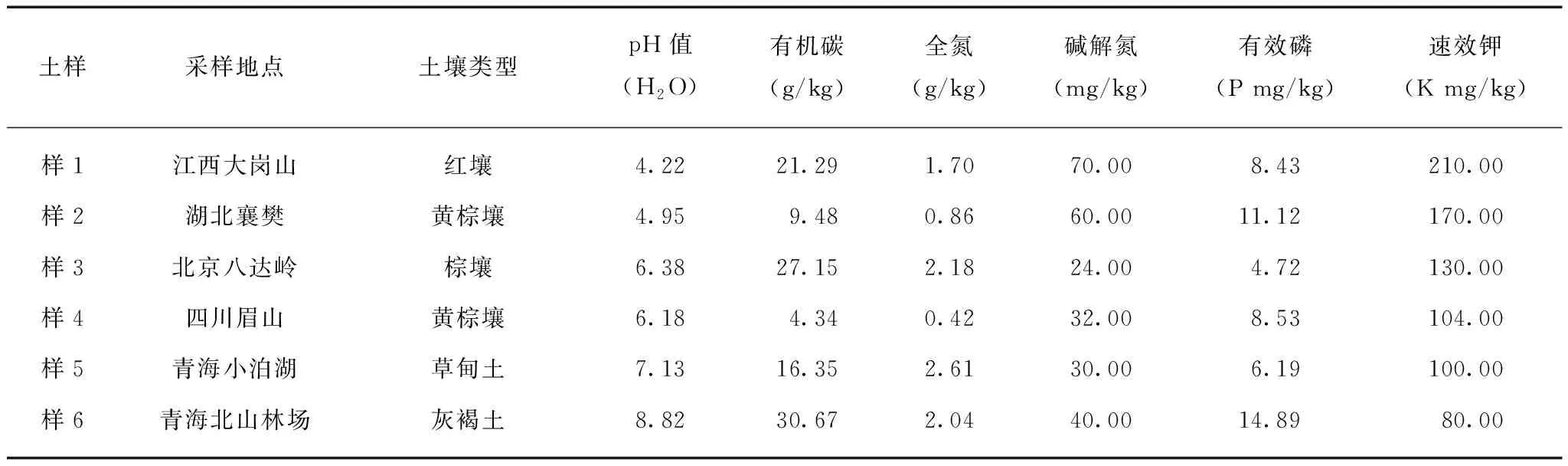
表1 土样的基本情况
1.2 测定方法
1.2.1 pH值与缓冲液的选择
根据我国大部分土壤pH值为4~9的范围,以及有学者将最适pH值5~6的磷酸酶定义为酸性磷酸酶,本研究采用的pH值分别为4、5和6,共3个梯度。缓冲液的选择主要基于目前酶测定过程中广泛应用的3种类型,分别为50 mmol/L醋酸盐缓冲液(简称ACEB)[7-8]、50 mmol/L柠檬酸盐缓冲液(简称CITB)[14]以及改进的通用缓冲液(简称MUB)[2,15]。根据pH值和缓冲液种类的选择,本研究共采用9种缓冲液培养条件。为尽量减少在调节pH值过程中引入外来离子对酶促反应的干扰,本研究选用0.5 mol/L醋酸和0.5 mol/L NaOH调节ACEB的pH值;用50 mmol/L柠檬酸和50 mmol/L柠檬酸钠调节CITB的pH值;用0.1 mol/L HCl和0.5 mol/L NaOH调节MUB的pH值。
1.2.2 终止剂的选择
在常规的土壤磷酸酶活性测定过程中,酶促反应结束后通常通过添加0.5 mol/L CaCl2和0.5 mol/L NaOH来终止反应,并使其显色[16]。经预实验发现,在所选用高有机质含量土样中,添加0.5 mol/L NaOH后可因腐殖质的水解干扰而影响比色结果。因此,本研究改用0.1 mol/L,pH值为12的Tris终止反应[2]。
1.2.3 测定过程
测定方法参照文献[2]中介绍的方法,以对硝基苯磷酸二钠(C6H4NNa2O6P·6H2O,CAS编号:4264-83-9)为底物。测定方法略作修改,具体为:称取1.00 g新鲜土壤,添加8 mL缓冲液和1 mL对硝基苯磷酸二钠基质溶液后,轻摇混匀,于37℃下培养1 h。培养结束后,在混合土液中添加1 mL 0.5 mol/L的CaCl2和4 mL 0.1 mol/L的Tris缓冲液(pH值12)终止反应。经过滤后,在410 nm波长条件下进行比色测定。在测定土壤酶活性的同时做空白参照。空白参照实验与土壤磷酸酶活性测定的区别是,在培养结束后添加对硝基苯磷酸二钠。用每小时1 g土酶促反应产物(对硝基酚)的μmol量表示土壤酸性磷酸酶活性,酶活性单位为μmolpNP/(g·h)。
1.3 数据统计分析
所有数据使用Excel 2007软件进行整理,用SPSS 19.0软件进行数据统计分析。采用平均值±标准偏差表示土壤酸性磷酸酶活性。不同土壤酸性磷酸酶活性差异采用One-way ANOVA进行统计分析,组间两两差异显著性比较采用Duncan法(P<0.05)。pH值和缓冲液种类与酶活性的交互作用采用Two-way ANOVA进行统计分析(P<0.05)。基于多因素方差分析进行pH值、缓冲液种类和不同土样对酶活性影响的研究(P<0.05)。
2 结果与分析
2.1 不同培养条件下土壤酸性磷酸酶活性的区分度
在不同的缓冲液和不同pH值培养条件下,测得的6个土样之间酸性磷酸酶活性的区分度有一定的区别(表2)。就土样磷酸酶活性的数值来看,在pH值4和5的培养条件下,样1、2、3和4的酸性磷酸酶活性均在CITB条件下最高;在pH值6时,6个土样酸性磷酸酶活性均在ACEB培养条件下最高。从不同土样之间土壤酸性磷酸酶活性的区分度来看,不同的培养条件也存在一定的差异。其中,在pH值4和5条件下,不同土样间土壤酸性磷酸酶活性的区分度均在CITB条件中显著,6个土样间酶活性的差异区分序列为a、b、c、cd、cd、d和a、b、c、d、e、f;而在pH值6条件下,土样间酸性磷酸酶活性的区分度在ACEB条件中最显著,区分序列为a、b、c、d、e、f。就MUB而言,无论pH值为4、5还是6,不同土样之间酸性磷酸酶活性变化的区分序列均为a、b、c、d,较其他2种缓冲液的差异的变化相对平缓。

表2 不同培养条件下土壤酸性磷酸酶活性 [μmol pNP/(g·h)]
注:表中数据为平均值±标准偏差;同列数据后小写字母不同表示差异显著(P<0.05)。
2.2 不同pH值条件下土壤酸性磷酸酶活性的变化
针对同一缓冲液环境条件下,随着pH值的变化,土样酸性磷酸酶活性变化幅度与方向不同(表3)。从表3可以看出,由pH值4到5时,样1、2和3在3种不同缓冲液条件下所测土壤的酸性磷酸酶活性变化量均为正值,变化幅度均在ACEB条件下最大,在MUB条件下最小;而样4、5和6在3种不同缓冲液条件下变化不尽一致。其中,样4和6的酸性磷酸酶活性变化量在MUB条件下表现为负值,且变化幅度在该条件下最小。
在pH值由5到6时,样1、2和3土壤酸性磷酸酶活性变化量均在ACEB和MUB条件下为正值,在CITB条件下为负值。样4、5和6在不同环境条件下变化量不同,其中,样4在MUB条件下酸性磷酸酶活性变化量表现为正值,而样5和6在ACEB条件下表现为正值。就变化幅度而言,这6种土样在ACEB和CITB条件下的酸性磷酸酶活性变化幅度,均高于MUB缓冲液条件下的变化幅度。
就同一土样而言,在缓冲液由pH值4变化到6时,土壤酸性磷酸酶活性的极差不同(表3)。除样4外,不同土样酸性磷酸酶活性的极差值均在ACEB条件下为最大,变化范围为6.01~31.88;而在MUB条件下极差值最小,变化范围为1.79~5.95,酶活性变化范围窄。因此,在同样pH值的变化区间内,不同土样酸性磷酸酶活性的变化幅度有较大的差异。

表3 不同pH值条件下土壤酸性磷酸酶活性变化 [μmol pNP/(g·h)]
注:△1:表示pH值4~5一个单位酶活性变化;△2:表示pH值5~6一个单位酶活性变化;R:表示pH值4~6酶活性极差。
2.3 不同缓冲条件下土壤酸性磷酸酶活性变异的统计
不同缓冲液条件下,所测土壤酸性磷酸酶活性的统计分析结果见表4。在ACEB培养条件下,土壤酸性磷酸酶活性的极差随着pH值的增加而增大,pH值6时极差达到最大值(33.40)。就变异系数而言,在缓冲液pH值为4时的酸性磷酸酶活性变异系数为1.08,高于pH值5和6时的变异系数。
在CITB缓冲条件下,不同pH值之间土壤酸性磷酸酶活性的平均值、极差和变异系数的变化幅度明显。其中,土壤酸性磷酸酶活性的平均值和极差在pH值5的缓冲条件下达到最大值,而变异系数最小,仅为0.51。
相对于ACEB和CITB缓冲液,用MUB缓冲液条件测定的6个不同土样的酸性磷酸酶活性的平均值、极差数值和变异系数比较接近。其中,当缓冲液pH值从4变化到6时,土壤酸性磷酸酶活性极差数值变化范围是23.39~27.82;变异系数数值变化范围是0.80~0.92。由此看来,用MUB缓冲液测定的不同土样之间的变异系数较其他缓冲液大,且与缓冲液pH值的变化无关。

表4 土壤酸性磷酸酶活性统计分析
2.4 pH值和缓冲液对土样磷酸酶活性的共同影响
pH值和缓冲液种类是同时作用于土壤磷酸酶的培养条件,二者共同影响着土壤磷酸酶活性测定。通过双因素方差分析表明,缓冲液的pH值高低、种类以及二者的交互作用均显著影响土壤酸性磷酸酶活性的变化(表5),但对不同土样影响的程度有所不同。样1、2、3和4中,pH值对土壤酸性磷酸酶活性变化的影响程度大于缓冲液种类以及二者交互的影响程度;而在样5和6中,pH值的影响程度相对较小。这说明pH值和缓冲液种类对土壤酸性磷酸酶活性的影响程度,与选定的土样有关。

表5 pH值与缓冲液对土壤酶活性影响的双因素方差分析
3 讨论
3.1 土壤特征对土壤酸性磷酸酶活性的影响
土壤酶来源于生物的分泌,其活性受多种土壤性质的影响。本研究选取了6种不同土壤类型的土样,利用3种广泛使用的缓冲液,比较不同pH值条件下土壤酸性磷酸酶活性,力求找出具有普遍性的适宜缓冲液和pH值。但利用三因素方差分析发现,不同土样(F=1 675.28,p=0.00)对土壤酸性磷酸酶活性的影响最显著(表6),其次是pH值(F=708.94,p=0.00)对酶活性的影响,而缓冲液种类对酶活性的影响程度最小(F=125.58,p=0.00)(表6)。因此,在不同缓冲液测定的土壤酸性磷酸酶差异中,土样起关键作用。

表6 缓冲液pH值和种类与土壤类型对土壤酶活性影响的三因素分析
虽然影响土壤酸性磷酸酶活性高低的性质指标很多,但对土壤就pH值和有机质指标的研究非常普遍。就所选定的土样而言,土壤pH值低,土壤有机质含量高的土样如样1和2,土壤酸性磷酸酶活性相对较高,而样6的pH值高,土壤有机质低,土壤酸性磷酸酶活性相对较低。对土壤pH值、有机碳和土壤酸性磷酸酶活性进行相关性分析,结果表明,土壤pH值、有机碳和酸性磷酸酶活性相关程度弱。由于土壤酸性磷酸酶活性受多因素的影响,而选定的不同土壤类型因存在多变量的差异,使得缓冲液及pH值对土壤酸性磷酸酶的影响甚为复杂。针对土壤自身pH值可显著影响土壤酸性磷酸酶活性的状况,在土壤酸性磷酸酶的测定中,对适宜缓冲液和pH值的选择,尽量选用性质相近的土壤如酸性土、石灰性土壤等开展研究。
3.2 pH值和缓冲液对土壤酸性磷酸酶活性的影响
pH值的变化可显著地改变土壤磷酸酶活性的变化。在酶活性的测定中,pH值的大小通过缓冲液实现。醋酸盐缓冲液pH值范围为3.6~5.8,其中广泛采用pH值为5测定土壤酸性磷酸酶活性[6,8,17]。但本研究发现,随缓冲液pH值的增加,土壤酸性磷酸酶活性呈较剧烈的上升,并没有支持采用pH值为5的醋酸盐缓冲液为最适环境条件的结论。此外,在醋酸盐缓冲液条件下,用不同pH值范围测定的不同土样之间土壤酸性磷酸酶活性变异系数剧烈变化:即在缓冲条件为pH值5或6时变异系数分别为0.52和0.60,而在pH值为4时的变异系数为1.08。这在一定程度上影响着数据的可比性。
柠檬酸盐缓冲液作为主要的酸性缓冲液,其pH值范围在3.0~6.6之间。如果把pH值为5看作是一个最适的pH值,只有柠檬酸盐缓冲液有这种现象,即土壤酸性磷酸酶活性在缓冲液pH值由4到5环境条件下呈上升趋势,而在pH值由5到6时呈下降趋势。就不同土样酸性磷酸酶活性变异系数而言,在不同pH值范围内的变化幅度较醋酸盐缓冲液条件低但高于MUB缓冲液。
MUB是一种广谱缓冲液,缓冲液pH值范围是2.6~12.0[14]。在酸性磷酸酶活性的测定中,通常认为pH值6.5时,土壤酸性磷酸酶活性最高[18]。从表3数据来看,也有个别土壤的酸性磷酸酶活性并没有随着pH值增加呈上升趋势,这在一定程度上说明pH值6.5并不是所有土壤的最适pH值,在选定的3种缓冲液中,MUB缓冲液条件下土壤酸性磷酸酶活性变异系数在0.80~0.92之间,不同pH值之间的变异系数的变化趋势平稳,也较其他缓冲液的变异系数高。因此,MUB缓冲液有利于不同土样之间数据的比较。针对目前不少学者提出了使用接近待测土壤pH值的缓冲环境测定土壤磷酸酶的现状,选用MUB缓冲液应是合理的选择。
4 结论
为选择适宜的测定土壤酸性磷酸酶活性的培养条件,采用3种常用的缓冲液,分别测定了6种不同特征的土壤酸性磷酸酶活性。研究结果表明,采用MUB缓冲液条件可获得较稳定的土样区分序列,且与缓冲液的pH值的变化无关,而在醋酸盐缓冲液和柠檬酸盐缓冲液条件下,不同土样的酸性磷酸酶区分度序列受缓冲液pH值影响明显。就不同土样之间土壤酸性磷酸酶活性变异系数而言,醋酸盐缓冲液和柠檬酸盐缓冲液条件下,不同pH值范围获得的变异系数变化剧烈;而采用MUB缓冲液获得的变异系数较其他缓冲液大,且趋势平稳,有利于不同土样间数据的比较。因此,选用MUB缓冲液测定土壤酸性磷酸酶活性应是合理的选择。针对土壤自身的pH值能显著影响土壤酸性磷酸酶活性的状况,在土壤酸性磷酸酶的测定中,应进一步开展适宜缓冲液和pH值的选择的研究。

