超高效液相色谱-串联质谱法测定猪肉和猪尿中的苯乙醇胺A
卢艳芬
(长沙市畜禽水产品质量检测中心 湖南长沙 410013)
1 前言
苯乙醇胺A又称为克仑巴胺,化学名称为2-4-(4-硝基苯基)丁基-2-基氨基-1-甲氧基苯乙醇,是一种人工合成的化学物质。苯乙醇胺A是福莫特罗的同分异构体,是美国礼来公司合成莱克多巴胺时产生的副产物,具有同克仑特罗、莱克多巴胺和沙丁胺醇等药物相同的作用和效果,属于β-受体激动剂。苯乙醇胺A同样具有营养再分配作用[1],可以用于刺激动物生长,加强蛋白质在动物体内沉积,提高基础代谢水平,使体脂趋于分解,促进生猪长速加快,提高瘦肉率[2]。而人吃了含这种药物的猪肉后,可出现恶心、头晕、四肢无力、手颤等中毒症状,特别是对心脏病、高血压患者危害更大[3]。2010年12月农业部公告禁止在饲料和动物饮用水中添加该物质[4]。
目前,关于动物源性食品中β2-受体激动剂类药物残留检测的报道较多[5-8],但关于苯乙醇胺A在动物源性食品及动物尿液中检测方法的研究非常少[9,10]。孙志文等利用酶解16h后反萃再过SPE小柱的处理方法,经液相色谱-串联质谱仪检测猪肌肉中的苯乙醇胺A[11]。本文对猪尿和猪肉中苯乙醇胺A的酶解、固相萃取等提取方法和色谱质谱测定进行了系列研究,设计出了快速、准确、灵敏度高的苯乙醇胺A超高效液相色谱串联质谱测定法。
2 材料与方法
2.1 材料
2.1.1 仪器
UPLC-MS/MS:waters公司TQD系列;离心机:湘仪H-1650型;固相萃取装置:Alltech;pH计:雷磁PHSJ-4A型;涡旋混匀器:德国IKA,MS3型;振荡器:苏州威尔 SHA-C型;超声仪:昆山 KQ-500DE型;氮气吹干仪:美国N-EVAPTM112型;固相萃取柱:waters公司MCX,60mg/3mL。
2.1.2 试剂
苯乙醇胺A标准品 (多伦多化学研究公司);甲醇(色谱纯,Merck);高氯酸(分析纯);β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶(Merck);乙酸铵(色谱纯,TEDIA);甲酸(色谱纯);氨水(分析纯);乙酸(分析纯);盐酸(分析纯)。
2.2 方法
2.2.1 液相色谱参考条件
色谱柱:BEH C18(50*2.1mm,1.7μm);流动相:A相为0.1%甲酸水溶液,B相为甲醇溶液;梯度洗脱:0 -3.4min 维持 95.0%A,3.4 -3.6min 为95%A 变化至72%A,3.6 -5.5min 维持72%A,5.5-5.7min为72%A 变化至 30%A,5.7 -6.7min维持30%A,6.7-8min为30%A变化至95%A。流速:0.3mL/min;柱温:35℃;进样量:4μL。
2.2.2 质谱参考条件
电喷雾离子源;正离子扫描;多反应检测;电离电压:3.0kV;源温:120℃;雾化温度:350℃;锥孔气流速:50L/h;雾化气流速:580L/h。苯乙醇胺A的检测条件如表1。

表1 苯乙醇胺A最优化的质谱参数
2.2.3 样品前处理
2.2.3.1 猪肉样品
酶解:准确称取2g样品于50mL离心管里,加入0.2mol/L 乙酸铵缓冲溶液(pH=5.2)8.0mL,加入β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶40μL,涡旋混匀,于52℃下避光水浴震荡反应2 h。提取:酶解后放置至室温,用高氯酸调pH至1,涡旋混匀,于80℃水浴中超声30min,11000r/min高速离心10min,倾出上清液于另一50mL离心管里,加入0.1mol/L高氯酸溶液4mL于残渣中,涡旋并超声10min后11000r/min高速离心10min。合并上清液,用10mol/L氢氧化钠溶液调节pH至4,待用。
净化:MCX小柱依次用3mL甲醇,3mL水活化,取备用液的1/2过柱,再依次用3mL 0.1mol/L高氯酸溶液,3mL甲醇淋洗,抽干,用3mL 5%氨化甲醇洗脱。洗脱液在40℃下用氮气吹干,用甲醇+0.1%甲酸溶液(5+95)1mL溶解,涡旋混匀,过0.22μm有机滤膜,供液质联用仪用。
2.2.3.2 猪尿样品
准确移取2mL尿样于50mL离心管中,加入2mol/L 乙酸铵溶液(pH=5.2)200μL,用乙酸调pH至5.2,加入40μLβ - 盐酸葡萄糖醛苷酶/芳基硫酸酯酶,涡旋混匀,52℃下水浴振荡器中反应2h。反应完成后11000r/min离心10min,取上清液全部过MCX固相萃取小柱。MCX柱依次用3mL甲醇、3 mL水对柱子进行活化,依次用3mL 2%甲酸溶液、3mL甲醇淋洗,用3mL 5%氨化甲醇溶液进行洗脱,收集洗脱液,在45℃下氮气吹干,加入甲醇+0.1%的甲酸溶液 (5+95)2mL溶解残渣,过0.22μm滤膜后待测。
3 结果与讨论
3.1 前处理条件的优化
β-兴奋剂依据其结构可分为苯胺型(典型化合物如克伦特罗)和苯酚型(典型化合物如莱克多巴胺)两大类。苯乙醇胺A属于苯酚型结构,为中等极性的疏水性化合物,易溶于酸性溶液、碱性溶液、甲醇、乙酸乙酯等极性溶剂。因此,设计残留分析时,多以酸性混合有机溶剂为提取液进行提取。
苯酚型激动剂在动物机体的代谢以轭合态存在,故其残留检测必须要经过水解过程。通常的水解方法有酸解[12,13]、碱解[14]和酶解[15,16]等,而对于猪肉和猪尿,通常采用酸解和酶解两种方法。考虑到酸解成本低,反应后的杂质少等特点,我们在设计提取方案时,首先考虑的是酸解提取。考察了不同的酸解浓度(0.2、0.5、1、2mol/L 等 )和不同酸解温度(60、80℃)下的提取条件。结果发现:对于苯酚型的受体激动剂如沙丁胺醇、莱克多巴胺等,由于其高轭合率,酸解不能将其全部游离出来,致使目标化合物回收率低,无法满足检测要求。因此,改用酶解方法进行提取。在现有的文献资料中,β-兴奋剂的酶解一般都需要反应12-16h[17]。这样长时间的酶解不适用于实际工作中的快速监测。为此,本文对β-兴奋剂类化合物的酶解条件进行了研究,以期找到合适的酶解条件。苯乙醇胺A与沙丁胺醇和莱克多巴胺都属于苯酚型。由于实际工作中没有苯乙醇胺A的阳性样品,故以沙丁胺醇阳性猪尿为考察对象,研究了52℃下猪尿中沙丁胺醇的酶解时间(1-16h)与酶解效率的关系,以及与传统37℃16h酶解方法的比较。结果见表2。从表2中可以看出,在52℃下 ,酶解2h时,猪尿中沙丁胺醇的酶解浓度已经达到了峰值,且与37℃16h酶解条件下的峰面积值相当。在改变酶解温度的同时,还增加了高氯酸沉降蛋白、80℃高温灭活及超声提取等步骤,以进一步提高回收率。

表2 不同酶解条件下猪尿中的沙丁胺醇峰面积
3.2 色谱质谱条件的优化
根据苯乙醇胺A的化学结构及性质,选取BEH C18(50*2.1mm,1.7μm)色谱柱进行分析。此外,在流动相中加入适量的甲酸以增加其检测的灵敏度,在合适的条件下,苯乙醇胺A在6.12 min左右出峰,总运行时间为8min,保证了在样品中杂质组分与目标化合物的有效分离,从而减少了基质的干扰和抑制作用。此外,为增加测试的准确度,本实验采用空白基质加标准品的方法来做标准工作曲线。
为获得较高灵敏度的检测结果和消除基质对目标物质的抑制作用,在本实验中采用空白基质加苯乙醇胺A标准溶液进行调谐,选取最优的毛细管电压、碰撞能等参数,其结果见表1。苯乙醇胺A的二级质谱图和提取离子多反应监测图见图1和图2。

图1 苯乙醇胺A的二级质谱图

图2 苯乙醇胺A的多反应监测色谱图
3.3 方法的线性关系和测定限
3.3.1 方法的线性关系
用甲醇+0.1%甲酸水(5+95)配制系列浓度标准工作溶液:0.2、1、2、5、10、20、50μg/L。在确定的实验条件下进样分析,制作标准工作曲线,其结果见图3。从图中可以看出在0.2μg/L -50μg/L的浓度范围内,苯乙醇胺A相关系数大于0.9999,线性范围宽,线性相关性好。
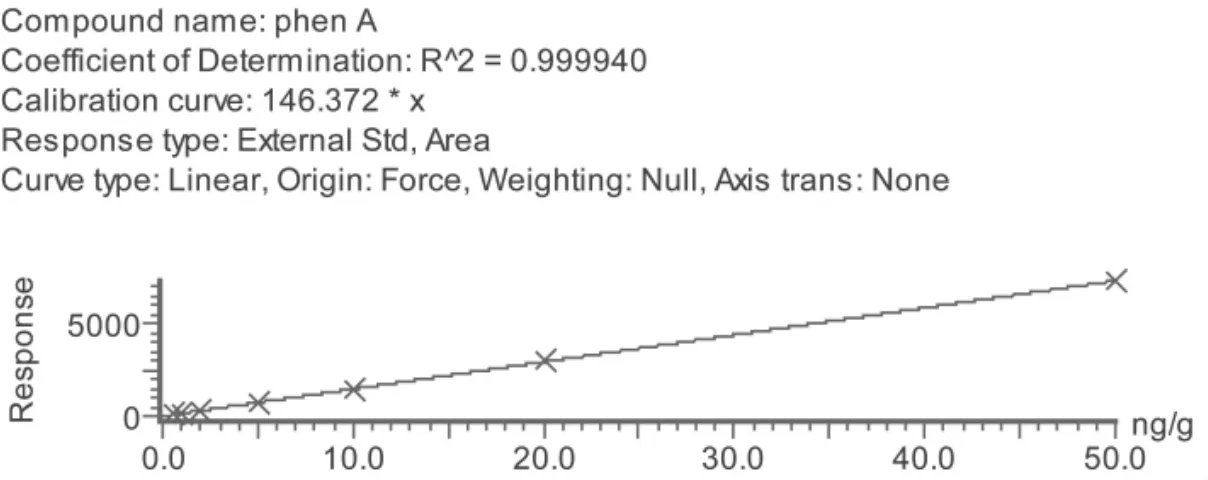
图3 苯乙醇胺A的标准工作曲线
3.3.2 方法的灵敏度
本方法条件下,测得苯乙醇胺 A的检测限(LOD,S/N=3)和定量限 (LOQ,S/N=10)分别为0.2μg/kg、0.5μg/kg(猪肉)和 0.2μg/L、5μg/L(猪尿)。多反应监测图见图4和图5。

图4 空白猪肉样品添加苯乙醇胺A的多反应监测色谱图(0.2μg/kg、0.5μg/kg)
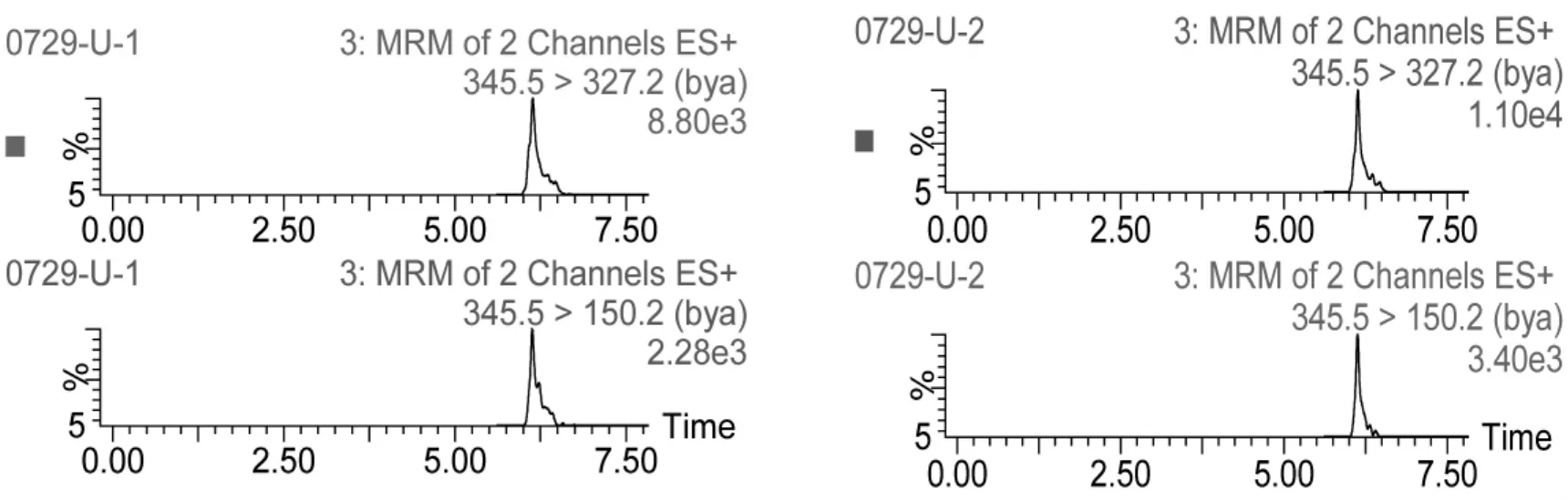
图5 空白猪尿样品添加苯乙醇胺A的多反应监测色谱图(0.2μg/L、0.5μg/L)
3.4 方法的回收率和精密度
对空白猪肉和猪尿样品进行了3个浓度的添加回收实验:0.5、1、2μg/kg 和 0.5、1、2μg/L。每个浓度做6次平行测定,苯乙醇胺A测定的回收率和精密度结果见表3。
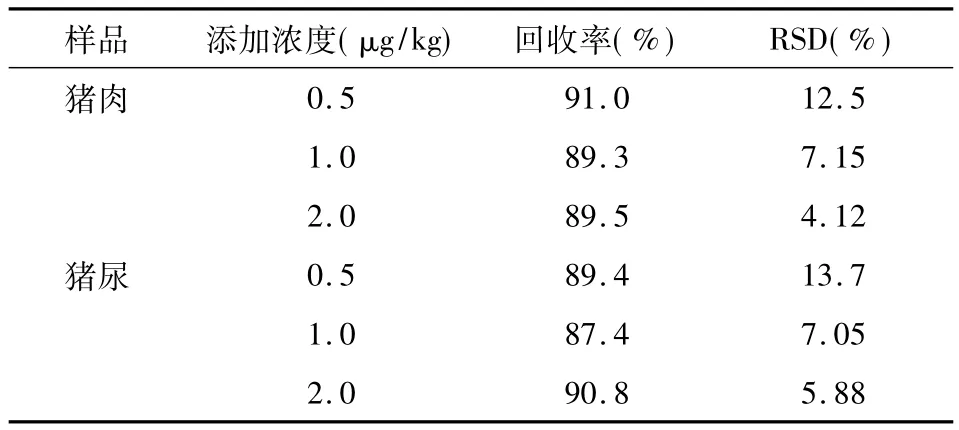
表3 回收率与精密度实验结果(n=6)
猪肉样品的回收率为79.0% -103%,相对标准偏差为4.1% -12.5%;猪尿样品的回收率为80.3% -102%,相对标准偏差为:5.9% -13.7%。
4 方法的协同实验
本方法在我中心实验室制定完成后,与湖南省出入境检验局检验检疫技术中心、长沙市食品质量安全监督检测中心对其进行了协同验证实验。猪尿和猪肉各3个添加浓度、每个浓度进行6次平行测定。协同实验结果:猪肉中0.5、1、2μg/kg 添加回收率在71.0% -107%之间,变异系数在2.1% -15.1%之间;猪尿中 0.5、1、2μg/L 添加回收率在76% -105%之间,变异系数在2.46% -11.93%之间。
5 结论
本研究建立了猪肉和猪尿中苯乙醇胺A残留的UPLC-MS/MS快速定性和定量方法,将酶解时间从现有各标准中的12-16h缩短到2h,大大节约了分析时间;样品处理方法简单,有机溶剂消耗少,节约了分析成本。方法精密度和准确度高,实用性强,适用于生猪屠宰前后猪尿和猪肉中苯乙醇胺A残留监控。
[1]丁焕中,陈杖榴,杨志凌.营养重分配剂莱克多巴胺的药理作用和应用[J].兽药与饲料添加剂,2002,1(7):18 -20.
[2]Pan S J,Hancock J,Ding Z P,et al.Effects of clenbuterol on insulin resistance in conscious obese Zucker rats[J].Am J Physiol Endocrinol Metab,2001,280:E554-E561.
[3]Alida A M,Stolker,Paulus W,et al.The use of supercritical fluid extraction for the determination of steroids in animal tissues[J].Analyst,1998,123(12):2671 -2676.
[4]中华人民共和国农业部公告第1519号[Z].
[5]牛晋阳,庞宇.姚欣乐.液质法测定猪肉中十种β-兴奋剂残留[J].食品科学,2010,31(8):241-244.
[6]赵善贞,陈舜胜,邓晓军,等.高效液相色谱-串联质谱法测定动物源性食品的4种β-兴奋剂残留量[J].理化检验-化学分册,2009,45(8):968 -971.
[7]安洪泽,张素霞,沈建忠,等.高效液相色谱一紫外串联荧光检测法测定猪饲料中五种β-兴奋剂[J].饲料工业,2008,29(6):54 -56.
[8]M W F Nielen,J J P Lasaroms,M L Essers,et al.Multiresidue analysis of beta- agonists in bovine and porcine urine,feed and hair using liquid chromatography electrospray ionisation tandem mass spectrometry[J].Analytical and Bioanalytical Chemistry,2008,391(1):199 -210.
[9]农业部1486号公告-1-2010饲料中苯乙醇胺A的测定高效液相色谱-串联质谱法[S].
[10]曲斌,郑胜兰,陆桂萍,等.固相萃取-UPLC-MS/MS快速测定猪尿中的苯乙醇胺 A[J].中国兽药杂志,2012,46(1):25-27.
[11]孙志文,闫小峰.猪肌肉组织中苯乙醇胺A残留液相色谱-串联质谱检测方法[J].中国兽医杂志,2011,47(4):72 -74.
[12]Katia D W,Hubert D B,Dirk C.LC -MS-MS to detect and identify four beta-agonists and quantify clenbuterol in liver[J].Analyst,1998,123(12):2701 -2705.
[13]Philippe A G,Marie- Ckaude S,Richard H.Quantitative analysis of clenbuterol in meat products using liquid chromatographyelectrospray ionizations tandem mass spectrometry[J].Journal of Chromatography B:Biomedical Sciences and Applications,1999,736(1 -2):209 -219.
[14]Fente C A,Vazquez B I,Franco C,et al.Determination of clenbuterol residues in bovine hair by using diphasic dialysis and gas chromatography-mass spectrometry[J].Journal of Chromatography B:Biomedical Sciences and Applications,1999,726(1 -2):133-139.
[15]Lucia D,Rosa V,Jordi O,et al.Derivatization procedures for the detection of β2-agonist by gas chromatographic mass spectrometric analysis[J].Journal of Mass Spectrometry,2000,35(11):1285 -1294.
[16]O’Keeffe M J,O’Keeffe M,Glennon J D.Supercritical fluid extraction(SFE)as a multi- residue extraction procedure for β- agonists in bovine liver tissue[J].Analyst,1999,124(9):1355-1360.
[17]Hogendoorn E A,van Zoonen P,Polettini A ,et al.Hyphenation of Coupled-column Liquid Chromatography and Thermospray Tandem Mass Spectrometry for the Rapid Determination of β-Agonist Residues in Bovine Urine Using Direct Large-volume Sample Injection[J].J Mass Spectrom,1996,31(4):418-426.

