中华眼镜蛇毒活性组分抑制微血管形成研究
朱 柳,余清声,刘新艳,余红娥、3,袁 牧,王桂平,楼晓华,滕脉坤
(1.广州医学院药物研究中心,广东 广州 510182;2.中国科学技术大学生命科学学院,安徽 合肥 230026;3.广东药学院,广东 广州 510006)
血管生成是体内一种重要的生理和病理过程,许多疾病的发生与血管的异常增生紧密相关,如慢性炎性反应、糖尿病性视网膜病和肿瘤的生长和转移等,寻找有效抑制血管生成的药物是防治肿瘤及肿瘤扩散等血管生成性疾病的研究热点[1]。中华眼镜蛇毒活性组分(China cobra venom active factor,CCVAF)是从中国安徽南部眼镜蛇毒中分离纯化的活性组分,为一新型类心脏毒素碱性蛋白[2]。本课题组前期的研究显示,CCVAF能选择性抑制血管内皮细胞增殖并诱导内皮细胞凋亡[3-5],可能通过影响内皮细胞的活性而潜在地抑制血管生成。本文通过观察CCVAF对内皮细胞集落(克隆)形成、细胞迁移及微血管形成的影响,探讨CCVAF的抗血管生成作用,为CCVAF可能应用于抗血管生成提供实验依据。
1 材料和方法
1.1 材料
CCVAF,质谱分析其相对分子质量为7005,中国科技大学生命科学学院滕脉坤教授提供;新生牛肺主动脉,取自广州市奶牛研究所;人宫颈腺癌细胞株 Hela,由广州医学院李冰教授惠赠;RPMI1640培养基、胶原酶、胰蛋白酶购自 Gibco公司;MCDB 131无血清培养基及ε-氨基已酸(纤维蛋白水解抑制剂)、血管内皮细胞生长因子VEGF均为Sigma公司产品;牛纤维蛋白原 (fibrinogen)和牛凝血酶(Thrombin)为中国药品生物制品检定检验所产品;胎牛血清(FBS)购自杭州四季青;其它试剂均为国产分析纯。
SPF级 SD雄性大鼠,(200±10)g,购自广东省医学实验动物中心,合格证号:No.0017132,SCXK(粤)2003-0002,粤监证字 2006A01。
一次性培养瓶、培养板、24孔板及Transwell共培养板均为Corning Corstar产品;组织解剖显微镜,日本 Nikon;倒置显微镜,重庆光学仪器厂;二氧化碳培养箱,美国 Quene;图像采集仪,德国Leica MD20型。
1.2 方 法
1.2.1 细胞克隆形成实验 按文献[5]培养新生牛肺主动脉血管内皮细胞(BAVEC)并鉴定(细胞Ⅷ因子染色呈阳性,证明为内皮细胞),取生长良好、培养至3~4代的内皮细胞消化成单细胞悬液,计数,稀释,以200细胞/平皿的密度分别接种于60 mm的培养皿,置37℃、含95%O2及5%CO2饱和湿度培养箱内培养。待细胞完全贴壁后吸弃上清,CCVAF组每皿分别加入由含10%灭活胎牛血清的RPMI 1640培养液配制的CCVAF液(1.25,2.5,5.0 μg/mL)4mL,溶剂对照组加入不含CCVAF的培养液。每组设5个平行样本,每3天换液1次,培养14天肉眼可见克隆时,Giemsa染色,低倍镜下计数等于或超过 50个细胞的克隆数,计算克隆形成率及抑制率。克隆形成率(%)=克隆数/种植细胞数×100%。克隆形成抑制率(%)=(克隆形成率溶剂对照-克隆形成率CCVAF)/克隆形成率溶剂对照×100%。
1.2.2 双室联合培养细胞迁移实验参照Murohara等[6]的方法进行。分别培养Hela细胞及BAVEC,取生长良好的融合近80%的Hela细胞消化计数,调整密度为1×108/L,按600μL/孔接种于Transwell双室培养板的下室。待细胞贴壁后吸弃上清,实验组各孔加入由含10%灭活胎牛血清的RPMI 1640培养液配制的CCVAF(1.25,2.5,5.0μg/mL),溶剂对照组加不含CCVAF的培养液,以下室不接种Hela细胞的孔加入培养液作为空白对照组。另取培养3~4代生长良好的BAVEC,调细胞密度为1×108/L,按 600μL/孔均匀接种于带8μm聚碳酸酯微孔滤膜的Transwell培养板上室每组各孔,每组设2个平行孔,共重复 3次。置37℃、含95%O2及5%CO2饱和湿度培养箱内行Hela-BAVEC共培养6h。小心取出共培养板,取出 Transwell上室,用棉签小心拭去上室膜上未迁移的内皮细胞,翻转膜的另一面用D-Hanks液小心清洗,95%乙醇固定,D-Hanks液冲洗,行苏木素染色,伊红复染。将 Transwell上室倒置于显微镜下观察,随机取上下左右4个视野进行细胞计数(20×),计算细胞迁移抑制率。迁移抑制率(%)=(迁移细胞数溶剂对照-迁移细胞数CCVAF)/迁移细胞数溶剂对照×100%。
1.2.3 大鼠胸主动脉环微血管形成实验 参照Nicosia等[7]的方法改良进行。大鼠脱臼处死,无菌操作下迅速取出胸主动脉,置MCDB 131无血清培养液中漂洗,在组织解剖显微镜下小心去除血管外脂肪、黏附组织及血管分支,截断成若干1mm长的动脉环,用MCDB131培养液冲洗10次待用。将纤维蛋白原用MCDB131无血清培养液稀释成3g/L,并于每1mL纤维蛋白原溶液中添加牛凝血酶溶液(50NIHu/mL)20μL,混匀后迅速在24孔板内各加入5滴凝成纤维蛋白胶做铺垫;之后每孔添加正在凝结的纤维蛋白溶液8滴,立即将准备好的动脉环平放沉于蛋白胶孔正中部位;待完全凝成胶后,CCVAF组为加入培养液配制的CCVAF(2.5μg/mL);(VEGF+CCVAF)组为加入培养液配制的含VEGF(20ng/mL)及CCVAF(2.5μg/mL);溶剂对照组加MCDB131无血清培养液;VEGF对照组加培养液配制的VEGF(20ng/mL);每孔加入量为1mL,每组设6个平行样本。置于37℃、饱和湿度、CO2培养箱中培养。其中在培养最初3天,每天在培养液中添加ε-氨基已酸(300mg/L,抑制纤维蛋白水解),之后每隔1天改成加100mg/L,每2天换液1次。并于倒置显微镜下仔细观察并计数动脉环断面附近内皮细胞和新生血管的生成情况,记录新生血管数目。以培养天数为横坐标,微血管数为纵坐标,绘制生长曲线,并计算第13天时的CCVAF组及(VEGF+CCVAF)组相对于溶剂对照组及VEGF对照组的微血管生成抑制率。微血管生成抑制率CCVAF/13d(%)=(微血管生成数溶剂对照/13d-微血管生成数CCVAF/13d)/微血管生成数溶剂对照/13d×100%。微血管生成抑制率(VEGF+CCVAF)/13d(%)=(微血管生成数VEGF/13d-微血管生成数(VEGF+CCVAF)/13d)/微血管生成数VEGF/13d×100%。
1.3 统计分析
2 结 果
2.1 CCVAF对BAVEC克隆形成的影响
细胞培养14天后各组都形成了数量不等和(或)大小不等的集落。溶剂对照组形成的集落大小较均匀,且集落细胞团较大;而CCVAF组形成的集落细胞团随浓度增大(1.25,2.5,5.0μg/mL)而依次变小,5.0μg/mL组中有的仅见一些散在的细胞,或细胞零散聚在一起不成集落。从表1中可见,CCVAF(1.25,2.5,5.0μg/mL)各组与溶剂对照组间的克隆形成率差异有统计学意义,随 CCVAF浓度的增大,细胞克隆形成率减少;即 CCVAF能抑制内皮细胞的克隆形成,并且存在剂量效应关系,克隆形成抑制率与CCVAF浓度呈正相关(r=0.982,P<0.05)。
表1 CCVAF对细胞克隆形成的影响(±s,n=5)Tab.1 Effects of CCVAF on BAVEC colony formation(±s,n=5)

表1 CCVAF对细胞克隆形成的影响(±s,n=5)Tab.1 Effects of CCVAF on BAVEC colony formation(±s,n=5)
与溶剂对照组比较:1P<0.05,2 P<0.0011 P<0.05,2 P<0.001 vs solvent control group
?
2.2 CCVAF对内皮细胞迁移的影响
利用Transwell双室细胞联合培养诱导细胞迁移模型,空白对照组(下室不含Hela细胞)的内皮细胞有少量的细胞自主迁移,但与溶剂对照组细胞迁移数差异有统计学意义(P<0.001),表明空白对照组的细胞自主迁移可忽略。当 Hela细胞与内皮细胞共培养6 h后,与溶剂对照组比较,CCVAF组的内皮细胞迁移数减少,随 CCVAF浓度增大其细胞迁移数差异有统计学意义(见表2)。当 CCVAF浓度为1.25,2.5,5.0μg/mL时,其对细胞迁移抑制率分别为20.5%,59.0%,73.5%,呈剂量依赖性(r=0.902,P<0.05)。
表2 CCVAF对细胞迁移的影响(±s,n=6)Tab.2 Effects of CCVAF on BAVEC migration(±s,n=6)

表2 CCVAF对细胞迁移的影响(±s,n=6)Tab.2 Effects of CCVAF on BAVEC migration(±s,n=6)
与空白对照组比较:1P<0.001;与溶剂对照组比较:2P<0.0011P<0.001 vs blank control group;2 P<0.001 vs solvent control group
?
2.3 CCVAF对动脉微血管形成的影响
动脉环在不同的生长条件下形成的微血管数量不同,随着培养时间的延长,溶剂对照组微血管管腔样结构数量逐渐增多,而VEGF对照组生成的微血管管腔样结构数量比溶剂对照组的增多,(CCVAF+VEGF)组及CCVAF组生成的微血管管腔样结构数量相对较少,见图1。培养后第4天开始,即有内皮细胞从动脉横断面切口处逐渐向外生长出现管腔样结构,其中比较了各组在培养至第5,9及13天的微血管生成状况,结果显示与溶剂对照组比较,VEGF对照组、(CCVAF+VEGF)组及CCVAF组形成的微血管管腔样结构数量差别有统计学意义(P<0.05);而与VEGF对照组比较,(CCVAF+VEGF)组及CCVAF组形成的微血管管腔样结构数量差别也有统计学意义(P<0.05),见表3。从第13天结果看,溶剂对照组微血管管腔样结构新生微血管数达 30多条,VEGF对照组新生微血管数量则多达近60条;而CCVAF组及(CCVAF+VEGF)组仅见少数几条新生血管芽出,周围仅见一些散在分布的细胞,其中CCVAF组相对于溶剂对照组的微血管生成抑制率达 86.5%,而(VEGF+CCVAF)组相对于VEGF对照组的微血管生成抑制率达88.1%,见表3及图2。
3 讨 论
血管生成是指在生理和病理情况下机体在原有血管的基础上形成新血管的过程,而内皮细胞的增殖和迁移是新生血管形成的重要环节。本研究从内皮细胞体外大量扩增形成集落的方法观察CCVAF对内皮细胞克隆的影响,结果表明,CCVAF能够剂量依赖性地抑制内皮细胞体外克隆的形成,与本课题组前期研究得到的CCVAF选择性抑制内皮细胞的增殖[3]、诱导内皮细胞的凋亡[4]、通过抑制胞内 c-myc、c-fos、PCNA的表达而抑制内皮细胞增殖[5]的结果一致。
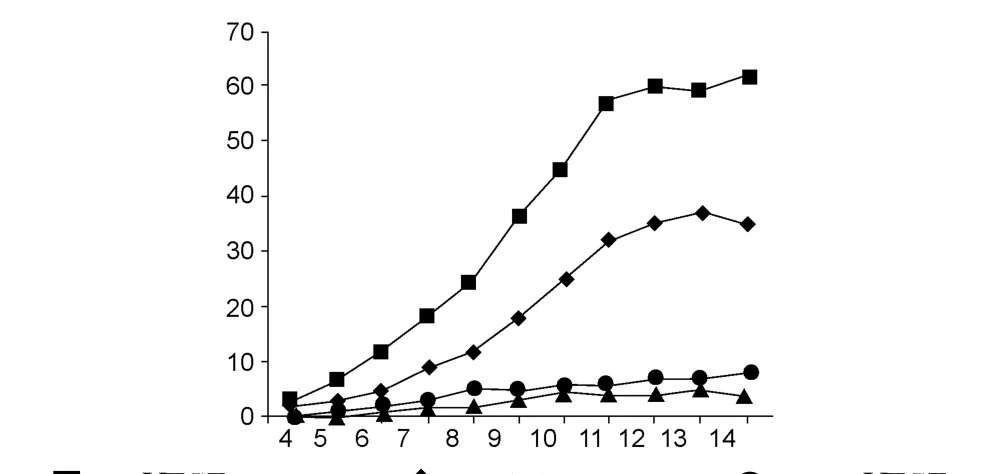
图1 大鼠动脉环无血清培养血管生长曲线Fig.1 Growth curve of neovascularization of rat aortic ring of groups
表3 CCVAF对动脉微血管形成的影响(±s,n=6)Tab.3 Effects of CCVAF on neovascularization of rat aortic ring(±s,n=6)
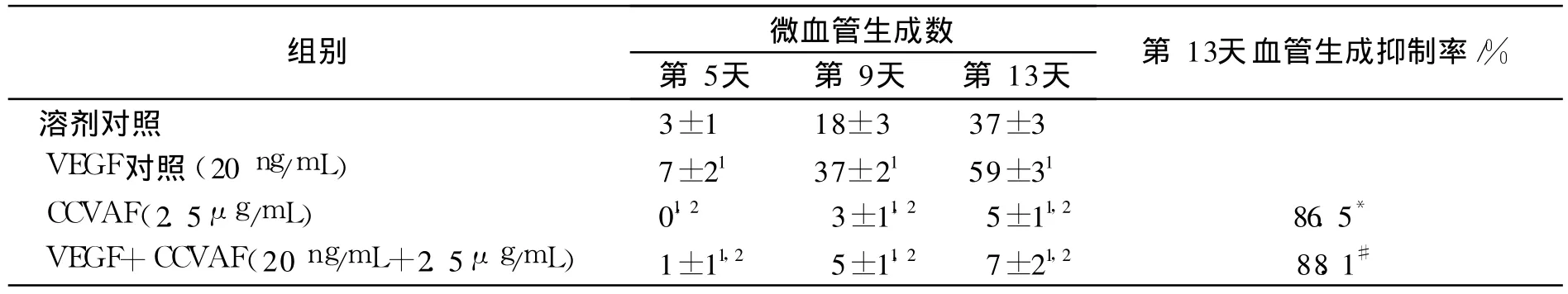
表3 CCVAF对动脉微血管形成的影响(±s,n=6)Tab.3 Effects of CCVAF on neovascularization of rat aortic ring(±s,n=6)
与溶剂对照组比较:1P<0.05;与VEGF对照组比较:2 P<0.05;*.相对于溶剂对照组;#.相对于VEGF对照组1 P<0.05 vs solvent control group;2P<0.05vs VEGF control group;*was the inhibition rate of CCVAF group vs Solvent control groups 13th;#was the inhibition rate of(VEGF+CCVAF)group vs VEGF control group 13th
组别 微血管生成数第5天第9天第13天第13天血管生成抑制率/%溶剂对照 3±1 18±3 37±3 VEGF对照(20 ng/mL) 7±21 37±21 59±31 CCVAF(2.5μg/mL) 01,2 3±11,2 5±11,2 86.5*VEGF+CCVAF(20ng/mL+2.5μg/mL) 1±11,2 5±11,2 7±21,2 88.1#

图2 动脉环培养至第13天各组微血管生成的典型生长图像(40×)Fig.2 Neovascularization of rat aortic ring of groups on 13th day(40×)
肿瘤的生长、侵袭和转移依赖于肿瘤内新生血管形成,而内皮细胞的增殖活性则是肿瘤血管生成的重要一环。肿瘤细胞本身可以自分泌或旁分泌的途径分泌 VEGF等细胞促进因子,通过与受体结合激活一系列信号转导机制,导致内皮细胞的分裂、增殖、迁移,促进新血管的形成[8]。肿瘤细胞与内皮细胞在血管生成过程密切相关。为了考察 CCVAF是否能够抑制血管内皮细胞的迁移,实验中采用了Transwell双室细胞共生培养模型来进行。本实验方法是模拟肿瘤生长过程中肿瘤细胞在共生环境作用对血管内皮细胞的作用。这样培养于下室的肿瘤细胞所分泌的细胞促进因子等渗至培养上清液中,促使种植于上室的内皮细胞(在相同的培养上清液的作用下),穿过聚碳酸酯滤膜的微孔到达膜的下面,计算滤膜下的细胞数来反映细胞的迁移情况。本课题组曾报道 CCVAF能抑制肺癌细胞H1299诱导的血管内皮细胞迁移[9],本文证明 CCVAF能够剂量依赖地抑制人宫颈腺癌 Hela细胞诱导的内皮细胞迁移,为考察 CCVAF抑制微血管的生成提供了依据。
CCVAF能够抑制内皮细胞的增殖,抑制内皮细胞的迁移,其最终能否抑制血管的生成是最关键的。用于评价血管生成的体内方法有多种,如利用兔耳槽、基质胶种植和鸡胚绒毛尿囊膜等[10]。由于血管生成是一个极其复杂的过程,体内过程中其生物化学机制受到血管生成因子与抑制因子之间的调节的影响。本研究采用动脉环外植体(aorta ring explant)培养技术,使血管生成的研究能在体外可控环境下进行,从而排除体内因素的干扰。本研究参照 Nicosia等[7]的方法进行并作了一些改进:选用24孔细胞培养板替代替代传统的琼脂环的固定作用,简化了操作步骤,也便于无菌操作,且节省了大量培养液(若用10 cm内径的培养皿固定3个琼脂环,则 MCDB 131每次需用30mL)。改良后的动脉环无血清培养方法材料易得,操作简便,排除了体内研究多因素的影响,并能随时观察血管生成不同阶段的情况,条件可控且能模拟体内环境,能相对客观评价药效。研究结果显示,两个对照组动脉环周围微血管生长良好,尤其是VEGF组,微血管生长数量、状态明显高于不含VEGF对照组,说明 VEGF促进了微血管的生长和生成;而含CCVAF的两个实验组,微血管芽生大大减少,甚至仅见一些散在的内皮细胞,表明 CCVAF对大鼠动脉环微血管生成具有显著的抑制作用,且这种作用与拮抗 VEGF的促血管生成作用是相关的,其抗血管生成的作用首先抑制了内皮细胞的增殖,从而抑制管腔样结构的形成。
[1]Lennernäs B,Albertsson P,Lennernäs H,etal.Chemotherapy and antiangiogenesis--drug-specific,dose-related effects[J].Acta Oncologica,2003,42(4):294-303.
[2]Rong H,Lou X H,Teng M K,etal.Purification,partial characterization,crystallization and preliminary X-ray diffraction of a novel cardiotoxin-like basic protein from Naja naja atra(South Anhui)venom[J].Acta Crystallogr F,2007,63(2):130-134.
[3]刘新艳,余清声,余红娥,等.中华眼镜蛇毒活性组分选择性抑制内皮细胞增殖[J].中国药理学通报,2006,22(2):184-188.
[4]刘新艳,余清声,余红娥,等.中华眼镜蛇毒活性组分诱导内皮细胞凋亡[J].中国药理学通报,2008,24(6):822-826.
[5]朱柳,余清声,袁牧,等.眼镜蛇毒活性组分抑制内皮细胞生长及其生化机制初探[J].中国生化药物杂志,2009,30(6):361-364.
[6]Murohara T,Witzenbichler B,Spyridopoulos I,etal.Role of endothelial nitric oxide synthase in endothelial cell migration[J].Arterioscler Thromb Vasc Biol,1999,19(5):1156-1161.
[7]Nicosia R F,Ottinetti A.Growth of microvessels in serum-free matrix culture of rat aorta.A quantitative assay of angiogenesis in vitro[J].Lab Invest,1990,63:115-122.
[8]Mattern J,Koomagi R,Volm M,etal.Association of vascular endothelial growth factor expression with intratumoral microvessel density and tumour cell proliferation in human epidermoid lung carcinoma[J].Br J Cancer,1996,73(7):931-934.
[9]余红娥,余清声,刘新艳,等.中华眼镜蛇毒组分抑制肺癌细胞H1299诱导的血管内皮细胞迁移的研究[J].中华现代临床医学杂志,2004,2(6):772-774.
[10]Hasan J,Shnyder S D,Bibby M,etal.Quantitativeangio genesisassays in vivo——a review[J].Angiogenesis,2004,7(1):1-16.

